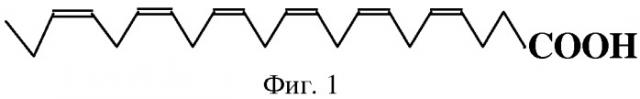Способ получения докозагексаеновой кислоты
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности, а именно к способу получения докозагексаеновой кислоты. Способ получения докозагексаеновой кислоты включает щелочной гидролиз морских жиров, обработку солей жирных кислот раствором йода, экстракцию йод-лактонов жирных кислот неполярным органическим растворителем, удаление из смеси непрореагировавших свободных жирных кислот, раскрытие йод-лактонов жирных кислот силирующим агентом, нейтрализацию выделившегося свободного йода тиосульфатом натрия и экстракцию свободных жирных кислот неполярным органическим растворителем при определенных условиях. Вышеуказанный способ позволяет получить конечный продукт высокой чистоты с повышенным выходом. 4 з.п. ф-лы, 4 ил., 1 табл., 6 пр.
Реферат
Изобретение относится к пищевой и фармацевтической промышленности и может быть использовано для получения композиций с высоким содержанием докозагексаеновой кислоты (ДГК), обладающей выраженным биологическим действием. Формула докозагексаеновой кислоты приведена на фиг.1.
Полиненасыщенные жирные кислоты омега-3 серии из морских источников, в первую очередь эйкозапентаеновая и докозагексаеновая кислоты, известны как средства профилактики и лечения сердечно-сосудистых заболеваний (Simopoulos А.Р. Omega-3 Fatty Acids in Inflammation and Autoimmune Diseases //J. of the American College of Nutrition, 2002. Vol.21, N 6, Р. 495-505). Однако несмотря на увеличение продолжительности жизни человека также увеличилась распространенность заболеваний, связанных со старением, в частности нейродегенеративных заболеваний, таких как болезнь Альцгеймера, рассеянный склероз и болезнь Паркинсона (Habeck C., Stern Y. Alzheimer's Disease Neuroimaging Initiative. Multivariate data analysis for neuroimaging data: overview and application to Alzheimer's disease //Cell Biochem. Biophys., 2010. Vol.58, Р. 53-67). Эти заболевания, прогрессирующие с возрастом, также связаны с социально-экономическим статусом, работой, физической активностью, генетикой, а в последние два десятилетия питание также выделяют в качестве фактора, имеющего немаловажное значение (Stampfer M.J. Cardiovascular disease and Alzheimer's: common links //J. Inter. Med., 2006. Vol.260, Р. 211-223). В этом выводе есть общее мнение, что здоровое питание может предотвратить развитие многих заболеваний, таких как ожирение, гипертензия, сахарный диабет, инсульт, некоторые виды рака, а теперь и нейродегенеративные заболевания (Massaro M. et al. Nutraceuticals and prevention of atherosclerosis: focus on omega-3 polyunsaturated fatty acids and Mediterranean diet polyphenols //Cardiovasc. Ther., 2010. Vol.28, Р. 13-19). Эпидемиологические исследования показывают, что население, значительно потребляющее рыбу и другую пищу, богатую омега-3 полиненасыщенными жирными кислотами (ω3 ПНЖК), имеет низкий уровень нейродегенеративных заболеваний (Tully А.М. et al. Low serum cholesterol ester docosahexaenoic acid levels in Alzheimer's disease: a case - control study //Br. J. Nutr., 2003. Vol.89, Р. 483-489). ω3 ПНЖК, особенно докозагексаеновая кислота (ДГК, Δ4,7,10,13,16,19-C22:6 , 22:6ω3), играют фундаментальную роль в развитии и сохранении нервной системы, а в последние годы появились неоспоримые доказательства их участия в предупреждении и/или в лечении нейродегенеративных заболеваний (Ikemoto A. et al. Reversibility of n-3 fatty acid deficiency - induced alterations of learning behavior in the rat: level of n-6 fatty acids as another critical factors //J Lipid Res, 2001. Vol.42, Р. 1655-1663). В нервной ткани ДГК находится в высоких концентрациях, особенно в фосфолипидах нейронов и глиальных мембран. Однако старение и прогрессирование нейродегенеративных заболеваний значительно снижают содержание ДГК в головном мозге (Tully et al., 2003), особенно в коре головного мозга, мозжечке и гипоталамусе, что приводит к значительному снижению текучести мембран нейронов и изменению нейронного гомеостаза (Sodeberg M. et al. Fatty acid composition of brain phospholipids in aging and in Alzheimеґ's disease //Lipids, 1991. Vol.26, Р. 421-425; Kalminj S. et al. Dietary intake of fatty acid and fish in relation to cognitive performance at middle age //Neurology, 2004. Vol.62, Р. 275-280). Наибольшее количество доказательств в отношении нейропротекторного эффекта ДГК наблюдается при болезни Альцгеймера. ДГК может подавить цитотоксические эффекты накопления β-амилоидного пептида, что является основным механизмом, связанным с нейропротекторным действием жирных кислот (Bazan N.G. Neuroprotectin D1-mediated anti-inflammatory and survival signaling in stroke, retinal degenerations, and Alzheimer's disease //J Lipid Res, 2009. Vol.50 (Suppl.), Р. 400-405).
Основываясь на всем вышесказанном, целесообразно рассмотреть положительный эффект увеличения потребления ДГК как в виде пищевых продуктов, богатых этой жирной кислотой (рыба и прочее), так и содержащих ДГК препаратов с высокой ее концентрацией. К сожалению, большинство патологий, когда приступают к их лечению, находятся в запущенном состоянии. Поэтому некоторые превентивные меры, которые были бы эффективны ранее, как сбалансированная по ДГК диета уже не оказывают нужного результата. По мнению многих исследователей и медиков,° в данном случае результативно применение высокообогащенных препаратов ДГК, в которых отсутствовали бы другие «балластные» жирные кислоты. Такие композиции с высоким содержанием ДГК рассматриваются учеными как наиболее перспективные к широкому применению при нейрогенеративных заболеваниях.
На данный момент из научной и патентной литературы нам не известно о методах получения фармацевтических композиций с высоким содержанием ДГК, получение которых проходило бы при одновременно высоком выходе и высокой чистоте целевого продукта, при сохранении эффективности технологического процесса - кардинальном упрощении технологических стадий, сокращении времени проведения процесса, повышении его экологичности. Тем самым, достигается интенсификация процесса, что дает фармацевтическим предприятиям возможность получения новых препаратов (композиций) с высоким содержанием ДГК, оказывающих лечебно-профилактическое действие при нейродегенеративных заболеваниях.
Известен способ получения эфиров полиненасыщенных жирных кислот из рыбных жиров и препаратов на их основе (EP Application №0 292 846 A2 « A process for the extraction of polyunsaturated fatty acid esters from fish oils and pharmaceutical and/or dietetic compositions containing said esters», 18.05.88, Int. Cl.4 C11C 3/04, A61K 31/23, A23D 5/00, A23L 1/30). Способ основан на разной летучести эфиров жирных кислот в вакууме при высокой температуре и осуществляется следующим образом. Рыбный жир для перевода жирных кислот из триглицеридов в этиловые эфиры обрабатывают 5%-ным раствором серной кислоты в этаноле, охлаждают, добавляют воды, экстрагируют этиловые эфиры жирных кислот гексаном, для удаления окисленных производных гексановый раствор подвергают хроматографической очистке, гексан упаривают, а сам продукт используют для молекулярной дистилляции при температуре 80-125°С и остаточном давлении 10-3 мм рт. ст. Исходный рыбный жир (как и получаемые из него этиловые эфиры жирных кислот) содержит 10,7% ДГК. После описанных процедур конечный продукт содержит 39,9% ДГК.
Способ имеет ряд недостатков:
1. Достаточно трудоемкая подготовка к осуществлению способа - кислотный этанолиз и хроматографическая очистка от окисленных примесей.
2. Высокая температура, до 125°С, вызывает такие явления, как окисление полиненасыщенных жирных кислот, образование диеновых конъюгатов, миграцию двойных связей в цепочке жирной кислоты, полимеризацию продукта, а также деградацию кислоты на короткоцепочечные летучие продукты.
3. Использование конечного продукта, полученного по данному способу, допустимо лишь при очень тщательной хроматографической очистке, которую авторы, по какой-то причине, не указывают, поскольку привнесение в фармацевтическую композицию измененного по химической структуре продукта будет опасным для потребителей.
4. Способ не обеспечивает высокую концентрацию ДГК в конечном продукте (39,9%), наблюдаемое увеличение только в 3,7 раза. Полученная композиция, после очистки, действительно может быть использована в пищевых целях, но не в качестве препарата высокой эффективности.
Известен способ получения концентрата этиловых эфиров эйкозапентаеновой и докозагексаеновой кислот (Авторское свидетельство SU №1581737 А1 «Способ получения концентрата этиловых эфиров эйкозапентаеновой и докозагексаеновой кислот», 30.07.90, МКИ5 С11С 1/00, С11 В 7/00). Данный способ концентрирования полиненасыщенных жирных кислот основан на физическом принципе предпочтительного комплексообразования кристаллов мочевины с насыщенными и мононенасыщенными жирными кислотами в виде осадка, в то время как полиненасыщенные жирные кислоты остаются в исходном растворе. Способ осуществляют следующим образом. Рыбный жир подвергают щелочному гидролизу для получения свободных жирных кислот, затем свободные жирные кислоты растворяют в растворе мочевины в этаноле в соотношении 1 : 3 : 12 (жирные кислоты-мочевина-этанол, г/г/мл), выдерживают смесь 1-3 часа при комнатной температуре, затем 8-12 часов при 0°С, осадок отфильтровывают, а из раствора спирта выделяют концентрат ненасыщенных жирных кислот. Так, из 4 г свободных жирных кислот (пример 2), полученных гидролизом рыбного жира, с содержанием ДГК 5,3% по способу получено 330 мг концентрата полиненасыщенных жирных кислот с содержанием ДГК - 37,0%. Выход по ДГК составляет 57,8%.
Способ имеет следующие недостатки:
1. Для осуществления максимального концентрирования ДГК по способу предполагается использование больших объемов растворителя и мочевины, что требует соответствующего аппаратурного оформления - больших аппаратов с рубашками для последовательного нагрева и охлаждения реакционной смеси, дополнительных мерных емкостей и др. Для регенерации растворителя необходимо создание специализированной перегонки ввиду большого количества осадка в упариваемом растворе.
2. Осадок комплекса мочевины с насыщенными и мононенасыщенными кислотами является в данном процессе отходом и его утилизация проблематична. Существуют методы разложения данного осадка на свободные жирные кислоты и мочевину с возможностью ее регенерации, но данный процесс осуществляют в кипящем углеводороде, например изооктане. Реализация этого сопутствующего процесса, учитывая критерии пожарной безопасности, вероятно, будет более сложной, чем основная технология. Экологическая составляющая в этом процессе очевидна, и ее решение пока не найдено.
3. Концентрирование ДГК не превышает 37% в конечном продукте, что очень низко для использования его как источника этой кислоты. К тому же более 40% ДГК теряется при осуществлении способа, что крайне не экономично.
Известен способ получения композиции, содержащей докозагексаеновую кислоту (UK Patent Application GB 2 098 065 «Antithrombotic compositions containing docosahexaenoic acid», 17.11.82, Int. Cl.3 A61K 31/20, A61K 31/16). Способ основан на комбинировании различных методов - низкотемпературной кристаллизации, молекулярной дистилляции и хроматографии. Метод низкотемпературной кристаллизации использует физические свойства индивидуальных жирных кислот - разные точки их плавления, как в свободном виде, так и в растворах органических растворителей при различных температурах, что обеспечивает первичное концентрирование полиненасыщенных жирных кислот. Полученный концентрат подвергают обогащению по 2-му методу - молекулярной перегонке в вакууме и в заключение используют 3-й метод - хроматографию. Способ осуществляют следующим образом (пример 1): из свежего мяса скумбрии (100 кг) тепловым способом выделяют жир (15 кг), его гидролизуют до получения свободных жирных кислот (9 кг), смесь охлаждают до -60°С, получая 4 кг ненасыщенных жирных кислот, далее концентрат подвергают молекулярной перегонке при остаточном давлении 10-2 мм рт. ст. и дополнительно концентрируют колоночной хроматографией, получая 900 г концентрата ДГК с чистотой 82%.
К недостаткам способа следует отнести:
1. Проведение процесса при очень низкой температуре (-60°С) является весьма затратным, ибо низкие температуры предполагают специализированные мощности, предназначенные для этого, и, возможно, функционирование больших помещений при этой температуре, если речь идет о получении промышленных партий препарата.
2. Вторая стадия - молекулярная перегонка, использующая высокие температуры (до 110°С), способствует значительному окислению ДГК и общим потерям при ее производстве.
3. Способ изначально предполагает существенное образование окисленных и полимеризованных соединений, почему на конечном этапе используют адсорбционную хроматографию. Это достаточно дорогая процедура при получении продукта, учитывая, что сорбент (обычно силикагель) в дальнейшем не регенерируют.
4. Концентрирование ДГК составляет только 82% при выходе по ДГК - приблизительно 24,6% (авторы не указывают содержание ДГК в жире японской скумбрии, но, основываясь на известных данных, можно предположить, что это в пределах 30% (Bae J.H. Heavy Metal Contents and Chemical Compositions of Atlantic (Scomber scombrus), Blue (Scomber australasicus), and Chub (Scomber japonicus) Mackerel Muscles //Food Sci. Biotechnol., 2011. Vol.20, P. 709-714).
Известен способ получения метиловых эфиров полиненасыщенных жирных кислот из рыбного жира (Adolf R.O. et al., "The Isolation of Omega-3 Polyunsaturated Fatty Acids and Methyl Esters of Fish Oils by Silver Resin" //JAOCS, 1985. Vol.62, P. 1592-1595). Реализация данного способа основана на способности полиненасыщенных соединений образовывать координационные связи с атомами серебра - чем больше двойных связей, тем сильнее устойчивость таких соединений. Нанося соли серебра на хроматографические сорбенты, можно регулировать равновесие в системе насыщенных - ненасыщенных жирных кислот. Способ осуществляют следующим образом: рыбный жир (американская сельдь) переводят в метиловые эфиры жирных кислот, далее, используя хроматографическую колонку со смолой, содержащей ионы серебра, хроматографируют их в системе полярных растворителей, получая при элюции концентрат с содержанием 20,4% ДГК (исходное содержание ДГК - 11,1%). Если же для «серебряной» хроматографии использовали готовый концентрат полиненасыщенных жирных кислот с содержанием 20,5% ДГК, то лучшим показателем был состав в одной из фракций - 95,4% ДГК.
Способ имеет следующие недостатки:
1. Несмотря на возможность получения высоко обогащенных концентратов полиненасыщенных жирных кислот, способ предназначен, скорее, для лабораторного применения, так как не дает высокие выходы конечного продукта.
2. Использование в способе солей серебра чрезвычайно удорожает стоимость конечного продукта. Системы элюции вымывают импрегнированные соли серебра с сорбента, и в дальнейшем регенерация растворов с солями серебра, так же как и сорбента с их остатками в комплексе реализуемого процесса, невозможна.
3. Производительность процесса очень мала. Используют значительные по объему колонки (340-750 мл) для разделения 0,5-10,0 г вещества. Требуются значительные количества растворителей, постоянная их регенерация.
4. Чистота лучшего образца не превышает 95,4%, при этом нужно учитывать, что он получен из предварительно подготовленного концентрата. Если же рассматривать примеры с метиловыми эфирами исходного рыбного жира, то конечный продукт содержит 20,4% ДГК, а выход составляет только 49,5%.
Известен способ получения докозагексаеновой кислоты из жира печени трески (Medina А.R. et al. Concentration and Purification of Stearidonic, Eicosapentaenoic, and Docosahexaenoic Acids from Cod Liver Oil and the Marine microalga Isochrysis galbana //JAOCS, 1995. Vol.72, P. 575-583). Способ основан на разной подвижности жирных кислот в условиях хроматографии высокого давления на специализированных сорбентах. Способ осуществляют следующим образом: жир печени трески гидролизуют с выделением свободных жирных кислот (содержание ДГК - 11%), далее разделяют по составу жирных кислот на хроматографической колонке с обращенной фазой (С-18), элюируя колонку различными системами растворителей. Способ позволяет получать концентраты ДГК с выходом 70,5-100%, но с содержанием данной кислоты не более 72-85%.
Способ имеет многие недостатки:
1. Колоночная хроматография обеспечивает разделения нужных продуктов, но при этом известно, что соотношение разделяемая смесь-сорбент обычно составляет 1 : 10-100, г/г. Это очень большое использование сорбента для разделения малых количеств веществ. К тому же после разделения веществ сорбент на колонке необходимо регенерировать, и для этого требуются растворители в не меньшем объеме, чем для выделения целевого продукта.
2. Способ использует различные системы элюции при различном соотношении растворителя с водой. Это предполагает регенерацию растворителя, и, исходя из приведенных объемов, она очень значительна.
3. Использование в качестве растворителя метанола, а именно в примерах с его участием в системах элюции концентрация ДГК самая высокая, вызывает опасения по дальнейшему использованию такого продукта в пищевой индустрии.
4. Реализация способа не обеспечивает получение препаратов с высоким содержанием ДГК, а учитывая затраты на их производство и малую производимость, не может претендовать на массовое использование.
Известен способ получения докозагексаеновой кислоты из жира печени трески (Wright S.W., Kuo E.Y., Corey E.J. An Effective Process for the Isolation of Docosahexaenoic Acid in Quantity from Cod Liver Oil //J. Org. Chem., 1987. Vol.52, P 4399-4401). Способ осуществляли следующим образом: жир печени трески (200 г) подвергали щелочному гидролизу, отделяли неомыляемые вещества, подкисляли для выделения свободных жирных кислот (180 г). Далее полиненасыщенные жирные кислоты концентрировали методом разделения литиевых солей жирных кислот в ацетоне (получили концентрат с содержанием 42% ДГК, 50 г). Затем проводили реакцию йод-лактонизации жирных кислот в тетрагидрофуране с участием йода (соотношение 1,2 моль йода на 1 моль ДГК) и калия йодистого в течение 48 часов, после чего йод-лактоны экстрагировали этилацетатом, упаривали, перерастворяли в гексане, отмывали непрореагировавшие жирные кислоты водно-метанольным раствором карбоната калия, гексановый раствор последовательно промывали водой и солевым раствором, упаривали с получением 24,11 г йод-лактона ДГК (выход в расчете на йод-лактон ДГК 81%). Далее полученный йод-лактон ДГК раскрывали с высвобождением исходной ДГК в растворе йодистого натрия и триметилхлорсилана (соотношение йод-лактон ДГК / триметилхлорсилан, TMS-Cl - 1 : 2, моль/моль) в ацетонитриле. Выделившийся свободный йод связывали раствором сульфита натрия и цитрата натрия. Жирные кислоты экстрагировали смесью гексана и дихлорметана, объединенные экстракты промывали водой, солевым раствором, высушивали и упаривали до получения 13,55 г ДГК с чистотой 100% (выход на стадии 78%).
Общий выход:
1) при расчете от 180 г жирных кислот при среднем содержании ДГК в жире печени трески 12,5% - 58,9% (авторы не указывают исходную концентрацию ДГК, но по литературным данным в жире печени атлантической трески Gadus morhua содержится 10,5-14,3% ДГК, Gruger E.H. «Fatty acid composition». In: Fish oils/Ed. Stansby M.E. Westport, Connecticut: The AVI Publ. Comp., Inc., 1967. P. 15);
2) при расчете от 50 г концентрата полиненасыщенных жирных кислот - 63,2%.
Способ имеет следующие недостатки:
1. Растворители, используемые при осуществлении способа - тетрагидрофуран и метанол, чрезвычайно ядовиты и не должны быть использованы при получении препаратов, назначаемых человеку. Полученные таким способом препараты следует отнести к веществам для биохимических исследований.
2) Способ осуществляют в 4-е стадии, что значительно усложняет процесс и увеличивает время его осуществления почти до 3-х суток (66 часов и более).
3) Предварительное концентрирование, использующее метод осаждения литиевых солей насыщенных кислот из ацетона, сугубо лабораторный метод, так как объемы растворителя в 20 раз превышают объем разделяемой массы. Масштабирование такого метода для производства необоснованно и не эффективно.
4) Реакция йод-лактонизации проведена с низким выходом (81%), то есть часть ДГК из полученного на предыдущей стадии концентрата просто теряется. Это увеличивает затраты на выпуск данного препарата.
5) Выход на стадии раскрытия йод-лактона ДГК также низок - 78%. Можно заключить, что условия проведения реакции не оптимальны. Это зависит и от соотношения компонентов в среде, и от времени проведения реакции, и от других немаловажных деталей.
6) Авторы указывают, что продукт, выделенный таким образом, чистый (100%). Однако 4-стадийное получение ДГК малоэффективно ввиду не высоких выходов на каждой из стадий, общий выход очень низкий - 58,9%, хотя достоинство любого процесса - максимальное использование исходного сырья, минимизация потерь продукта, труда и времени. Данный способ для возможного применения в промышленном производстве должен быть критически воспринят и существенным образом доработан.
Наиболее близким к заявляемому нами способу является способ получения докозагексаеновой кислоты, описанный в Авторском свидетельстве SU 1631067 от 28.02.1991 «Способ получения докозагексаеновой, эйкозапентаеновой и арахидоновой кислот или их смеси» (авторы Н.А. Латышев, А.Б. Имбс, Н.В. Гайдай, Д.В. Куклев, С.П. Касьянов). Способ осуществляют следующим образом: рыбный жир омыляют действием раствора щелочи, затем подкисляют кислотой для выделения свободных жирных кислот, далее переводят их в калиевые соли и обрабатывают раствором йода (с добавлением КI) в расчете на ДГК при соотношении ДГК /I2 = 1 : 0,5-1,2, моль / моль, в течение 3-15 минут, непрореагировавший йод нейтрализуют водным раствором тиосульфата натрия, образовавшийся йод-лактон ДГК экстрагируют органическими растворителями (бензол, гексан, диэтиловый эфир, хлороформ, этилацетат), упаривают растворитель, перерастворяют смесь в гексане, отмывают свободные жирные кислоты от йод-лактона ДГК водно-спиртовыми растворами бикарбоната или карбоната калия, упаривают гексан и раскрывают йод-лактон ДГК в безводном ацетонитриле силирующим агентом (триметилйодсилан, TMS-I или триметилхлорсилан, TMS-Cl) в соотношении йод-лактон ДГК / силирующий агент = 1 : 1,2-1,5, моль /моль, в течение 20-30 минут, нейтрализуют выделившийся йод раствором тиосульфата натрия и экстрагируют ДГК из смеси органическим растворителем.
К недостаткам данного способа следует отнести:
1) Использование уже готовой смеси свободных жирных кислот. Однако, при внедрении метода в полупромышленное или промышленное производство данная отправная точка совершенно не экономична, поскольку реакция йод-лактонизации жирных кислот, в частности ДГК, с йодом протекает, когда жирные кислоты находятся в растворе в виде солей (мыл). А при таком подходе получается следующее: вначале рыбный жир подвергают щелочному гидролизу и, вместо того, чтобы сразу использовать эту смесь для йод-лактонизации, подкисляют ее кислотой, выделяют свободные жирные кислоты и эти же кислоты далее растворяют в щелочных агентах и запускают в реакцию. Фактически в процессе образуется дополнительная ненужная стадия, значительно отнимающая реактивы, время и приводящая к образованию побочных кислотно-солевых растворов, требующих усилий по нейтрализации и внимания для обеспечения экологической безопасности.
2) Использование в смеси для йод-лактонизации калия йодида (KI). Известно, что его добавление к раствору йода замедляет реакцию йод-лактонизации и позволяет более «плавно» проводить процесс. Поэтому йод даже добавляют в избытке на содержание ДГК до 1,2 моль/моль, время реакции ограничивают 3-15 минутами. Но данные соотношения не реализуют себя при масштабировании процесса от лабораторной колбы к реактору. Такие незначительные временные показатели приводят к изменению в составе образующихся йод-лактонов жирных кислот - образуется уже не только йод-лактон ДГК, но и йод-лактоны эйкозапентаеновой и арахидоновой кислот, тем более, что этому способствует соотношение йода к ДГК, гораздо большее, чем того требует стехиометрия - 1,2 моль I2/1 моль ДГК. Данная стадия процесса при упомянутых условиях имеет один очень большой недостаток - даже небольшое несоответствие в протекании процесса приводит к образованию йод-лактона-ДГК с высоким содержанием примесей, что не только исключает его дальнейшее использование для получения высокообогащенного концентрата ДГК, но и значительно снижает выход ДГК.
3) Упомянутые органические растворители и их смеси, которые используют для экстракции йод-лактона-ДГК, особенно бензол, хлороформ, диэтиловый эфир и этилацетат, не являются предпочтительными для такой экстракции, так как «забирают» с собой много других примесей, в первую очередь, свободные жирные кислоты. В дальнейшем требуется удаление этих растворителей, растворение смеси в гексане и проведение дальнейших процедур, что снижает эффективность процесса, требует дополнительных объемов растворителей, усложнения технологического процесса и неоправданного применения для этого производственного оборудования.
4) Авторы, приводя в качестве силирующих агентов TMS-I и TMS-C1, необходимых для раскрытия йод-лактона ДГК, фактически используют только триметилйодсилан (TMS-I). При этом наиболее доступный и недорогой триметилхлорсилан (в несколько раз более дешевый на рынке, чем TMS-I) для раскрытия йод-лактона ДГК не применяют, что удорожает продукт и сужает рамки технологического процесса.
Задача, решаемая изобретением, - разработка простого и экономичного способа получения докозагексаеновой кислоты, с высоким качеством и выходом продукта при одновременном снижении затрат производства и времени технологического цикла.
Заявляемый технический результат достигается тем, что в известном способе получения докозагексаеновой кислоты, включающем щелочной гидролиз морского жира, обработку солей жирных кислот раствором йода для образования йод-лактонов жирных кислот, экстракцию йод-лактона ДГК жирных кислот неполярным органическим растворителем, удаление из смеси непрореагировавших свободных жирных кислот, раскрытие йод-лактона жирных кислот силирующим агентом, нейтрализацию выделившегося свободного йода тиосульфатом натрия, подкисления реакционной смеси и экстракцию свободных жирных кислот, согласно изобретению обработку солей жирных кислот раствором йода ведут непосредственно после гидролиза при соотношении докозагексаеновая кислота: йод, равном 1:0,80-0,95, моль/моль, при температуре смеси 18-22°C, при этом продолжительность добавления раствора йода к реакционной смеси составляет 30-60 минут, при общей продолжительности процесса йод-лактонизации 90-120 минут; а раскрытие йод-лактонов докозагексаеновой кислоты (ДГК) проводят при соотношении йод-лактон ДГК/силирующий агент = 1:1,55-2,20, моль/моль, температуре смеси 18-22°C и продолжительности реакции 3-5 часов.
Проведение обработки йодом солей жирных кислот, т.е. проведение стадии йод-лактонизации, непосредственно в реакционной смеси после щелочного гидролиза морского жира обеспечивает непрерывность способа получения ДГК, который протекает по схеме: рыбный жир → гидролиз с образованием солей жирных кислот → реакция йод-лактонизации → раскрытие йод-лактонов с высвобождением ДГК. Это значительно упрощает и сокращает процесс получения ДГК по сравнению с прототипом. Процесс в прототипе предусматривает еще несколько ненужных дополнительных манипуляций - подкисление, выделение свободных жирных кислот и повторный перевод их в солевую форму.
Щелочной гидролиз морского жира ведут раствором гидроксидов щелочных металлов. Экспериментально было установлено, что на проведение реакции йод-лактонизации не влияет, в виде какой соли присутствуют в смеси жирные кислоты. В дальнейших технологических экспериментах по йод-лактонизации форма, в какой находилась жирная кислота, зависела только от щелочного агента, которым гидролизовали рыбный жир. В качестве щелочного агента, в частности, могут быть использованы NaOH, KOH, LiOH, вследствие чего расширяется ассортимент веществ, используемых для проведения гидролиза. Как показывают приведенные примеры заявки, наиболее предпочтительными щелочными агентами являются гидроксиды калия и натрия, так как гидролиз протекает очень быстро в сравнении с литиевой щелочью; к тому же данный реактив в несколько раз дороже, чем NaOH и КОН (в 2-3-и раза), что влияет на экономичность процесса.
Проведение йод-лактонизации в заявленных режимных параметрах позволяет, в конечном результате, повысить выход и чистоту получаемого целевого продукта. Реакцию с раствором йода ведут в расчете на докозагексаеновую кислоту в соотношении ДГК/I2=1:0,80-0,95, моль/моль, при температуре смеси 18-22°C и продолжительности добавления раствора йода к реакционной смеси 30-60 минут, при общей продолжительности процесса йод-лактонизации 90-120 минут.
Использование в реакции йод-лактонизации количества йода меньше, чем содержание в исходном сырье ДКГ, очень важно для образования чистого йод-лактона ДГК, так как известно, что гамма-йод-лактоны (в том числе йод-лактон-ДГК) образуются в первую очередь, а дельта-йод-лактоны (в том числе йод-лактоны арахидоновой и эйкозапентаеновой кислот) значительно медленнее. Поэтому обоснованным является явный недостаток йода не только для всех кислот, которые образуют йод-лактоны, но даже для ДГК, образующую йод-лактон быстрее других. Рамки взятого соотношения ДГК/I2=1:0,80-0,95, моль/моль, гарантируют, что в реакционной смеси йод-лактон ДГК будет практически единственным образующимся йод-лактоном. Соотношение ДГК/I2=1:0,80, моль/моль, является нижним пределом к снижению количества йода в реакции, так как дальнейшее уменьшение оставляет чистоту продукта точно такой же, а выход образования йод-лактона ДГК снижается пропорционально снижению добавляемого йода. Соотношение ДГК/I2=1:0,95, моль/моль, ограничивает верхний предел применения йода, поскольку, несмотря на общее увеличение выхода йод-лактона ДГК, излишне добавляемый йод начинает реагировать с арахидоновой и эйкозапентаеновой кислотами, образуя их йод-лактоны. Таким образом, получается смесь йод-лактонов, которая далее не приводит к выделению чистого целевого продукта - ДГК.
Продолжительность добавления раствора йода к реакционной смеси - 30-60 минут - была определена как наиболее оптимальная. При добавлении раствора йода к среде, где происходит реакция йод-лактонизации, йод добавляют всегда по каплям, поскольку может происходить крайне нежелательное локальное повышение его концентрации. При этом недостатка йода в данном конкретном месте уже нет, а это провоцирует, в свою очередь, образование сразу трех йод-лактонов - и йод-лактона-ДГК, и йод-лактона арахидоновой кислоты, и йод-лактона эйкозапентаеновой кислоты. Избежать такого положения можно только при медленном добавлении раствора йода к смеси, в несколько раз большем, чем в прототипе, - 30-60 мин. При этом повышение времени прилива раствора йода более 60 минут уже никак не сказывается на качестве продукта, а снижение менее 30 минут чревато протеканием вышеописанных побочных реакций.
Общее проведение реакции йод-лактонизации определено в 90-120 минут по причине того, что очень незначительная часть йода даже в условиях его недостатка в реакционной среде все еще остается непрореагировавшей. Поэтому необходимо дополнительное время для полного прохождения реакции йод-лактонизации. Обычно это составляет 30-60 минут после добавления последних капель раствора йода к смеси или, рассматривая всю реакцию йод-лактонизации, 90-120 минут. Точку окончания реакции определяют достаточно просто - отсутствие запаха йода от реакционной смеси. Полное окончание реакции делает возможным исключение из технологического процесса стадии нейтрализации непрореагировавшего йода водным раствором тиосульфата натрия (Na2S2O3*5H2O), которая является обязательной стадией в прототипе.
Раскрытие йод-лактона ДГК проводят при соотношении йод-лактон ДГК/силирующий агент = 1:1,55-2,20, моль/моль, при температуре смеси 18-22°C и продолжительности реакции 3-5 часов.
В качестве силирующего агента могут быть использованы в частности, триметилйодсилан (TMS-I), триметилхлорсилан (TMS-C1), триэтилхлорсилан (TES-C1), триэтилйодсилан (TES-I). Предпочтительно в качестве силирующего агента использовать триметилхлорсилан, поскольку этот агент является недорогим и доступным, что, в конечном результате, не только упрощает, но и удешевляет процесс получения целевого продукта.
Снижение концентрации силирующего агента менее 1,55 моль не позволит раскрыться всему йод-лактону ДГК, что приведет к снижению выхода и дополнительным процедурам очистки.
Верхняя граница ДГК/силирующий агент = 1,55:2,20, моль/моль, определяет соотношение TMS-C1 к йод-лактону ДГК. Поскольку TMS-C1 в реакционной среде достаточно медленно переходит в активную форму триметилйодсилан (TMS-I), то для сдвига равновесия в сторону образования триметилйодсилана необходим определенный избыток TMS-C1. Увеличение этого избытка более чем 2,20 моль TMS-C1 на 1 моль йод-лактона-ДГК уже ни оказывало никакого влияния на течение реакции и являлось с экономической точки зрения чрезмерным.
Проведение стадии раскрытия йод-лактонов жирных кислот силирующим агентами ведут в среде ацетонитрила, что способствует снижению производственных затрат на получение целевого продукта (ДГК) ввиду невысокой стоимости данных реактивов. При использовании для раскрытия йод-лактонов жирных кислот силирующих хлорсилановых агентов в среду дополнительно вводят йодид натрия.
Оптимальная продолжительность реакции раскрытия йод-лактон-ДГК - 3-5 часов. Данный диапазон определен исходя из возможности трансформации TMS-C1 в TMS-I, который далее быстро реагирует с йод-лактоном-ДГК. Уменьшение времени реакции менее 3-х часов не обеспечивает образование необходимого количества TMS-I, требуемого для раскрытия йод-лактона ДГК. В результате снижается общий выход ДГК и требуются дополнительные процедуры очистки. Увеличение времени реакции более 5 часов не влияет на выход продукта (ДГК), так как весь йод-лактон-ДГК за это время полностью раскрывается.
Температура проведения реакции йод-лактонизации и реакции раскрытия йод-лактонов - 18-22°C обеспечивает достижение технического результата - получение чистого целевого продукта с хорошим выходом. К тому же, данный диапазон температур приближен к температурам реальных промышленных помещений, поскольку именно такая температура является наиболее комфортной при работе производственного персонала. При этом не нужно расходовать никаких дополнительных усилий по терморегулированию протекающих процессов - поскольку обе реакции не экзотермические, то температура их проведения соответствует температуре окружающей среды - 18-22°C.
В качестве неполярного органического растворителя в заявляемом технологическом процессе могут быть использованы, в частности, пентан, гексан, петролейный эфир, гептан. Для упрощения способа и уменьшения производственных затрат на получение ДГК целесообразно образовавшийся в процессе йод-лактонизации йод-лактон-ДГК экстрагировать из реакционной смеси пентаном или гексаном. Эти растворители в меньшей степени растворяются в реакционной смеси, не образуют эмульсий и имеют высокую экстракционную способность к йод-лактону-ДГК. Преимуществом использования данных растворителей является также то, что после экстракции их объединенные растворы не нужно упаривать и заново перерастворять йод-лактон-ДГК в гексане для того, чтобы удалить из раствора непрореагировавшие свободные жирные кислоты. Объединенные экстракционные растворы сразу обрабатывают для удаления свободных жирных кислот.
Соблюдение заявляемых режимных параметров на всех этапах технологического процесса обеспечивает высокий выход и качество целевого продукта - ДГК.
Способ осуществляют следующим образом.
Пример 1
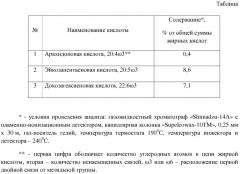
Для получения композиций с ДГК использовали морской (рыбный) жир со следующим составом жирных кислот, образующих йод-лактоны (см. табл. 1).
Каждый опыт проводили, используя в качестве исходного сырья 100 г рыбного жира вышеприведенного состава. Содержание ДГК в 100 г жира составляет 6,4 г.
Процесс получения композиций с ДГК проводили постадийно следующим образом.
1) Гидролиз жира
Принципиальная схема гидролиза жира* приведена на фиг. 2
100 г рыбного жира загружали в 2 л стеклянную емкость с подогревом и мешалкой и добавляли раствор 14,5 г NaOH в 500 мл 70%-ного этанола. Смесь перемешивали 1 час при температуре 65°C. Контроль за окончанием реакции гидролиза жира проводили тонкослойной хроматографией продуктов реакции на пластинках со слоем силикагеля («Sorbfil», Россия) в системе 80:20:1, гексан-диэтиловый эфир-уксусная кислота (объемные %). Далее реакционную смесь охлаждали до комнатной температуры.
2) Реакция йод-лактонизации
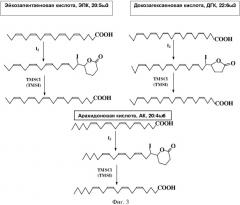
На Фиг. 3 приведена принципиальная схема получения ДГК методом йод-лактонизации.
К реакционной смеси с предыдущей стадии при перемешивании в течение 60 минут приливали раствор 4 г йода в 100 мл 95%-ного этанола. Температура проведения процесса 18°C. Соотношение ДГК/I2=1:0,95, моль/моль. Далее реакционной смеси давали дополнительную выдержку 30 минут. Общее время проведения процесса 90 минут.
Йод-лактон-ДГК экстрагировали пентаном 3 раза × 100 мл. Экстракты объединяли. Далее из объединенного экстракта удаляли свободные жирные кислоты, промывая его 2%-ным раствором Na2CO3, 3 раза × 30 мл. Пентановый экстракт упаривали.
Получено 8,40 г йод-лактона-ДГК, выход 94,2%, чистота 99,8%.
3) Раскрытие йод-лактона ДГК
Йод-лактон-ДГК добавляли к раствору 10 г NaI в 100 мл ацетонитрила и при перемешивании и температуре 18°C добавляли в течение 5 часов силирующий агент триметилхлорсилан, TMS-C1, при соотношении йод-лактон ДГК/силирующи