Молекулярные конъюгаты с поликатионным участком и лигандом для доставки в клетку и ядро клетки днк и рнк
Иллюстрации
Показать всеНастоящее изобретение относится к биотехнологии и представляет собой молекулярные конъюгаты, способные связываться с нуклеиновыми кислотами (ДНК или РНК) для доставки их в клетки млекопитающего, экспрессирующие рецепторы трансферрина. Указанные молекулярные конъюгаты состоят из поликатионной последовательности, представленной модифицированным сигналом ядерной локализации Т-антигена вируса SV40, и лиганда. В качестве лигандов клеточных рецепторов используется одна их двух последовательнсотей - HAIYPRH или THRPPMWSPVWP. Комплексы молекулярного конъюгата и нуклеиновой кислоты используют для получения препаратов для генной терапии или диагностики различных заболеваний. Для получения указанных комплексов растворы нуклеиновой кислоты и молекулярного конъюгата сливают при соотношении зарядов в реакционной среде от 1:0,63 и менее и используют для комплексообразования растворов с ионной силой менее 300 мМ. Настоящее изобретение позволяет повысить эффективность доставки генетических конструкций в клетки. 8 н. и 4 з.п. ф-лы, 8 ил., 1 табл., 1 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области медицины, фармакологии, биотехнологии, генной инженерии, генной терапии, а именно к доставке в клетки ДНК и РНК с терапевтической, диагностической и исследовательской целью.
Уровень техники
В развитии технологий генной терапии слабым местом остается обеспечение эффективной доставки генетических конструкций на основе ДНК и/или РНК внутрь клетки.
В настоящее время развивается целый ряд подходов, направленных как на повышение эффективности доставки генетических конструкций в клетки, так и обеспечение возможности их целенаправленной доставки только в определенные клетки и ткани.
Методы доставки генов в клетки млекопитающих
Плазматические мембраны клеток являются надежным барьером для проникновения чужеродных нуклеиновых кислот - РНК либо ДНК, если, конечно, нуклеиновые кислоты не находятся в вирусных частицах или не захватываются фагоцитирующими клетками. В некоторых случаях все же удается сделать мембрану временно проницаемой для ДНК и РНК, изменяя физическое состояние мембраны (текучесть, целостность). Возможность осуществления таких изменений зависит от ряда факторов: метаболической активности клеток, запаса энергетических веществ, способности к фагоцитозу, стадии жизненного цикла клеток.
Если полинуклеотидные последовательности не способны самостоятельно проникать в клетки через плазматическую мембрану, то относительно низкомолекулярные олигодезоксинуклеотиды (ОДН), возможно, составляют исключение. Механизм проникновения ОДН в клетки млекопитающих до конца не изучен, хотя предполагают, что ОДН поглощаются клетками сочетанием адсорбционного эндоцитоза и пиноцитоза, которые отчасти активируются путем связывания ОДН с рецептороподобными белками поверхности клеток широкого спектра тканей (Gewirtz A. M. et al., 1996). Большая часть попавших в клетки ОДН в конечном итоге оказывается в эндосомно/лизосомных везикулах и там гидролизуется ферментами.
В целом, большую роль в развитии методов генотерапии играет разработка средств и способов переноса "лечащих" генов (в составе векторов экспрессии) в организм, которые должны обеспечить высокую эффективность доставки генетических конструкций, их избирательное попадание в те или иные клетки и ткани, стабильное функционирование трансгенов в клетках при минимальных побочных эффектах: токсическом, воспалительном, иммуногенном и, возможно, мутагенном и онкогенном (Culver K. W., 1994). Кроме того, должны быть учтены и такие факторы, как экономичность создания и использования средств доставки.
Методы доставки генов в соматические и половые клетки млекопитающих в зависимости от условий обращения с клетками могут быть классифицированы как методы переноса in vitro, ex vivo и in vivo (Culver K. W., 1994). В первом случае (in vitro) доставку гена проводят в культивируемые клетки или ткани млекопитающих, чаще всего в экспериментальных целях, когда мишенью воздействия являются нормальные, мутантные или патологически измененные клетки. Во втором случае (ех vivo) перенос осуществляют в кратковременно культивируемые in vitro клетки, взятые из организма, и после подтверждения факта доставки в них "лечащего" гена клетки возвращают в организм экспериментального животного, донора или больного человека для достижения лечебного эффекта. В третьем случае (in vivo} направленный перенос генов с той же целью проводят непосредственно в клетки или ткани (мишени) живого организма.
Другая классификация наиболее распространенных средств доставки векторов экспрессии в клетки основана на способе переноса:
1. Вирусные (рекомбинантные аденовирусы, ретровирусы, аденоассоциированные вирусы, вирусы группы герпеса и осповакцины).
2. Невирусные биологические (липосомы, катионные липиды; поликатионы; вирусные оболочки, молекулярные конъюгаты; микросферы).
3. Физико-химические, физические (кальций-фосфатная трансформация клеток in vitro, электропорация, баллистическая процедура, микрокапиллярная инъекция).
Перенос генов с помощью рекомбинантных вирусов
Для переноса in vivo можно использовать рекомбинантные ретровирусы, аденовирусы, аденоассоциированные вирусы и вирусы герпеса. Доставка "лечащих" генов в составе рекомбинантных ретровирусов хронологически является одним их первых успешных опытов генотерапии человека. Разрабатываются проекты лечения, по которым ретровирусные частицы инъецируют in vivo с доставкой непосредственно в определенные ткани и органы (представленные пролиферирующими клетками). Кроме того, в некоторых случаях в организм больного инокулируют продуцирующие ретровирус "пакующие" клетки, например, интракраниально (стереотактически) в случае злокачественных опухолей головного мозга. К недостаткам ретровирусного переноса генов следует отнести возникающую при случайной встройке в хромосомы провируса опасность выключения экспрессии жизненно важных генов или активации онкогенов (Temin Н. М., 1990). Кроме того, по не вполне ясным причинам, ретровирусные векторы экспрессии со временем инактивируются, хотя и продолжают сохраняться в интегрированном с хромосомной ДНК виде.
Наиболее эффективны в доставке «лечащих» генов в организм млекопитающих рекомбинантные аденовирусы, поскольку инфекционный титр такого вируса может достигать 1010 БОЕ/мл; кроме того, аденовирусы обладают широкой тропностью к различным тканям, а при попадании в клетки их генетический материал вместе с "лечащим" геном перемещается в клеточные ядра, где сохраняется от двух недель до нескольких месяцев (Rosenfeld М. A. et al., 1991). "Лечащий" ген замещает в вирусном геноме область ранних генов аденовируса, вследствие чего такой вирус в клетках теряет способность к размножению и некоторое время спустя разрушается. К недостаткам переноса генов в составе аденовирусов относятся определенная токсичность дефектных вирусных частиц, способных продуцировать некоторые ранние вирусоспецифические белки в организме, и, кроме того, их высокая иммуногенность, что затрудняет повторные курсы лечения. Для снижения токсичности и иммуногенности разрабатывают серии аденовирусных векторов нового поколения, лишенных уже целого ряда вирусных генов (Fisher K. J. et al., 1996), что позволяет избежать синтеза вирусоспецифических белков после доставки "лечащего" гена в организм. В этом случае развитие иммунных реакций задержано и происходит лишь при повторных инъекциях аденовируса. Вирусные частицы вводят в организм внутривенными инъекциями или в виде аэрозоля в дыхательные пути для лечения наследственных дефектов дыхательного эпителия. В частности, для лечения больных муковисцидозом (наследственный дефект гена CFTR) в дыхательные пути пациента в виде аэрозоля вводят рекомбинантный аденовирус, содержащий вектор экспрессии гена CFTR (Zabner J. et al., 1993; Harvey В. G. et al., 1999; Lerondel S. et al., 2001; Davies J. C., 2002; Griesenbach U. et al., 2002; Gaden F. et al., 2004). Разрабатываются проекты по переносу "лечащих" генов в составе рекомбинантных вирусов других видов: аденоассоциированных вирусов (Nomura S. et al., 2004; Tietge U. J. et al., 2004; Oka K. et al., 2001; Kozarsky K. F. et al., 1996; Kobayashi K. et al., 1996; Kozarsky K. F. et al., 1994; Kozarsky K. et al., 1993; Flotte Т. R., 2004), вирусов простого герпеса (Coffin R. S. et al., 1996a; Weir J. P. et al., 1996; Coffin R. S. et al., 1996b; Wang M. et al., 1998; Wolfe D. et al., 2004; Niranjan A. et al., 2004; Goss J. R. et al., 2004; Cao B. et al., 2004; Goins W. F. et al., 2004), вируса осповакцины (Guo Z. S. et al., 2004; Di N. M. et al., 2003; Walther W. et al., 2000).
Аденоассоциированный вирус доставляет гены (небольшого размера) в одну из хромосом (19-ю) человека. К преимуществам такой доставки относят относительную легкость последующего удаления вирусного вектора из клеточной ДНК путем коинфекции клеток-мишеней вирусом-хелпером. Ограничением векторов, приготовленных на основе аденоассоциированых вирусов, является относительно низкая вместимость их капсиды для полинуклеотидов - около 5 т.п.н., что делает невозможным перенос крупноразмерных клеточных генов. Недавно появилось сообщение о разработке гибридного вектора, в котором репликативная форма рекомбинантного аденоассоциированного вируса упакована в капсид аденовируса. Емкость такого вектора оказывается существенно выше при сохранении сайт-специфической интегративной способности, присущей аденоассоциированным вирусам (Goncalves M. A. et al., 2004).
Рекомбинантные герпесвирусы рекомендуется использовать для доставки "лечащих" генов в клетки нервной ткани, в ядрах которых герпесвирусный геном способен длительно сохраняться в латентном состоянии (в виде эписомы) (Flotte Т. R., 2004; Coffin R. S. et al., 1996; Weir J. P. et al., 1996; Coffin R. S. et al., 1996; Wang M. et al., 1998; Gregorevic P. et al., 2004; Gruchala M. et al., 2004). Рекомбинантные вирусы вакцины (геном которых локализуется в цитоплазме) используют для процедуры молекулярного вакцинирования организма продуктами экспрессии чужеродных генов (Walther W. et al., 2000; Di N. M. et al., 2003; Guo Z. S. et al., 2004).
Невирусные системы переноса генов
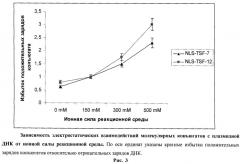
Голая плазмидная ДНК быстро деградирует под действием нуклеаз плазмы, что является серьезным препятствием при проведении трансфекций (Hashida M. et al., 1996; Crook K. et al., 1996). Эта проблема частично решается конденсацией ДНК позитивно зараженными молекулами, что защищает ДНК от действия нуклеаз (Sandgren S. et al., 2004; Wiethoff C.M. and Middaugh C.R., 2003; Luo D. and Saltzman W.M., 2000). He менее важная задача для невирусных систем - облегчение преодоления плазматической мембраны. Основным путем проникновения в клетку ДНК с помощью невирусных систем доставки является эндоцитоз. В большинстве случаев проникновение идет за счет клатрин- и кавеолин-независимого эндоцитоза, а также клатрин-независимого и адсорбционного эндоцитоза (Takei K. et al., 2001; Nichols B.J. et al., 2001). В некоторых типах клеток проникновение реализуется по механизму макропиноцитоза или фагоцитоза для достаточно крупных частиц (Apodaca G., 2001) (рис.2-11).
Впервые невирусные средства доставки были применены более 20 лет назад. Системы доставки генетических векторов должны выполнять несколько функций: связываться с доставляемым генетическим материалом, упаковывая ДНК и обеспечивая не только проникновение сквозь мембрану, но и защиту ДНК как до попадания в клетку, так и непосредственно после трансфекции, обеспечивая выход из лизосомных компартментов, сохранение в цитоплазме и транслокацию в ядро клетки. Преодоление не только плазматической мембраны, но и избежание лизосомной деградации введенной ДНК является весьма сложной задачей.
Известно, физиологические концентрации солей и белков в сыворотке крови существенно влияют на физико-химические свойства невирусных носителей и часто приводят к снижению или полной потере их свойств, что на данный момент сильно ограничивает применение таких систем in vivo (Molas M. et al., 2003; Ignatovich I. et al., 2003). В настоящее время ведутся активные исследования по разработке невирусных средств доставки, эффективных in vivo.
Катионные липиды
Первая удачная трансфекция с использованием катионных липидов (липоплекс) была проведена в 1987 году (Feigner P.L. et al. 1987). С тех пор этот метод нашел широкое применение не только в исследовательских целях, но и в клинических протоколах (Nabel G.J. et al., 1990). Его использование является относительно безопасным и простьм методом для локальной доставки в низких дозах (Li S. et al., 2000).
Основным компонентом мембран липосом являются фосфолипиды. Кроме того, для стабилизации частиц во внеклеточной среде в состав вводят 40-50 мол. % холестерина. Тропность липосом к клеткам разных типов зависит от заряда, который можно изменять варьированием фосфолипидного состава и различными добавками (Ropert С.1999).
Взаимодействие ДНК с катионными липосомами - это самопроизвольный процесс, инициирующийся ДНК-опосредованным слиянием липосом и крупномасштабной липидной реаранжировкой. Однако при образовании ДНК-липосомного комплекса не происходит конденсации ДНК (Li S. et al., 2000, Zuidam N. J. and Barenholz Y., 1998).
ДНК-липосомный комплекс относительно легко проникает в клетки в результате электростатической адсорбции позитивно заряженной мембраны липосом с плазматической мембраной эукаротической клетки или идет с участием эндоцитоза (Li S, et al., 2000; Zuidam N. J. et al., 1998; Smith R. M. and Wu G. Y. 1999). В ряде случаев существенную роль в проникновении комплексов ДНК с катионными липидами в нефагоцитирующие культивируемые клетки млекопитающих играет клатрин-опосредованный эндоцитоз (Zuhom I. S. et al., 2002). Молекулы клеточной поверхности, отвечающие за взаимодействие с липоплексом, еще не полностью изучены, однако известно, что важную роль в этом процессе играют протеогликаны клеточной поверхности (Scherman D. et al., 1998, Singh M., 1999).
Возможность применения катионных липидов не зависит от пролиферативной активности клеток, благодаря чему липоплекс может использоваться для трансформации неделящихся или медленно пролиферирующих клеток (Zuidam N. J. et al., 1998). Недостатком этого метода является деградация значительной части чужеродной ДНК под действием лизосомных гидролаз, а также токсичность при использовании в высоких дозах (Erbacher P. et al., 1996). Освобождение из эндосомальных компартментов в большинстве случаев достигается за счет повреждения мембраны эндосомы путем замещения части липидных компонентов между мембранами липосомы и эндосомы (Хи Y. and Szoka F. С., 1996). В соответствии с данной моделью анионные липиды эндосомальной везикулы взаимодействуют с катионными липидами липосом по «флип-флоп» механизму, обеспечивая частичное слияние мембран и высвобождение ДНК. С этим хорошо согласуются данные об увеличении эффективности трансфекции при добавлении к комплексам катионные липиды-ДНК нейтральных DOPE липидов, облегчающих слияние мембран (Hui S. et al., 1996; Farhood H. et al., 1995).
Молекулярные конъюгаты
Молекулярные конъюгаты представляют собой поликатионы, в большинстве случаев ковалентно сцепленные с лигандами клеточных рецепторов (Fajac I. et al., 2000). По сравнению с катионными липидами молекулярные конъюгаты более эффективно конденсируют ДНК в компактные структуры, что увеличивает стабильность комплексов и, в ряде случаев, способствует ядерной локализации переносимых генетических конструкций (Rudolph С. et al., 2000). В настоящее время создано и активно используется несколько различных типов молекулярных конъюгатов, на основе таких поликатионов как поли-L-лизин, полиэтиленимин и другие (Nolan G.P. et al., 1998; Kost T.A., 1999; Fajac I. et al., 2000; Rudolph C. et al., 2000).
Поликатионы легко ассоциируют с ДНК в растворе благодаря электростатическим взаимодействиям позитивно заряженных аминогрупп и отрицательно заряженных фосфатных групп ДНК. Размер формирующегося комплекса в значительной степени зависит от используемого лиганда (Rudolph С.et al., 2000). Как правило, образуется структура с диаметром менее 80-100 нм (Fajac I. et al., 2000), что позволяет использовать такой комплекс для доставки ДНК в различные типы клеток, т.к. большинство их имеют размер первичных эндосомальных компартметов 100-120 нм. (Cristano R.J. et al., 1995). Комплекс ДНК-конъюгат избирательно связывается клеточными рецепторами, с помощью лигандного участка конъюгата и переносится внутрь клетки рецептор-опосредованным эндоцитозом (Smith R.M., 1999; Gottschalk S. et al., 1996, Zeiphati 0. et al., 1998). В качестве лигандов к поверхностным клеточным рецепторам часто используют молекулы аксиалогликопротеинов, инсулина, трансферрина, эпидермального ростового фактора и др. белков, а также низкомолекулярные соединения (гликозидные остатки и др.) (Yanagihara K. et al., 2000).
Главное ограничение, возникающее при использовании поликатионных носителей - это быстрая инактивация и исчезновение из кровеносного русла при системном введении, что объясняется двумя основными причинами - агрегацией и абсорбцией белками сыворотки в условиях in vivo (Dash P.R. et al., 1999; Ogris M. et al., 1999).
При образовании комплекса электростатические взаимодействия между молекулой ДНК и поликатионным носителем приводят к образованию частицы, имеющей нейтральный заряд, что позволяет частицам легко агрегировать в водных растворах. Для снижения агрегации комплексов и их инактивации при добавлении в культуральную среду или системном введении в организм используют следующие подходы: «стерическую стабилизацию», добавляя молекулы полимера, в частности, полиэтиленгликоля (ПЭГ), предохраняющие от слипания, к которым в большинстве случаев присоединены лиганды, обеспечивающие специфическое взаимодействие с клеточными рецепторами. Еще один подход к повышению устойчивости комплексов - «электростатическая стабилизация». В этом случае образующиеся комплексы обладают положительным или отрицательным зарядом, что блокирует их слипание за счет электростатического отталкивания (Molas M. et al., 2003). Такие системы приобретают большую стабильность в присутствии солевых растворов и белков сыворотки (Ahn С.Н. et al., 2002; Oupicky D. et al., 2002). Аналогичные системы используются не только для поликатионных носителей (Ahn et al., 2002; Harada-Shiba et al., 2002; Oupicky et al., 2002), но также для систем на основе катионных липидов (Kamps et al., 2000; Ng et al., 2000; Carrion et al., 2001; Bendas et al., 2003).
Комплекс ДНК-конъюгат, не имеющий никаких молекулярных сигналов, попадая в клетку, существует в ней непродолжительное время (24-48 ч) и разрушается в лизосомах (Subramanian А. et al., 1999, Cristano R.J. et al., 1995). В связи с этим многие конъюгаты часто содержат молекулярные сигналы дестабилизации эндосомных мембран (такие как амфипатические пептиды вирусного происхождения, способные при снижении рН дестабилизировать эндосомы и способствовать выходу комплексов ДНК-конъюгат в цитоплазму) или (и) сигналы ядерной транслокации, что способствует проникновению чужеродной ДНК в ядро и сохранению ее в виде эписом продолжительное время (Colin М. et al., 2000, Yanagihara K. et al., 2000).
Некоторые молекулярные конъюгаты могут использоваться без применения дополнительных эндосомодестабилизирующих компонентов. Показано, что лизосомоопосредованная деградация комплексов ДНК с конъюгатами, синтезированными на основе полиэтиленимина, существенно ниже, чем при использовании в качестве поликатиона поли-L-лизина. По-видимому, отмеченное обстоятельство связано с буферными свойствами полиэтиленимина (Li S., Huang L. 2000, Nguyen H-K., et al., 2000). Точный механизм, обеспечивающий освобождение ДНК из эндосомных компартментов, недостаточно исследован, однако по мнению некоторых авторов основан на буферизации содержимого лизосом за счет иминогрупп полиэтиленимина, и на действии иминогрупп в качестве протонных акцепторов (эффект «протонной губки») (Kichler et al., 2001). Остается не ясным, вызывает ли ингибирование созревания эндосом непосредственное повреждение их мембраны и освобождение комплекса из поздних эндосом, или повышает вероятность выхода их содержимого за счет затягивания созревания эндосом, хотя, возможно, на практике реализуются обе эти гипотезы (Molas М. et al., 2003).
Существует большое число работ, в которых тестируются различные стратегии, увеличивающие эффективность освобождения комплексов из эндосомных компартментов, как за счет ингибирования деградации, так и за счет введения специфических доменов обеспечивающих дестабилизацию везикул (например некоторые порообразующие пептиды) (Yessine M-A. and Leroux J.-C., 2004.). Например использование хлорокина с различными комплексами ДНК/поликатион, в том числе поли-Ь-лизином и полиэтиленамином, обеспечивает увеличение рН и, как следствие, ингибирует гидролитическую активность лизомных энзимов (Gotten М. et al., 1990; Fajac I. et al., 2000; Zanta M.A. et al., 1997).
Несмотря на значительное увеличение эффективности трансфекции, применение агентов, повреждающих эндосомы, в значительной степени нарушает работу клетки, ингибируя рециркуляцию рецепторов на плазматическую мембрану и оказывая сильный токсический эффект (Molas М. et al., 2003).
К недостаткам существующих молекулярных конъюгатов, синтезированных, в основном, на основе поли-L-лизина или полиэтиленимина, следует отнести их токсичность, что ограничивает использование комплексов в высоких концентрациях (Gottschalk S. et al., 1996), а так же недостаточно высокую эффективность доставки экзогенной ДНК.
Весьма перспективным представляется применение для синтеза молекулярных конъюгатов низкомолекулярных лигандов и катионных носителей. По сравнению с белковьми молекулами, использование низкомолекулярных соединений позволяет повысить соотношение лиганд / ДНК, а так же существенно снизить размеры формируемого комплекса. Последнее является чрезвычайно важным, т.к. компактные комплексы (с диаметром 10-30 нм) способны самостоятельно проникать в ядро, что способствует длительной и эффективной экспрессии гена интереса (Erbacher P. et al., 1996).
Таким образом, из всех существующих на сегодняшний день невирусных способов доставки генов в организм млекопитающих, только молекулярные конъюгаты потенциально удовлетворяют одному из важных критериев для разработки систем переноса генов в опухолевые клетки человека - обеспечивать адресную доставку ДНК в клетки-мишени.
Лиганды трансферринового рецептора
Невирусная генотерапия заживления поверхностных повреждений млекопитающих предполагает создание молекулярных конъюгатов, способных эффективно доставлять гены митогенных факторов роста в клетки тканей, непосредственно окружающих места повреждений, прежде всего, в фибробласты кожи. Удачным кандидатом на роль рецептора, связывающего комплексы ДНК/конъюгат и обеспечивающиго их интернализацию клетками, является рецептор трансферрина.
Рецептор трансферрина человека активно изучается в качестве модели рецептор-опосредованного эндоцитоза (Thorstensen K. and Romslo I., 1993; Ponka P. and Lok C. N., 1999), как маркер пролиферации клеток (Ponka P. and Lok С.N., 1999; Inoue Т. et al., 1993) и как мишень для доставки в клетки различных фармакологических препаратов (Jones A. R. and Shusta E. V., 2007). Он представляет собой димер из двух идентичных трансмембранных гликопротеинов с молекулярной массой 95 кД, сцепленных ковалентно за счет межмолекулярных дисульфидных связей. Основная часть железа, поступающего в клетки, поглощается с участием рецептора трансферрина. Лигандом для рецептора трансферрина является трансферрин - внеклеточный транспортный белок с молекулярной массой 80 кД, способный эффективно связывать четыре иона Fe3+ (Ponka P. and Lok С.N., 1999). Особенностью трансферрина является изменение конформации при взаимодействии с ионами железа, что, как считается, является критичным для взаимодействия с рецептором (Ponka P. and Lok С.N., 1999). Экспрессия рецептора трансферрина происходит во всех клетках и тканях организма, но уровень экспрессии в разных тканях варьирует (Davies M. et al., 1981; Enns С.А., 1982). Максимальная экспрессия наблюдается в активно пролиферирующих клетках (10000-100000 молекул на клетку), тогда как неделящиеся клетки содержат всего несколько молекул рецепторов (Inoue T. et al., 1993).
Широкое распространение получило использование конъюгатов на основе трансферрина для доставки в клетки различных фармакологических препаратов. В частности, в литературе имеются сообщения об успешной доставке в опухолевые клетки цитотоксического агента доксорубицина, ковалентно сцепленного с трансферрином (Yeh С.J. G. and Faulk W. P., 1984; Barabas K. et al., 1992; Sizensky J. A. et al., 1992; Berczi A. et al., 1993a; Berczi A. et al., 1993b), доставки в клетки сплавленных белков, представляющих собой трансферрин, сцепленный с терапевтическими полипептидами (АН S. А. et al., 1999а; All S. A. et al., 1999b), переносе генов с помощью молекулярных конъюгатов трансферрин-полилизин в различные культивируемые клетки млекопитающих (Wagner E. et al., 1991; Strydom S. et al., 1993; Taxman D. J. et al., 1993; Schwarzenberger P. et al., 2001). В целях генотерапии трансферрин используется не только в составе молекулярных конъюгатов с полилизином, но и в комплексе с катионными липидами (Penacho N. et al., 2008), в составе наночастиц на основе катионных липидов и др. (Abela R. А. et al., 2008). Особенностью всех выше перечисленных систем переноса генов является использование в качестве лиганда природного трансферрина. Этот подход имеет существенные недостатки. Во-первых, результирующий комплекс ДНК/конъюгат обладает большим размером (более 100 нм), что затрудняет выход ДНК из эндосом и перенос в ядро (см. выше). Во-вторых, афинность взаимодействия трансферрина с рецептором очень сильно зависит от насыщения трансферрина ионами железа, что затрудняет получение транфекционно активных комплексов конъюгат-ДНК. Вместе с тем, в литературе имеется сообщение об обнаружении методом фагового дисплея пептидных лигандов, способных высокоаффинно взаимодействовать с рецептором трансферрина и индуцировать его интернализацию (Lee J. H. et al., 2001).
В последние годы появилось множество публикаций о свойствах пептидов HAIYPRH и THRPPMWSPVWP. Данные пептиды были обнаружены сразу в нескольких лабораториях, использующих фаговую библиотеку гептапептидов. Показано наличие у данных пептидов различных свойств, в том числе способность к интернализации в клетку в качестве лиганда рецептора трансферрина.
Показана возможность связывания с мышцами целого ряда пептидов, в том числе и HAIYPRH (US Patent 6,329,501 - Methods and compositions for targeting compounds to muscle, 2001)
В серии патентов и публикаций группы авторов показано использование пептида HAIYPRH и THRPPMWSPVWP для доставки в клетки различных агентов.
В патенте (US Patent 6743893 - Receptor-mediated uptake ofpeptides that bind the human transfemn receptor) описываются свойства этих двух пептидов, HAIYPRH и THRPPMWSPVWP, но патентуется только THRPPMWSPVWP. Он рассматривается в качестве лиганда трансферринового рецептора, обеспечивающего путем интернализации доставку в клетку различных агентов, таких как антигены, химиотерапевтические вещества, различные метки (флуоресцирующие или имеющие окраску). Однако в формуле данного патента отсутствует пункт о доставке в клетку ДНК или РНК, не кодирующих последовательность THRPPMWSPVWP для целей генной терапии.
В другом патенте (US 2008166293 - RECEPTOR-MEDIATED UPTAKE OF PEPTIDES THAT BIND THE HUMAN TRANSFERRED RECEPTOR, 2008-07-10) показано, что открыты два пептида (HAIYPRH и THRPPMWSPVWP), способных связываться и интернализироваться с помощью трансферринового рецептора человека (hTfR). Когда эти пептиды слиты с другими молекулами, то такой слитый продукт поглощается клетками, экспрессирующими hTfR. В качестве таких молекул, которые могут быть доставлены в клетку, рассматриваются пептиды, белки, антигены, химиотерапевтические вещества, противоопухолевые агенты, визуализируемые или радиоизотопные метки, липосомы, в том числе содержащие вторичные агенты. При этом в данном патенте авторы указывают на то, что пептид HAIYPRH не препятствует связыванию трансферрина с его рецептором, а также постулируют связывание данного пептида в другом участке рецептора, чем трансферрин, что косвенно свидетельствует в пользу того, что доставка различных агентов в клетку с помощью данного пептида, возможно, не опосредована рецептором трансферрина. Эти данные ставят под сомнение предыдущие патенты данных авторов, в которых настаивается на именно рецептор-опосредованном поглощении пептида HAIYPRH и связанных с ним агентов. Кроме того, в формуле данного патента отсутствует пункт о доставке в клетку ДНК или РНК для целей генной терапии.
В одном из патентов (СА 2449412, COLLAWAN J., MOORE В., LEE J., JEFFREY. RECEPTOR-MEDIATED UPTAKE OF PEPTIDES THAT BIND THE HUMAN TRANSFERRIN RECEPTOR 2002-06-06) показана возможность использования пептидов HAIYPRH и THRPPMWSPVWP для доставки слитых с ними молекул в клетки, экспрессирующие рецептор трансферрина (hTfR) путем интернализации связавшегося с рецептором пептида. Патентуется данный пептид, слитый с любьм другим белком или пептидом, с химиотерапевтическим агентом, флуоресцирующей или другого типа меткой, антигеном, а также нуклеотидной последовательностью, кодирующей этот пептид, в том числе и слитый с другими пептидами. В этом патенте не приводится использование данного пептида, слитого с пептидом ядерной локализации, не показана возможность использования пептида для генной терапии.
В другом патенте (USPTO Patent Application 20080166293, Receptor-mediated uptake of peptides that bind the human transferrin receptor) предлагается использовать пептиды HAIYPRH и THRPPMWSPVWP для доставки в клетку пептидов, белков, химиотерапевтических агентов, противоопухолевых агентов, визуализируемых маркеров и изотопов. Не предлагается использование данного пептида, слитого с пептидом ядерной локализации, не показана возможность использования пептида для генной терапии.
Предлагается использовать пептиды HAIYPRH и THRPPMWSPVWP для доставки в клетку пептидов, белков, химиотерапевтических агентов, флуоресцирующих маркеров (WO/2002/044329, RECEPTOR-MEDIATED UPTAKE OF PEPTIDES THAT BIND THE HUMAN TRANSFERRIN RECEPTOR). He предлагается использование данного пептида, слитого с пептидом ядерной локализации, не показана возможность использования пептида для генной терапии.
Особенностью патента (US Patent Application 20060193778 - Receptor-mediated uptake of peptides that bind the human transferrin receptor) является то, что постулируется доставка с помощью пептида HAIYPRH молекулы ДНК, кодирующей пептид HAIYPRH.
Показана возможность использования данных пептидов THRPPMWSPVWP и HAIYPRH в ряде конструкций для доставки молекул нуклеиновых кислот через клеточные мембраны и гемато-энцефалический барьер (US Patent Application 20050222009 - Dual phase - PNA conjugates for the delivery of PNA through the blood brain barrier, патент WO/2005/035550). Однако в данном патенте рассматриваются только комплексы на основе ковалентных связей, в том числе и с использованием линкерных молекул. Молекулы нуклеиновой кислоты, которые входят в эти комплексы, ограничены размером 100 пар нуклеотидов, пептиды HAIYPRH и THRPPMWSPVWP рассматриваются исключительно как специфические лиганды для рецептора. В качестве нуклеиновой кислоты рассматривается ДНК, кДНК, РНК и т.п. В качестве поликатионной половины рассматриваются пептиды, однако последовательности рецептор-связывающего пептида и поликатионного пептида в данном патенте разделены пространственно молекулами другого типа (нуклеиновыми кислотами, гидрофобными молекулами). Т.е. не рассматривается в качестве пептида доставки единая пептидная молекула, состоящая из последовательности HAIYPRH и поликатионного пептида. Кроме того, в данном изобретении не применяется пептид ядерной локализации для доставки конструкций в клеточное ядро.
Во всех этих патентах не приводятся условия формирования комплексов ДНК-пептид для целей генной терапии.
Схожие характеристики и у другого патента этой группы авторов (US Patent Application 20080038349 - Peptide-Pna Chimera Targeting Inducible Nitric Oxide Synthetase).
Авторы еще одного патента (US Patent Application 20070231300 - COVALENT CONJUGATES BETWEEN ENDOPEROXIDES AND TRANSFERRIN AND LACTOFERRIN RECEPTOR-BINDING AGENTS) предлагают использовать пептидные последовательности HAIYPRH и THRPPMWSPVWP для доставки в клетки гидропероксидов.
Во всех этих патентах не приводятся условия формирования комплексов ДНК-пептид для целей генной терапии.
Раскрытие изобретения
Приведенные выше недостатки вирусных векторов обусловили повышение значимости разработки невирусных систем переноса в клетки нуклеиновых кислот (НК) - ДНК и РНК. В качестве такой системы невирусного переноса ДНК и РНК в клетку нами были разработаны молекулярные конъюгаты, представляющие собой пептиды, состоящие из двух частей.
Одна часть является лигандом для клеточных рецепторов и представлена одной из двух пептидных последовательностей - SEQ ID NO 1 и SEQ ID NO 2. Данные последовательности обеспечивают связывание с клеточными рецепторами с последующей интернализацией. По имеющимся данным связывание происходит с рецептором трансферрина, хотя, возможно, не только с ним. Преимуществом использования клеточного рецептора трансферрина является его высокая экспрессия на пролиферирующих клетках, которая может достигать 10000-100000 молекул на клетку, что в значительной мере определяет эффективность доставки в клетку генотерапевтических конструкций, связанных с лигандом данного рецептора. Однако использование для целей генной терапии в качестве лиганда природного трансферрина имеет существенные недостатки, описанные выше. Используемые же нами пептидные последовательности обнаружены методом фагового дисплея пептидных лигандов, способных высокоаффинно взаимодействовать с рецептором трансферрина и индуцировать его интернализацию. Причем последние данные свидетельствуют о том, что данные пептиды не препятствуют связыванию трансферрина с его рецептором, что свидетельствует о связывании их в другом участке рецептора, отличном от участка связывания с трансферрином (US 2008166293, 2008). Это косвенно также может свидетельствовать в пользу того, что доставка различных агентов в клетку с помощью данного пептида, возможно, не опосредована не только рецептором трансферрина.
Другая часть разработанных нами молекулярных конъюгатов - поликатионная. Она представлена пептидной последовательностью модифицированного сигнала ядерной локализации Т-антигена вируса SV40 (SEQ ID NO 3).
Поликатионы взаимодействуют ассоциируют с ДНК в растворе благодаря электростатическим связям позитивно заряженных аминогрупп и отрицательно заряженных фосфатных групп ДНК. Обычно формируются структуры с диаметром менее 80-100 нм (Fajac I. et al., 2000), что позволяет использовать такой комплекс для доставки нуклеиновых кислот в различные типы клеток, т.к. большинство их имеют размер первичных эндосомальных компартметов 100-120 нм. (Cristano R.J. et al., 1995).
Таким образом, поликатионная часть разработанных нами молекулярных конъюгатов обеспечивает их связывание с нуклеиновьми кислотами (ДНК или РНК) и транспортировку последних в ядро клетки. Лигандная же часть служит для рецептор-опосредованной интернализации комплекса, обеспечивая таким образом его проникновение в клетку.
Осуществление изобретения
В работе использовали реактивы для пептидного синтеза и производные аминокислот (Sigma Chemical Co., Fisher Scientific, Bachem, США; Reanal, Венгрия; Saxon Biochemicals GMBH, Германия), 4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидо-норлейциламинометил полимер (Gl Biochem, Китай). Диметилформамид перед использованием перегоняли в вакууме и хранили над молекулярными ситами 4 Å. Индивидуальность производных аминокислот контролировали методом ТСХ на пластинках Merck F 254 (Германия) в следующих системах растворителей: 1% аммиак-втор-бутиловый спирт, 1:3 (А); хлороформ-метанол, 9:2 (Б); хлороформ-метанол-уксусная кислота, 90:7:3 (В). Визуализацию хроматограмм проводили УФ облучением при 254 нм и методом обугливания в серной кислоте.
Твердофазный синтез пептидов проводили на полуавтоматическом синтезаторе NPS-4000 (Neosystem Laboratoires, Франция).
Анализ полученных пептидов методом ВЭЖХ проводили с использованием хроматографа System Gold (Beckman, США) на колонках Zorbax 300SB-C18 (4.6×150 мм, 5 мкм) для аналитической хроматографии и Discovery С18 (10×250 мм, 5 мкм) для препаративной. Условия хроматографии: УФ-детекция при 230 нм, градиент ацетонитрила в 0.1% H3PO4 при скорости потока 1 мл/мин для аналитической и градиент ацетонитрила в 0.1% TFA при скорости потока 5 мл/мин для препаративной хроматографии. Аминокислотный анализ проводили на анализаторе "Microtechna" T339M (Чехословакия) после гидролиза пептидов 6 н. HCl при 110°С в течение 24 ч. Масс-спектры регистрировали на времяпролетном масс-рефлектроне МХ-5303 с источником ионов типа "Электроспрей".
Использованные в работе пептиды синтезировали на 4-(2',4'-диметоксифенил-Fmoc-аминометил)-феноксиацетамидо-норлейциламинометил-полимере с содержанием аминогрупп 0.5 ммоль/г. Для защиты боковой функции Ser, Thr и Tyr использовали But-группу, для Arg - Pbf, для Lys и Trp - ВОС, для His - Trt. В качестве временной Nα-защиты служила Fmoc-группировка.
Наращивание пептидной цепи проводили на полуавтоматическом пептидном синтезаторе NPS-4000 (Neosystem Laboratoires, Франция) по следующему протоколу для каждого цикла: 1). CH2Cl2 (1 мин); 2). DMF (1 мин); 3). 20% пиперидин/DMF (2 и 8 мин); 4). DMF (3×1 мин); 5). Изопропиловый спирт (3×1 мин); 6). DMF (3×1 мин); 7). Реакция конденсации (2 ч); 8). DMF (2 x 1 мин); 9). CH2Cl2 (1 мин).
Для конденсации использовали четырехкратные избытки активированных 1-оксибензотриазоловых эфиров соответствующих Fmoc-аминокислот, полученных in situ (по 1 экв. Fmoc-аминокислоты, DIC и HOBt, перемешивание в DMF при 0°С, 30 мин). По окончании реакции проводили тест на полноту ацилирования. При необходимости повторной конденсации использовали следующий протокол:
а). DMF (1 мин); б). 5% DIEA/DMF (1 и 2 мин), после чего стадии 6) - 9) повторяли.
В случае неполного прохождения реакции конденсации при ее повторении 1-2 раза, непрореагировавшие группировки ацетилировали (после промывки CH2Cl2 к пептидил-полимеру добавляли 10 экв. уксусного ангидрида, 10 экв. 10% DIEA/CH2Cl2 и перемешивали в течение 10 мин).
Отщепление синтезированных пептидов от полимера с одновременным деблокированием проводили действием смеси TIS: Н2О: TFA (2.5: 2.5: 95; 5 мл/0.5 г смолы) в течение 2 ч. Реакционную смесь разбавляли охлажденным эфиром и осадок отфильтровывали на фильтре Шотта. Пептид отделяли от полимера растворением в TFA и повторно осаждали эфиром. Выпавший продукт отфильтровывал