Способ скрининга и мониторинга онкологических заболеваний и набор для его осуществления (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к области биохимии. Заявлены варианты способа скрининга и мониторинга онкологических заболеваний, включающего забор образца ткани, выделение из образца ткани РНК, синтез кДНК, амплификацию методом множественной обратной транскрипции полимеразой цепной реакции с последующим анализом амплифицированных продуктов. При этом ПЦР проводят с использованием композиции праймеров с последовательностями SEQ ID NO: 1-24 и 26-29, специфических к мРНК генов MAGEA1-6, GAGE1-8, NY-ESO-1, SSX1, 2, 4, XAGE1, TRAG3 и MAGEC1. Анализ амплифицированных продуктов проводят в том числе с использованием зондов, представленных последовательностями SEQ ID NO: 30-35 и 37. Также заявлены варианты набора для осуществления скрининга и мониторинга онкологических заболеваний. Набор включает праймеры с последовательностями SEQ ID NO: 1-24 и 26-29, а также может дополнительно включать зонды с последовательностями SEQ ID NO: 30-35 и 37. Изобретение позволяет повысить точность диагностики онкологических заболеваний различных органов. 4 н. и 3 з.п. ф-лы, 3 ил., 2 табл.
Реферат
Группа изобретений относится к молекулярной биологии и биотехнологии, касается вариантов способа скрининга и мониторинга онкологических заболеваний и вариантов набора для его осуществления, которые могут быть использованы в медицине.
Онкологические заболевания являются одной из наиболее распространенных причин смерти среди людей. Эффективность лечения рака во многом зависит от стадии заболевания. Выявление онкологического заболевания на ранней стадии повышает вероятность выздоровления.
В настоящее время для скрининга злокачественных новообразований и мониторинга течения заболевания используются лабораторные методы и способы обнаружения белковых опухолевых маркеров, определяемые в сыворотке крови с помощью специфических моноклональных антител: СА125, раково-эмбрионального антигена СЕА (US 7056660, С07Н 21/04, CM2Q 1/68, опубл. 06.06.2006 г.), альфа рецептора интерлейкина 2 (RU 2144675, G01N 33/53, опубл. 20.01.2000 г.) или простат - специфического антигена (US 7622564, С07Н 21/04, С07К 14/705, С07К 14/82, С07К 16/30, C12N 15/09, С12Р 21/06, C12Q 1/68, опубл. 09.02.2006). Описаны методы диагностики онкологических заболеваний, в которых в качестве маркеров используются полинуклеотиды (RU 2174409, А61К 48/00, G12N 15/12, опубл. 20.05.2000 г.). внеклеточные нуклеиновые кислоты (RU 2251696, G01N 33/53, опубл. 27.01.2005 г.).
Недостатки данных способов выражаются в низкой чувствительности или недостаточной специфичности используемых маркеров, высоком проценте ложноположительных или ложноотрицательных результатов.
Представленные недостатки определили направленность научных исследований на поиск более специфичных маркеров онкологического процесса. Наиболее близкими к заявляемому проекту являются способы диагностики онкологических заболеваний, основанные на выявлении мРНК, специфичной для опухолевых клеток. К настоящему времени известна группа раково-тестикулярных (СТ - от английского cancer/testis) генов, характеризующаяся ограниченной экспрессией в клетках человека. Транскрипция СТ генов наблюдается в семенниках, клетках зародыша и плаценты, иногда в клетках иммунопривилегированных тканей, а также в неопластических клетках различного происхождения. В остальных клетках экспрессия СТ генов подавлена эпигенетически [Simpson A.J.G., Caballero О.L., Jungbluth А., et al. 2005. Cancer/testis antigens, gametogenesis and cancer. Nature reviews. 5, 615-625]. Ограниченная экспрессия СТ генов позволяет использовать их мРНК в качестве маркеров опухолевых клеток при различных онкологических заболеваниях.
К настоящему моменту известны несколько методов обнаружения мРНК СТ генов методом обратной транскрипции - полимеразной цепной реакции (ОТ-ПЦР) или количественной ПЦР. Тестируются образцы опухолей, полученные хирургически, или образцы биологических жидкостей. Непосредственно сразу после извлечения образцы замораживают в жидком азоте для хранения и транспортировки. Для анализа образца проводят выделение мРНК. На ее основе синтезируется комплементарная ДНК (кДНК), которая амплифицируется с использованием ПЦР. Результаты реакции регистрируются методом электрофореза нуклеиновых кислот.
Известны способы идентификации мРНК группы генов MAGE-A методом ОТ-ПЦР, включающие праймеры и наборы для осуществления методов, например: US 5612201, С07К 14/47, С07К 16/30, C12Q 1/68, А61К 38/00, А61К 39/00, С07Н 21/02, С07Н 21/04, С12Р 19/34, опубл. 18.03.1997 г.; US 6057105, C12Q 1/68, С07Н 21/00, С07Н 21/04, С12Р 19/34, 02.05.2000 г; US 6475727, C12N 15/09, C12Q 1/68, G01N 33/50, G01N 33/574, опубл. 05.11.2002 г.; US 6939671, C12Q 1/68, С07Н 21/04, С12Р 19/34, опубл. 24.10.2002 г.; US 7491814, С07К 14/47, С12Р 19/34, C12Q 1/68, опубл. 06.07.2006 г.), мРНК группы генов SSX (US 6287756, А61К 38/00, С07Н 21/04, С07К 14/82, C12N 15/09, C12N 5/10, С12Р 19/34, С12Р 21/04, C12Q 1/00, C12Q 1/68, опубл. 11.09.2001 г.) и мРНК группы генов GAGE (US 7098008, C12N 15/09, C12N 15/12, C12Q 1/68, G01N 27/447, G01N 33/483, G01N 33/50, С12Р 19/34, опубл. 05.06.2003 г.). Присутствие в биологическом образце молекул мРНК генов MAGE-A, SSX и GAGE является индикатором опухолевого процесса в организме человека.
К недостаткам данных методов можно отнести низкую частоту обнаружения каждой из мРНК данных СТ генов, вызванную гетерогенностью экспрессии генов в опухолевых клетках. Случайный характер экспрессии СТ генов является основной проблемой для использования их мРНК в качестве маркеров опухолевых клеток. Для увеличения эффективности диагностики используют комбинации из нескольких маркеров.
Известен метод детекции метастазирующих опухолевых клеток в периферической крови человека при заболевании раком молочной железы, раком желудка, раком поджелудочной железы, раком толстого кишечника и метастазирующей меланомой с помощью мультимаркерной количественной ОТ-ПЦР с регистрацией результатов реакции в режиме реального времени. Метод основан на использовании панели биологических маркеров, среди которых MAGE-А3, GalNAcT, MART-1. РАХ3, Mitf, TRP-2, тирозиназа и другие (US 7910295, С12Р 19/34, C12Q 1/68, G01N 33/53, опубл. 30.12.2004 г.). Описан способ детекции меланомных или карциномных клеток с использованием количественной полимеразной цепной реакции в реальном времени. В качестве маркеров меланомы в данном изобретении используются мРНК GalNAc-T. MAGE-А3, MART-1, РАХ3 и TRP-2, маркеров карциномы - мРНК C-Met, MAGE-А3, Stanniocalcin 1, Stanniocalcin 2, mammaglobin, HSP27, GalNAc-T, CK20 и beta-HCG (US 8039218, C12P 19/34, C12Q 1/68, G01N 33/53, опубл. 01.06.2006 г.).
К недостаткам представленных методов относится присутствие мРНК генов, постоянно экспрессирующихся в клетках кожи и других тканей человека, что позволяет использовать эти маркеры только для количественного сравнения между образцами.
Для увеличения эффективности диагностики используют комбинации большого количества мРНК маркеров. Используемые способы включают выделение РНК, синтез кДНК с использованием олиго-Т праймера, содержащего последовательность промотора для Т7 РНК-полимеразы, синтез комплементарной РНК с использованием дидезоксинуклеозидтрифосфатов, меченных флуоресцентными красителем, гибридизацию с олигонуклеотидами, ковалентно связанными с поверхностью чипа, регистрацию результатов реакции и сравнение профилей экспрессии исследуемых генов между образцами с использованием компьютерных программ. Такой метод позволяет анализировать характер экспрессии от нескольких десятков до нескольких тысяч генов в исследуемом образце.
Известен способ обнаружения опухолевых клеток рака крови с использованием анализа экспрессии более чем семи тысяч генов человека. Метод основан на определении в образце биопсии паттернов мРНК 7074 генов, с использованием биочипов высокой плотности, которая сравнивается с паттерном мРНК тех же генов в образце, полученном от здорового человека. Основным недостатком этого метода является использование генов домашнего хозяйства для нормализации при сравнении паттернов мРНК между образцами и чипов высокой плотности, которая предполагает проведение исследования в нескольких повторах для исключения неспецифических сигналов (US 6936417, C12Q 1/68, 26.02.2004 г.).
Недостатками методов, основанных только на ОТ-ПЦР, является низкая частота обнаружения одного онкомаркера, а методов, основанных на использовании чипов высокой плотности, - низкая специфичность и сложность интерпретации результатов. Также они обладают общим недостатком - отсутствием метода хранения и транспортировки исследуемых образцов или использованием метода глубокой заморозки, при котором происходит деградация мРНК в момент оттаивания.
Наиболее близким по технической сущности и достигаемому результату к предлагаемому изобретению является наиболее специфичный и чувствительный способ, основанный на выявлении мРНК двух семейств генов MAGEA и GAGE, включающий праймеры и набор для их использования (US 7098008, C12N 15/09, C12N 15/12, C12Q 1/68, G01N 27/447, G01N 33/483, G01N 33/50, С12Р 19/34, опубл. 05.06.2003 г.), выбранный в качестве ближайшего аналога (прототипа).
В способе по прототипу праймеры получены на основе высокогомологичных последовательностей двенадцати субтипов гена MAGE и восьми субтипов гена GAGE. Диагностический набор предназначен для детекции мРНК шести субтипов гена MAGE и восьми субтипов гена GAGE методом ОТ-ПЦР для диагностики рака на начальных стадиях, мониторинга прогрессии заболевания и прогнозирования его течения.
Недостатком способа является низкая частота обнаружения используемых маркеров в периферической крови (в 3 из 20 случаев).
В задачу изобретения положено создание способа скрининга и мониторинга онкологических заболеваний с более высокой чувствительностью.
Технический результат от использования изобретения заключается в повышении точности диагностики онкологических заболеваний различных органов.
Это достигается тем, что в способе скрининга и мониторинга онкологических заболеваний путем выявления онкологических маркеров, состоящих из матричной РНК (мРНК) раково-тестикулярных генов MAGE и GAGE в образцах тканей человека, включающем забор образца ткани, выделение из образца ткани РНК, синтез кДНК и амплификацию методом множественной обратной транскрипции полимеразой цепной реакции с последующим анализом амплифицированных продуктов, дополнительно детектируют мРНК генов NY-ESO-1, SSX, XAGE1, TRAG3 и MAGEC1, при этом амплификацию проводят с композицией праймеров, специфических к мРНК генов MAGEA1-6, GAGE1-8, NY-ESO-1, SSX1, 2, 4, XAGE1, TRAG3 и MAGEC1, представленных последовательностями SEQ ID NO: 1-29; композицию праймеров используют для выявления онкологических маркеров, представляющих собой мРНК шести генов MAGEA (MAGEA1-6), мРНК восьми генов GAGE (GAGE1-8), мРНК трех генов SSX (SSX1, 2 и 4), мРНК NY-ESO-1, мРНК XAGE1, мРНК MAGEC1 и мРНК TRAG3; осуществляют консервацию образцов тканей путем смешивания образцов тканей с равным объемом консервирующего буфера.
Это достигается также тем, что в способе скрининга и мониторинга онкологических заболеваний путем выявления онкологических маркеров, состоящих из матричной РНК (мРНК) раково-тестикулярных генов MAGE и GAGE в образцах тканей человека, включающем забор образца ткани, выделение из образца ткани РНК, синтез кДНК и амплификацию с последующим анализом амплифицированных продуктов, дополнительно детектируют мРНК генов NY-ESO-E SSX, XAGEE TRAG3 и MAGEC1, при этом амплификацию проводят с использованием нуклеозидтрифосфатов, меченных флуоресцентным красителем, и анализируют присутствие мРНК генов MAGEA1-6, GAGE1-8, NY-ESO-1, SSX1, 2, 4, XAGE1, TRAG3 и MAGEC1 методом гибридизации нуклеиновых кислот с использованием композиции праймеров, представленных последовательностями SEQ ID NO: 1-29, и зондов, представленных последовательностями SEQ ID NO: 30-37; используют композицию праймеров и зондов для выявления онкологических маркеров, представляющих собой мРНК шести генов MAGEA (MAGEA1-6), мРНК восьми генов GAGE (GAGEJ-8), мРНК трех генов SSX (SSX1, 2 и 4), мРНК NY-ESO-1, мРНК XAGE1, мРНК MAGEC1 и мРНК TRAG3; осуществляют консервацию образцов тканей путем смешивания образцов тканей с равным объемом консервирующего буфера.
Это достигается также тем, что набор для осуществления скрининга и мониторинга онкологических заболеваний включает праймеры, имеющие последовательности SEQ ID NO: 1-29.
Это достигается также тем, что набор для осуществления скрининга и мониторинга онкологических заболеваний включает праймеры, имеющие последовательности SEQ ID NO: 1-29, и зонды, имеющие последовательности SEQ ID NO: 1-37.
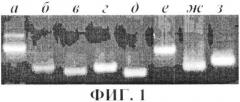
На фиг.1 представлены результаты обнаружения мРНК раково-тестикулярных генов в образце опухолевого очага больного раком толстого кишечника методом ОТ-ПЦР (электрофореграмма), б - мРНК TRAG3 (159 п.н.); в - мРНК MAGEC1 (138 п.н.); г - мРНК NY-ESO-1 (159 п.н.); д - мРНК SSXE2.4 (129 п.н.); е - мРНК MAGEA1-6 (265 п.н.); ж - мРНК XAGE1 (162 п.н.); з - мРНК GAGE 1-8 (170 п.н.).
На фиг.2. представлена гибридизационная картина обнаружения мРНК раково-тестикулярных генов: 1 - мРНК MAGEA1-6, 2 и 8 - отрицательный контроль, 3 - мРНК NY-ESO-1, 4 - мРНК MAGEC1, 5 - мРНК TRAG3, 6 - мРНК SSX1, 2, 4, 7 - мРНК XAGE1, 9 - мРНК GAGE1-8.
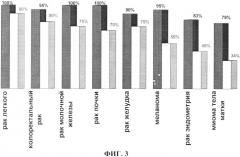
На фиг.3 представлена диаграмма частоты обнаружения мРНК MAGEA1-6, GAGE 1-8, NY-ESO-1, SSX1, 2, 4. XAGE1, TRAG3 и MAGE-C1 в опухолевых очагах и периферической крови онкологических больных (черная заливка - опухолевые очаги, серая заливка - периферическая кровь).
В соответствии с изобретением по 1 варианту используют композиции из праймеров для выявления онкологических маркеров, представляющих собой мРНК шести генов MAGEA (MAGEA1-6), мРНК восьми генов GAGE (GAGE1-8), мРНК трех генов SSX (SSX1, 2 и 4), мРНК NY-ESO-1, мРНК XAGE1, мРНК MAGEC1 и мРНК TRAG3, и в соответствии с изобретением по 2 варианту используют композиции из праймеров и зондов для выявления онкологических маркеров, представляющих собой мРНК шести генов MAGEA (MAGEA 1-6), мРНК восьми генов GAGE (GAGE 1-8), мРНК трех генов SSX (SSX1, 2 и 4), мРНК NY-ESO-1, мРНК XAGE1, мРНК MAGEC1 и мРНК TRA.G3, которые с высокой частотой детектируются в образцах тканей больных раком, включая периферическую кровь, но не выявляется в периферической крови людей без онкологических заболеваний. Данное наблюдение позволило создать способ диагностики онкологических заболеваний, основанный на исследовании тканей человека на присутствие композиции маркеров и с высокой вероятностью диагностировать наличие новообразования в случае обнаружения одной или более мРНК из представленных в композиции.
Обнаружение мРНК генов, входящих в композицию, осуществляют с помощью традиционных методов, например ОТ-ПЦР, гибридизации нуклеиновых кислот и т.д. Лучшие результаты достигались методом множественной ОТ-ПЦР с использованием оригинальных праймеров и гибридизацией нуклеиновых кислот с оригинальными олигонуклеотидными зондами. Образец ткани человека используют для анализа сразу после инвазивного вмешательства или помещают в консервирующий раствор, транспортируют до места использования или хранят при отрицательных температурах. Из образца выделяют РНК, которую превращают в кДНК и амплифицируют в присутствии оригинальных олигонуклеотидов и нуклеозидтрифосфатов, содержащих флуоресцентный краситель. Меченую кДНК гибридизуют с оригинальными олигонуклеотидными зондами, прикрепленными к подложке, и оценивают результат по присутствию флуоресценции. Предлагаемый способ осуществляют следующим образом.
Используют следующие нуклеотидные последовательности mRNA, зарегистрированные и обозначенные в базе данных GenBank: Homo sapiens (далее - Hs) G antigen 1 (GAGE1), NM_001468; Hs G antigen 2 (GAGE2), NM_001472; Hs G antigen 3 (GAGE3), NM_001473; Hs G antigen 4 (GAGE4), NM__001474; Hs G antigen 5 (GAGE5), NM_001475; Hs G antigen 6 (GAGE6), NM_001476; Hs G antigen 7 (GAGE7), NM021123; Hs G antigen 8 (GAGE8), NM_012196; Hs G antigen, family D. 2 (XAGE1), NM 020411; Hs autoimmunogenic cancer/testis antigen NY-ESO-1, U87459; Hs melanoma antigen family С, 1 (MAGEC1), NM_005462 и XM_936930; Hs synovial sarcoma, X breakpoint 1 (SSX1), NM_005635 XM; Hs synovial sarcoma, X breakpoint 2 (SSX2), transcript variant 1, NM 003147; Hs synovial sarcoma, X breakpoint 4 (SSX4), transcript variant 1, NM_005636; Hs melanoma antigen family A, 1 (MAGEA1), NM_004988; Hs melanoma antigen family A, 2 (MAGEA2), NM_153488; Hs melanoma antigen family A, 3 (MAGEA3), NM_005362; Hs melanoma antigen family A, 4 (MAGEA4), NM 001011548; Hs melanoma antigen family A, 5 (MAGEA5), NM_021049; Hs melanoma antigen family A, 6 (MAGEA6), NM 005363; Hs taxol resistant associated protein (TRAG3), AF 080246.1.
Анализ нуклеотидных последовательностей проводят с использованием ресурсов, доступных в интернете на портале NCBI, и компьютерной программы MEGA3.1.
На основе проведенного анализа, для каждой из исследуемых мРНК подбирают олигонуклеотидные праймеры, специфичные к местам соединения экзонов, что позволяло предотвратить амплификацию хромосомной ДНК при проведении ПЦР, и разрабатывают олигонуклеотидные зонды, специфичные к синтезируемой в ПЦР ДНК.
Для семейств генов MAGEA, GAGE, SSX конструируют универсальные праймеры и зонды, позволяющие одновременно детектировать мРНК шести генов MAGEA (MAGEA1-6), а также универсальные праймеры и зонды для мРНК восьми генов GAGE (GAGE 1-8) и праймеры и зонды, специфичные одновременно к мРНК трех генов SSX (SSX1, 2, 4).
Праймеры используют в ОТ-ПЦР, а праймеры и зонды - в гибридизации нуклеиновых кислот.
Для осуществления заявленного способа скрининга и мониторинга онкологических заболеваний используют следующий набор олигонуклеотидов в качестве праймеров и зондов для детекции и/или идентификации мРНК генов MAGEA1-6, GAGE 1-8, NY-ESO-1, SSX1, 2, 4, XAGE1, TRAG3 и MAGEC1.
Количество последовательностей: 37
№ последовательности: SEQ ID NO: 1
Длина: 19 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов MAGEA1-6
Описание последовательности SEQ ID NO: 1(5′-3′):
ACTGAAGGAGAAGATCTGC
№ последовательности: SEQ ID NO: 2
Длина: 19 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов MAGEA 1-6
Описание последовательности SEQ ID NO: 2(5′-3′):
GTGCTTGGCCCCTCCTCTTC
№ последовательности: SEQ ID NO :3
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов MAGEA 1-6
Описание последовательности SEQ ID NO: 3(5′-3′):
GAAGGAGAAGATCTGCCWGT (W=А или Т)
№ последовательности: SEQ ID NO:4
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов MAGEA 1-6
Описание последовательности SEQ ID NO: 4(5′-3′):
CTGGAGGCTCCCTGAGGACT
№ последовательности: SEQ ID NO: 6
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов SSX1, 2, 4
Описание последовательности SEQ ID NO: 5(5′-3′):
GAGAAGTTCCGAAAGGCCTT
№ последовательности: SEQ ID NO: 7
Длина: 21 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов SSX1, 2, 4
Описание последовательности SEQ ID NO: 7(5′-3′):
AGGTTATGACTAAACTAGGT
№ последовательности: SEQ ID NO: 8
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов SSX1, 2, 4
Описание последовательности SEQ ID NO: 8(5′-3′):
AAGTCATCTGAGGACGTTCA
№ последовательности: SEQ ID NO: 9
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена XAGE1
Описание последовательности SEQ ID NO: 9(5′-3′):
CTACTGAGACACGGCGGACA
№ последовательности: SEQ ID NO: 10
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена XAGE1
Описание последовательности SEQ ID NO: 10(5′-3′):
TTGTTTCAGCTTGTCTTCAT
№ последовательности: SEQ ID NO: 11
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена XAGE1
Описание последовательности SEQ ID NO: 11(5′-3′):
ATACAGCTGAGATCCCAGTG
№ последовательности: SEQ ID NO: 12
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена XAGE1
Описание последовательности SEQ ID NO: 12(5′-3′):
TTGTGGTTGCTCTTCACCTG
№ последовательности: SEQ ID NO: 13
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена MAGEC1
Описание последовательности SEQ ID NO: 13(5′-3′):
CCTATCCAGTCTTCAAGGTG
№ последовательности: SEQ ID NO: 14
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена MAGEC1
Описание последовательности SEQ ID NO: 14(5′-3′):
CAGGACAACTCTGAGGACTC
№ последовательности: SEQ ID NO: 15
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена MAGEC1
Описание последовательности SEQ ID NO: 15(5′-3′):
AGTGCCAGGAGTCAAGGTTC
№ последовательности: SEQ ID NO: 16
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена MAGEC1
Описание последовательности SEQ ID NO: 16(5′-3′):
GCATATCCTTGTCCCCCATG
№ последовательности: SEQ ID NO: 17
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена NY-ESO-1
Описание последовательности SEQ ID NO: 17(5′-3′):
AGAGCCGCCTGCTTGAGTTC
№ последовательности: SEQ ID NO: 18
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена NY-ESO-1
Описание последовательности SEQ ID NO: 18(5′-3′):
TCTGCAGCAGTCAGTCGGAT
№ последовательности: SEQ ID NO: 19
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена NY-ESO-1
Описание последовательности SEQ IDNO: 19(5′-3′):
CCTGCTTGAGTTCTACCTCG
№ последовательности: SEQ ID NO: 20
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена NY-ESO-1
Описание последовательности SEQ ID NO: 20(5′-3′):
GCAGTCAGTCGGATAGTCAG
№ последовательности: SEQ ID NO: 21
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов GAGE 1-8
Описание последовательности SEQ ID NO: 21(5′-3′):
ATTGGGCCTATGCGGCCCGA
№ последовательности: SEQ ID NO: 22
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов GAGE 1-8
Описание последовательности SEQ ID NO: 22(5′-3′):
TCCAACAYAGGAGCAGCCTG (Y=Т или С)
№ последовательности: SEQ ID NO: 23
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов GAGE 1-8
Описание последовательности SEQ ID NO: 23(5′-3′):
AGCATCTGCAGSTCAAGGGC (S=G или С)
№ последовательности: SEQ ID NO: 24
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК генов GAGE 1-8
Описание последовательности SEQ ID NO: 24(5′-3′):
TCTTTTAACACTGTGATTGC
№ последовательности: SEQ ID NO: 26
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена TRAG3
Описание последовательности SEQ ID NO: 26(5′-3′):
AGAAGCCCTATCAAAGTTCC
№ последовательности: SEQ ID NO: 27
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена TRAG3
Описание последовательности SEQ ID NO: 27(5′-3′):
TTGTGGTCCCGCTATGGCTC
№ последовательности: SEQ ID NO: 28
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена TRAG3
Описание последовательности SEQ ID NO: 28(5′-3′):
AGAAGCCCTATCAAAGTTCC
№ последовательности: SEQ ID NO: 29
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: праймер для детекции и/или идентификации мРНК гена TRAG3
Описание последовательности SEQ ID NO: 29(5′-3′):
TCGTTCGGCTGGTCAGAGTG
№ последовательности: SEQ ID NO: 30
Длина: 30 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: зонд для детекции и/или идентификации мРНК генов MAGEA1-6
Описание последовательности SEQ ID NO: 30(5′-3′):
GGCATGATGACTCTGGTCAGGGCAACAGGC
№ последовательности: SEQ ID NO: 31
Длина: 30 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: зонд для детекции и/или идентификации мРНК генов SSX 1, 2, 4
Описание последовательности SEQ ID NO: 31(5′-3′):
CCACGGTTAGGGTCATTATCCAAATCATTC
№ последовательности: SEQ ID NO: 32
Длина: 30 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: зонд для детекции и/или идентификации мРНК гена XAGE1
Описание последовательности SEQ ID NO: 32(5′-3′):
TGCATCAGTCAAACACCGGGGATAAATCTG
№ последовательности: SEQ ID NO: 33
Длина: 30 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: зонд для детекции и/или идентификации мРНК гена MAGEC1
Описание последовательности SEQ ID NO: 33(5′-3′):
TAGAGCACCACCTTAAGAGAAGAAGAGCTG
№ последовательности: SEQ ID NO: 34
Длина: 30 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: зонд для детекции и/или идентификации мРНК гена NY-ESO-1
Описание последовательности SEQ ID NO: 33(5′-3′):
GCCAGCTCTGCTTCCATGGGTGTCGCGAA
№ последовательности: SEQ ID NO: 35
Длина: 20 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: зонд для детекции и/или идентификации мРНК генов GAGE1-8
Описание последовательности SEQ ID NO: 35(5′-3′):
TGAAGATGGTCCTGATGGGCAGGAGATGGA
№ последовательности: SEQ ID NO: 37
Длина: 30 нуклеотидов
Тип молекулы: одноцепочечная линейная ДНК
Происхождение: синтетическая последовательность
Назначение: зонд для детекции и/или идентификации мРНК гена TRAG3
Описание последовательности SEQ ID NO: 37(5′-3′):
GAGCCTTTTGTTCCTGGAACTTCCTTGATG
Исследуют образцы периферической крови и образцы опухолевых очагов, полученные после резекции опухоли. Для предотвращения деградации мРНК при хранении и транспортировке, например, 0,5 мл периферической крови или 0,5 г образца ткани смешивают с равным объемом консервирующего буфера, содержащего от 1 до 4 тМ гуанидинтиоционата, 250 тМ ацетата натрия и 1% Triton Х-100. При необходимости полученный консервант транспортируют на льду до места использования или хранят при минусовых температурах в течение года.
По 1 варианту осуществляют детекцию мРНК MAGEA1-6, GAGE1-8, NY-ESO-1, SSX 1, 2, 4. XAGE1, TRAG3 и MAGE-C1 методом ОТ-ПЦР.
Выделение нуклеиновых кислот проводят известными способами.
Например, к 200 мкл смеси образца и консервирующего буфера добавляют равный объем смеси фенола с хлороформом (1:1), перемешивают и центрифугируют. Супернатант переносят в новую пробирку, смешивают с равным объемом изопропанола, центрифугируют. Полученный осадок промывают этанолом, высушивают и разводят водой. Применяют также имеющиеся в продаже наборы реагентов для выделения нуклеиновых кислот согласно рекомендациям производителей. Для синтеза комплементарной ДНК (кДНК) используют обратную транскриптазу (ревертазу), например M-MuLV (Fermentas, ЕС) согласно рекомендациям производителя. В качестве затравки применяют гексануклеотиды, поли-Т олигонуклеотиды или праймеры, специфичные к мРНК раково-тестикулярных генов, представленные последовательностями SEQ ID NO: 2, 6, 10, 14, 18, 22 и 27, по отдельности или в различных комбинациях.
Полученные образцы кДНК амплифицируют, используя метод ПЦР в два раунда.
В первом раунде проводят множественную ПЦР с использованием смеси праймеров, представленных последовательностями SEQ ID NO: 1, 2, 5, 6, 9, 10. 13, 14, 17, 18, 21, 22, 26 и 27. Например, используют реакционную смесь, содержащую следующие компоненты: 85 мМ ацетата калия, 25 мМ трицина, рН 8.7, 8% глицерина, 1% диметилсульфоксида, 1.5 мМ Mg2+, по 0.4 мМ дАТФ, дГТФ, дТТФ, дЦТФ, 10 рМ каждого из праймеров, 5 мкл кДНК и 5 е.a. Taq-полимеразы. Проводят горячий старт и 35 циклов ПЦР при условиях: 94°C - 30 сек, 55°C - 30 сек, 72°C - 45 сек.
Во втором раунде ПЦР проводят отдельную детекцию мРНК каждого из семейств генов: для мРНК MAGEA1-6 с праймерами, представленными последовательностями SEQ ID NO: 3 и 4; трех мРНК SSX1, 2, 4 с праймерами, представленными последовательностями SEQ ID NO: 7 и 8; мРНК XAGE1 с праймерами, представленными SEQ ID NO: 11 и 12; мРНК MAGEC1 с праймерами, представленными последовательностями SEQ ID NO: 15 и 16; мРНК NY-ESO-1 с праймерами, представленными последовательностями SEQ ID NO: 19 и 20; мРНК GAGE 1-8 с праймерами, представленными последовательностями SEQ ID NO: 23 и 24; мРНК TRAG3 с праймерами, представленными последовательностями SEQ ID NO: 28 и 29.
Результаты реакции регистрируют методом электрофореза в 2%-ном агарозном геле. О присутствии мРНК раково-тестикулярных генов судят по присутствию фрагментов кДНК размером: мРНК TRAG3 - 159 п.н.; мРНК MAGEC1 - 138 п.н.; мРНК NY-ESO-1 - 159 п.н.; мРНК SSX1.2.4 - 129 п.н.; мРНК MAGEA1-6 - 265 п.н.; мРНК XAGE1 - 162 п.н.; мРНК GAGE1-8 - 170 п.н.
Для подтверждения идентичности амплифицированные фрагменты кДНК выделяют из 2%-ного агарозного геля с использованием набора ′′DNA Extraction Kit′′ (′′Fermentas′′ ЕС). Очищенную кДНК секвенируют, используя набор BigDye Terminator v3.1 Cycle Sequencing Kit (′′Applied Biosystems′′) на приборе ABI Prism 3130 (США) согласно рекомендациям производителей.
Нуклеотидные последовательности сравнивают с представленными в базе данных GenBank, затем кДНК используют в дальнейшей работе в качестве маркеров размерности.
По 2 варианту детектируют мРНК генов MAGEA 1-6, GAGE 1-8, NY-ESO-1, SSX 1, 2, 4, XAGE1, TRAG3 и MAGE-C1 методом гибридизации нуклеиновых кислот на ДНК-чипе.
Например, в качестве подложки используют предметные стекла для микроскопии с активированной поверхностью. На рабочей поверхности формируют реакционную камеру. ДНК-зонды наносят с использованием ротизированного устройства для автоматического пьезоэлектрического точечного нанесения ультрамалых объемов жидкостей. Для детекции мРНК MAGEA 1-6 наносят зонд, представленный последовательностью SEQ ID NO: 30; мРНК SSX 1, 2, 4 наносят зонд, представленный последовательностью SEQ ID NO: 31; мРНК XAGE1 наносят зонд, представленный последовательностью SEQ ID NO: 32; мРНК MAGE-C1 наносят зонд, представленный последовательностью SEQ ID NO: 33; мРНК NY-ESO-1 наносят зонд, представленный последовательностью SEQ ID NO: 34; мРНК GAGE 1-8 наносят зонд, представленный последовательностью SEQ ID NO: 35; мРНК TRAG3 наносят зонд, представленный последовательностью SEQ ID NO: 37.
Выделение нуклеиновых кислот, обратную транскрипцию и первый раунд ПЦР проводят, как описано выше. Проводят 30 циклов второго раунда асимметричной ПЦР при условиях: 94°C - 30 сек, 55°C - 30 сек, 72°C - 45 сек. В реакции используют праймеры, представленные последовательностями SEQ ID NO: 3, 4, 7. 8, 11, 12, 14, 15, 19, 20, 23, 24, 25, 28 и 29. Также используют нуклеозидтрифосфаты, меченные флуоресцентным красителем, например Су3- или Су5- дЦТФ. В данной реакции получают набор фрагментов кДНК, меченных флуоресцентным красителем, которые гибридизуют с олигонуклеотидными зондами, нанесенными на подложку. Результаты гибридизации оценивают с помощью любого устройства, способного регистрировать и оценивать флуоресцентный сигнал.
Сопоставление результатов детекции мРНК MAGEA 1-6. GAGE 1-8, NY-ESO-1, SSX 1, 2, 4, XAGE1. TRAG3 и MAGE-C1 обоими методами показало их сходство, однако данный метод менее длителен и трудоемок.
Разработанный способ тестировали на возможность скрининга и мониторинга онкологических заболеваний. Исследовали частоту обнаружения двадцати двух мРНК (MAGEA1-6, GAGE1-8. NY-ESO-1, SSX1, 2, 4, XAGE1, TRA.G-3 и MAGE-C1) в образцах опухолевых очагов и периферической крови 30 больных раком легкого, 64 больных раком толстого кишечника. 40 больных раком молочной железы, 37 больных раком почки, 12 больных раком желудка, 18 больных меланомой, 63 больных раком эндометрия и 59 больных миомой матки. Также были исследованы перевиваемые клеточные линии, полученные из опухолей больных раком легкого (А549, NCI-H23), лейкемией (Jurkat, J937, HL60, CCRF- СЕМ, К6-1а): лимфомой (NCI-H78. Н9), лимфомой Беркитта (Ramos, Daudi), колоректальным раком (Colo205, НСТ116, НСТ15. SW-60, Т84, СаСо2), раком молочной железы (MCF-7, T47d, HS578), гепатоклеточной карциномой (Нер3В, HepG2), раком простаты (РС-3М, Du145, LNBupLN3), раком почки (А498, SN12C, http://CaK.il. ACHN) и яичников (SK-OV-3). В качестве контроля использовали образцы периферической крови 30 добровольцев без онкологических заболеваний.
Установлено, что в образцах периферической крови людей без онкологических заболевай мРНК MAGEA1-6, GAGE1-8,NY-ESO-1, SSX1, 2, 4, XAGE1, TRAG3 и MAGE-C1 не выявляется. Результаты обнаружения мРНК СТ генов в образцах опухолевых очагов и периферической крови больных различными заболеваниями представлены на фиг. 3. В опухолевых очагах больных раком хотя бы одна из 22 мРНК была обнаружена в 83-100% образцов. В периферической крови больных раком легкого, молочной железы, почки, желудка и колоректальным раком мРНК 22 СТ генов была выявлена в 75-90% случаев. При меланоме, раке эндометрия и миоме тела матки - в 55-34% случаев. В клеточных линиях, полученных из опухолей больных колоректальным раком, гепатоклеточной карциномой и раком простаты, были обнаружены мРНК MAGEA1-6, XAGE1. SSX1, 2 и 4, MAGEC1 и TRAG3, раком легкого, молочной железы и почки - мРНК MAGEA1-6, SSX1, 2 и 4, XAGE1 и TRAG3, лимфомой -мРНК MAGEA1-6. XAGE1 и TRAG3, раком яичников - мРНК MAGEA1-6 и TRAG3, лимфомой Беркитта - мРНК MAGEA1-6. Из пяти исследованных клеточных линий от больных лимфомой мРНК РТ генов была обнаружена в CCRF-CEM (мРНК MAGEA1-6).1937 (мРНК XAGE1) и К6-1а (мРНК MAGEA1-6 и TRAG3) и не выявлялась в клетках Jurkat и HL60.
Проведено сравнение частоты обнаружения композиции мРНК СТ генов при использовании разных методов консервации образцов. Исследовали 63 образца опухолевых очагов рака тела матки. Из них 12 образцов ткани консервировалось с использованием метода заморозки до минус 70°C, а 41 образец с использованием консервирующего буфера, содержащего 4 М гуанидинтиоционата, 250 тМ ацетата натрия и 1% Triton Х-100 Установлено, что в образцах, консервированных простым замораживанием, мРНК СТ генов выявлялась в 4 из 12 образцов (25%), а в образцах, помещенных в консервирующий буфер, - 34 из 41 (83%).
Для анализа возможности ранней диагностики онкологических заболеваний исследовали периферическую кровь больных первой стадией рака легкого, молочной железы, толстого кишечника и рака эндометрия на присутствие композиции мРНК СТ генов. Хотя бы одна из мРНК, представленных в композиции, была обнаружена в периферической крови у 58% (7 из 12) больных раком легкого, 50% (6 из 12) больных раком молочной железы, 66% (6 из 9) больных колоректальным раком и у 45% (18 из 40) больных раком эндометрия.
Для установления источника происхождения мРНК СТ генов исследовали периферическую кровь больных колоректальным раком. Проводили разделение на клетки и фракции внеклеточных нуклеиновых кислот, как описано ранее [Рыкова Е.Ю., Скворцова Т.Э., Хоффман А.Л., и др. 2008. Циркулирующие внеклеточные ДНК и РНК крови в диагностике опухолей молочной железы. Биомедицинская химия. 54, 94-103]. Образцы периферической крови центрифугировали для получения плазмы и форменных элементов. Для элюции внеклеточных нуклеиновых кислот, связанных с поверхностью клеток крови через ионные взаимодействия, к суспензии клеток добавляли буфер, содержащий 15 mM EDTA и 0.9% NaCl, центрифугировали и отбирали надосадочную жидкость. Для протеолитического отщепления нуклеопротеидных комплексов к полученному осадку клеток добавляли равный объем 0.125% трипсина, инкубировали в течение 1 мин при помешивании, добавляли 5 мМ ингибитора сериновых протеаз PMSF и разделяли фракции центрифугированием. К полученным таким образом фракциям добавляли равный объем консервирующего буфера и тестировали на присутствие мРНК СТ генов. Во фракциях внеклеточных нуклеиновых кислот периферической крови мРНК СТ генов детектировалась только на III-IV стадиях заболевания. Во фракциях клеток крови, с поверхности которых были удалены внеклеточные нуклеиновые кислоты, мРНК СТ генов обнаруживалась на всех четырех стадиях заболевания. То есть на всех стадиях колоректального рака мРНК СТ генов обнаруживалась в клетках, циркулирующих в кровотоке. При этом на первой и второй стадиях заболевания мРНК СТ генов была обнаружена только в клетках крови и не выявлена во фракциях, содержащих внеклеточные нуклеиновые кислоты Таким образом, обнаружение хотя бы одной из двадцати двух используемых в композиции мРНК свидетельствует о присутствии в кровяном русле циркулирующих клеток опухоли. Это позволяет применять разработанный способ для обнаружения в периферической крови циркулирующих опухолевых клеток, что может быть использовано в прогностических целях и для мониторинга проводимой терапии онкологичес