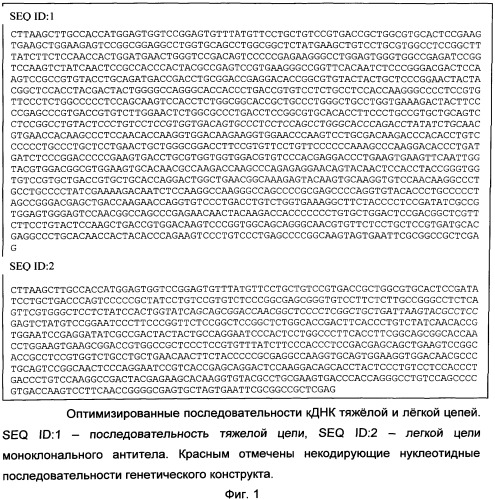
Оптимизированные последовательности днк, кодирующие легкую и тяжелую цепи моноклонального антитела, связывающего фактор некроза опухоли альфа, предназначенные для биосинтеза антитела, способ получения антитела посредством рекомбинантной клеточной линии cho-s
Иллюстрации
Показать всеИзобретение относится к биохимии, в частности к молекулярной биологии, биотехнологии, генной инженерии. Изобретение представляет собой оптимизированные последовательности ДНК, кодирующие легкую и тяжелую цепь моноклонального антитела, предназначенные для синтеза антитела в рекомбинантных CHO-S клетках, и способ получения данного антитела в указанных клетках. Изобретение позволяет максимизировать продуктивность клеток и оптимизировать пострансляционные модификаций антитела, в частности гликозилирования тяжелых цепей антитела. В результате проделанной работы были разработаны несколько условий, позволяющих получать моноклональное антитело с высокой продуктивностью. 3 н. п. ф-лы, 2 ил., 6 табл.
Реферат
Изобретение относится к фармацевтической субстанции терапевтического моноклонального антитела, нейтрализующего активность ФНО-α человека. Представлены оптимизированная последовательность ДНК, способ биосинтеза антитела на основе рекомбинантной клеточной линии CHO-S с описанием важных параметров конечного продукта. Изобретение может быть использовано для создания фармацевтического препарата, применяемого при аутоиммунных заболеваниях, в частности ревматоидного артрита, болезни Крона, язвенного колита, анкилозирующего спондилита, псориатического артрита и др.
Антитела (иммуноглобулины) - класс биологических молекул, синтезируемых В-лимфоцитами иммунной системы. Они обладают свойством высокоспецифично связываться с чужеродными объектами, тем самым нейтрализуя и индуцируя их уничтожение клетками-киллерами. С развитием гибридомных клеточных технологий и молекулярно-биологических методов появилась возможность искусственно создавать и производить антитела, специфичные только к заданной молекулярной мишени (моноклональные антитела). В настоящее время это свойство моноклональных антител активно используется для лечения различных онкологических и аутоимунных заболеваний. Аутоиммунные заболевания, среди которых доминирует ревматоидный артрит, представляет собой тяжелую социальную и экономическую проблему. Золотым стандартом лечения ревматоидного артрита является использование рекомбинантных препаратов на основе моноклональных антител к фактору некроза опухоли (ФНО). Блокирование моноклональными антителами связывания ФНО с иммунокомпетентными клетками обеспечивает противовоспалительный эффект таких лекарств и стойкую ремиссию у больных.
С целью промышленной продукции белков, имеющих фармацевтическое значение, в частности моноклональных антител, широко используются клетки СНО. Важным свойством клеток СНО для использования в клеточной биотехнологии является их широкая приспособляемость к разнообразным условиям культивирования и высокая генетическая пластичность, что позволяет с относительной легкостью проводить с данными клетками различные генетические манипуляции. Кроме того, эти клетки способны к росту при очень высокой клеточной плотности в больших крупногабаритных ферментерах объемом до 10 тыс. литров. Более того, клетки СНО соответствуют принципам биологической безопасности, поскольку подавляющее большинство патогенных вирусов человека, включая вирусы иммунодефицита, полиомиелита, гриппа и герпеса, неспособно в них размножаться.
Вышеупомянутые качества сделали клетки СНО главной клеточной культурой в мировой биотехнологии. В настоящее время около 70% рекомбинантных фармацевтических биопрепаратов производится именно на основе клеток СНО.
Уже существующий на рынке препарат на основе моноклонального антитела к ФНО-α человека моноклональное антитело (Ремикейд®) до сих производится в клеточной линии мышиной меланомы SP2/0, разработанной около 20 лет назад, в то время как разработанный штамм-продуцент моноклонального антитела к ФНО-α человека производится в CHO-S клетках, являющихся на сегодня «золотым стандартом» по соотношению эффективности и безопасности в производстве биофармацевтических препаратов, и позволяет минимизировать риски загрязнения продукта эндогенными вирусами и белками клетки-продуцента в процессе производства. Очевидно, переход на принципиально новую клеточную систему экспрессии требует создания и отработки каждой стадии нового технологического процесса - от культивирования до стадий финальной очистки и получения ГЛФ.
Для эффективной экспрессии требуется оптимизация последовательности ДНК целевого белка. Показано, что на эффективную экспрессию влияют такие факторы, как процент содержания G-пар, вторичная структура РНК, наличие внутренних сигналов сплайсинга, наличие коротких рамок считывания, длинных гомополимерных последовательностей, использование кодонов и пар кодонов с разной степенью встречаемости. Было показано, что для антител оптимизация последовательности ДНК может значительно повысить уровень экспрессии. Таким образом, последовательности ДНК, кодирующие тяжелую и легкую цепи моноклонального антитела к ФНО, были оптимизированы для получения высокого уровня экспрессии.
Разработка клеточной линии-продуцента моноклонального антитела к ФНО-α человека включала в себя следующие этапы:
- оптимизация последовательностей ДНК, кодирующих легкую и тяжелую цепь антитела (фиг.1);
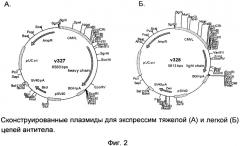
- создание двух экспрессионных конструкций, кодирующих тяжелую и легкую цепи рекомбинантного моноклонального антитела (фиг.2);
- проведение трансфекции клеток СНО полученными экспрессионными плазмидами;
- отбор клонов и создание клеточного банка штамма-продуцента.
Были сконструированы экспрессионные плазмиды v240 и v241, содержащие кДНК, кодирующие рекомбинантное моноклональное антитело к ФНО-α человека, под контролем цитомегаловирусного промотора. Экспрессионные плазмиды были синтезированы с использованием стандартных молекулярно-биологических методов.
Была проведена трансфекция клеточной линии CHO-S химическим методом. Успешно трансфецированные клетки были отобраны с применением антибиотиков: зеоцин и бластицидин. Для отбора клонов, имеющих максимальную продуктивность по антителу, был использован метод предельных (лимитирующих) разведений с последующей оценкой концентрации моноклонального антитела с помощью ИФА. Отобранные клоны амплифицировали в условиях нормального клеточного роста и создали клеточные банки.
Техническим результатом изобретения является максимизация продуктивности клеток и оптимизация пострансляционных модификаций антитела, в частности гликозилирования тяжелых цепей антитела. В результате проделанной работы были разработаны несколько условий, позволяющие получить моноклональное антитело с высокой продуктивностью и различным гликозилированием тяжелой цепи в зависимости от условий культивирования.
Примеры
В качестве основной среды для культивирования была выбрана среда ActiCHO P CD (GE Healthcare) с добавлением 6 мМ L-глутамин и 0,1% Pluronic F-68. В качестве добавок использованы UMG (300 мМ уридин, 1500 мМ галактоза, 0,6 mM MnCl2), ActiCHO FeedA CD (GE Healthcare) совместно с ActiCHO FeedB CD (GE Healthcare) (в объемном соотношении 10:1, добавляются по отдельности) глюкоза 250 г/л и FunctionMAX Titer Enhancer (Life Technologies). Разработанные схемы культивирования, описывающие порядок внесения различных компонентов, представлены в таблице 1. Клетки культивировали в шейкерных колбах на орбитальном шейкере при ~110 об/мин при 36,5°С, 5% CO2 в инкубаторе. Для культивирования использовали клетки, депонированные во Всероссийскую Коллекцию Промышленных Микроорганизмов под регистрационным номером Н-145.
| Таблица 1 | |||||||||||||
| Схема внесения компонентов при культивировании | |||||||||||||
| Компоненты | День | ||||||||||||
| 0 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | |
| ActiCHO Feed-A+B | 1,76% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% | 1,7 6% |
| FM | 3,5% | 3,5% | 3,5% | 3,5% | |||||||||
| UMG | 4х | 4х | 4х | 4х | 4х | 4х |
Было экспериментально выяснено, что добавление NaCl до концентрации 0,5 М и 1М увеличивает выход целевого антитела после первой стадии аффинной очистки. В качестве аффинного сорбента использовали Mab Select (GE Healthcare). Для оптимизации условий использовали 5 мл сорбента. Перед нанесением образцов колонну уравновешивали 4-5 объемами (относительно объема колонны) буфера Mab 1 (20 mM PhNa, 0,5 М NaCl, pH 7,0). Элюцию с колонны осуществляют 4-5 объемами буфера Mab 2 (100 mM Gly-HCl, pH 3,5). Выход оценивали по количеству белка, измеренным спектрофотометрически, после элюции. Было доказано, что внесение хлорида натрия перед стадией аффинной хроматографии в концентрации 0,5М и 1М увеличивает выход антитела (таблица 2). Было решено добавлять хлорид натрия к культуральной жидкости в концентрации 0,5М непосредственно до стадии фильтрации культуральной жидкости.
| Таблица 2 | |
| Выход антитела к ФНО-α с MabSelect в зависимости от концентрации хлорида натрия в культуральной жидкости | |
| Концентрация NaCl в культуральной жидкости, М | Емкость сорбента MabSelect, мг/мл |
| 0 | 17,7 |
| 0,5 | 26,28 |
| 1 | 26,3 |
Перед очисткой антитела культуральную жидкость размораживают, добавляют NaCl до конечной концентрации 0,5М и фильтруют. Первую стадию очистки проводят при температуре 2-8°С. Условия очистки такие же, как и описаны выше с учетом большего объема сорбента. В процессе элюции белковый раствор титруют до значений рН 5,5±0,2 раствором 1 М Трис-HCl рН 8,0. Вторую стадию очистки моноклонального антитела проводят на сорбенте Fractogel SO3 (Merck) при температуре 2-8°С. Колонну уравновешивают буфером Frac 1 (20 mM NaAc, рН 5,5). Раствор моноклонального антитела разводят уравновешивающим буфером Frac 1 (20 mM NaAc, рН 5,5) до значения проводимости не выше 5 mS/cm (кратность разведения 3-4 раза), доводят рН до значения 5,5±0,2 0,25 М уксусной кислотой, наносят на колонну. Колонну промывают 300 мл буфера Frac 1. Элюцию с колонны осуществляют ступенчатым градиентом 20% буфера Frac 2 (20 mM NaAc, 1 М NaCl, рН 5,5) в буфере Frac 1 (20 mM NaAc, рН 5,5). Начиная с оптической плотности 10 mAU (UV 280 нм), собирают фракции и анализируют методом ГФ-ВЭЖХ. По результатам анализа объединяют фракции с чистотой 98,5% и выше. Полученный раствор белка фильтруют через насадку фильтрующую на флакон Стеритоп 0,22 мкм. Затем раствор антитела концентрируют, используя мембраны для тангенциальной фильтрации с пределом отсечения 50 кДа, уравновешенную буфером ГЛФ (5 mM натрия гидрофосфат, 1,6 mM натрия дигидрофосфат, 142 mM сахарозы, 0,05% полисорбат-80). Далее раствор подвергается последней стадии - гель-фильтрующей хроматографии на сорбенте Sephadex G25 (GE Healthcare). Процесс проводят при температуре 2-8°С. На колонну, предварительно уравновешенную буфером ГЛФ, наносили раствор моноклонального антитела, элюцию с колонны проводили в буфере ГЛФ объемом. Полученный раствор антитела фильтруют через фильтр на 0,2 мкм и при -20°С.
Выявлен состав стабильной фармацевтической композиции в виде лифилизата, куда входят, мг: разработанное антитело против ФНО-α человека - 100; натрия гидрофосфат дигидрат - 6,1; натрия дигидрофосфат моногидрат - 2,2; сахароза - 500 и полисорбат - 80-0,5. Для получения данной композиции были использованы следующие условия сушки:
Замораживание - 2 часа при -30 - -40°С,
Сублимация при -20°С, 6 часа, 70-110 мТорр,
Ступенчатый переход на десорбцию - от -20 до +25°С в течение 2 часов при 70-110 мТорр,
Десорбция при +25°С, 5 часов, 70-110 мТорр.
Для оценки биологической активности были проведены in vitro и in vivo исследования. В частности, был проведен ряд исследований для комплексной оценки связывания антитела с антигеном: методом ИФА было изучено связывание с человеческим ФНО-α в растворимой мономерной и тримерной формах, методом сортировки флуоресцентно-активированных клеток было изучено связывание с трансмембранным нерастворимым ФНО-α на поверхности клеток и, более того, с помощью метода поверхностного плазменного резонанса были определены константы диссоциации (для комплекса антитела с мономерной и тримерной формой ФНО-α). Для оценки биологической активности было проведено исследование нейтрализующей активности по отношению к WEHI-164. Результаты представлены в таблице 3. Данные подтверждают наличие биологической активности полученного антитела in vitro.
| Таблица 3 | ||
| Результаты оценки биологической активности in vitro моноклонального антитела к ФНО-α человека | ||
| Исследование | Значение | Стандартное отклонение |
| Связывание с растворимым ФНО-а человека в мономерной форме, ЕС50 (нМ) | 0.1335 | 0.0262 |
| Связывание с растворимым ФНО-а человека в гомотримерной форме, ЕС50 (нМ) | 0.0251 | 0.0037 |
| Связывание с трансмембранным ФНО-а человека, ЕС50 (нМ) | 5.632 | 0.5928 |
| Нейтрализующая активность по отношению к клеткам WEHI-164, ЕС50 (нМ) | 0.4854 | 0.0888 |
Эффективность разработанного моноклонального антитела к ФНО-α человека была доказана in vivo на трансгенных мышах Tg197 с гиперэкспрессией ФНО-α человека, приводящей к развитию полиартрита, начиная с 3-4-й недели жизни животного. Была проведена оценка терапевтической эффективности разработанного антитела в предотвращении проявления симптомов артрита у генетически модифицированных мышей Tg197. Для проведения данного исследования мыши (12 мышей в каждой группе, равное количество самцов и самок) получали исследуемое антитело болюсно, однократно (в дозировках 10 мг/кг и 30 мг/кг), внутрибрюшинно на четвертой неделе жизни после появления проявлений артрита, но до развития данных проявлений, а затем проводили оценку состояния данных мышей в возрасте более 5 недель до достижения 9-й недели жизни. Как показали результаты исследования, лечение исследуемым препаратом при дозировке 10 мг/кг оказывало подавляющее действие на развитие проявления полиартрита, однако не обеспечивало полную защиту от развития данного заболевания. В случае дозировки 30 мг/кг исследуемый препарат оказывал подавляющее действие на развитие проявления полиартрита и сохранял их статистически единообразными по сравнению с мышами в возрасте 3 недель из контрольной группы, не получавших препарат. В таблицах 4-6 приведены данные исследования эффективности разрабатываемого препарата на мышах Tg197.
| Таблица 4 | ||||||
| Средняя масса тела в группе | ||||||
| Средняя масса тела (г) | Неделя 4 | Неделя 5 | Неделя 6 | Неделя 7 | Неделя 8 | Неделя 9 |
| Возраст 4 недели, контрольная группа, не получавшая препарат | 10,93 | - | - | - | - | - |
| G1-PRM-002 10 мг/кг | 12,24 | 15,28 | 16,62 | 17,36 | 18,02 | 18,88 |
| G2-PRM-002 30 мг/кг | 12,27 | 15,75 | 17,51 | 18,21 | 19,78 | 20,86 |
| G3-физиологический | 12,26 | 14,34 | 15,23 | 15,58 | 15,71 | 16,40 |
| Таблица 5 | ||||||
| Средняя оценка артрита, in-vivo | ||||||
| Средняя оценка артрита в условиях in-vivo | Неделя 4 | Неделя 5 | Неделя 6 | Неделя 7 | Неделя 8 | Неделя 9 |
| Возраст 4 недели, контрольная группа, не получавшая препарат | 0,38 | - | - | - | - | - |
| G1-PRM-002 10 мг/кг | 0,40 | 0,43 | 0,66 | 0,71 | 0,82 | 0,91 |
| G2-PRM-002 30 мг/кг | 0,38 | 0,28 | 0,36 | 0,32 | 0,35 | 0,45 |
| G3-физиологический раствор | 0,29 | 0,70 | 0,88 | 0,99 | 1,27 | 1,25 |
| Таблица 6 | ||
| Средняя гистопатологическая оценка уровня развития артрита, ех-vivo | ||
| Средняя гистопатологическая оценка уровня развития артрита | Неделя 4 | Неделя 9 |
| Возраст 4 недели, контрольная группа, не получавшая препарат | 1,50 | - |
| G1-PRM-002 10 мг/кг | - | 2,83 |
| G2-PRM-002 30 мг/кг | - | 1,42 |
| G3-физиологический раствор | - | 3,27 |
1. ДНК, кодирующая тяжелую цепь антитела, связывающего человеческий ФНО-α, представленная SEQ ID:1 и предназначенная для синтеза данного антитела в рекомбинантных CHO-S клетках.
2. ДНК, кодирующая легкую цепь антитела, связывающего человеческий ФНО-α, представленная SEQ ID:2 и предназначенная для синтеза данного антитела в рекомбинантных CHO-S клетках.
3. Способ получения моноклонального антитела, связывающего человеческий ФНО-α, включающий введение ДНК по пп.1 и 2 в рекомбинантные CHO-S клетки, их культивирование и последующую очистку антитела к ФНО-α.