Триазиновые, пиримидиновые и пиридиновые аналоги и их применение в качестве терапевтических агентов и диагностических проб
Иллюстрации
Показать всеИзобретение относится к соединениям формулы (Ib):
где R2 представляет собой гетероарильную группу и где указанная моноциклическая гетероарильная группа является незамещенной или замещенной одной или более группами, выбранными из F, Cl, Br, I, -NR10R11 и С1-С12 алкила; а также группами, выбранными из F, -NH2, -NHCH3, -N(CH3)2, -ОН, -ОСН3, -С(O)СН3, -NHC(O)CH3, -N(C(O)CH3)2, -NHC(O)NH2, -CO2H, -СНО, -СН2ОН, -C(=O)NHCH3, -C(=O)NH2, и -СН3; R3x, R3y, R3z и R3p представляют собой водород; R4x, R4y, R4z и R4p независимо друг от друга выбраны из группы, состоящей из: водорода, F, Cl, Br, I, и -С(С1-С6 алкил)2NR10R11; и R10 и R11 представляют собой водород, которые являются ингибиторами фосфоипозитид-3-киназы (PI3K) и мишенью рапамицина у млекопитающих (mTOR). 5 н. и 2 з.п. ф-лы., 7 табл., 50 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым терапевтическим агентам и диагностическим пробам, включая их фармацевтически приемлемые соли, пролекарства и метаболиты, которые подходят для модулирования активности белка или фермента, для модулирования клеточной активности, такой как сигнальная трансдукция, пролиферация, дифференцировка, запрограммированная гибель клеток, миграция и секреция цитокина. Более конкретно, в изобретении предложены соединения, которые ингибируют, регулируют, обеспечивают детектирование и/или модулируют активность киназы, в частности, фосфоинозитид-3-киназы (PI3K), мишени рапамицина у млекопитающих (mTOR), соединения, ингибирующие ДНК-ПК и АТМ-киназу, их фармацевтически приемлемые соли и пролекарства; композиции указанных новых соединений, как взятых в отдельности, так и в комбинации с по меньшей мере одним дополнительным терапевтическим агентом, с фармацевтически приемлемым носителем; и применения указанных новых соединений, как взятых в отдельности, так и в комбинации с по меньшей мере одним дополнительным терапевтическим агентом, для профилактики или лечения ряда заболеваний, в частности, заболеваний, характеризующихся патологической активностью серин/треонин-киназ, рецепторных тирозинкиназ и липидных киназ. Изобретение также относится к способам применения соединений для in vitro, in situ u in vivo диагностики, разработки исследований или лечения клеток млекопитающих или родственных патологических состояний.
УРОВЕНЬ ТЕХНИКИ
Протеинкиназы участвуют в передаче сигналов, контролирующих активацию, рост, дифференцировку, выживание и миграцию клеток в ответ на действие внеклеточных медиаторов или раздражителей, включая факторы роста, цитокины или хемокины. В целом, указанные киназы подразделяют на две группы: киназы, которые предпочтительно фосфорилируют тирозиновые остатки, и киназы, которые предпочтительно фосфорилируют сериновые и/или треониновые остатки. Тирозинкиназы включают рецепторы мембранного фактора роста, например, рецептор эпидермального фактора роста (EGFR), и цитозольные нерецепторные киназы, включая киназы семейства Src, киназы семейства Syk и киназы семейства Тес.
Нежелательно высокая активность протеинкиназы играет роль во многих заболеваниях, включая рак, нарушения обмена веществ, иммунологические заболевания и воспалительные нарушения. Указанные заболевания могут быть вызваны непосредственно или косвенно за счет нарушения механизмов контроля вследствие мутации, избыточной экспрессии или нежелательной активации фермента.
Протеинтирозинкиназы - как рецепторные тирозинкиназы, так и нерецепторные киназы - имеют большое значение для активации и пролиферации клеток иммунной системы. В числе поддающихся наиболее раннему обнаружению явлений при активации иммунорецептора в мастоцитах, Т-клетках и В-клетках, находится стимулирование нерецепторных тирозинкиназ.
Ранее фосфоинозитид-3-киназы (PI3K) были идентифицированы как липидкиназы, ассоциированные с вирусными онкогенами [Whitman et al., Nature 315:239-242 (1985), Sugimoto et al., Proc. Natl. Acad. Sci. 81:2117-2121 (1984); Mascara et al., Proc. Natl. Acad. Sci. 81:2728-2732 (1984)], а в последние 20 лет были получены дополнительные доказательства взаимосвязи между раковыми заболеваниями и PI3KCully et al., Nat. Rev., Cancer 6:184-192 (2006); Wimann et al., Curr. Opin. Cell Biol. 17:141-149 (2005); Vivanco et al., Nat. Rev., Cancer 2:489-501 (2002). С того времени считается, что PI3K модулируют широкий диапазон клеточной активности и играют важную роль в контроле роста и метаболизма. Путь маркировки PI3K у генетически модифицированных мышей и исследования наследственных заболеваний у людей, таких как синдром Каудена, туберозный склероз, атаксия-телеангиэктазия, Х-сцепленная миотубулярная миопатия и нейропатия Шарко-Мари-Тус, предоставили дополнительную информацию о клеточной и системной роли фосфоинозитидной сигнальной системы. Нарушение регуляции уровня фосфоинозитидов и, в частности, продуктов класса I PI3K, Ptdlns (3,4,5)P3, играет роль в патогенезе рака, хронических воспалительных, аллергических заболеваний, нарушений обмена веществ, диабета и проблем с сердечнососудистой системой.
PI3K представляют собой семейство ферментов, которые осуществляют фосфорилирование по положению 3'-ОН инозитольного кольца фосфоинозитидов. PI3K разделяют на три класса на основании структурных особенностей и специфичности в отношении липидного субстрата in vitro [Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008)]. PI3K I класса образуют гетеродимеры, которые состоят из одного из четырех тесно связанных каталитических субъединиц ~110 кДа и ассоциированной регуляторной субъединицы, относящейся к двум различным семействам. In vitro они способны превращать PtdIns в PtdIns-3-P, PtdIns-4-P в PtdIns(3,4)P2 и PtdIns(4,5)P2 в PtdIns(3,4,5)P3, но субстрат in vivo представляет собой PtdIns(4,5)P2 [Cantley et al., Science 296:1655-1657 (2002)]. PI3K I класса активируются при помощи широкого спектра рецепторов клеточной поверхности, включающих рецепторы фактора роста, а также рецепторы, связанные с G-белками.
PI3K II класса способны фосфорилировать PtdIns и PtdIns-4-P in vitro, но до сих пор соответствующие субстраты in vivo являются предметом исследований. Указанный класс крупных (170-200 кДа) ферментов содержит три представителя, характеризуемых С-терминальным доменом гомологии С2. В настоящее время для PI3K II класса молекулы-адаптеры не идентифицированы. PI3K III класса способны фосфорилировать исключительно PtdIns и вырабатывать, таким образом только PtdIns-3-P. Единственный представитель указанного класса представляет собой Vps34, прототипом которого является S. cerevisiae Vps34p (вакуолярный белок, сортирующий мутантные белки 34), который, как было показано, играет важную роль в миграции вновь синтезированных белков из аппарата Гольджи в вакуоль дрожжевых клеток, эквивалент лизосом млекопитающих в органеллах [Schu et al., Science 260:88-91 (1993)].
Фосфоинозитид-4-киназы (PI4K) осуществляют фосфорование по положению 4'-ОН инозитольного кольца PtdIns и вырабатывают, таким образом, PtdIns-4-P. Указанный липид затем может быть дополнительно фосфорилирован при помощи PtdIns-4-P 5-киназ для выработки PtdIns(4,5)P2, который представляет собой главный источник фосфолипазы С и сигнала PI3K в плазматической мембране. Известны четыре изоформы PI4K: P14KIIα и β и P14KIIIα и β. PI4KIII являются наиболее тесно связанными с PI3K.
Класс PI3K-связанных белков, называемый PI3K IV класса, состоит из высокомолекулярных ферментов с каталитическим ядром, аналогичным PI3K и PI4K, и включает мишень рапамицина (mTOR, также называемую FRAP), ДНК-зависимую протеинкиназу (ДНК-ПК), мутировавший генный продукт атаксии-телангиэктазии (ATM), атаксию, связанную с телеангиэкстазией (ATR), SMG-1 и трансформационный/транскрипционный ассоциированный с доменом белок (TRRAP). Первые пять представителей являются активными белковыми серин-треонинкиназами, которые участвуют в контроле роста клеток и контроле генома/транскриптома [Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008)]. ДНК-ПК, ATM, ATR и SMG-1 участвуют в ответе на повреждение ДНК. Единственной активной киназой, не участвующей в повреждении ДНК, является mTOR, которая регулируется факторами роста и доступностью питательных веществ и координирует синтез белка, рост и пролиферацию клеток. Мишень рапамицина (mTOR) образует комплекс 1 и интегрирует сигнал фактора роста (посредством PI3K7PKB и каскад Ras/MAPK), энергетический статус (LKB1 и АМРК) и детектирование питательных веществ. TOR позитивно регулируется PKB/Akt, которая фосфорилирует негативный регулятор TSC2 в комплексе туберозного склероза (TSC), что приводит к активации GТРазы Rheb и mTOR [Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008)]. В то же время, mTOR стимулирует трансляцию рибосомных белков и, следовательно, биогенез рибосом посредством активации p70S6K [Wullschleger et al., Cell 124:471 (2006)]. Рапамицин и его производные RAD001 и CCI-779 связываются с FKBP12 и очень селективно блокируют активность комплекса mTOR 1 (mTORC1). С применением рапамицина и его производных проводили множество клинических испытаний, в основном на пациентах с опухолью, характеризующейся усиленной передачей сигнала PI3K и гиперактивной mTOR. Многообещающие результаты были получены для лимфомы из клеток зоны мантии, рака эндометрия и почечно-клеточной карциномы [Guertin et al., Cancer Cell 12:9 (2007)]. Рапамицин и его производные сохраняют анти-ангиогенную активность, так как они нейтрализуют действие VEGF [Guba et al., Nat. Med. 8:128 (2002)], что открывает возможность для лечения, комбинированного с традиционной химиотерапией [Beuvink et al.), Cell 120:747 (2005)].
Путь PI3K представляет собой ключевой каскад трансдукции сигнала, контролирующий регуляцию роста, пролиферации, выживания клеток, а также миграцию клеток. PI3K активируются большим количеством различных стимулов, включающих факторы роста, воспалительные медиаторы, гормоны, нейротрансмиттеры и иммуноглобулины и антигены [Wimann et al., Trends Pharmacol. Sci. 24:366-376 (2003)]. Изоформы PI3K 1 класса: PI3Kα, β и δ - связываются с одной из р85/р55/р50 регуляторных субъединиц, которые содержат два SH2 домена, которые связываются с высокой аффинностью с фосфорилированными мотивами Tyr-X-X-Met. Указанные мотивы присутствуют в активированных рецепторах факторов роста, их субстратах и в ряде белков-адаптеров. В соответствии с представленным выше описанием, активация сигнального каскада PI3K/PKB обладает положительным действием на рост, выживание и пролиферацию клеток. Конститутивная позитивная регуляция сигнала PI3K может обладать разрушающим действием на клетки, приводя к неконтролируемой пролиферации, усиленной миграции и росту, независимому от адгезии. Указанные явления благоприятствуют не только образованию злокачественных опухолей, но также развитию воспалительных и аутоиммунных заболеваний.
Путь «PI3 киназа/Akt/PTEN» является привлекательной мишенью для разработки противораковых лекарственных средств, так как можно ожидать, что указанные агенты будут ингибировать пролиферацию, обращать подавление апоптоза и подавлять резистентность раковых клеток к цитокиновым агентам. Ингибиторы PI3 киназы представлены в литературе [см., в частности, Marone et al., Biochimica et Biophysica Acta 1784:159-185 (2008), Yaguchi et al. (2006), Jour. Of the Nat. Cancer Inst. 98(8):545-556; US 6770641; US 6653320; US 6403588; US 6703414; WO 9715658; WO 2006046031; WO 2006046035; WO 2006046040; WO 2007042806; WO 2007042810; WO 2004017950; US2004092561; WO 2004007491; WO 2004006916; WO 2003037886; US2003149074; WO 2003035618; WO 2003034997; WO 2007084786; WO 2007095588; WO 2008098058; US 2003158212; EP 1417976; US 2004053946; JP 2001247477; JP 08175990; JP 08176070]. Производные 1,3,5-триазина и пиримидина в качестве фармацевтических средств были получены в связи с их противораковой, противовоспалительной, анальгетической и антиспазматической активностью. В частности, хорошо известен гексаметилмеламин или алтретамин (ГММ или N2,N2,N4,N4,N6,N6-гексаметил-1,3,5-триазин-2,4,6-триамип), который разрабатывали в качестве аналога противоопухолевого агента триэтиленмеламина (ТЭМ); ГММ выступает в качестве пролекарства гидроксиметилпентаметилмеламина (ГМПММ: метаболически активная форма ГММ) [Johnson et al., Cancer, 42:2157-2161 (1978)]. ГММ представлен на рынке в Европе при показаниях для лечения рака яичников и мелкоклеточного рака легких.
Известны некоторые соединения триазина, обладающие активностью, ингибирующей PI3 киназу, и ингибирующие рост раковых клеток [WO 02088112 (ЕР1389617), «HETEROCYCLIC COMPOUNDS AND ANTITUMOR AGENT CONTAINING THE SAME AS ACTIVE INGREDIENT», Kawashima et al., Дата подачи заявки: 26.04.2002; WO 05095389 (ЕР1741714). «HETEROCYCLIC COMPOUND AND ANTI-MALIGNANT-TUMOR AGENT CONTAINING THE SAME AS ACTIVE INGREDIENT», Kawashima et al., Дата подачи заявки: 30.03.2005; WO 06095906 (ЕР1864665), «IMMUNOSUPPRESSIVE AGENT AND ANTI-TUMOR AGENT COMPRISING HETEROCYCLIC COMPOUND AS ACTIVE INGREDIENTS», Haruta et al., Дата подачи заявки: 11.03.2005; WO 09905138 (ЕР1020462), HETEROCYCLIC COMPOUNDS AND ANTITUMOR AGENT CONTAINING THE SAME AS ACTIVE INGREDIENT, Kawashima et al., Дата подачи заявки: 24.07.1998]. Триазиновое соединение ZSTK474, разработанное в исследовательских лабораториях Zenyaku Kogyo, представляет собой первое, вводимое перорально, триазиновое соединение, обладающее высокой активностью против PI3K, которое проявляло сильную противораковую активность против ксенотрансплантатов человеческого рака у мышей без проявлений критической токсичности [Yaguchi et al., Journal of The National Cancer Institute, 98:545-556, (2006)]. ZSTK474 представляет собой конкурирующий с АТР ингибитор изоформ фосфатидилинозитол 3-киназы I класса [Kong et al., Cancer Sci, 98:1638-1642 (2007)].
Известны некоторые пиримидиновые соединения, связывающие р110 альфа, обладающие активностью, ингибирующей PI3 киназу, и ингибирующие рост раковых клеток (Интеллектуальная собственность компании AstroZeneca: WO 07066103, WO 07080382, WO 08023159, WO 08023180, WO 08032027, WO 08032033, WO 08032036, WO 08032041, WO 08032072, WO 08032077, WO 08032086, WO 08032089, WO 08032091; Интеллектуальная собственность компании Genentech/Piramed/Roche: US2007009880, WO 07127183, WO 08073785, WO 07042810, WO 07122410, WO 07127175, WO 07129161, WO 08070740, WO 2006046031, WO 2006046040, WO 2007042806, WO 2007122410; Интеллектуальная собственность компании Novartis: WO 07084786, WO 08098058).
Для увеличения спектра раковых заболеваний, которые можно лечить указанными соединениями, и увеличения противораковой активности указанных соединений, активных против PI3K и/или mTOR, авторы настоящего изобретения провели углубленные исследования производных на основе триазина, пиримидина и пиридина и получили, таким образом, новые гетероциклические соединения, представленные формулой (I) и формулами от (Ia) до (Ii), которые проявляют сильную биологическую активность против липидных киназ.
По сравнению с ингибиторами PI3K, описанными Zenyaku Kogyo (WO 02088112 (ЕР 1389617), WO 2005095389 (ЕР 1741714), WO 2006095906 (ЕР 1864665), WO 09905138 (ЕР 1020462)], AstraZeneca (WO 07066103, WO 07080382, WO 08023159, WO 08023180, WO 08032027, WO 08032033, WO 08032036, WO 08032041, WO 08032072, WO 08032077, WO 08032086, WO 08032089, WO 08032091), Piramed/Genentech (US 2007009880, WO 07127183, WO 08073785, WO 07042810, WO 07122410, WO 07127175, WO 08070740, WO 2006046031, WO 2006046040, WO 2007122410), Yamanouchi/Piramed (WO 01083456) и Novartis (WO 07084786, WO 08098058), ингибиторы согласно настоящему изобретению отличаются включением атома N в основное гетероциклическое кольцо, что обеспечивает лучшую биологическую активность относительно целевого фермента, и/или включением нового молекулярного фрагмента, делающего молекулу в целом более активной или более селективной к соответствующему ферменту.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится в целом к новым производным на основе триазина, пиримидина и пиридина и их применению в качестве терапевтических агентов и диагностических проб.
Изобретение также относится к ингибиторам киназы и диагностическим пробам для определения киназы.
Изобретение также относится к соединениям, ингибирующим фосфоинозитид 3-киназу (PI3K) и мишень рапамицина у млекопитающих (mTOR), с противораковой активностью, их фармацевтическим составам указанных соединений, которые потенциально являются применимыми для лечения заболеваний, состояний и/или нарушений, модулированных PI3K и mTOR киназами. Соединения могут ингибировать рост опухоли у млекопитающих и могут быть применимыми для лечения пациентов, страдающих от рака.
Изобретение также относится к способам применения соединений для диагностики т vitro, in situ и in vivo или лечения или клеток млекопитающих, организмов или связанных патологических состояний.
Конкретно, в одном из аспектов настоящего изобретения предложены соединения формулы (I).
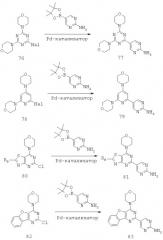
Более конкретно, в одном из аспектов настоящего изобретения предложены триазиновые соединения формул от (Ia) до (Id), пиримидиновые соединения формул от (If) до (Ii) и пиридиновые соединения формул (Ie) и от (If) до (Ii):
и их стереоизомеры, геометрические изомеры, таутомеры, сольваты, метаболиты, N-оксидные производные и фармацевтически приемлемые соли.
В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая триазиновое или пиримидиновое или пиридиновое соединение формулы (I) или одной из формул от (Ia) до (Ii) и фармацевтически приемлемый носитель. Фармацевтическая композиция может дополнительно содержать один или более дополнительный терапевтический агент, выбранный из антипролиферативных агентов, противовоспалительных агентов, иммуномодулирующих агентов, нейротропных факторов, агентов для лечения заболеваний крови, агентов для лечения диабета и агентов для лечения иммунодефицитных нарушений.
В другом аспекте настоящего изобретения предложены способы ингибирования активности PI3K киназы, включающие взаимодействие PI3K киназы с эффективным для ингибирования количеством соединения формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства.
В другом аспекте настоящего изобретения предложены способы профилактики или лечения заболевания или нарушения, модулированных PI3 киназами, включающий введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства. Примеры указанных заболеваний, состояний или нарушений включают, но не ограничиваются только ими, гиперпролиферативные нарушения (например, рак, включающий меланому и другие раковые заболевания кожи), нейродегенерацию, гипертрофию сердца, боли, мигрени, нейротравматические заболевания, инсульт, диабет, гепатомегалию, сердечнососудистые заболевания, болезнь Альцгеймера, кистозный фиброз, аутоиммунные заболевания, атеросклероз, рестеноз, псориаз, аллергические заболевания, воспаление, неврологические нарушения, заболевания, связанные с гормонами, состояния, связанные с трансплантацией органов, иммунодефицитные нарушения, деструктивные поражения костей, гиперпролиферативные нарушения, инфекционные заболевания, состояния, связанные с гибелью клеток, агрегацию тромбоцитов, вызванную тромбином, хроническую миелогенную лейкемию (ХМЛ), заболевание печени, патологические иммунные состояния, включающие активацию Т-клеток, и нарушения ЦНС.
В другом аспекте настоящего изобретения предложены способы профилактики или лечения гиперпролиферативного нарушения, включающие введение млекопитающему, нуждающемуся в указанном лечении, эффективного количества соединения формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомера, геометрического изомера, таутомера, сольвата, метаболита, N-оксидного производного или фармацевтически приемлемой соли или пролекарства, индивидуально или в комбинации с одним или более дополнительным соединением, обладающим антигиперпролиферативными свойствами.
В другом аспекте настоящего изобретения предложен способ применения соединения согласно настоящему изобретению для лечения заболевания или состояния, модулированных PI3 киназой и/или mTOR, у млекопитающего.
Дополнительный аспект настоящего изобретения включает применение соединения согласно настоящему изобретению в получении лекарственного средства для лечения или профилактики заболевания или состояния, модулированного PI3 киназой, у млекопитающего.
Другой аспект настоящего изобретения включает наборы, содержащие соединение формулы (I) или одной из формул от (Ia) до (Ii) или его стереоизомер, геометрический изомер, таутомер, сольват, метаболит, N-оксидное производное или фармацевтически приемлемую соль или пролекарство; контейнер и, возможно инструкцию по применению или вкладыш с показаниями для лечения.
Другой аспект настоящего изобретения включает способы получения, способы выделения и способы очистки соединений формулы (I) или одной из формул от (Ia) до (Ii).
Другой аспект настоящего изобретения включает новые промежуточные соединения, применимые для получения соединений формулы (I) или одной из формул от (Ia) до (ii).
Дополнительные преимущества и новые особенности настоящего изобретения предложены, в частности, в следующем описании, и, в частности, станут понятными специалистам в данной области техники после рассмотрения следующего описания или могут быть изучены при практическом исследовании настоящего изобретения. Преимущества настоящего изобретения могут быть реализованы и получены при помощи средств, комбинаций, композиций и способов, конкретно отмеченных в прилагаемой формуле изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ТИПИЧНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
Обратимся к подробному описанию конкретных вариантов реализации настоящего изобретения, примеры которых проиллюстрированы в прилагаемых структурах или формулах. При том, что изобретение описывают совместно с пронумерованными вариантами реализации, следует понимать, что они приведены, как не ограничивающие изобретение в рамках указанных вариантов реализации. Напротив, изобретение охватывает все альтернативы, модификации и эквиваленты, которые могут быть включены в рамки настоящего изобретения, определенного формулой изобретения.
Специалисту в данной области техники станут понятны способы и вещества, аналогичные или эквивалентные, описанным в настоящей заявке, которые можно применять при практическом осуществлении настоящего изобретения. Настоящее изобретение никаким образом не ограничено способами и веществами, описанными в настоящей заявке.
В случае если одна или более ссылка на публикацию, патенты и аналогичные материалы, отличается или противоречит настоящей заявке в отношении, включающем, но не ограничивающимся, конкретными терминами, применением терминов, описанных техник и т.д., следует принимать во внимание исключительно содержание настоящей заявки.
ОПРЕДЕЛЕНИЯ
Термин «алкил», используемый в настоящей заявке, относится к насыщенному линейному или разветвленному одновалентному углеводородному радикалу, содержащему от одного до двенадцати атомов углерода (С1-С12), где алкильный радикал может быть возможно независимо замещен одним или более заместителем, описанным ниже. В другом варианте реализации алкильный радикал содержит от одного до восьми атомов углерода (С1-С8), или от одного до шести атомов углерода (С1-С6). Примеры алкильных групп включают, но не ограничиваются только ими, метил (Me, -СН3), этил (Et, -СН2СН3), 1-пропил (н-Pr, н-пропил, -СН2СН2СН3), 2-пропил (и-Pr, изопропил, -СН(СН3)2), 1-бутил (н-Bu, н-бутил, -СН2СН2СН2СН3), 2-метил-1-пропил (и-Bu, изобутил, -CH2CH(СН3)2), 2-бутил (втор-Bu, втор-бутил, -СН(СН3)СН2СН3), 2-метил-2-пропил (трет-Bu, трет-бутил, -С(СН3)3), 1-пентил (н-пентил, -СН2СН2СН2СН2СН3), 2-пентил (-СН(СН3)СН2СН2СН3), 3-пентил (-СН(СН2СН3)2), 2-метил-2-бутил (-С(СН3)2СН2СН3), 3-метил-2-бутил (-СН(СН3)СН(СН3)2), 3-метил-1-бутил (-СН2СН2СН(СН3)2), 2-метил-1-бутил (-СН2СН(СН3)СН2СН3), 1-гексил (-СН2СН2СН2СН2СН3), 2-гексил (-СН(СН3)СН2СН2СН2СН3), 3-гексил (-CH(CH2CH3)(CH2CH2CH3)), 2-метил-2-пентил (-С(СН3)2СН2СН2СН3), 3-метил-2-пентил (-СН(СН3)СН(СН3)СН2СН3), 4-метил-2-пентил (-СН(СН3)СН2СН(СН3)2), 3-метил-2-пентил (-СН(СН3)(СН2СН3)2), 2-метил-3-пептил (-СН(СН2СН3)СН(СН3)2), 2,3-диметил-2-бутил (-С(СН3)2СН(СН3)2), 3,3-димстил-2-бутил (-СН(СН3)С(СН3)3, 1-гептил, 1-октил, и т.д.
Термин «алкенил» относится к линейному или разветвленному одновалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-С8), содержащему по меньшей мере один ненасыщенный участок, т.е. углерод-углеродную sp2 двойную связь, где алкенильный радикал может быть возможно замещен одним или более заместителем, описанным в настоящей заявке, и включает радикалы, обладающие «цис-» и «транс-» ориентациями, или как альтернатива, «Е» и «Z» ориентациями. Примеры включают, но не ограничиваются только ими, этиленил или винил (-СН=СН2), аллил (-СН2СН=СН2) и т.д.
Термин «алкинил» относится к линейному или разветвленному одновалентному углеводородному радикалу, содержащему от двух до восьми атомов углерода (С2-С8), содержащему по меньшей мере одни ненасыщенный участок, т.е., углерод-углеродную sp тройную связь, где алкинильный радикал может быть возможно независимо замещен одним или более заместителем, описанным в настоящей заявке. Примеры включают, но не ограничиваются только ими, этинил (-С≡СН), пропинил (пропаргил, -СН2С≡СН) и т.д. Термин «галоген» (или гало-) предпочтительно представляет собой хлор или фтор, но также может представлять собой бром или йод.
Термины «карбоцикл», «карбоциклил», «карбоциклическое кольцо» и «циклоалкил» относятся к одновалентному, неароматическому, насыщенному или частично ненасыщенному кольцу, содержащему от 3 до 12 атомов углерода (С3-С12) в составе моноциклического кольца или от 7 до 12 атомов углерода в составе бициклического кольца. Бициклические карбоциклы, содержащие от 7 до 12 атомов, могут быть сгруппированы, например, в виде бицикло [4,5], [5,5], [5,6] или [6,6] систем, а бициклические карбоциклы, содержащие 9 или 10 атомов в кольце, могут быть сгруппированы в виде бицикло [5,6] или [6,6] систем или мостиковых систем, таких как бицикло[2.2.1]гептан, бицикло[2.2.2]октан и бицикло [3.2.2] нонан. Примеры моноциклических карбоциклов включают, но не ограничиваются только ими, циклопропил, циклобутил, циклопентил, 1-циклопен-1-енил, 1-циклопент-2-енил, 1-циклопент-3-енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, циклогексадиенил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил, циклододецил и т.д.
«Арил» означает одновалентный ароматический углеводородный радикал, содержащий 6-20 атомов углерода (С6-С20), полученный при удалении одного атома водорода от одного атома углерода исходной ароматической системы. Некоторые арильные группы представлены в типичных структурах, как «Ar». Арил включает бициклические радикалы, содержащие ароматическое кольцо, конденсированное с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим кольцом. Типичные арильные группы включают, но не ограничиваются только ими, радикалы, полученные из бензола (фенил), замещенных бензолов, нафталина, антрацена, бифенил, инденил, инданил, 1,2-дигидронафталин, 1,2,3,4-тетрагидронафтил и т.д. Арильные группы являются возможно независимо замещенными одним или более заместителем, описанным в настоящей заявке.
Термины «гетероцикл», «гетероциклил» и «гетероциклическое кольцо», которые в настоящей заявке используют взаимозаменяемо, относятся к насыщенному или частично ненасыщенному (т.е, содержащему одну или более двойную и/или тройную связь внутри кольца) карбоциклическому радикалу, содержащему от 3 до 20 атомов в кольце, в котором по меньшей мере один атом кольца представляет собой гетероатом, выбранный из азота, кислорода, фосфора и серы, остальные атомы кольца представляют собой атомы С, где один или более атом кольца возможно независимо замещен одним или более заместителем, описанным далее. Гетероцикл может представлять собой моноцикл, содержащий от 3 до 7 членов в кольце (от 2 до 6 атомов углерода и от 1 до 4 гетероатомов, выбранных из N, О, Р и S) или бицикл, содержащий от 7 до 10 членов в кольце (от 4 до 9 атомов углерода и от 1 до 6 гетероатомов, выбранных из N, О, Р и S), например: бицикло [4,5], [5,5], [5,6] или [6,6] систему. Гетероциклы, описанные в работе Лео А. Паке: «Principles of Modern Heterocyclic Chemistry» (W.A. Benjamin, New York, 1968), особенно в Разделах 1, 3, 4, 6, 7 и 9; «The Chemistry of Heterocyclic Compounds, A series of Monographs» (John Wiley & Sons, New York, от 1950 до настоящего времени), особенно в Разделах 13, 14, 16, 19 и 28; и J. Am. Chem. Soc. (1960) 82:5566. «Гетероциклил» также включает радикалы, в которых гетероциклические радикалы конденсированы с насыщенным, частично ненасыщенным кольцом или ароматическим карбоциклическим или гетероциклическим кольцом. Примеры гетероциклических колец включают, но не ограничиваются только ими, пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидино, морфолино, тиоморфолино, тиоксанил, пиперазинил, гомопиперазинил, азетидинил, оксетанил, тиетанил, гомопиперидинил, оксепанил, тиепанил, оксазепинил, диазепипил, тиазепинил, 2-пирролинил, 3-пирролинил, индолинил, 2Н-пиранил, 4Н-пиранил, диоксанил, 1,3-диоксоланил, пиразолинил, дитианил, дитиоланил, дигидропиранил, дигидротиснил, дигидрофуранил, пиразолидинилимидазолинил, имидазолинил, 3-азабицикло[3.1.0]гексанил, 3-азабицикло[4.1.0]гептанил, азабицикло[2.2.2]гексанил, 3Н-индолилхинолизинил и N-пиридил мочевину. Также в рамки настоящего определения включены спирогруппы. Примеры гетероциклической группы, в которой 2 углеродных атома кольца замещены оксо (=O) группами, представляют собой пиримидинонил и 1,1-диоксотиоморфолинил. Гетероциклические группы, описанные в настоящей заявке, являются возможно независимо замещенными одним или более заместителем, описанным в настоящей заявке.
Термин «гетероарил» относится к одновалентному ароматическому радикалу 5-, 6- или 7-членных колец и включает конденсированные системы колец (по меньшей мере одно из которых является ароматическим), состоящие из 5-20 атомов, содержащие один или более гетероатом, независимо выбранный из азота, кислорода и серы. Примеры гетероарильных групп представляют собой пиридинил (включая, например, 2-гидроксипиридинил), имидазолил, имидазопиридинил, пиримидинил (включая, например, 4-гидроксипиримидинил), пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, тиазолил, оксадиазолил, оксазолил, изотиазолил, пирролил, хинолинил, изохинолинил, тетрагидроизохинолинил, индолил, бензимидазолил, бензофуранил, циннолинил, индазолил, индолизинил, фталазинил, пиридазинил, триазинил, изоиндолил, птеридинил, пуринил, оксадиазолил, триазолил, тиадиазолил, фуразанил, бензофуразанил, бензотиофиенил, бензотиазолил, бензооксазолил, хиназолинил, хиноксалинил, нафтиридинил и фуропиридинил. Гетероарильные группы являются возможно независимо замещенными одним или более заместителем, описанным в настоящей заявке.
Гетероциклические или гетероарильные группы могут быть связаны с углеродом (связанными через атом углерода) или с азотом (связанными через атом азота), где связывание возможно. В качестве примера и не для ограничения, связанные через атом углерода гетероциклы или гетероарилы присоединены в положении 2, 3, 4, 5 или 6 пиридина, положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола, положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2, 3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина.
В качестве примера и не для ограничения, связанные через атом азота гетероциклы и гетероарилы присоединены в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолипа, 3-имидазолипа, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1H-индазола, положении 2- изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или β-карболина.
Термин «моноциклический гетероарил» относится к пяти- или шестичленному незамещенному или замещенному моноциклическому гетероарильному радикалу, который содержит 1, 2, 3 или 4 гетероатома в кольце, независимо выбранных из N, О и S. Моноциклический гетероарил может быть присоединен в положении С-2 пиримидинового кольца в соответствии с формулами Ia-Ii по любому атому углерода (связанный через атом углерода) или азота (связанный через атом азота) моноциклической гетероарильной R3 группы. Моноциклические гетероарильные радикалы включают, но не ограничиваются только ими, 2-пиридил, 3-пиридил, 4-пиридил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-имидазолил, 4-имидазолил, 3-пиразолил, 4-пиразолил, 2-пирролил, 3-пирролил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 2-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 2-оксазолил. 4-оксазолил, 5-оксазолил, 2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 3-триазолил, 1-триазолил, 5-тетразолил, 1-тетразолил и 2-тетразолил. Моноциклический гетероарил является возможно независимо замещенным одним или более заместителем, описанным в настоящей заявке.
Термины «лечить» и «лечение» относятся к терапевтическому лечению и профилактическим или превентивным мерам, где целью является предотвращение или замедление (ослабление) нежелательного патологического изменения или нарушения, такого как развитие или распространение рака. Для задач настоящего изобретения благоприятные или желательные клинические результаты включают, но не ограничиваются только ими, уменьшение симптомов, снижение тяжести заболевания, стабильное (т.е., не ухудшающееся) состояние заболевания, задержка или замедление прогрессирования болезни, облегчение или ослабление состояние заболевания и ремиссия болезни (частичная или полная), детектируемые или недетектируемые. «Лечение» также может означать повышение выживаемости по сравнению с предполагаемой выживаемостью без получения лечения. Пациенты, нуждающиеся в лечении, включают пациентов, страдающих от болезненного состояния или нарушения, а также к пациентам, которые склонны к болезненному состоянию или нарушению, или пациентов, которым необходима профилактика болезненного состояния или нарушения.
Фраза «терапевтически эффективное количество» означает количество соединения согласно настоящему изобретению, которое (i) лечит или предотвращает конкретное заболевание, состояние или нарушение, (ii) уменьшает, облегчает или устраняет один или более симптом конкретного заболевания, состояния или нарушения или (iii) предотвращает или задерживает проявление одного или более симптома конкретного заболевания, состояния или нарушения, описанного в настоящей заявке. В случае рака, терапевтически эффективное количество лекарственного средства может уменьшать количество раковых клеток; уменьшать размер опухоли, ингибировать (т.е., замедлять до некоторой степени, а предпочтительно останавливать) проникновение раковых клеток в периферические органы, ингибировать (т.е., замедлять до некоторой степени, а предпочтительно останавливать) метастазы опухоли, ингибировать до некоторой степени рост опухоли и/или ослаблять до некоторой степени один или более симптом, вызванный раком. В зависимости от степени, в которой лекарственное средство может предотвращать рост и/или убивать существующие раковые клетки, лекарственное средство может быть цитостатическим и/или цитотоксическим. Эффективность раковой терапии можно измерить, например, при помощи определения времени до прогрессирования (ТТР) и/или определения скорости ответа (RR).
Термины «рак» и «раковый» относятся или описывают физиологическое состояние у млекопитающих, которое, как правило, характеризуется нерегулируемым ростом клеток. «Опухоль» содержит одну или более раковую клетку. Примеры раковых заболеваний включают, но не ограничиваются только ими, карциному, лимфому, бластому, саркому и лейкемию или лимфолейкоз. Более конкретные примеры указанных раковых заболеваний включают плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак легких, немелкоклеточный рак легких (НМРЛ), аденокарциному легких и плоскоклеточную карциному легких, рак брюшной полости, гепатоклеточный рак, рак желудка или ЖКТ, включающий рак желудочно-кишечного тракта, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, карциному эндометрия или матки, рак слюнных желез, рак почек или ренальный рак, рак простаты, вульварный рак, рак щитовидной железы, карциному печени, карциному полового члена, а также рак головы и шеи.
«Химиотерапевтический агент» представляет собой химическое соединение, применимое для лечения рака. Примеры известных химиотерапевтич