2,6-диаминопиридиновые соединения для лечения заболеваний, связанных с амилоидными белками, или для лечения глазных болезней
Иллюстрации
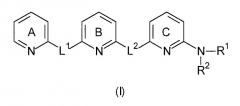
Показать всеИзобретение относится к соединениям формулы (I)
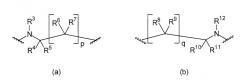
где пиридиновые кольца А, В и С являются независимо незамещенными или замещенными одним или несколькими заместителями, которые независимо выбраны из группы, состоящей из: C1-6-алкила, галогеналкила, имеющего 1-6 атомов углерода, Hal или OR13; L1 и L2 независимо выбраны из остатков, имеющих формулу (а) или (b)
где, по меньшей мере, один из L1 или L2 имеет формулу (b); R1 и R2 независимо выбраны из группы, состоящей из водорода, C1-6-алкила и фенила; R3 выбран из водорода и C1-6-алкила; R4, R5, R6 и R7 независимо выбраны из группы, состоящей из водорода и C1-6-алкила; R8, R9, R10 и R11 независимо выбраны из группы, состоящей из водорода и C1-6-алкила; R12 выбран из группы, состоящей из водорода и C1-6-алкила; R13 независимо выбран из группы, состоящей из водорода, C1-6-алкила и фенила; р равно 1 или 2; q равно 0, 1 или 2 и Hal выбран из группы, состоящей из F, Cl, Br, и I, которые могут быть использованы при лечении группы расстройств и нарушений, связанных с амилоидным белком. 4 н. и 13 з.п.ф-лы, 1 ил., 6 таб., 13 пр.
Реферат
Сущность изобретения
Настоящее изобретение относится к новым соединениям, которые могут использоваться для лечения группы расстройств и нарушений, связанных с амилоидными белками, в частности с глазными расстройствами, такими как глаукома или возрастная дегенерация желтого пятна (AMD), и заболеваний или состояний, связанных с амилоидоподобными белками. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим эти соединения, и к использованию этих соединений для производства лекарственных средств для лечения заболеваний или состояний, связанных с амилоидными или амилоидоподобными белками. Также описывается способ лечения заболеваний или состояний, связанных с амилоидными или амилоидоподобными белками.
Соединения по настоящему изобретению могут также использоваться при лечении или предотвращении глазных болезней, связанных с патологическими нарушениями/изменениями в тканях зрительной системы, в частности, связанных с патологическими нарушениями/изменениями в тканях зрительной системы, связанными с бета-амилоидными белками, таких как нейронная дегенерация. Указанные патологические нарушения могут происходить, например, в различных тканях глаза, таких как зрительный кортекс, приводя к кортикальной недостаточности зрения; как передняя камера и как зрительный нерв, приводя к глаукоме; как хрусталик, приводя к катаракте из-за осаждения бета-амилоидных белков; как стекловидное тело, приводя к глазным амилоидозам; как сетчатка, приводя к первичной дегенерации сетчатки и дегенерации желтого пятна, например, к возрастной дегенерации желтого пятна; как зрительный нерв, приводя к друзам зрительного нерва, к оптической нейропатии и к невриту зрительного нерва; и как роговая оболочка, приводя к решетчатой дистрофии.
Область техники, к которой относится изобретение
Множество возрастных заболеваний основываются на амилоидных или амилоидоподобных белках или связаны с ними и отличаются, в частности, возникновением внеклеточных отложений амилоидных или амилоидоподобных материалов, которые вносят вклад в патогенез, а также в развитие заболевания.
Эти нейродегенеративные заболевания включают как расстройства центральной нервной системы, так и расстройства периферической нервной системы, в частности, глазные расстройства.
Такие расстройства включают, но, не ограничиваясь этим, неврологические расстройства, такие как болезнь Альцгеймера (AD), заболевания или состояния, отличающиеся потерей способности к когнитивному запоминанию, такие, например, как умеренные когнитивные нарушения (MCI), деменция с тельцами Леви, синдром Дауна, наследственная церебральная геморрагия с амилоидозом голландского типа; гуамский комплекс паркинсонизма-деменции. Другие расстройства, которые основываются на амилоидоподобных белках или связаны с ними, представляют собой прогрессирующий супрануклеарный паралич, рассеянный склероз; болезнь Крейтцфельда-Якоба, болезнь Паркинсона, деменцию, связанную с ВИЧ, ALS (амиотрофический боковой склероз), миозит с тельцами включения (IBM), диабет взрослых; сенильный сердечный амилоидоз; эндокринные опухоли и другие заболевания, включая связанные с амилоидами глазные болезни, которые нацелены на различные ткани глаза, такие как зрительный кортекс, включая кортикальную недостаточность зрения; как передняя камера и зрительный нерв, включая глаукому; как хрусталик, включая катаракту из-за осаждения бета-амилоидных белков; стекловидное тело, включая глазные амилоидозы; как сетчатка, включая первичную дегенерацию сетчатки и дегенерацию желтого пятна, например, возрастную дегенерацию желтого пятна; как зрительный нерв, включая друзы зрительного нерва, оптическую нейропатию и неврит зрительного нерва; и как роговая оболочка, включая решетчатую дистрофию.
Бета-амилоид (Aβ) является главным компонентом сенильных бляшек при болезни Альцгеймера (AD). Эти бляшки вызываются аномальным процессингом белка-предшественника амилоида (APP) и участвуют в нейропатии AD. Aβ также, как показано недавно, участвует в развитии глазных расстройств, таких как глаукома, посредством апоптоза ганглионарных клеток сетчатки (RGC). Связь между глаукомой и AD демонстрируется в нескольких исследованиях на пациентах с AD, демонстрирующих также потери RGC, связанные с типичными глаукоматозными изменениями, такими как оптическая нейропатия и ослабление зрительной функции.
Глаукома представляет собой группу заболеваний зрительного нерва, включающих потерю ганглионарных клеток сетчатки (RGC), при характерной картине оптической нейропатии. Глаукома часто, но не всегда, сопровождается повышением глазного давления, которое может представлять собой результат блокировки циркуляции водной жидкости или ее дренирования.
Хотя повышенное внутриглазное давление представляет собой значительный фактор риска для развития глаукомы, порог внутриглазного давления, который был бы определяющим для возникновения глаукомы, не может быть определен.
Повреждение может также вызываться плохим подводом крови к витальным волокнам зрительного нерва, слабостью структуры нерва, и/или проблемой со здоровьем самих нервных волокон.
Нелеченая глаукома приводит к необратимому повреждению зрительного нерва и возникающей в результате потере поля зрения, которая может развиться до слепоты.
RGC представляют собой нервные клетки, которые передают зрительные сигналы от глаза в мозг. Каспаза-3 и каспаза-8, два главных фермента в процессе апоптоза, активируются в этом процессе, приводя к апоптозу RGC. Каспаза-3 расщепляет белок-предшественник амилоида (APP) с получением нейротоксичных фрагментов, включая амилоид β. В отсутствие защитного воздействия APP, аккумуляция амилоида β в слое ганглионарных клеток сетчатки вызывает гибель RGC и необратимую потерю зрения.
Различные типы глаукомы классифицируются как открытоугольные глаукомы, если состояние является хроническим, или закрытоугольные глаукомы, если острая глаукома возникает внезапно. Глаукома обычно воздействует на оба глаза, но заболевание может развиваться в одном глазу быстрее, чем в другом.
Хроническая открытоугольная глаукома (COAG), также известная как первичная открытоугльная глаукома (POAG), представляет собой наиболее распространенный тип глаукомы. COAG вызывается микроскопической блокировкой трабекулярной сети, которая уменьшает дренирование оттока водной жидкости в венозный синус склеры, и повышает внутриглазное давление (IOP). POAG обычно воздействует на оба глаза и тесно связана с возрастом и положительной семейной историей. Частота ее появления увеличивается у пожилых людей, поскольку механизм дренирования жидкости из глаза может постепенно забиваться с возрастом. Повышение внутриглазного давления у субъектов, подверженных хронической открытоугольной глаукоме, не сопровождается никакими симптомами, пока не почувствуется потеря в центральной области зрения.
Остроугольная глаукома (AACG) или закрытоугольная глаукома представляет собой относительно редкий тип глаукомы, отличающийся внезапным увеличением внутриглазного давления до 35-80 мм рт. ст., приводя к острой боли и необратимой потере зрения. Внезапное повышение давления вызывается перекрыванием угла фильтрования и блокировкой дренажных каналов. Индивидуумы с узкими углами имеют повышенный риск внезапной закупорки угла. AACG обычно возникает в одном глазу, но существует риск для обоих глаз. Возраст, катаракта и псевдокапсулярная эксфолиация также являются факторами риска, поскольку они связаны с увеличением хрусталика и расширением или сужением угла. Внезапный приступ глаукомы может быть связан с острой глазной болью и головной болью, с воспалением глаз, тошнотойой и с помутнением зрения.
Смешанная глаукома или глаукома с сочетанным механизмом представляет собой смесь или сочетание открытоугольной и закрытоугольной глаукомы. Она возникает у пациентов с острой ACG, у которых угол открывается после лазерной иридотомии, но которые продолжают нуждаться в лекарственных средствах для контроля IOP, а также у пациентов с POAG или с псевдоэксфолиативной глаукомой, у которых постепенно развивается сужение угла.
Глаукома при нормальном давлении (NTG), известная также как глаукома при низком давлении (LTG), отличается прогрессирующим повреждением зрительного нерва и потерей периферического зрения, сходными с теми, которые наблюдаются при других типах глаукомы; однако внутриглазное давление находится в нормальном диапазоне, или оно даже ниже нормального.
Врожденная (младенческая) глаукома представляет собой относительно редкий наследуемый тип открытоугольной глаукомы. Недостаточное развитие области дренирования приводит к повышению давления в глазу, которое может приводить к потере зрения из-за повреждения зрительного нерва и к увеличению глаза. Ранняя диагностика и лечение являются критичными для сохранения зрения у младенцев и детей, подверженных этому заболеванию.
Вторичная глаукома может возникать в результате повреждения глаза, воспаления радужной оболочки глаза (а), диабета, или использования стероидов у индивидуумов, восприимчивых к стероидам. Вторичная глаукома может также быть связана с или закупоркой или блокировкой ретинальной вены.
Пигментарная глаукома отличается отсоединением гранул пигмента от радужной оболочки. Гранулы вызывают блокировку глазной системы дренирования, приводя к повышению внутриглазного давления и повреждению зрительного нерва.
Эксфолиативная глаукома (псевдокапсулярная эксфолиация) отличается отложением хлопьевидного материала на передней капсуле и в углу глаза. Аккумуляция хлопьевидного материала блокирует систему дренирования, и повышает глазное давление.
Диагноз глаукомы может быть поставлен с использованием различных исследований. определяет давление в глазу с помощью измерения тонуса или твердости его поверхности. Для этого исследования доступны несколько типов тонометров, наиболее распространенным является аппланационный тонометр. Пахиметрия определяет толщину роговой оболочки, которая, в свою очередь, является мерой внутриглазного давления. Гониоскопия дает возможность для исследования угла фильтрования и площади дренирования глаза. Гониоскопия может также определять, могут ли аномальные кровеносные сосуды блокировать дренирование водной жидкости из глаза. Офтальмоскопия делает возможным исследование зрительного нерва и может детектировать отпадение слоя нервных волокон или изменение диска зрительного нерва, или зазубривание этой структуры (образования в ней углубления), которое может вызываться повышением внутриглазного давления или отпадением аксонов. Гониоскопия является также полезной при оценке повреждения нерва из-за плохого протекания крови или повышенного внутриглазного давления. Исследования поля зрения субъективно картируют поле зрения, это может детектировать признаки глаукоматозного повреждения зрительного нерва. Они представляются с помощью конкретных картин потерь поля зрения. Глазная когерентная томография, объективная мера потерь слоя нервных волокон, осуществляется посредством наблюдения толщины слоя волокон зрительного нерва (которая изменяется при глаукоме) посредством разницы в прохождении света через поврежденную аксональную ткань.
Дегенерация желтого пятна представляет собой распространенное заболевание глаз, которое вызывает ухудшение состояния желтого пятна, которое представляет собой центральный участок сетчатки (ткани толщиной с лист бумаги на задней внутренней поверхности глаза, где светочувствительные клетки посылают зрительные сигналы в мозг). Острое, четкое, 'переднее' зрение вырабатывается с помощью желтого пятна. Повреждение желтого пятна приводит к развитию слепых пятен и к помутнению или нарушению зрения. Возрастная дегенерация желтого пятна (AMD) является главной причиной ухудшения зрения в Соединенных Штатах для людей в возрасте больше 65 и является главной причиной реальной слепоты среди Европейцев. Приблизительно 1,8 миллиона американцев в возрасте 40 и старше имеют развитую AMD, а еще 7,3 миллиона людей с промежуточной стадией AMD имеют значительный риск потери зрения. Правительство оценивает, что к 2020 году будет 2,9 миллиона людей с развитой AMD. Жертвы AMD часто бывают неприятно удивлены и озабочены, обнаруживая, насколько мало известно о причинах и лечении этого состояния с потерей зрения.
Имеются две формы дегенерации желтого пятна: сухая дегенерация желтого пятна и влажная дегенерация желтого пятна. Сухая форма, при которой клетки желтого пятна начинают медленно разрушаться, диагностируется у 85 процентов случаев дегенерации желтого пятна. Обычно сухая AMD воздействует на оба глаза, хотя и один глаз может потерять зрение, в то время как другой глаз остается нетронутым. Друзы, которые представляют собой желтые осаждения под сетчаткой, представляют собой распространенные ранние признаки болезни сухой AMD. Риск развития развитой сухой AMD или влажной AMD увеличивается, когда количество или размер друз увеличивается. Иногда бывает, что сухая AMD развивается и вызывает потерю зрения без перехода во влажную форму заболевания; однако бывает также, что сухая AMD на ранней стадии внезапно переходит во влажную форму.
Влажная форма, хотя она составляет только 15 процентов от всех случаев, дает 90 процентов слепоты, и считается развитой AMD (ранней или промежуточной стадии влажной AMD нет). Влажной AMD всегда предшествует сухая форма заболевания. Когда сухая форма ухудшается, у некоторых людей начинается аномальный рост кровеносных сосудов позади желтого пятна. Эти сосуды являются очень хрупкими, и будут иметь утечки жидкости и крови (отсюда 'влажная' дегенерация желтого пятна), вызывая быстрое повреждение желтого пятна.
Сухая форма AMD сначала часто вызывает легкое помутнение зрения. Центр зрения, в частности, может стать мутным и этот участок становится больше, когда болезнь прогрессирует. Симптомы могут и не замечаться, если поражается только один глаз. При влажной AMD, могут появляться прямые линии, волнистые, и может происходить быстрая потеря центрального зрения.
Диагностика дегенерации желтого пятна, как правило, включает исследование расширенного глаза, исследование остроты зрения и глазного дна с использованием процедуры, называемой исследованием глазного дна, чтобы помочь в диагностике AMD, и - если ожидается влажная AMD, может также осуществляться флуоресцеиновая ангиография. Если сухая AMD достигает развитых стадий, то современного лечения для предотвращения потери зрения не существует. Однако высокие дозы конкретных препаратов антиоксидантов и цинка могут отсрочить или предотвратить развитие промежуточной AMD до развитой стадии. Macugen® (пегаптаниб натрий, инъекция), лазерная фотокоагуляция и фотодинамическая терапия могут контролировать аномальный рост кровеносных сосудов и кровотечение в желтом пятне, что является полезным для некоторых людей, которые имеют влажную AMD; однако зрение, которое уже потеряно, не будет восстанавливаться с помощью этих методик. Если зрение уже потеряно, то имеются средства для людей с плохим зрением, которые могут помочь улучшить качество жизни.
Один из самых ранних признаков возрастной дегенерации желтого пятна (AMD) представляет собой аккумуляцию внеклеточных отложений, известных как друзы, между базальной отпадающей оболочкой пигментированного эпителия сетчатки (RPE) и мембраной Бруха (BM). Недавние исследования, осуществленные Anderson et al. подтвердили, что друзы содержат бета-амилоидный белок. (Experimental Eye Research 78 (2004) 243-256).
Прионы вызывают нейродегенеративные заболевания, такие как скрепи у овец, бычью губкообразную энцефалопатию у крупного рогатого скота и болезнь Крейтцфельдта-Якоба у людей. Единственный известный компонент частицы представляет собой изоформу белка, присущую скрепи, PrPSc. Хотя прионы размножаются, нет доказательств того, что они содержат нуклеиновую кислоту. PrPSc получается из неинфекционного клеточного белка PrPC с помощью посттрансляционного процесса, в течение которого PrPC подвергается выраженному конформационному изменению.
Белок PrPSc, присущий скрепи, играет критическую роль в нейронной дегенерации, и в течение развития заболевания подвергается трехстадийному преобразованию, следующим образом: PrPC (нормальная клеточная изоформа белка) - PrPSc: инфекционная форма (изоформа белка, присущая скрепи) - белок PrP27-30.
Такой каскад событий происходит в течение развития болезни Крейтцфельдта-Якоба (CJD), Куру, синдрома Герстманна-Страусслера-Шайнкера (GSS), летальной врожденной асомнии у людей, скрепи у овец и коз, энцефалопатии у норок и бычьей губкообразной энцефалопатии у крупного рогатого скота.
Клеточный нетоксичный белок (PrPC) представляет собой сиалогликопротеин с молекулярной массой от 33000 до 35000, который экспрессируется в основном в нейронах. При заболеваниях, указанных выше, PrPC преобразуется в измененную форму (PrPSc), которая отличается от своего нормального гомолога своей относительной стойкостью к дигестии с помощью протеаз. PrPSc аккумулируется в центральной нервной системе пораженных животных и индивидуумов, и его протеазоустойчивая сердцевина агрегирует вне клеток.
Амилоидоз не представляет собой отдельного заболевания, но скорее представляет собой разнообразную группу прогрессирующих болезненных процессов, отличающихся отложениями во внеклеточных тканях воскообразного крахмалоподобного белка, называемого амилоидным белком, который аккумулируется в одном или нескольких органах или системах организма. Когда амилоидные отложения увеличиваются в размерах, они начинают вмешиваться в нормальное функционирование органа или системы организма. Имеется, по меньшей мере, 15 различных типов амилоидоза. Главные формы представляют собой первичный амилоидоз без известных предшественников, вторичный амилоидоз, который следует после какого-нибудь другого состояния, и наследственный амилоидоз.
Вторичный амилоидоз возникают у людей, которые имеют хроническую инфекцию или воспалительное заболевание, такое как туберкулез, бактериальную инфекцию, называемую наследственной средиземноморской лихорадкой, костные инфекции (остеомиелит), ревматоидный артрит, воспаление тонкого кишечника (грануломатозный илеит), болезнь Ходжкина и проказу.
Друзы зрительного нерва представляют собой глобулярные конкреции белка и солей кальция, которые как считается, представляют собой секреции наследственно изменённых сосудистых структур, которые воздействуют на слой аксональных нервных волокон. Эта аккумуляция происходит в перипапиллярном слое нервных волокон и, как считается, повреждает слой нервных волокон либо непосредственно, посредством сжатия, либо опосредованно, прерывая сосудистое снабжение слоя нервных волокон. Она обычно становится видимой после первого десятилетия жизни пораженных индивидуумов. Чаще всего она происходит на обоих глазах, но может также происходить в одном глазу и может вызывать умеренную потерю периферического зрения в течение многих лет.
Оптическая нейропатия представляет собой заболевание, отличающееся повреждением зрительного нерва, вызываемым демиелинизацией, блокировкой поступления крови, недостаточностью питания или токсинами. Демиелинизирующие оптические нейропатии (смотри неврит зрительного нерва, ниже), как правило, вызываются фундаментальным процессом демиелинизации, таким как рассеянный склероз. Блокировка поступления крови, известная как ишемическая оптическая нейропатия, может приводить к гибели или дисфункции клеток зрительного нерва. Неартериальная ишемическая оптическая нейропатия обычно встречается у людей среднего возраста. Факторы риска включают высокое давление крови, диабет и атеросклероз. Артериальная ишемическая оптическая нейропатия обычно встречается у людей постарше после воспаления артерий (артериита), в частности, темпоральной артерии (темпоральный артериит). Потеря зрения может быть быстрой или развиваться постепенно в течение 2-7 дней, и повреждение может происходить на одном или обоих глазах. У людей с оптической нейропатией, вызываемой экспонированием токсина или питательной недостаточностью, обычно поражаются оба глаза.
Примерно 40% людей с неартериальной ишемической оптической нейропатией испытывают самопроизвольное улучшение со временем. Неартериальная ишемическая оптическая нейропатия лечится посредством контролирования давления крови, диабета и уровней холестерина. Артериальная ишемическая оптическая нейропатия лечится с помощью больших доз кортикостероидов для предотвращения потери зрения во втором глазу.
Неврит зрительного нерва связан с умеренной или острой потерей зрения в одном или обоих глазах и может вызываться системным процессом демиелинизации (смотри выше), вирусной инфекцией, вакцинацией, менингитом, сифилисом, рассеянным склерозом и внутриглазным воспалением (увеитом). Движение глаз может быть болезненным, и зрение может ухудшаться с повторением рецидивов. Диагностика включает исследования реакций зрачков и определение того, набух ли диск зрительного нерва. Магнитно-резонансная томография (MRI) может показать наличие рассеянного склероза или, редко, опухоли, которая давит на зрительный нерв, в этом случае зрение улучшается после того, как давление опухоли ослабляется. В большинстве случаев неврит зрительного нерва проходит сам в течение нескольких месяцев без лечения. В некоторых случаях, может быть необходимым лечение с помощью кортикостероидов, вводимых внутривенно.
Катаракта представляет собой помутнение, которое развивается в хрусталике глаза или в его оболочке. Катаракты, как правило, вызывают прогрессирующую потерю зрения, и могут вызывать слепоту, если остаются нелечеными. При моргагниевой катаракте, кортекс катаракты постепенно ожижается с образованием молочно-белой жидкости и может вызывать острое воспаление, если капсула хрусталика разрушается, и дает протечку. Если ее не лечить, катаракта может также вызвать факоморфическую глаукому. Катаракты могут быть врожденными по природе или вызываться генетическими факторами, старостью, долговременным ультрафиолетовым излучением, экспонированием для радиации, диабетом, ранением глаз или физической травмой.
Экстракапсулярная (ECCE) хирургия представляет собой наиболее эффективное лечение при лечении катаракты. При операции, хрусталик удаляется, но большая часть капсулы хрусталика остается интактной. Факоэмульсификация, малый надрез на одной стороне роговой оболочки, как правило, используется для разрушения хрусталика перед извлечением.
Глазной амилоидоз представляет собой наследственное расстройство, связанное с врожденной амилоидопатической полиневропатией (FAP) типа I, и отличающийся аномальными конъюктивальными сосудами сухой кератоконъюнктивит, аномалии зрачка и, в некоторых случаях, помутнение стекловидного тела и вторичную глаукому. FAP типа I связана с мутациями в транстиретине (TTR), тетрамерном белке плазмы (преальбумине), синтезируемом в печени, в пигментном эпителии сетчатки 2 и в сосудистой оболочке мозга. Различные мутации заставляют транстиретин полимеризоваться в виде складчатой структуры из амилоидных фибрил, приводя к наследственному амилоидозу. Наиболее часто встречающаяся мутация представляет собой TTR-met303, при которой метионин замещает валин в положени 30 в транстиретине.
FAP типа IV связана с решетчатой дистрофией роговой оболочки (LCD). Решетчатая дистрофия роговой оболочки представляет собой наследственный, первичный, обычно билатеральный амилоидоз роговой оболочки, отличающийся присутствием решетчатых преломляющих линий с двойным контуром в строме роговой оболочки. LCD типа I (Бибера-Хааба-Диммера) представляет собой аутосомальное доминантное, билатерально симметричное расстройство роговой оболочки, отличающееся присутствием многочисленных полупрозрачных тонких решетчатых линий с белыми точками и слабым помутнением в верхнем и среднем слоях центральной стромы. Симптомы возникают в течение первого или второго десятилетий жизни, вызывая прогрессирующую потерю зрения. Большинство пациентов нуждаются в трансплантации роговой оболочки к 40 годам жизни. LCD типа II связана с системным амилоидозом (синдромом Меритоя) и отличается присутствием толстых решетчатых линий в лимбе, центральной роговой оболочке и строме. Зрение не ухудшается до поздней старости. LCD типа III поражает людей среднего возраста, и отличается присутствием толстых решетчатых линий, которые простираются от лимба до лимба. LCD типа III A отличается аккумуляцией амилоидных отложений в строме и присутствием полос амилоидного белка между стромой и слоем Баумана, LCD типа III A отличается от LCD типа III присутствием эрозии роговой оболочки, возникновением белых пятен и аутосомальной доминантной наследственной структурой.
Лечения для глаукомы нет. Большинство видов лечения для глаукомы создаются для понижения и/или контроля внутриглазного давления (IOP), которое может повредить зрительный нерв, который передает зрительную информацию в мозг. Глазные капли от глаукомы часто являются первым выбором по сравнению с хирургическим лечением глаукомы, и могут быть очень эффективными при контроле IOP для предотвращения повреждения глаз. Медицинские препараты для лечения глаукомы классифицируются по их активным химическим соединениям, и могут быть перечислены в следующих далее категориях, (при этом лекарственные средства, одобренные в настоящее время, показаны в скобках):
- Бета-блокаторы (тимоптик, бетоптик, исталол, тимолол) работают посредством уменьшения продуцирования (водной) жидкости в глазу.
- Ингибиторы угольной ангидразы (трусопт, азопт, диамокс, наптазан, даранид) уменьшают скорость продуцирования внутриглазной жидкости.
- Альфа-адренергические агонисты (альфаган, альфаган-P, иопидин) также уменьшают продуцирование внутриглазной жидкости.
- Простагландины (ксалатан, лумиган, траватан Z, рескула) перенаправляют дренирование внутриглазной жидкости в другой путь в задней части глаза, уменьшая тем самым избыточное глазное давление.
- Парасимпатомиметики (карбахол, пилокарпин) работают посредством повышения оттока водной жидкости из глаза, увеличивая, таким образом, дренирование внутриглазной жидкости.
- Эпинефрин уменьшает скорость продуцирования внутриглазной жидкости, и увеличивает отток водной жидкости из глаза.
Наряду с медицинскими препаратами, предназначенными для контроля IOP, определенные исследовательские способы лечения глаукомы концентрируются на защите зрительного нерва. Лекарственное средство мемантин от болезни Альцгеймера в настоящее время исследуется при показаниях глаукомы в качестве нейропротектора. Однако рандомизированное клиническое исследование антагониста N-метил-d-аспартата (NMDA) мемантина при открытоугольной глаукоме не показывает значительной эффективности.
Дополнительные виды лечения глаукомы представляют собой лазерную хирургию, которая включает трабекулопластику, процедуру, которая помогает внутриглазной жидкости покидать глаз более эффективно. Согласно Glaucoma Foundation, примерно 80% пациентов реагируют на процедуру достаточно хорошо, чтобы отложить или исключить дополнительную операцию. Однако давление опять увеличивается в глазах у половины всех пациентов в пределах двух лет после лазерной хирургии, согласно National Eye Institute. Хирургическую операцию осуществляют, если медицинские препараты и начальное лазерное лечение оказываются безуспешными при понижении давления внутри глаз. Один из типов операции, трабекулэктомия, создает отверстие в стенке глаза, так что внутриглазная жидкость может удаляться. Однако примерно у одной трети пациентов после трабекулэктомии развивается катаракта в пределах пяти лет, согласно Glaucoma Foundation. Если трабекулэктомия не дает результата, дополнительные хирургические процедуры включают помещение дренажной трубки в глаз между роговицей и радужной оболочкой и использование лазерного или криогенного лечения для разрушения ткани в глазу, которая создает внутриглазную жидкость. Хирургическая операция может сохранить оставшееся зрение у пациента, но она не улучшает зрения. На самом деле зрение может ухудшаться после хирургической операции.
Современная терапия для лечения глаукомы старается замедлить развитие потери поля зрения посредством понижения и контроля внутриглазного давления. Как рассмотрено выше, это делается либо с помощью лекарственных средств, понижающих IOP, либо с помощью лазерной трабекулопластики. Долговременные исследования воздействий понижения IOP, как показано, являются эффективными при замедлении развития заболевания у некоторых пациентов. К сожалению, имеются пациенты, которые продолжают терять поле зрения, несмотря на понижение их IOP, или пациенты вообще не реагирующие на лекарственные средства, понижающие IOP. По этой причине, имеется необходимость в разработке новых видов лечения, нацеленных на параметр, иной, чем внутриглазное давление. Такая новая цель представляет собой нейропротекцию RGC.
Возрастная дегенерация желтого пятна (AMD) является главной причиной слепоты среди европейцев в возрасте 65. Хотя, в исследованиях дегенерации желтого пятна достигнут большой прогресс в последнее время, не существует видов лечения, которые предотвращают гибель нейронных клеток, которая происходит в ходе заболевания. Не существует также окончательных видов лечения для других глазных болезней, связанных с нейронной дегенерацией, связанной с бета-амилоидными белками, таких как кортикальная недостаточность зрения, друзы зрительного нерва, оптическая нейропатия, неврит зрительного нерва, глазной амилоидоз и решетчатая дистрофия.
Амилоидные отложения, как правило, содержат три компонента. Фибриллы амилоидных белков, которые составляют примерно 90% амилоидного материала, содержат один из нескольких различных типов белков. Эти белки способны складываться в так называемые "бета-складчатые" листовые фибриллы, уникальную конфигурацию белка, которая демонстрирует сайты связывания с конго красным, что приводит к возникновению уникальных свойств окрашивания амилоидного белка. В дополнение к этому, амилоидные отложения тесно связаны с компонентом (AP) амилоида P (пятиугольного), гликопротеина, родственного обычному амилоиду P сыворотки (SAP), и с сульфатированными гликозаминогликанами (GAG), сложными угледоводородами соединительной ткани.
Одна из разработок в направлении лечения расстройств и нарушений, связанных с амилоидным белком, или состояний, связанных с амилоидоподобными белками, таких как болезнь Альцгеймера и прионные заболевания, представляет собой конструирование молекул, которые связываются с аномальной конформацией β-листа Aβ и PrP, соответственно, тем самым предотвращая агрегацию этих молекул. Конформация β-листа пептидов отличается тем, что образуются водородные связи в виде регулярной структуры между соседними нитями аминокислот. Это система приводит к возникновению стабильной трехмерной структуры. Акцепторы H-связи (группа C=O) и доноры H-связи (группа NH) чередуются во встречающихся в природе пептидах в конформации β-листа с атомами, которые должны связываться, располагаясь примерно на одной линии. В каждой нити аминокислот, расстояния между соседними донорами H-связи и акцепторами H-связи попадают в конкретные пределы. В частности, расстояние между донором H-связи (группой NH) и акцептором H-связи (группой C=O) в одном аминокислотном остатке составляет от 3,5 до 4,0 Å. Расстояние между акцептором H-связи (группой C=O) одного аминокислотного остатка и донором H-связи (группой NH) следующего аминокислотного остатка, которые участвуют в связывании различных нитей, составляет от 2,6 до 2,9 Å. Другими словами, расстояния между соседними донорами H-связи и акцепторами H-связи в пределах одной аминокислотной нити изменяются в следующих пределах:
донор H-связи (аминокислота 1) - акцептор H-связи (аминокислота 1) = 3,5-4,0 Å;
акцептор H-связи (аминокислота 1) - донор H-связи 2 (аминокислота 2) = 2,6-2,9 Å.
Лиганды, которые конструируются для связывания β-листов, в идеале имеют порядок доноров H-связи и акцепторов H-связи, который является комплементарным к порядку доноров H-связи и акцепторов H-связи в аминокислотных нитях β-листа.
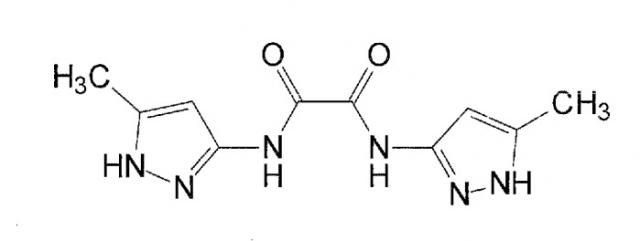
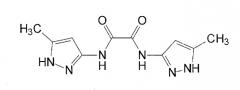
В WO 03/095429 и в Rzepecki et al., Synthesis (2003) 12, 1815-1826 описываются синтетические молекулы, которые, как сказано, связываются с β-конформацией Aβ или PrP, тем самым предотвращая их агрегацию. Для этой цели синтезированы определенные молекулы, содержащие два или более аминопиразольных остатка, связанных с помощью линкеров, содержащих карбонильную группу, например, “AmpOx” и “Тример ”.
“AmpOx”
“Тример”
Некоторые из молекул, описанных в WO 03/095429, как сказано, имеют ингибирующее воздействие на образование агрегатов Aβ в двух биофизических анализах. Согласно Rzepecki et al., Synthesis (2003) 12, 1815-1826 одна из молекул, описанных там, способна уменьшать агрегацию рекомбинантного PrPC в растворе. Однако физико-химические свойства, в этих исследованиях не изучались.
WO 2008/061795 описывает определенные гетероциклические соединения, которые являются пригодными для лечения заболеваний, связанных с амилоидными или амилоидоподобными белками.
Физико-химические свойства играют ключевую роль в преодолении гематоэнцефалического барьера нейротерапевтическими препаратами. Факторы, релевантные для успешного действия лекарственных средств для CNS, обсуждаются в (H. Pajouhesh и G. R. Lenz, NeuroRx®: J. Am. Soc. Exp. Neurother. (2005) Vol. 2, 541). Они включают коэффициент распределения между водой и н-октанолом (LogP), то есть, в основном, липофильность соединения. Некоторые соединения, описанные в WO 03/095429 и в Rzepecki et al., Synthesis (2003) 12, 1815-1826, имеют неблагоприятные вычисленные значения LogP и, по этой причине, как ожидается, они не преодолевают гематоэнцефалический барьер. В частности, “AmpOx” имеет вычисленное значение LogP ниже нуля.
Другие соединения, описанные в указанных выше документах, имеют свойства, которые делают их непригодными для введения пациенту из-за их вредных побочных воздействий. Например, “Тример” является мутагенным, канцерогенным и метаболически нестабильным.
Сущность изобретения
Целью настоящего изобретения является получение соединений, которые могут использоваться при лечении заболеваний или состояний, связанных с амилоидными или амилоидоподобными белками, включая амилоидоз, но в особенности, глазных болезней, таких как глаукома. Соединения должны быть способны преодолевать гематоэнцефалический барьер. Кроме того, они должны быть фармацевтически приемлемыми, в частности, они не должны иметь мутагенных или канцерогенных свойств или быть метаболически нестабильными. Соединения должны иметь разумно высокую растворимость в воде, сохраняя при этом свою биологическую активность.
Другой целью настоящего изобретения является создание улучшенных возможностей для лечения субъектов, пораженных глазными болезнями, связанными с патологическими нарушениями/изменениями в тканях зрительной системы, в частности, связанными с патологическими нарушениями/изменениями в тканях зрительной системы, связанными с бета-амилоидными белками, такими, например, как нейронная дегенерация. Указанные патологические нарушения могут возникать, например, в различных тканях глаза, таких как зрительный кортекс, приводя к кортикальной недостаточности зрения; как передняя камера и как зрительный нерв, приводя к глаукоме; как хрусталик, приводя к катаракте из-за осаждения бета-амилоидных белков; как стекловидное тело, приводя к глазному амилоидозу; как сетчатка, приводя к первичной дегенерации сетчатки и дегенерации желтого пятна, например, к возрастной дегенерации желтого пятна; как зрительный нерв, приводя к возникновению друз зрительного нерва, оптической нейропатии и невриту зрительного нерва; и как роговая оболочка, приводя к решетчатой дистрофии.
Авторы настоящего изобретения неожиданно обнаружили, что эти цели могут быть достигнуты с помощью соединений