Способ получения метастазов печени в эксперименте
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к экспериментальным исследованиям в онкологии, и может быть использовано при воспроизведении метастатического процесса в печени. Способ включает оперативное выведение селезенки под кожу у белых беспородных крыс. После заживления операционной раны в ткань селезенки имплантируют суспензию опухолевых клеток саркомы 45 в физиологическом растворе в объеме 0,1 мл в разведении 1×106. Через 2,5-3 недели проводят морфологическое исследование печени. При исключении влияния стрессорных факторов на процесс метастазирования злокачественной опухоли и приближении этого процесса к естественному предлагаемый способ позволяет отслеживать динамику роста первичного опухолевого узла и обеспечивает распространение метастазов в печень только наиболее значимым - гематогенным путем. 5 ил.
Реферат
Изобретение относится к медицине, а именно к экспериментальной онкологии, и может быть использовано при воспроизведении метастатического процесса в печени у крыс и в дальнейшем для разработки новых способов их экспериментальной терапии.
Одной из самых важных задач при лечении злокачественных опухолей является борьба с метастазами. Осложняет ситуацию то, что первичная опухоль и метастазы могут иметь разную чувствительность к тем или иным препаратам, в результате чего лекарства, которые хорошо справляются с первичной опухолью, могут оказаться бессильны против метастазов. Метастазирование свойственно многим типам рака. Например, колоректальному раку, который наиболее часто метастазирует в печень. Поэтому разработка экспериментальных моделей метастатического поражения печени является актуальным вопросом.
Известны способы создания внутриорганной опухоли печени у крыс путем пункционного введения 0,1 мл 20% взвеси клеток перевитой подкожно гепатокарциномы (Г-27) и модели мультицентрического опухолевого поражения печени с использованием внутрипортального введения взвеси клеток перевитого подкожно альвеолярного слизистого рака (РС-1) (Каталитическая терапия экспериментальных опухолей печени. /Могирев С.В., 2005, Москва, автореф. дис. к.м.н., с.18).
Недостатком этих способов является необходимость проведения оперативного вмешательства в момент введения опухолевой взвеси клеток либо в печень крыс, либо в портальную вену с одной стороны, с другой - образовавшийся опухолевый процесс в печени нельзя считать метастазом, поскольку отсутствует первичный очаг, дающий метастатические отсевы.
Известно, что при метастазировании простым переносом и размножением клеток в местах новой дислокации процесс не ограничивается: клетки опухоли и метастазов продолжают активно изменяться. В частности, Wu et al. (2012) пришли к выводу, что образовывать метастазы способны лишь некоторые клетки опухоли на ранней стадии ее развития. Затем и в первичной опухоли и в метастазах накапливаются новые мутации. Мутации некоторых генов, идентифицированные авторами, могут нарушать пути метаболизма и передачи сигналов, и эти пути могут служить мишенями для эффективной терапии (Xiaochong Wu, Paul A. Northcott, Adrian Dubuc et al. Clonal selection drives genetic divergence of metastatic medulloblastoma // Nature. 2012 V.482, Р.5629-5630).
Другая группа исследователей установила, что метастазы «ответвлялись» от первичной опухоли довольно рано, а затем и опухоли и метастазы эволюционировали независимо друг от друга, накапливая разные мутации. Только 30-37% мутации оказались общими для опухолевых клеток из первичной опухоли и ее метастазов (Marco Gerlinger, Andrew J. Rowan, Stuart Horswell et al. Intratumor heterogeneity and branched evolution revealed by multiregion sequencing // The New England Journal of Medicine, 2012. V.366. Р.883-892).
Известно, что экспериментальная аденокарцинома толстого кишечника крыс, полученная путем внутрибрюшинного введения химического канцерогена 1,2-диметилгидразина, часто метастазирует в печень (Морфофункциональное состояние тимуса в условиях развития опухоли толстой кишки. / Стручко Г.Ю, Меркулова Л.М., Москичев Е.В. и др. // Здравоохранение Чувашии №3, 2009. С.47-52; Морфология рака толстой кишки после применения 1,2-диметилгидразин дегидрохлорида/ Москвичев Е.В., Стручко Г.Ю., Меркулова Л.М., Кострова О.Ю., Бюл. эксперим. биол. и мед., 2009, №1, с.76).
Недостатком этого метода является то, что воспроизведение аденокарциномы составляет у крыс - 40-65%, а метастазы в печени регистрируются еще реже. Необходимо также отметить и токсическое воздействие канцерогена на организм животного, длительные сроки эксперимента - 150 суток.
Наиболее близкими по технической сущности к предлагаемому являются способы моделирования метастазов в печени путем инъекции в селезенку под общей анестезией: у мышей - взвеси видоспецифических опухолевых клеток: асцитной опухоли Эрлиха (Способ моделирования метастазов в печень. /Удинцев С.Н., Фомина Т.И., Разина Т.Г./ патент №4906903, 1995 г.) или аденокарциномы толстого кишечника (АКАТОЛ) (Исследование эффективности гепатопротектора Лохеина в комплексной терапии экспериментальных злокачественных опухолей./ Малиновская Е.А., Сибирский онкологический журнал, 2003, №4, с.17-21), у крыс линии BDJX - взвеси опухолевых клеток без указания типа опухоли (Средство для местного применения и способ лечения и профилактики опухолевого поражения печени и брюшины с его использованием./ Александров В.Б., Разбирин В.Н., Царанов К,Н., патент №223365, 2004 г.).
Эти способы также имеют ряд существенных недостатков:
- АКАТОЛ и асцитная опухоль Эрлиха являются видоспецифическими для мышей;
- для воссоздания процесса метастазирования у крыс необходимо использовать линейных животных;
- не указан % воспроизведения метастатического поражения печени у мышей и крыс;
- введение взвеси опухолевых клеток в селезенку осуществляется во время оперативного вмешательства, под наркозом, которые сами по себе являются стрессирующими факторами, влияющими на процесс метастазирования опухолей;
- нельзя контролировать динамику роста первичного опухолевого узла.
В совокупности указанные недостатки не позволяют стандартизировать модель, что необходимо для оценки новых способов лечения.
Целью настоящего изобретения является разработка способа получения метастатического поражения печени у белых беспородных крыс с визуальным контролем динамики роста первичного опухолевого узла и большим процентом выхода метастазов в течение небольшого промежутка времени (от момента перевивки саркомы 45 в селезенку до появления опухолевого процесса в печени).
Поставленная цель достигается тем, что предварительно на беспородных крысах проводится операция по выведению селезенки под кожу. Через 2 недели, после заживления операционной раны крысам интралиенально вводится по 0,1 мл взвеси опухолевых клеток саркомы 45 в физиологическом растворе в разведении 1*106. Метастатическое поражение печени регистрируется через 17-21 дней.
Изобретение «Способ получения метастазов печени в эксперименте» является новым, так как оно неизвестно в области экспериментальных исследований в онкологии о воспроизведении метастатического процесса в печени у крыс.
Новизна изобретения заключается в том, что предварительно до интралиенального введения взвеси опухолевых клеток селезенка выводится под кожу, что приводит к возможности визуально контролировать рост первичной опухоли, исключает влияние стрессорных факторов (оперативное вмешательство, наркоз) в момент перевивки опухоли, что приближает процесс экспериментального метастазирования к естественному. Также данный метод предполагает использование нелинейных животных, поскольку перевитая в селезенку опухоль приводит к постепенному разрушению органа, а следовательно, и к нарушению иммунной противоопухолевой защиты. Кроме того, саркома 45 является перевивной неагрессивной опухолью, которая при стандартной подкожной перевивке не дает метастазов, поэтому полученные метастазы в печени при интралиенальном введении опухолевой взвеси являются истинно гематогенными метастазами (занос опухолевых клеток через нижнюю полую вену - наиболее значимый путь метастазирования), в отличие, например, от аденокарциномы, при которой возможно и гематогенное и лимфогенное метастазирование.
Изобретение «Способ получения метастазов печени в эксперименте» является промышленно применимым, так как может быть использовано в научно-исследовательских учреждениях онкологического профиля для воспроизведения экспериментальной модели метастазирования в печень злокачественной опухоли с целью разработки методов экспериментальной терапии этой патологии.
Для пояснения предлагаемого изобретения предложены рисунки.
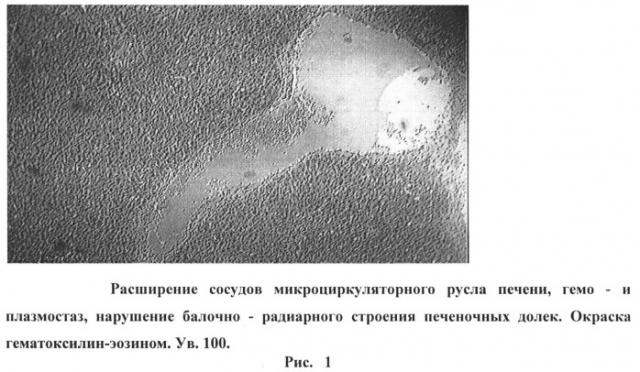
На рисунке 1 изображено расширение сосудов микроциркуляторного русла печени, гемо- и плазмостаз, нарушение балочно-радиарного строения печеночных долек. Окраска гематоксилин-эозином. Ув. 100.
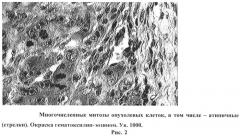
На рисунке 2 изображены многочисленные митозы опухолевых клеток, в том числе - атипичные (стрелки). Окраска гематоксилин-эозином. Ув. 1000.
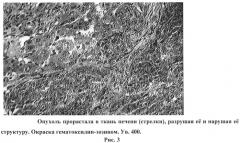
На рисунке 3 изображена опухоль, прорастающая в ткань печени (стрелки), разрушая ее и нарушая ее структуру. Окраска гематоксилин-эозином. Ув. 400.
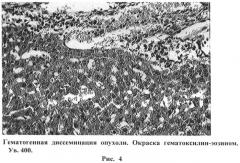
На рисунке 4 изображена гематогенная диссеминация опухоли. Окраска гематоксилин-эозином. Ув. 400.
На рисунке 5 изображен микропрепарат измененной ткани печени. Визуализируются кровеносные сосуды с плазмостазом и желчный проток - спавшийся, неправильной формы, с многослойным измененным эндотелием (стрелки). Окраска гематоксилин-эозином. Ув. 400.
Способ получения метастазов печени в эксперименте выполняется следующим образом.
Все манипуляции с животными производятся в боксе. Инструменты, посуду, руки дезинфицируют общепринятым способом. Ассистент фиксирует крысу в положении на спине, удаляет шерсть с передней поверхности тела, смазывает кожу живота 70% спиртом и дает эфирный наркоз. Затем экспериментатор в стерильных условиях проводит верхнюю срединную лапаротомию, аккуратно отсепарорывает кожу от мышц, формируя «карман», и делает небольшой вертикальный разрез в мышечном слое передней брюшной стенки под левой реберной дугой, достаточный, чтобы через него «прошла» селезенка без повреждений.
После того как экспериментатор извлек селезенку из отверстия в мышцах, он ушивает этот разрез, чтобы селезенка фиксировалась под кожей в кармане. Далее ассистент ушивает операционную рану и обрабатывает шов 5% спиртовым раствором йода.
Ориентировочно через 2 недели (возможно и в более поздние сроки) после заживления операционной раны и восстановления животного интралиенально вводят 0,1 мл взвеси опухолевых клеток саркомы 45 в физиологическом растворе в разведении 1*106. Для этого, соблюдая все условия асептики, описанные выше, ассистент фиксирует крысу на спине. Селезенка визуализируется в виде бугорка на животе крысы. Над местом возвышения ассистент сбривает шерсть, обрабатывает кожу 5% спиртовым раствором йода. Экспериментатор рукой в стерильной перчатке захватывает кожную складку с выступающей селезенкой и в месте максимального ее возвышения, что приблизительно соответствует центру органа, иглой 5 см3 шприца прокалывает кожу и селезенку неглубоко, примерно до середины органа, и вводит опухолевую взвесь. Затем извлекает иглу, и место введения плотно, сильно не надавливая, прижимает ватным тампоном, смоченным в 70% спирте с небольшим добавлением йода, на 1 минуту, чтобы исключить вытекание вводимой взвеси.
Через 2,5-3 недели после интралиенального введения взвеси С-45 начал регистрироваться рост опухоли в селезенке. Через 45 дней после внутриселезеночной перевивки С-45 у некоторых животных появилось желтушное окрашивание кожных покровов и слизистых оболочек, повысился билирубин в крови.
Процедура была проведена 40 животным. Метастазы в печени появились у 95% крыс.
После вскрытия крыс обнаруживался первичный опухолевый узел в селезенке размером от 9,75 см3 до 16,2 см3. Селезенка утрачивала строение органа, ее ткань была представлена лишь единичными небольшими островками на поверхности опухолевого узла. В печени визуализировался, как правило, 1-2 фокусный рост опухоли размером 18,71-34,56 см3. На поверхности измененной ткани органа находились единичные кисты, заполненные желчью.
Морфологически первичный опухолевый узел в селезенке состоял из плотно расположенных полиморфных веретенообразных клеток с умеренным количеством митозов, без признаков повреждения, окруженных рыхлой соединительно-тканной капсулой, за исключением немногочисленных дегенеративно-измененных элементов и мелких участков некроза; а также небольших единичных островков ткани селезенки.
При микроскопическом исследовании печени наблюдалось значительное кровенаполнение органа с очагами кровоизлияний. Сосуды микроциркуляторного русла были расширены и полнокровны, отмечались гемо- и плазмостаз (рис.1).
Балочно-радиарное строение печеночных долек на крупных участках срезов нарушено (Рис.1). В части клеток паренхимы - дистрофичекие изменения: вакуолизация цитоплазмы и ядер, некоторые ядра в состоянии пикноза, в других - лизис хроматина. Лишь небольшое количество гепатоцитов с признаками их регенерации в виде деления ядер и самих клеток. Регистрировались малочисленные лейкоцитарные инфильтраты.
Картина деструктивных изменений в печени дополнялась обилием однородных клеток, имеющих чаще всего округлую форму с гиперхромными большими ядрами, с многочисленными фигурами митоза (10 и более в поле зрения), в том числе - атипичными (Рис.2).
Такого рода недифференцированные клетки могут быть отнесены к незрелой форме саркомы, а именно круглоклеточной саркоме. Стромы в такой опухоли было мало. Опухоль прорастала в ткань печени, разрушая ее и нарушая ее структуру (Рис.3).
На некоторых микропрепаратах видны сосуды с распространением опухолевых клеток по ходу их стенок и с наличием опухолевых конгломератов в просветах (гематогенная диссеминация опухоли) (Рис.4).
Кроме того, анализируя микрокартину желчных протоков и прилегающей к ним ткани печени, мы пришли к выводу о морфологических признаках холестаза (наблюдалось набухание выстилки синусоидов, их дистрофические изменения, наличие вакуолей).
Описанные изменения возникали, по всей видимости, из-за нарушения оттока желчи вследствие прорастания опухолевыми клетками, не только кровеносных сосудов, но и желчных протоков.
Некоторые желчные протоки не имели четкого просвета, были образованы несколькими рядами овальных крупных клеток с большим вытянутым ядром и базофильной цитоплазмой (Рис.5), что указывало на их пролиферацию, по всей видимости имело приспособительно-компенсаторное значение и было направлено на коррекцию желчевыделения.
Таким образом, метастазы в печени, на наш взгляд, обладали гистологическими признаками большей «опухолевой агрессии», чем первичная опухоль.
Технико-экономическая эффективность «Способа получения метастазов печени в эксперименте» заключается в том, что полученные метастазы злокачественной опухоли печени являются морфологически подтвержденной круглоклеточной саркомой, воспроизводятся в 95% случаев, растут и приводят к гибели животных. Способ осуществляется на белых беспородных крысах, исключает влияние оперативного вмешательства и общего наркоза на воссоздание процесса метастазирования, позволяет визуально контролировать рост первичного опухолевого узла, предполагает распространение метастазов в печень только наиболее значимым - гематогенным путем. Способ экономичен, доступен, обеспечивает воспроизведение опухолей в прогнозируемом количестве.
Способ воспроизведения метастатического процесса в печени у крыс, включающий внутриселезеночное введение опухолевых клеток, отличающийся тем, что белым беспородным крысам предварительно под кожу выводят селезенку, после заживления операционной раны в ткань селезенки имплантируют суспензию опухолевых клеток саркомы 45 в физиологическом растворе в объеме 0,1 мл в разведении 1×106 и через 2,5-3 недели проводят морфологическое исследование печени.