Способ получения соединения, применимого в качестве ингибитора tafia
Иллюстрации
Показать всеИзобретение относится к области органической химии, а именно к способу получения соединения формулы (I), который включает взаимодействие соединения формулы (IV) с диэфиром щавелевой кислоты формулы (V). Также изобретение относится к промежуточным соединениям и способам их получения. Технический результат: разработан новый способ получения соединения формулы (I), обладающего полезными биологическими свойствами. 5 н. и 4 з.п. ф-лы, 4 пр.
Реферат
Настоящее изобретение относится к способу получения соединения формулы I, которое ингибирует фермент TAFIa (активированный ингибитор активируемого тромбином фибринолиза), и к используемым в нем новым промежуточным соединениям.
Фермент TAFIa образуется, например, путем активирования тромбина из зимогена ингибитора активируемого тромбином фибринолиза (TAFI). Фермент TAFI называют также прокарбоксипептидазой В, прокарбоксипептидазой U или прокарбоксипептидазой R плазмы, и он представляет собой профермент, сходный с карбоксипептидазой В (L. Bajzar, Arterioscler. Thromb. Vasc. Biol. 2000, страницы 2511-2518).
Во время образования сгустка крови тромбин образуется в качестве конечного продукта каскада коагуляции и вызывает превращение растворимого фибриногена плазмы в нерастворимый фибриновый матрикс. Одновременно тромбин активирует эндогенный ингибитор фибринолиза TAFI. Таким образом, активированный TAFI (TAFIa) образуется во время образования тромба и лизиса из зимогена TAFI путем активации тромбина; тромбомодулин в комплексе с тромбином усиливает этот эффект примерно в 1250 раз. TAFIa расщепляет основные аминокислоты в карбокси-конце фибриновых фрагментов. После этого потеря карбокси-терминальных лизинов в качестве сайтов связывания плазминогена приводит к ингибированию фибринолиза. Эффективные ингибиторы TAFIa предотвращают потерю данных высокоаффинных лизиновых сайтов связывания плазминогена и, таким образом, способствует эндогенному фибринолизу за счет плазмина: ингибиторы TAFIa обладают профибринолитическим эффектом.
Для поддержания гемостаза в крови развиваются механизмы, приводящие к свертыванию крови и к разрушению сгустков крови; они находятся в равновесии. Если нарушенное равновесие благоприятствует коагуляции, фибрин образуется в больших количествах, так что патологические процессы тромбообразования могут привести к серьезным заболеваниям у людей.
Так же, как чрезмерная коагуляция может привести к серьезным патологическим состояниям, вызванным тромбозом, антитромботическое лечение вызывает риск нежелательного кровотечения за счет нарушения образования необходимой гемостатической пробки. Ингибирование TAFIa повышает эндогенный фибринолиз - без влияния на коагуляцию и агрегацию тромбоцитов - то есть нарушенное равновесие сдвинуто в сторону фибринолиза. Таким образом, возможно как противодействовать образованию клинически существенного тромба, так и повышать лизис уже существующего сгустка крови. С другой стороны, не ухудшается образование гемостатической пробки, так что, вероятно, не следует ожидать геморрагического диатеза (Bouma et al., J. Thrombosis and Haemostasis, 1, 2003, страницы 1566-1574).
Ингибиторы TAFIa уже были описаны в международных заявках WO 03/013526 и WO 2005/105781. Сайт-специфический синтез N-замещенных имидазолов из α-аминокислот описан Ning Xi et al.; Tetrahedron Letters, Vol. 46, No. 43, 2005, страницы 7315-7319.
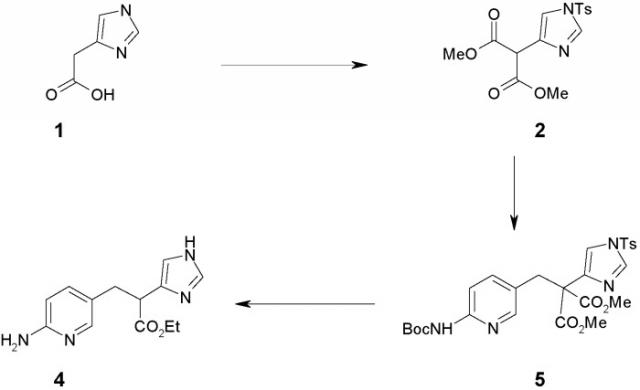
Стратегия синтеза в синтетических подходах, используемых для получения соединений формулы I в предшествующей области, включала позднее введение группы R1. Это показано на схеме 1 и имеет большое преимущество для выяснения взаимосвязей структура-активность, поскольку данная стратегия допускает большое разнообразие конечных продуктов. Описанные синтетические подходы являются длинными (7-8 стадий) и исходят из дорогостоящей имидазоилуксусной кислоты 1 для получения соединения 6 или 7. Такая стратегия приводит к необходимости использования защиты и последующего снятия защиты, таким образом жестко ограничивая эффективность синтеза.
Схема 1
В настоящее время было найдено, что упомянутых недостатков можно избежать при помощи короткого и эффективного синтетического пути, в котором, кроме того, обходятся без дорогостоящих и неудобных стадий очистки, таких как колоночная хроматография.
Данная цель достигается путем использования N1-замещенных производных имидазоилуксусной кислоты в качестве исходных соединений для данного синтетического подхода, который дает возможность получать соединение формулы I в несколько стадий химических реакций, с хорошими выходами и с высокой чистотой.
Таким образом, данное изобретение относится к способу получения соединения формулы I
и/или всех стереоизомерных форм соединения формулы I и/или смесей данных форм в любом соотношении, в которой
A2 представляет собой аминопиридил, который не замещен или замещен независимо одним, двумя или тремя атомами галогена или метилами,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, или
радикал формулы III
-A3-A5 (III)
где A3 представляет собой -(CH2)r-Het, где Het представляет собой пирролидин, бензотиофен или пиперидин, который не замещен или замещен независимо одним, двумя или тремя R1,
A5 представляет собой
a)1) -C(O)-R3,
a)2) -C(O)-N(R4)-R5,
a)3) -(SO2)-R6 или
a)4) -C(O)-O-R7,
r представляет собой целое число ноль, 1, 2 или 3,
где R1 представляет собой
a) фенил, который не замещен или замещен независимо одним, двумя или тремя -(C1-C4)-алкилами,
b) галоген,
c) -(C1-C4)-алкил,
d) -(C3-C6)-циклоалкил,
e) -CF3,
f) -O-CF3,
g) триазолил или
h) пиридинил,
где R3, R6 и R7 идентичны или различны и представляют собой независимо
a) атом водорода,
b) -(C1-C6)-алкил, который не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
где R4 и R5 идентичны или различны и представляют собой независимо
a) атом водорода,
b) -(C1-C6)-алкил или -(C2-C6)-алкенил, в котором алкил или алкенил не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, и
Z представляет собой
1) -(C1-C6)-алкил,
2) -(C1-C6)-алкил-OH,
3) -(C1-C4)-алкилен-(C3-C6)-циклоалкил,
4) -CH2-фенил, который не замещен или замещен одним или двумя NO2 или метокси,
5) -CH2-CH=CH2 или
6) -(C1-C10)-алкилен-O-C(O)-O-(C3-C6)-циклоалкил,
который включает
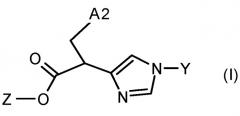
A) взаимодействие соединения формулы IV
с диэфиром щавелевой кислоты формулы V
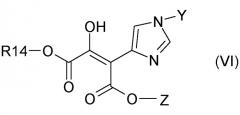
в которой R14 представляет собой -(C1-C6)-алкил, с получением соединения формулы VI
B) взаимодействие соединения формулы VI с соединением формулы VII
W-CH2-A2-R15 (VII)
в которой W представляет собой атом галогена или сложный сульфониловый эфир, и R15 представляет собой аминозащитную группу, с получением соединения формулы VIII
C) и взаимодействие соединения формулы VIII с получением соединения формулы I, или
D) необязательно соединение формулы I, полученное на стадиях A), B) и C) данного способа, и существующее благодаря своей химической структуре в виде энантиомерных форм, разделенных путем образования солей с энантиомерно чистыми кислотами или основаниями, хроматографией на хиральных стационарных фазах или путем получения производных с использованием хиральных энантиомерно чистых соединений, таких как аминокислоты, разделения диастереомеров, полученных таким образом, и удаление хиральных вспомогательных групп с получением чистых энантиомеров.
2) Изобретение относится также к способу получения соединения формулы I, в котором
A2 представляет собой аминопиридил, который не замещен или замещен независимо одним, двумя или тремя атомами галогена или метилами,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, или
радикал формулы III
-A3-A5 (III)
в которой A3 представляет собой -(CH2)r-Het, где Het представляет собой пирролидин, бензотиофен или пиперидин, который не замещен или замещен независимо одним, двумя или тремя R1,
A5 представляет собой
a)1) -C(O)-R3,
a)2) -C(O)-N(R4)-R5,
a)3) -(SO2)-R6 или
a)4) -C(O)-O-R7,
r представляет собой целое число ноль, 1, 2 или 3,
где R1 представляет собой
a) фенил, который не замещен или замещен независимо одним, двумя или тремя -(C1-C4)-алкилами,
b) галоген,
c) -(C1-C4)-алкил,
d) -(C3-C6)-циклоалкил,
e) -CF3,
f) -O-CF3,
g) триазолил или
h) пиридинил,
где R3, R6 и R7 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил, который не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
где R4 и R5 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил или -(C2-C6)-алкенил, где алкил или алкенил не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, и
Z представляет собой
1) -(C1-C6)-алкил,
2) -(C1-C6)-алкил-OH,
3) -(C0-C4)-алкилен-(C3-C6)-циклоалкил или
4) -(C1-C10)-алкилен-O-C(O)-O-(C3-C6)-циклоалкил.
3) Изобретение относится также к способу получения соединения формулы I, в котором
A2 представляет собой 2-аминопиридил, который не замещен или замещен независимо одним, двумя или тремя F, Cl, Br, I или метилами,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, или
радикал формулы III, в котором
A3 представляет собой -(CH2)r-Het, в котором Het представляет собой пирролидин или пиперидин, который не замещен или замещен независимо одним, двумя или тремя R1,
A5 представляет собой
a)1) -C(O)-R3,
a)2) -C(O)-N(R4)-R5,
a)3) -(SO2)-R6 или
a)4) -C(O)-O-R7,
r представляет собой целое число ноль, 1, 2 или 3,
где A5 связан с атомом азота A3,
где R1 представляет собой
a) фенил, который не замещен или замещен независимо одним, двумя или тремя -(C1-C4)-алкилами,
b) фтор,
c) -(C1-C4)-алкил,
d) -(C3-C6)-циклоалкил,
e) -CF3,
f) -O-CF3,
g) хлор,
h) триазолил или
i) пиридинил,
где R3, R6 и R7 идентичны или различны и независимо представляют собой
a) -(C1-C6)-алкил, который не замещен или замещен независимо одним, двумя или тремя R1,
b) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
c) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
где R4 и R5 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил или -(C2-C6)-алкенил, где алкил или алкенил не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, и
Z представляет собой -(C1-C6)-алкил или бензил.
4) Изобретение относится также к способу получения соединения формулы I, в котором
A2 представляет собой 2-аминопиридил,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен одним или двумя метилами, или -(CH2)r-Het, где Het представляет собой пирролидин или пиперидин, и Het замещен -C(O)-(CH2)m-фенилом или -C(O)-CH-(фенил)2, и m представляет собой целое число ноль, 1 или 2,
и Z представляет собой -(C1-C4)-алкил.
5) Изобретение относится также к способу получения соединения формулы I, в котором
A2 представляет собой 2-аминопиридил,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен одним или двумя метилами,
и Z представляет собой -(C1-C4)-алкил.
Термин “(C1-C6)-алкил” или “(C1-C10)-алкил” означает углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и включает от 1 до 6 атомов углерода или от 1 до 10 атомов углерода, например метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, пентил, изопентил, неопентил, гексил, 2,3-диметилбутан, неогексил, гептил, октил, нонил или децил.
Термин “-(C0-C4)-алкилен” означает углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и включает от 1 до 4 атомов углерода, например метилен, этилен, пропилен, изопропилен, изобутилен, бутилен или третичный бутилен. Термин “-C0-алкилен” означает ковалентную связь.
Термин “-(C2-C10)-алкенилен” означает углеводородные радикалы, углеродная цепь которых является линейной или разветвленной и включает от 2 до 10 атомов углерода, и содержит, в зависимости от длины цепи, 1, 2 или 3 двойных связи, например этенилен, пропенилен, изопропенилен, изобутенилен или бутенилен; заместители при двойной связи, если такая возможность существует в принципе, могут располагаться в виде Е- или Z-конфигурации.
Термин “(C3-C8)-циклоалкил” означает такие радикалы, как соединения, полученные из 3-8-членных моноциклов, таких как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
Термин “-(CH2)r-, в котором r представляет собой целое число ноль, 1, 2 или 3” означает такие радикалы, как метилен, этилен или пропилен. В случае, когда r представляет собой целое число ноль, данный радикал означает ковалентную связь. Термин “-(CH2)m-, в котором m представляет собой целое число ноль, 1 или 2” означает такие радикалы, как метилен или этилен. В случае, когда m представляет собой целое число ноль, данный радикал означает ковалентную связь.
Следует отметить в частичной формуле III, что связь с 1H-имидазолом осуществляется через A3, а не через A5.
Термин "(C1-C6)-алкил-OH" означает спирты, такие как метанол, этанол, 1-пропанол, изопропанол, 1-бутанол, изобутанол, втор-бутанол, пентанол или гексанол.
Термин “-CH2-фенил” означает бензил. Термин “-CH2-CH=CH2” означает аллил. Термин “галоген” означает фтор, хлор, бром или йод.
6) Следующий аспект данного изобретения относится к соединениям формулы VI
в которой R14 представляет собой -(C1-C6)-алкил,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, или
радикал формулы III
-A3-A5 (III)
в которой A3 представляет собой -(CH2)r-Het, где Het представляет собой пирролидин, бензотиофен или пиперидин, который не замещен или замещен независимо одним, двумя или тремя R1,
A5 представляет собой
a)1) -C(O)-R3,
a)2) -C(O)-N(R4)-R5,
a)3) -(SO2)-R6 или
a)4) -C(O)-O-R7,
r представляет собой целое число ноль, 1, 2 или 3,
где R1 представляет собой
a) фенил, который не замещен или замещен независимо одним, двумя или тремя -(C1-C4)-алкилами,
b) галоген,
c) -(C1-C4)-алкил,
d) -(C3-C6)-циклоалкил,
e) -CF3,
f) -O-CF3,
g) триазолил или
h) пиридинил,
где R3, R6 и R7 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил, который не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
где R4 и R5 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил или -(C2-C6)-алкенил, в которых алкил или алкенил не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
R14 представляет собой -(C1-C6)-алкил, и
Z представляет собой
1) -(C1-C6)-алкил,
2) -(C1-C6)-алкил-OH,
3) -(C1-C4)-алкилен-(C3-C6)-циклоалкил,
4) -CH2-фенил, который не замещен или замещен одним или двумя NO2 или метокси,
5) -CH2-CH=CH2 или
6) -(C1-C10)-алкилен-O-C(O)-O-(C3-C6)-циклоалкил.
7) Изобретение также относится к соединению формулы VI, в которой
R14 представляет собой -(C1-C6)-алкил,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, или
радикал формулы III
-A3-A5 (III)
в которой A3 представляет собой -(CH2)r-Het, где Het представляет собой пирролидин, бензотиофен или пиперидин, который не замещен или замещен независимо одним, двумя или тремя R1,
A5 представляет собой
a)1) -C(O)-R3,
a)2) -C(O)-N(R4)-R5,
a)3) -(SO2)-R6 или
a)4) -C(O)-O-R7,
r представляет собой целое число ноль, 1, 2 или 3,
где R1 представляет собой
a) фенил, который не замещен или замещен независимо одним, двумя или тремя -(C1-C4)-алкилами,
b) галоген,
c) -(C1-C4)-алкил,
d) -(C3-C6)-циклоалкил,
e) -CF3,
f) -O-CF3,
g) триазолил или
h) пиридинил,
где R3, R6 и R7 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил, который не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
где R4 и R5 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил или -(C2-C6)-алкенил, где алкил или алкенил не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
R14 представляет собой -(C1-C6)-алкил, и
Z представляет собой
1) -(C1-C6)-алкил,
2) -(C1-C6)-алкил-OH,
3) -(C0-C4)-алкилен-(C3-C6)-циклоалкил или
4) -(C1-C10)-алкилен-O-C(O)-O-(C3-C6)-циклоалкил.
8) Изобретение относится также к соединениям формулы VI, в которой
R14 представляет собой -(C1-C6)-алкил,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен одним или двумя метилами, или -(CH2)r-Het, где Het представляет собой пирролидин или пиперидин, и Het замещен -C(O)-(CH2)m-фенилом или -C(O)-CH-(фенил)2, и m представляет собой целое число ноль, 1 или 2,
и Z представляет собой -(C1-C4)-алкил или бензил.
9) Изобретение относится также к соединениям формулы VI, в которой
R14 представляет собой -(C1-C6)-алкил,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен одним или двумя метилами,
и Z представляет собой -(C1-C4)-алкил.
10) Изобретение относится также к способу получения соединений формулы VI, который включает взаимодействие соединения формулы IV
в которой Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, или
радикал формулы III
-A3-A5 (III)
A3 представляет собой -(CH2)r-Het, где Het представляет собой пирролидин, бензотиофен или пиперидин, который не замещен или замещен независимо одним, двумя или тремя R1,
A5 представляет собой
a)1) -C(O)-R3,
a)2) -C(O)-N(R4)-R5,
a)3) -(SO2)-R6 или
a)4) -C(O)-O-R7,
r представляет собой целое число ноль, 1, 2 или 3,
где R1 представляет собой
a) фенил, который не замещен или замещен независимо одним, двумя или тремя -(C1-C4)-алкилами,
b) галоген,
c) -(C1-C4)-алкил,
d) -(C3-C6)-циклоалкил,
e) -CF3,
f) -O-CF3,
g) триазолил или
h) пиридинил,
где R3, R6 и R7 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил, который не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
где R4 и R5 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил или -(C2-C6)-алкенил, где алкил или алкенил не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, и
Z представляет собой
1) -(C1-C6)-алкил,
2) -(C1-C6)-алкил-OH,
3) -(C1-C4)-алкилен-(C3-C6)-циклоалкил,
4) -CH2-фенил, который не замещен или замещен одним или двумя NO2 или метокси,
5) -CH2-CH=CH2 или
6) -(C1-C10)-алкилен-O-C(O)-O-(C3-C6)-циклоалкил,
с диэфиром щавелевой кислоты формулы V
в которой R14 представляет собой -(C1-C6)-алкил,
с получением соединения формулы VI.
Соединение формулы VI может существовать в виде двух таутомерных форм, которые являются следующими:
или
11) Следующий аспект изобретения относится к соединениям формулы VIII
в которой
R15 представляет собой аминозащитную группу, выбранную из трет-бутилоксикарбонила, бензилоксикарбонила, п-метоксибензилкарбонила, N-формила, N-ацетила, N-бензила, N-1-(дифенил)метила, N-тритила, (4-метоксифенил)дифенилметила, амидов N-диалкилфосфорных кислот и N-п-толуолсульфонила.
A2 представляет собой аминопиридил, который не замещен или замещен независимо одним, двумя или тремя атомами галогена или метилами,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, или
радикал формулы III
-A3-A5 (III)
в которой A3 представляет собой -(CH2)r-Het, где Het представляет собой пирролидин, бензотиофен или пиперидин, который не замещен или замещен независимо одним, двумя или тремя R1,
A5 представляет собой
a)1) -C(O)-R3,
a)2) -C(O)-N(R4)-R5,
a)3) -(SO2)-R6 или
a)4) -C(O)-O-R7,
r представляет собой целое число ноль, 1, 2 или 3,
где R1 представляет собой
a) фенил, который не замещен или замещен независимо одним, двумя или тремя -(C1-C4)-алкилами,
b) галоген,
c) -(C1-C4)-алкил,
d) -(C3-C6)-циклоалкил,
e) -CF3,
f) -O-CF3,
g) триазолил или
h) пиридинил,
где R3, R6 и R7 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил, который не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1,
где R4 и R5 идентичны или различны и независимо представляют собой
a) атом водорода,
b) -(C1-C6)-алкил или -(C2-C6)-алкенил, где алкил или алкенил не замещен или замещен независимо одним, двумя или тремя R1,
c) фенил, который не замещен или замещен независимо одним, двумя или тремя R1, или
d) -(C3-C6)-циклоалкил, который не замещен или замещен независимо одним, двумя или тремя R1, и
Z представляет собой
1) -(C1-C6)-алкил,
2) -(C1-C6)-алкил-OH,
3) -(C1-C4)-алкилен-(C3-C6)-циклоалкил,
4) -CH2-фенил, который не замещен или замещен одним или двумя NO2 или метокси,
5) -CH2-CH=CH2 или
6) -(C1-C10)-алкилен-O-C(O)-O-(C3-C6)-циклоалкил.
12) Следующий аспект изобретения относится к соединениям формулы VIII
R15 представляет собой трет-бутоксикарбонил,
A2 представляет собой 2-аминопиридил,
Y представляет собой -(C3-C8)-циклоалкил, который не замещен или замещен одним или двумя метилами, или -(CH2)r-Het, в котором Het представляет собой пирролидин или пиперидин, и Het замещен -C(O)-(CH2)m-фенилом или -C(O)-CH-(фенил)2, m представляет собой целое число ноль, 1 или 2,
и Z представляет собой -(C1-C4)-алкил или бензил.
13) Изобретение также относится к способу получения соединений формулы VIII, который включает взаимодействие соединение формулы VI с соединением формулы VII
W-CH2-A2-R15 (VII),
где W представляет собой галоген или сложный сульфониловый эфир, и R15 представляет собой аминозащитную группу с получением соединения формулы VIII
Реакцию стадии способа А), представляющую собой получение соединения формулы VI, можно осуществить в условиях конденсации Кляйзена (W. Wislicenus, Chem. Ber. 1886, 19, 3225). Эфир имидазоилуксусной кислоты формулы IV взаимодействует с диэфиром щавелевой кислоты формулы V в основных условиях, получая сложный β-кетоэфир формулы VI (показан в виде енольной формы).
Производные имидазоилуксусных кислот формулы IV можно получить классическим синтезом Марквальда (W. Marckwald, Chem. Ber. 1892, 25, 2354, N. Xi et al., Tetrahedron Lett. 2005, 46, 7315-7319), как показано на схеме 2. Сложные γ-амино β-кетоэфиры (формула II) можно получить согласно литературе (N. Xi et al., Tetrahedron Lett. 2005, 46, 7315-7319).
Схема 2
Диэфиры щавелевой кислоты хорошо известны в данной области и коммерчески доступны у многочисленных поставщиков (например, Sigma-Aldrich Chemie GmbH, Eschenstraße 5, 82024 Taufkirchen, Germany). Одним из диэфиров щавелевой кислоты является диэтиловый эфир щавелевой кислоты.
При получении соединения формулы VI следуют методике таким образом, что сначала в растворитель вводят эфир имидазоилуксусной кислоты формулы IV, и затем добавляют диэфир щавелевой кислоты и основание. Полученный раствор или суспензию медленно охлаждают.
После реакции соответствующей продолжительности соединение формулы VI высаживают, используя буферный раствор или кислоту. Соединение формулы VI выделяют, например, кристаллизацией или экстрагированием, например, при использовании тетрагидрофурана или метил-трет-бутилового эфира. Кристаллизации способствует охлаждение суспензии или дополнительное выпаривание растворителей.
Растворители, которые можно использовать на стадии реакции A), представляют собой спирты, такие как метанол, этанол, пропанол, изопропанол или бутанол. Предпочтительным является этанол.
Основание, используемое на стадии реакции A), представляет собой алкоголят щелочного металла, например, этилат натрия или калия. Предпочтительным является этилат натрия. Алкоголяты щелочных металлов коммерчески доступны (Sigma-Aldrich). Кроме того, алкоголяты щелочных металлов можно получить in situ из натрия или гидрида натрия в спирте, или из третичного алкоголята, такого как трет-бутилат калия или амилат натрия или калия.
Применяемая температура изменяется в интервале от 0ºC до 100ºC в зависимости от температуры кипения растворителя.
В стадии реакции A) изобретения используют от 100 моль до 200 моль (предпочтительно 157 моль) соединения формулы V и от 100 до 200 моль основания (предпочтительно 133 моль) на 100 моль соединения формулы IV. Используемое количество растворителя обычно составляет от 5 л до 15 л (предпочтительно 10 л) на кг соединения формулы IV.
Реакцию способа стадии В), представляющую собой получение соединения формулы VIII, можно осуществить в условиях конденсации ретро-Кляйзена (W. Wislicenus, Chem. Ber. 1891, 24, 1257; J. M. Cook et al., J. Am. Chem. Soc. 1982, 104, 318). Сложный β-кетоэфир формулы VI взаимодействует с алкилирующим реагентом формулы VII в основных условиях с получением соединения формулы VIII.
Алкилирующий реагент формулы VII, используемый на стадии способа В), известен в предшествующей области и может быть получен, как описано в международных заявках WO 03/013526 и WO 2005/105781.
R15 представляет собой аминозащитную группу и может быть выбран из множества групп, например, перечисленных, но не ограниченных группами, упомянутыми у T. W. Greene и P. G. M. Wuts: Protective Groups in Organic Synthesis, Third Edition, John Wiley and Sons, New York, 1999, 518-525, 531-540. Выбранная аминозащитная группа стабильна в основных условиях на стадии способа B) и может быть выбрана, например, из карбаматов, таких как трет-бутоксикарбонил и бензилоксикарбонил или п-метоксибензилкарбонил, амидов, таких как N-формил или N-ацетил, N-алкиларилов, таких как N-бензил, N-1-(дифенил)метил, N-тритил или (4-метоксифенил)дифенилметил, или N-Р и N-сульфонилзащитные группы, такие как N-диалкилфосфорамиды и N-толуолсульфонил. Конкретной защитной группой является трет-бутоксикарбонильная.
Остаток W в алкилирующем реагенте формулы VII можно выбрать из галогенов, таких как хлор, бром, йод, или из сульфониловых эфиров, таких как мезилат, тозилат, нозилат, брозилат, трифлат или нонафлат. Конкретный остаток W представляет собой бром и хлор.
При получении соединения формулы VIII следуют методике таким образом, что сначала в растворитель вводят соединение формулы VI и затем прибавляют основание. Полученный раствор или суспензию перемешивают некоторое время. После этого добавляют соединение формулы VII. Необязательно можно также добавить каталитические количества йодида тетра-(н)-бутиламмония (nBu4NI). После реакции соответствующей продолжительности добавляют воду и доводят рН реакционной смеси до значения, превышающего 9,0, предпочтительно 10,5. Соединение формулы VIII выделяют, например, кристаллизацией или экстрагированием, например, при использовании тетрагидрофурана или метил-трет-бутилового эфира. Кристаллизации способствует охлаждение суспензии или дополнительное выпаривание растворителей.
Подходящими основаниями для стадии реакции В) являются все основания, которые достаточно сильны для образования енолят-аниона из соединения формулы VI. Примеры подобных оснований представляют собой амиды щелочных металлов, гидриды, алкоголяты металлов, основания аминов или фосфазены. Применимыми основаниями являются, например, гексаметилдисилазид щелочного металла (MHMDS), другим основанием является литиевое основание (LiHMDS), которое можно получить промышленным образом (Sigma-Aldrich). Другие основания представляют диизопропиламид лития (LDA) или алкоголяты щелочных металлов, такие как трет-бутилат лития, натрия или калия, или этилат лития, натрия или калия, или основания аминов, такие как 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), или основания фосфазенов, такие как 2-трет-бутилимино-2-диэтиламино-1,3-диметилпергидро-1,3,2-диазафосфорин (ВЕМР).
Растворители, которые можно использовать на стадии реакции В), представляют собой растворители, совместимые с основными условиями реакции, такие как простые эфиры или спирты. Примеры простых эфиров представляют собой, но не ограничиваются, тетрагидрофураном (ТГФ), метил-трет-бутиловым эфиром (МТВЕ), диоксаном, диметоксиэтаном (DME) или 2-метилтетрагидрофураном. Предпочтительным является тетрагидрофуран. Примеры спиртов представляют собой, но не ограничиваются, метиловым спиртом (МеОН), этиловым спиртом (этанол), пропиловым спиртом (PrOH), изопропиловым спиртом (iPrOH), бутиловым спиртом (BuOH), изобутиловым спиртом (iBuOH). Предпочтительным является этанол.
Используемая температура изменяется в интервале от -78°С до 100°С в зависимости от температуры замерзания и температуры кипения растворителя.
В стадии реакции В) изобретения на 100 моль соединения формулы VI используют от 100 моль до 300 моль соединения формулы VII и от 100 до 250 моль основания. Количество используемого растворителя обычно составляет от 5 л до 15 л на кг соединения формулы VI.
Конденсацию ретро-Кляйзена, приводящую к моноалкилированному продукту формулы VIII, можно осуществить в водных основных условиях при рН>9,0, предпочтительно, 10,5. Применимые основания представляют собой водный карбонат щелочного металла, такой как карбонат калия, или гидроксид щелочного металла, такой как гидроксид натрия. Основание добавляют, когда завершается предшествующая реакция алкилирования, или его можно генерировать из основания, используемого на стадии алкилирования, добавляя воду.
Полученное при этом неочищенное соединение формулы VIII можно выделить путем стандартной методики водной обработки и можно очистить, например, хроматографически. Более применима очистка кристаллизацией или нагреванием в растворе. Подходящими растворителями для данной операции снова, помимо прочих, являются простые эфиры, такие как тетрагидрофуран (ТГФ), и более предпочтительно, метил-трет-бутиловый эфир (МТВЕ).
Реакцию стадии С), представляющую собой получение соединения формулы I, осуществляют снятием защиты аминозащитной группы R15. Снятие защиты можно осуществить в стандартных условиях, описанных у T. W. Green and P. G. M. Wuts: Protective Groups in Organic Synthesis, Third Edition, John Wiley and Sons, New York, 1999, 518-525, 531-540, и зависит от типа используемой защитной группы R15.
В случае, когда R15 представляет собой трет-бутоксикарбонил, снятие защиты можно осуществить в кислых условиях. Возможным способом является применение кислоты в протонном растворителе. Применимыми кислотами являются минеральные кислоты, такие как HBr, HCl, HI, H2SO4, H3PO-4, можно также использовать органические кислоты, такие как уксусная, трифторметансульфоновая или трифторуксусная, при этом предпочтительной является уксусная кислота. Растворители, используемые на данной стадии, представляют собой растворители типа простого эфира, такие как ТГФ, диоксан или МТВЕ, или протонные растворители, такие как вода или спирты. Определенным сложным эфиром Z является этиловый, и вода является определенным растворителем, который можно использовать на стадии способа С).
Применяемая температура изменяется в интервале от 0°С до 100°С в зависимости от температуры кипения растворителя.
На стадии С) реакции данного изобретения на 100 моль соединения формулы VIII используют от 1400 моль до 3000 моль кислоты. Количество используемого растворителя обычно составляет от 5 л до 15 л на 1 кг соединения формулы VIII.
На стадии способа D) соединение формулы I, если оно существует в виде смеси энантиомеров или диастереомеров, или образуется в виде их смесей, разделяют на чистые стереоизомеры либо при помощи хроматографии, необязательно на носителе из хирального вещества, либо, если соединение формулы I способно образовывать соли, при помощи дробной кристаллизации диастереомерных солей, полученных с оптически активным основанием или кислотой в качестве вспомогательных веществ. Хиральные стационарные фазы, подходящие для тонкослойной или колоночной хроматографии для разделения энантиомеров представляют собой, например, носители из модифицированного силикагеля (так называемые фазы Пиркле) и высокомолекулярные углеводы, такие как триацетилцеллюлоза. Кроме того, в аналитических целях можно использовать методы газовой хроматографии на хиральных стационарных фазах, после соответствующей функционализации, которая известна опытному специалисту. Для разделения энантиомеров рацемических карбоновых кислот получают диастереомерные соли, различающиеся по растворимости, с использованием оптически активного, обычно коммерчески доступного основания, такого как (-)-никотин, (+)- или (-)-фенилэтиламин, хининовые основания, L-лизин, или L- и D-аргинин, при этом менее растворимый компонент выделяют в виде твердого вещества, и более растворимый диастереомер высаживают из маточного раствора, а чистые энантимеры получают из полученных таким образом диастереомерных сол