Способ стимулирования восстановления иннервации тканей после травм и ишемии с помощью векторной конструкции
Иллюстрации
Показать всеИзобретение относится к области генной инженерии и генной терапии и может быть использовано в регенеративной медицине, травматологии, трансплантологии и нейробиологии для стимуляции роста и регенерации нервов и восстановления иннервации ишемизированных тканей. Способ по настоящему изобретению заключается в том, что в поврежденную мышцу вводят терапевтически эффективное количество рекомбинантной плазмиды с нуклеотидной последовательностью SEQ ID NO: 1, которая содержит модифицированную нуклеотидную последовательность, кодирующую BDNF человека, и последовательность Козак, в качестве плазмидного вектора используют pVax1 Invitrogen. Изобретение раскрывает эффективный способ, позволяющий ускорить восстановление структуры и проводимости периферических нервов после травм, путем трансфекции мышц, иннервируемых поврежденным нервом, новой плазмидной конструкцией, кодирующей мозговой нейротрофический фактор (BDNF). 2 з.п. ф-лы, 5 ил., 4 пр.
Реферат
Настоящее изобретение относится к области генной инженерии и генной терапии и может быть использовано в регенеративной медицине, травматологии, трансплантологии и нейробиологии для стимуляции роста и регенерации нервов и восстановления иннервации ишемизированных тканей. Предлагается способ, позволяющий ускорить восстановление структуры и проводимости периферических нервов после травм, путем трансфекции мышц, иннервируемых поврежденным нервом, новой плазмидной конструкцией, кодирующей мозговой нейротрофический фактор (BDNF).
Введение
Нарушения периферической иннервации, вызванные травмами, ишемией и нейродегенеративными заболеваниями являются важнейшей причиной временной и стойкой инвалидности населения России трудоспособного возраста [1]. Недостаточное восстановление иннервации также существенно снижает успешное приживление трансплантированных тканей и органов (печени, почек, сердца).
Стимуляция роста и восстановления периферического нерва - результат сложнейшего процесса, включающего множество физиологических и биохимических реакций. Для его осуществления, прежде всего, требуется поддержка выживания и регенерации нейронов и регуляция направления роста аксонов, в обеспечении которых основную роль нейротрофические факторы: мозговой нейротрофический фактор (BDNF), глиальный фактор роста (GDNF) и фактор роста нервов (NGF).
Таким образом, уже на основе теоретического анализа вопроса можно заключить, что на процесс регенерации нерва и восстановления периферической иннервации в участке повреждения стимулирующее воздействие может оказать локальное повышение продукции нейротрофических факторов.
Уровень техники
Одним из наиболее разработанных подходов к решению вопроса локального обеспечения определенных органов, тканей и их отдельных зон необходимыми полипептидными продуктами (гормонами, ферментами, ростовыми факторами и т.д.) является применение векторных конструкций, включающих гены, которые кодируют нужные белки, в данном случае ключевые факторы, стимулирующие рост нервов и восстановление периферической иннервации.
Известны способы стимуляции восстановления периферической иннервации, предусматривающие введение пациенту последовательности, кодирующей BDNF, в составе адено- и аденоассоциированных вирусов, а также в виде лентивирусных конструкций [2]. Ранее в нашей лаборатории был разработан способ стимуляции восстановления периферической иннервации посредством введения невирусной векторной конструкции, содержащей оптимизированную последовательность кДНК BDNF человека.
В силу указанных выше причин аналогами предлагаемого изобретения можно считать работу Alrashdan [3] и наши собственные данные [4, 5], где описаны способы регенерации периферического нерва после травмы.
В основе способа, предложенного Alrashdan et al., лежит стимуляция процесса путем инъекции в область нарушения иннервации аденовирусной конструкции, содержащей ген BDNF (BDNF-Ad), с целью локального повышения содержания данного клеточного фактора, участвующего в восстановлении нервных клеток. При этом, кроме того, что использование рекомбинантных вирусов для трансфекции не может считаться абсолютно безопасным, предложенное использование конструкции BDNF-Ad оказалось еще и недостаточно эффективным: период восстановления иннервации, по оценкам авторов, составлял примерно 3 недели.
В отношении способа, предложенного ранее, необходимо отметить, что несмотря на то, что удалось продемонстрировать положительное влияние разработанной невирусной конструкции на восстановление периферической иннервации, эффект был недостаточно выражен.
В связи с этим, была предпринята попытка усовершенствовать способ стимуляции восстановления периферической иннервации с помощью метода рекомбинантных ДНК в направлении повышения его эффективности.
Раскрытие изобретения
При разработке настоящего изобретения во внимание были приняты следующие факты.
Первое. Для успешной стимуляции роста и восстановления периферического нерва требуется поддержка выживания и регенерации нейронов, а также регуляция направления роста аксонов. Данную функцию выполняют нейротрофические факторы, такие как BDNF, глиальный фактор роста (GDNF) и фактор роста нервов (NGF). Соответственно, можно заключить, что стимуляции роста нервных окончаний и восстановления нервов с высокой степенью вероятности можно достичь, обеспечив долговременную продукцию нейротрофических факторов в участке повреждения.
Второе. Известно, что долговременная продукция нейротрофических факторов может быть обеспечена путем введения в поврежденную ткань генно-инженерных конструкций, содержащих кДНК этих белков. Для последовательности кДНК BDNF человека характерно высокое содержание т.н. «редких триплетов», что может негативно влиять на эффективность ее экспрессии. Ранее в нашей лаборатории такие триплеты были заменены на те, которые встречаются в генах человека наиболее часто, без изменения кодируемой аминокислотной последовательности, что обеспечило долговременную продукцию этого белка в поврежденных скелетных мышцах [4].
Добиться дальнейшего повышения эффективности продукции трансгена можно благодаря введению в его структуру консенсусной последовательности Козак [6].
Учитывая перечисленные факты, добиться повышения эффективности экспрессии BDNF в участках повреждения можно путем введения в экспрессионный вектор консенсусной последовательности Козак.
Третье. Для успешной стимуляции восстановления иннервации в ишемизированной ткани необходимо обеспечить высокий уровень продукции нейротрофного фактора. Соответственно, эффективным способом стимуляции восстановления иннервации в ишемизированных тканях с высокой вероятностью могло бы быть применение плазмидной конструкции, кодирующей мозговой нейротрофный фактор и обеспечивающей максимально возможную продукцию трансгена.
С учетом этого, решение поставленной задачи предполагало:
а) создание плазмидной конструкции, содержащей оптимизированную кДНК мозгового нейротрофического фактора (BDNF), в которую внесена консенсусная последовательность Козак;
б) оценка эффективности экспрессии созданной плазмидной конструкции in vitro; и
в) определение результата введения плазмидной конструкции на эффективность восстановления периферического нерва после травмы, а также на восстановление иннервации в ишемизированной ткани.
При осуществлении изобретения впервые была сконструирована (пример 1) рекомбинантная плазмида с SEQ ID NO: 1, приведенной в перечне последовательностей, содержащая оптимизированную последовательность кДНК BDNF (выделена серым затенением и полужирным шрифтом на SEQ ID NO: 1) и консенсусную последовательность Козак (выделена двойным подчеркиванием на SEQ ID NO: 1). При этом наилучшие результаты были получены при использовании в качестве вектора плазмиды pVax1 (#V260-20, Invitrogen), однако для клонирования могут быть использованы и другие плазмидные векторы, для которых характерна высококопийная репликация в Е.coli и высокий уровень экспрессии клонируемого гена в клетках млекопитающих.
В результате исследования экспрессии полученных плазмидных конструкций, было показано, что через 48 часов после трансфекции клеток наблюдается секреция соответствующих белков в среду культивирования. Благодаря включению оптимизированных нуклеотидных последовательностей применение плазмидных конструкций для экспрессии BDNF человека позволило достичь повышения продукции целевых белков примерно в 3 раза (пример 2).
На модели травматического повреждения периферического нерва мыши было получено экспериментальное подтверждение того, что сконструированная плазмидная конструкция после введения в мышцу, иннервируемую поврежденным нервом, существенно ускоряет восстановление структуры и проводимости поврежденного нерва. При этом было установлено, что введение плазмиды pVax1-K-BDNF обеспечивает дополнительное 1,5-2 кратное (в сравнении с использованием плазмиды, не содержащей консенсусной последовательности Козак, pVax1-BDNF) ускорение восстановления структуры и проводимости нерва, а следовательно, и иннервации соответствующих скелетных мышц (пример 3).
Впервые на модели ишемии задней конечности мыши была применена созданная плазмидная конструкция. Введение плазмидной конструкции pVax1-K-BDNF позволило достичь увеличения числа и суммарной длины аксонов в ишемизированной мышце в 2-3 раза, в отличие от разработанной ранее плазмиды pVax1-BDNF (пример 4).
Таким образом, в результате создания настоящего изобретения разработан способ стимулирования восстановления иннервации мышцы после травмы или ишемии, сущность которого состоит в том, что в мышцу, иннервируемую поврежденным нервом, вводят терапевтически эффективное количество плазмидного вектора, содержащего оптимизированную нуклеотидную последовательность SEQ ID NO: 1, кодирующую BDNF.
При этом основным техническим результатом является повышение эффективности способа: при использовании, по существу, одной и той же модели травматизации перферического нерва значения основных показателей иннервации ткани увеличились в сравнении с прототипом примерно вдвое. Дополнительными результатами данного способа следует считать возможность применения разработанной конструкции для стимуляции иннервации ишемизированных тканей и отказ от применения небезопасных аденовирусных конструкций.
Краткое описание чертежей
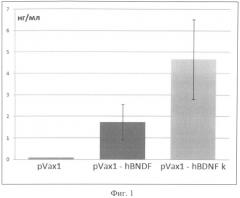
Фиг.1. Анализ эффективности продукции мозгового нейротрофного фактора, клетками траснфицированными плазмидными конструкциями.
Фиг.2. Восстановление функции мышц-разгибателей стопы. По оси ординат - значение PFI, усл.ед.; по оси абсцисс - время после повреждения, дни.
Фиг.3. Восстановление количества аксонов в поврежденном нерве. А. - нерв мыши, которой вводили плазмиду, не содержащую трансген. Б. - нерв мыши, которой вводили плазмидную конструкцию pVax1-BDNF. В. - нерв мыши, которой вводили плазмидную конструкцию pVax1-K-BDNF. Количество аксонов оценивали с помощью окрашивания кроличьими антителами к цитоскелету аксонов, белку NF200. Г. - результаты морфометрического анализа количества аксонов на срезе поврежденного нерва. По оси ординат - количество аксонов, шт.
Фиг.4. Восстановление проводимости нерва. А. - восстановление латентного периода СПДН, по оси ординат - длительность латентного периода, мс. Б. - восстановление амплитуды СПДН, по оси ординат - амплитуда СПДН, мВ.
Фиг.5. Восстановление количества нервных волокон в ишемизированной ткани. А. - ишемизированная мышца мыши, которой вводили плазмиду, не содержащую трансген. Б. - ишемизированная мышца мыши, которой вводили плазмидную конструкцию pVax1-BDNF. В. - ишемизированная мышца мыши, которой вводили плазмидную конструкцию pVax1-K-BDNF. Количество нервных волокон оценивали с помощью окрашивания кроличьими антителами к цитоскелету аксонов, белку NF200. Г. - восстановление количества нервных волокон на поперечных срезах ишемизированной мышцы, по оси ординат - количество нервных волокон, шт.; по оси абсцисс - время после повреждения, дни. Д. - восстановление суммарной длины нервных волокон на продольных срезах ишемизированной мышцы, по оси ординат - суммарная длина нервных, мкм; по оси абсцисс - время после повреждения, дни.
Осуществление изобретения
При осуществлении изобретения, помимо методов, подробно раскрытых в нижеследующих примерах, были использованы стандартные технологии генной инженерии, культивирования клеток млекопитающих и описанные ранее методы анализа регенерации нерва после травмы.
Пример 1. Создание плазмидной конструкции, кодирующей BDNF человека
Как описано ранее, дизайн оптимизированной плазмидной конструкции, кодирующей кДНК BDNF человека, производили следующим образом. Используя частоты встречаемости кодонов, приведенные на веб-сайте http://del.mediaglyphs.org/mg/bf/nucs_aa.html, среди триплетов нуклеотидов, кодирующих аминокислоты белковой последовательности природной кДНК BDNF, выявляли такие, которые встречаются в генах человека наиболее редко. Выявленные редкие триплеты, а также соседние с ними триплеты меняли на триплеты, кодирующие те же аминокислоты, но при этом встречающиеся в генах человека наиболее часто.
Для того чтобы повысить эффективность трансляции мРНК BDNF, в кДНК встраивали консенсусную последовательность Козак [6]. А именно, внесли 2 триплета, до старт-кодона 3'-GCCACC-5'. Для получения «сильной» последовательности Козак также необходимо было внести G непосредственно после старт-кодона. Для этого в последовательность был введен триплет GTG, кодирующий аминокислоту валин. Данный подход позволил достичь внедрения «сильной» последовательности Козак в кДНК BDNF, избежав при этом сдвига рамки считывания. Полученная последовательность нуклеотидов, кодирующая BDNF, представлена на фиг.1. Эту последовательность получали с помощью прямого химического синтеза фрагментов и последующей их сборки. Идентичность полученной последовательности ожидаемой определяли с помощью секвенирования.
Для клонирования оптимизированной кДНК в экспрессионный вектор к ее 5`- и 3`-концам добавляли последовательности, распознаваемые эндонуклеазами EcoRI и EcoRV (5`-GAATTC-3` и 5`-GATATC-3` соответственно). В данном примере в качестве вектора использовали плазмиду pVax1 (#V260-20, Invitrogen), однако, для клонирования могли быть использованы и другие плазмидные векторы, для которых характерна высококопийная репликация в Е.coli и высокий уровень экспрессии клонируемого гена в клетках млекопитающих.
Пример 2.
Анализ эффективности полученной плазмидной конструкции
Эффективность экспрессии разработанной плазмиды определяли по продукции целевого белка клетками линии HEK293, трансфицированными данной плазмидой. Клетки HEK293, высеянные в лунки 24-луночной плашки (50000 клеток на лунку) в среде DMEM, содержащей 2% эмбриональной телячьей сыворотки, трансфицировали плазмидами pVax1, pVax1-BDNF или pVax1-K-BDNF. Трансфекцию проводили с использованием по 1 мкг одной из плазмидных ДНК и по 1 мкл реагента Липофектамин 2000 (Invitrogen) в соответствии с протоколом производителя. Через 24 ч после трансфекции культуральную среду заменяли на свежую. Концентрацию BDNF в среде анализировали через следующие 48 часов культивирования.
Концентрацию BDNF в культуральной среде измеряли при помощи набора «ChemikineTM BDNF ELISA Kit» (Millipore, США) в соответствии с протоколом производителя. Согласно этим измерениям, продукция BDNF в культуральную среду клеток, трансфицированных плазмидой, не содержащей последовательности Козак, не более 2,5 нг/мл. При использовании плазмиды, содержащей оптимизированную кДНК, и последовательность Козак, концентрация BDNF в культуральной среде составляла около 5 нг/мл. При использовании плазмиды с оптимизированной кДНК и последовательностью Козак, выход целевого белка увеличивается примерно в 2 раза по сравнению с использованием ранее разработанной плазмиды, что свидетельствует о высокой эффективности плазмиды pVax1-K-BDNF, в которую включена консенсусная последовательность Козак (фиг.2).
Пример 3.
Влияние плазмиды pVax1-K-BDNF на восстановление периферического нерва и иннервации мышцы после травмы
Для исследования процесса регенерации перферического нерва использовали модель повреждения общего малоберцового нерва, как описано ранее [4, 5]. Сразу после повреждения нерва в переднюю большеберцовую мышцу вводили от 60 до 200 мкг плазмидной ДНК pVax1, pVax1-BDNF или pVax1-K-BDNF. Данная терапевтически эффективная концентрация была подобрана по результатам предварительных экспериментов.
Восстановление иннервации мышц оценивали через 1, 2, 4 и 7 суток по восстановлению функции мышц-разгибателей пальцев стопы. Восстановление функции мышц-разгибателей стопы анализировали с помощью измерения функционального индекса малоберцового нерва (PFI)Э, как описано ранее [5]. Было обнаружено, что уже через 2 суток у животных, которым была инъецирована pVax1-K-BDNF, значение PFI было примерно в 1,6 раза выше, чем в контроле, и в 1,4 раза выше, чем у животных, которым была инъецирована плазмида pVax1-BDNF (фиг.3).
Восстановление структурной целостности нерва оценивали с помощью иммуннофлуоресцентного окрашивания замороженных срезов поврежденных нервов через 4 суток после повреждения как описано ранее [4, 5]. Уже через 4 дня после повреждения у животных, которым была инъецирована pVax1-K-BDNF наблюдали примерно в 2,5 раза больше аксонов, содержащих NF200, по сравнению с нервами животных, которым вводили плазмиду pVax1, не содержащую трансгена (p<0,05; n=18) и примерно в 1,3 раза больше по сравнению с животными, которым была инъецирована плазмида pVax1-BDNF. Эти данные свидетельствуют о более быстром росте и лучшей выживаемости аксонов в поврежденных нервах животных, которым была инъецирована pVax1-K-BDNF.
Восстановление функции чувствительных нервных волокон оценивали с помощью вызванных потенциалов действия, регистрируемых с поверхностной веточки общего малоберцового нерва, как описано ранее [4, 5]. Полученные данные анализировали следующим образом. Регистрируемый СПДН содержит два параметра, позволяющие судить о степени восстановления нерва: латентный период и амплитуду.
Латентный период - промежуток времени от момента стимуляции нерва до момента регистрации вызванного потенциала действия, измеряется в миллисекундах (мс). Исходя из определения понятно, что латентный период характеризует скорость проведения возбуждения по нерву, причем величина латентного периода обратно пропорциональна скорости проведения возбуждения по нерву. Таким образом, укорочение латентного периода свидетельствует о большей скорости проведения вызванных потенциалов, что, в свою очередь, говорит о степени миелинизации для миелинизированных нервных волокон или об увеличении толщины безмиелиновых нервных волокон.
Амплитуда характеризует количество нервных волокон, участвующих в проведении возбуждения; измеряется в милливольтах (мВ). Чем больше амплитуда - тем больше количество восстановившихся нервных волокон.
При помощи регистрации вызванных потенциалов действия нерва через 7 суток после повреждения удалось показать, что инъекция генетической конструкции pVax1-K-BDNF стимулирует восстановление нерва. Инъекция плазмиды вызывала уменьшение латентного периода примерно в 1,6 раза и увеличение амплитуды СПДН примерно в 3 раза по сравнению с соответствующими значениями СПДН мышей, получивших плазмиду pVax1, не содержащую трансгена (фиг.5).
При этом инъекция плазмиды pVax1-K-BDNF приводила к более выраженному восстановлению проводимости нерва по сравнению с разработанной ранее плазмидой pVax1-BDNF. Так, у животных, получивших pVax1-K-BDNF, укорочение латентного периода было примерно в 1,5 раза, а увеличение амплитуды СПДН примерно в 1,3 раза больше по сравнению с соответствующими значениями для мышей, которым была инъецирована pVax1-BDNF. Эти данные свидетельствуют о том, что инъекция pVax1-K-BDNF стимулирует восстановление проводимости нервных волокон.
Пример 4.
Влияние плазмиды pVax1-K-BDNF на восстановление иннервации мышцы после ишемии
Для изучения процесса восстановления иннервации в ишемизированных мышцах задней конечности существует ряд методов, в основе которых лежит пережатие или иссечение бедренной артерии мыши. При этом использовали собственную модификацию известных моделей ишемии задней конечности у грызунов (Takeshita, 1994; Tsurumi, 1996). В работе использовали самцов мышей линии C57H1 весом 30 г. Все экспериментальные процедуры на животных соответствовали «Руководству по контролю над экспериментами с животными», одобренному местным этическим комитетом. Операцию проводили под анестезией ингаляцией 2,5% авертина. Производился продольный разрез кожи левого бедра мыши от области паховой связки до коленной области. Артерия выделялась целиком от начала бифуркации брюшной аорты до разделения на a.poplitae и a.saphenous и ее ветви, включая a.epigastrica inferior, a.femoralis profunda, a.circumflexus lateralis, перевязывались и отсекались. Также перевязывались и отсекались а.poplitae и a.saphenous. Бедренная артерия удалялась на всем протяжении от паховой связки до бифуркации на a.poplitae и a.saphenous.
Проведенные эксперименты показали, что такой способ повреждения является оптимальным для создания ишемии задней конечности мыши и позволяет достичь снижения кровотока до уровня менее 10% от контрольного. Другие способы индукции ишемии задней конечности, например, с помощью перевязки бедренной артерии мыши, оказались менее эффективными, поскольку приводили лишь к кратковременному нарушению кровотока в конечности и быстрому спонтанному восстановлению ее функциональной активности, что не позволило бы оценить эффект от введения генного лекарственного средства.
Исследования терапевтической эффективности Иннервина для восстановления иннервации ишемизированной мышцы проводили в течение 11 дней после индукции ишемии задней конечности. Для этого растворы плазмидной конструкции, содержащей кДНК BDNF либо контрольной плазмиды, не несущей кДНК нейротрофного фактора, в стерильном фосфатно-солевом буфере вводили на следующий день после операции путем чрескожных инъекций в мышцы конечности - 1 инъекция по 60 мкл, всего 200 мкг ДИК на мышь. Через 4, 7 и 11 дней у летально анестезированных животных изолировали m.tibialis anterior и замораживали в среде для замораживания Tissue-Tek (Sakura Finetek) с помощью плавного погружения в жидкий азот. Из замороженных мышц готовили поперечные и продольные криосрезы толщиной 6 мкм.
Критериями оценки эффективности Иннервина для восстановления иннервации порежденных мышц являются количество и суммарная длина нервных волокон, оцениваемые с помощью иммуннофлуоресцентного окрашивания криосрезов мышц с использованием специфичных антител к белку цитоскелета зрелых аксонов NF200. Окрашивание криосрезов проводили следующим образом: срезы после высыхания на предметном стекле фиксировали 4% формалином на фосфатном буфере в течение 5 минут, затем отмывали от фиксатора, помещали в 0,05 M раствор ацетата аммония на фосфатном буфере для блокирования аутофлуоресценции срезов на 10 минут и в 1% раствор бычьего сывороточного альбумина на фосфатном буфере для блокирования неспецифического связывания антител. Первичные и вторичные антитела разводили на фосфатно-солевом буфере, содержащем детергент 0,1% Triton X-100 и 5% нормальной козьей сыворотки. На срезы наносили первичные кроличьи антитела к белку цитоскелета зрелых аксонов NF200 (фирмы Abcam, разведение 1:80). Часть срезов окрашивали кроличьими неспецифическими иммуноглобулинами IgG в качестве отрицательного контроля (фирмы Thermo scientific). Срезы с нанесенными на них первичными антителами инкубировали во влажной камере при температуре 4°C в течение ночи. Далее срезы отмывали в фосфатно-солевом буфере (pH 7,0) 3 раза по 5 мин и наносили на них вторичные антитела: антитела козы против иммуноглобулинов кролика, конъюгированные с флуорохромом AlexaFluor 488 (фирмы Invitrogen). Срезы инкубировали в темном месте во влажной камере в течение 1 часа при комнатной температуре. Затем срезы, оберегая от света, отмывали в фосфатно-солевом буфере (pH 7,0). Далее срезы, оберегая от света, инкубировали в течение 2 мин, а затем снова отмывали в фосфатно-солевом буфере (pH 7,0) 3 раза по 5 мин. Со срезов стряхивали избыточную жидкость и заключали в специальную не флюоресцирующую среду Mounting Media (фирмы Vector).
Съемку полученных срезов осуществляли с помощью флуоресцентного микроскопа Leica6000, оборудованного CCD камерой (Leica Microsystems). Возбуждение красителя AlexaFluor 488 осущесствляли при длине волны 488 нм, а регистрацию вызванного возбуждения - при длине волны 546 нм. Количество окрашенных аксонов и их длину на полученных снимках оценивали при помощи программы Metamorph 7.1.
При анализе поперечных срезов ишемизированных мышц, окрашенных антителами против белка цитоскелета зрелых аксонов NF200, было обнаружено, что количество нервных волокон в мышцах животных, которым было введено генное лекарственное средство Иннервин было больше по сравнению с мышами, получившими контрольную плазмиду уже через 7 дней после индукции ишемии и введения плазмид, однако выявленное различие не было статистически достоверным. Через 11 дней после введения плазмид количество нервных волокон в мышцах животных, которым было введено генное лекарственное средство Иннервин было примерно в 4 раза больше по сравнению с мышами, получившими контрольную плазмиду (фиг.6).
При анализе продольных срезов мышц, окрашенных антителами против белка цитоскелета зрелых аксонов NF200, было обнаружено, что суммарная длина нервных волокон в мышцах животных, которым было введено генное лекарственное средство Иннервин, была больше уже через 4 дня после индукции ишемии и введения плазмид. Различия сохранялись и через 7 дней наблюдений, а через 11 дней суммарная длина нервных волокон у животных, которым было введено генное лекарственное средство Иннервин, была примерно в 3 раза больше по сравнению с мышами, получившими контрольную плазмиду.
Заключение
В результате проведенных исследований, впервые было показано, что инъекция плазмидной конструкци pVax1-K-BDNF в мышцу, иннервируемую повреждаемым нервом, с последующей электропорацией стимулирует регенерацию:
примерно в 1,6 раза в сравнении с контролем и в 1,4 раза в сравнении с разработанной ранее плазмидой ускоряется восстановление иннервации (сравни кривые на фиг.3), которое сопровождается увеличением числа аксонов в поврежденном нерве в 2,5 и 1,3 раза соответственно, (сравни столбцы на фиг.4), уменьшением латентного периода примерно в 1,6 и 1,5 раза соответственно, а также возрастанием почти в три и 1,3 раза соответственно, амплитуды суммарного потенциала действия нерва (сравни столбцы на фиг.5).
Установлено, что введение плазмиды pVax1-K-BDNF в ишемизированную мышцу с последующей электропорацией стимулирует восстановление иннервации, что выражается в увеличении числа аксонов в 7 раз, а суммарной длины нервных волокон более чем в 3 раза (сравни кривые на фиг.6).
На основании полученных данных был сделан вывод о том, что стимуляция восстановления структуры и функции нерва после травмы, а также иннервации ишемизированной ткани может быть достигнута путем введения плазмидной конструкции, содержащей оптимизированную нуклеотидную последовательность BDNF человека и консенсусную последовательность Козак. Высокая продукция целевого белка, достигнутая в результате проведенной модификации, обеспечила не только возможность использования этой плазмиды для стимуляции восстановления нервов после травмы, но и позволила стимулировать восстановление иннервации ишемизированной мышцы.
Список литературы
1. Одинак М.М., Живолупов С.А. Заболевания и травмы периферической нервной системы. Санкт-Петербург, СпецЛит., 2009.
2. Kwon BK, Liu J, Lam С, Plunet W, Oschipok LW, Hauswirth W, Di Polo A, Blesch A, Tetzlaff W. Brain-derived neurotrophic factor gene transfer with adeno-associated viral and lentiviral vectors prevents rubrospinal neuronal atrophy and stimulates regeneration-associated gene expression after acute cervical spinal cord injury. Spine (Phila Pa 1976). 2007; 32(11): 1164-73.
3. Alrashdan MS, Sung MA, Kim Kwon Y, Chung HJ, Kim SJ, Lee JH. Effects of combining electrical stimulation with BDNF gene transfer on the regeneration of crushed rat sciatic nerve. Acta Neurochir (Wien), 2011 (on line 09.06.2011)
4. Заявка на получение патента «Способ стимулирования восстановления периферической иннервации тканей с помощью векторных конструкций», Заявка 2011143050, Дата подачи заявки 25 октября 2011, Заявитель: Государственное учебно-научное учреждение Факультет фундаментальной медицины Московского Государственного Университета имени М.В. Ломоносова
5. Lopatina Т, Kalinina N, Karagyaur M, Stambolsky D, Rubina K, Revischin A, Pavlova G, Parfyonova Y, Tkachuk V. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011; 6(3): e17899.
6. Kozak M (October 1987). "An analysis of 5'-noncoding sequences from 699 vertebrate messenger RNAs". Nucleic Acids Res. 15 (20): 8125-8148.
1. Способ стимуляции восстановления иннервации поврежденной ткани с помощью введения в область повреждения векторной конструкции, обеспечивающей высокий уровень экспрессии фактора, участвующего в процессе регенерации нерва, который отличается тем, что в поврежденную мышцу вводят терапевтически эффективное количество рекомбинантной плазмиды с нуклеотидной последовательностью SEQ ID NO: 1, которая содержит модифицированную нуклеотидную последовательность, кодирующую BDNF человека, и последовательность Козак, в качестве плазмидного вектора используют pVax1 Invitrogen.
2. Способ по п.1, в котором повреждение представляет собой травму периферического нерва.
3. Способ по п.1, в котором повреждение представляет собой ишемическое повреждение конечности.