Обогащенные ангиогенином фракции молока
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения обогащенного ангиогенином продукта из пробы молока. Способ предусматривает нагрев пробы молока до более 70ºC, максимум до 75ºC, в течение, по меньшей мере, одной минуты, разделение фракций молока по их размеру, заряду или иммуноаффинности, выделение фракции, содержащей ангиогенин, с последующим получением обогащенного ангиогенином продукта. Изобретение позволяет увеличить чистоту ангиогенина в обогащенном продукте. 7 з.п. ф-лы, 10 ил., 2 табл., 5 пр.
Реферат
Область техники
Данное изобретение относится к способам получения обогащенного ангиогенином продукта из пробы молока и применению такого продукта в качестве пищевой добавки, нутрицевтического, фармацевтического или ветеринарного продукта или для приготовления терапевтической композиции.
Уровень техники
Ангиогенин является негликозилированным полипептидом 14 кДа, который продуцируется несколькими растущими типами клеток, включающими эндотелиальные клетки сосудов, клетки гладких мышц аорты, фибробласты и некоторые опухоли, такие как карциномы ободочной кишки, карциномы яичника и раковые опухоли молочной железы. Ангиогенин был выделен из ряда источников, включающих нормальную плазму человека, плазму коровы, коровье молоко и сыворотки мыши, кролика и свиньи. В каждом из этих источников ангиогенин присутствует при низких уровнях (менее 12 мг/л в коровьем молоке и менее 150 мкг/л в плазме человека).
Было показано, что, кроме того, он является сильным стимулятором ангиогенеза, ангиогенин имеет ряд других активностей. Они включают способность удалять дефекты кожи, такие как пигментированные пятна, модуляция иммунных реакций, защиту полиморфно-ядерных лейкоцитов от самопроизвольной деградации и микробицидную активность против системных бактериальных и грибковых патогенов. На основе этих известных физиологических функций этого белка могут быть предсказаны различные применения ангиогенина в медицине, диетических пищевых добавках и косметике.
Применение ангиогенина в таких приложениях требует эффективного способа для получения этого белка в коммерческом масштабе из подходящего источника. Целью предпочтительного варианта данного изобретения является обеспечение такого способа.
Сущность изобретения
Хотя коровье молоко легко доступно, его применение в качестве источника ангиогенина не является предпочтительным, так как ангиогенин присутствует в коровьем молоке только при низком уровне, и лактоферрин и лактопероксидаза, присутствующие в молоке, маскируют ангиогенин, затрудняя его очистку. Авторы этого изобретения нашли несколько способов для обогащения фракции молока ангиогенином, как описано в первом-пятом аспектах ниже и в их заявке, опубликованной как WO 2008/055310, причем каждый из этих способов способен продуцировать обогащенный ангиогенином продукт из молока.
Первый аспект обеспечивает способ получения обогащенного ангиогенином продукта из пробы молока, предусматривающий:
(a) контактирование этой пробы молока с захватывающим агентом, который взаимодействует с ангиогенином, так что ангиогенин, присутствующий в этой пробе молока, взаимодействует с этим захватывающим агентом с образованием комплекса ангиогенин-захватывающий агент;
(b) выделение этого комплекса из пробы молока;
(c) освобождение ангиогенина от захватывающего агента в этом комплексе и
(d) сбор этого ангиогенина из стадии (с) с получением посредством этого обогащенного ангиогенином продукта.
В одном варианте осуществления этот захватывающий агент иммобилизован на носителе.
В следующем варианте осуществления этим захватывающим агентом является антитело.
Второй аспект обеспечивает способ получения обогащенного ангиогенином продукта из пробы молока, предусматривающий:
(а) добавление этой пробы молока к носителю, на. котором иммобилизовано антитело, которое взаимодействует с ангиогенином, где ангиогенин, присутствующий в пробе молока, взаимодействует с антителом на носителе с образованием комплекса ангиогенин-антитело;
(b) отмывание компонентов, присутствующих в этой пробе молока, которые не взаимодействуют с этим антителом, из этого носителя для отделения этого комплекса от пробы молока;
(с) освобождение ангиогенина. от антитела в этом комплексе и
(d) сбор ангиогенина из стадии (с) с получением посредством этого обогащенного ангиогенином продукта.
В одном варианте первого или второго аспекта этот способ включает иммуноаффинную хроматографию.
Третий аспект обеспечивает способ получения обогащенного ангиогенином; продукта из пробы молока, предусматривающий::
(а) добавление пробы молока жидкой фазы ко второй фазе, причем указанная вторая фаза позволяет разделять компоненты пробы молока на основе размера этих компонентов; и
(b) сбор ангиогенина, который отделен от других компонентов этой пробы молока, с получением посредством этого обогащенного ангиогенином продукта, причем перед стадией (а) пробу молока не подвергают сычужному свертыванию или осаждению кислотой, или альтернативно эта проба молока не является молочной сывороткой или фракцией молочной сыворотки.
В одном варианте этого третьего аспекта эта вторая фаза является полупроницаемой фазой.
В следующих вариантах третьего аспекта эта полупроницаемая фаза позволяет компонентам, меньшим чем 20 кДа по размеру, или даже меньшим, чем 50 кДа по размеру, проходить через эту полупроницаемую фазу в виде пермеата. В предпочтительном варианте осуществления, эта полупроницаемая фаза позволяет компонентам, меньшим, чем 30 кДа по размеру, проходить через эту полупроницаемую фазу в виде пермеата. В таких вариантах осуществления, ангиогенин проходит через эту полупроницаемую фазу в виде пермеата.
Еще в одном варианте третьего аспекта эта полупроницаемая фаза позволяет компонентам, меньшим, чем 10 кДа по размеру, проходить через эту полупроницаемую фазу в виде пермеата. В одном таком варианте ангиогенин удерживается полупроницаемой фазой в качестве ретентата.
Еще в одном варианте третьего аспекта эту пробу молока заставляют протекать через полупроницаемую фазу.
В одном варианте третьего аспекта эту пробу молока заставляют проходить через полупроницаемую фазу посредством силы, прилагаемой с использованием шприца, сжатого газа, насоса, центрифужной силы или их комбинации.
В одном варианте третьего аспекта, второй фазой является полупроницаемая мембрана.
В следующем варианте третьего аспекта этот способ включает ультрафильтрацию.
Четвертый аспект обеспечивает способ получения обогащенного ангиогенином; продукта из пробы молока, предусматривающий:
(а) добавление пробы молока жидкой фазы ко второй фазе, причем указанная вторая фаза позволяет разделять компоненты пробы молока на основе размера этих компонентов;
(b) идентификацию фракций, содержащих ангиогенин, и сбор указанных фракций с получением обогащенного ангиогенином продукта.
В одном варианте этого четвертого аспекта этот способ включает эксклюзионную хроматографию по размерам (гель-фильтрацию).
В следующем варианте четвертого аспекта эта вторая фаза является смолой для эксклюзионной хроматографии по размерам.
В одном варианте четвертого аспекта эта смола разделяет белки с молекулярной массой в диапазоне приблизительно 10-20 кДа.
Пятый аспект обеспечивает способ получения обогащенного ангиогенином продукта из пробы молока, предусматривающий:
(a) приложение электрического поля к протекающей водной пробе молока в направлении, поперечном относительно потока этого молока;
(b) извлечение фракций потока молока, к которому было приложено электрическое поле; и
(c) идентификацию фракций, обогащенных ангиогенином, и сбор указанных фракций с получением обогащенного ангиогенином продукта.
В одном варианте пятого аспекта этот способ включает свободный электрофорез (электрофорез со свободным потоком (без носителя)). Этот свободный электрофорез может быть выбран из группы, состоящей из изоэлектрического фокусирования, зонального электрофореза, изотахофореза, ступенчатого электрофореза в электрическом поле и проточного фракционирования в электрическом поле. Кроме того, электрофорез со свободным потоком может быть непрерывным свободным электрофорезом или свободным электрофорезом с интервалами.
В одном дополнительном варианте осуществления этот способ проводят при денатурирующих условиях.
В следующем варианте пятого аспекта протекание водного молока проводят в: буферной среде, которая обеспечивает градиент рН. В одном варианте этот градиент является градиентом рН 8-11.
В следующем варианте одного из первого-пятого или более аспектов обогащенный ангиогенином продукт подвергают одной или нескольким дополнительным стадиям обогащения ангиогенином. Эти одна или несколько стадий обогащения ангиогенином могут быть выбраны из группы, состоящей из катионообменной хроматографии, электрофореза, в том числе свободного электрофореза, эксклюзионной хроматографии на основе размеров и ультрафильтрации. Это происходит, в частности, если важной является чистота фракции ангиогенина, например, для фармацевтического применения ангиогенина. Однако ожидается, что способ первого или второго аспектов способен обеспечивать обогащенный ангиогенином продукт высокой чистоты, в зависимости от специфичности захватывающего агента. Более высокая чистота ожидается, когда этим захватывающим агентом является антитело, специфическое в отношении ангиогенина.
Шестой аспект обеспечивает обогащенный ангиогенином продукт при получении способом по любому из первого-пятого аспектов.
Седьмой аспект обеспечивает применение обогащенного ангиогенином продукта по шестому аспекту этого изобретения в приготовлении пищевого продукта, нутрицевтического, фармацевтического или ветеринарного продукта.
Восьмой аспект обеспечивает пищевой продукт, нутрацевтический, фармацевтический или ветеринарный продукт, содержащий обогащенный ангиогенином продукт по шестому аспекту.
В варианте шестого или восьмого аспектов этот пищевой продукт является применяемой в спорте питательной или пищевой добавкой, в частности, пищевой добавкой для младенцев, атлетов, в частности участвующих в соревнованиях спортсменов, пожилых людей или немощных (слабых) людей.
Девятый аспект обеспечивает фармацевтическую композицию или ветеринарную композицию, содержащую обогащенный ангиогенином продукт по шестому аспекту.
Десятый аспект обеспечивает применение обогащенного ангиогенином продукта по шестому аспекту в приготовлении лекарственного средства для лечения и/или предупреждения нарушений, вызываемых вирусами, бактериями или грибками и их токсинами, или заболеваний, в которых требуется стимуляция ангиогенеза.
Одиннадцатый аспект обеспечивает применение обогащенного ангиогенином продукта, который может поражать патогены, которые вызывают инфекции поверхностей слизистых оболочек.
Двенадцатый аспект обеспечивает способ поражения патогенов, которые вызывают инфекции поверхностей слизистых оболочек, предусматривающий стадию введения субъекту эффективного количества нутрицевтического, фармацевтического или ветеринарного продукта по восьмому аспекту этого изобретения или композиции по девятому аспекту.
В одном варианте одиннадцатого или двенадцатого аспекта этого изобретения поверхности слизистых оболочек могут включать поверхности слизистых оболочек носа, глаз, ушей, легких, молочной железы и вагины.
Тринадцатый аспект обеспечивает способ лечения и/или предупреждения заболеваний, обусловленных вирусами, бактериями или грибками и их токсинами, или заболеваниями, в которых требуется стимуляция ангиогенеза, предусматривающий стадию введения субъекту эффективного количества нутрицевтического, фармацевтического или ветеринарного продукта по восьмому аспекту или композиции по девятому аспекту.
Краткое описание чертежей
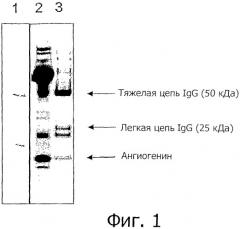
Фигура 1 показывает одномерный ДСН-полиакриламидный гель, окрашенный Sypro Ruby (Molecular Probes) и визуализированный с использованием 5-секундной экспозиции на системе формирования изображений ProXpress (Perkin Elmer). Дорожки 1, 2 и 3 представляют 1) стандарт молекулярных масс, 2) полученную из молока фракцию и 3) элюат из меченых гранул анти-ангиогенин-IgG Protein G Dynabeads после инкубации с полученной из молока фракцией.
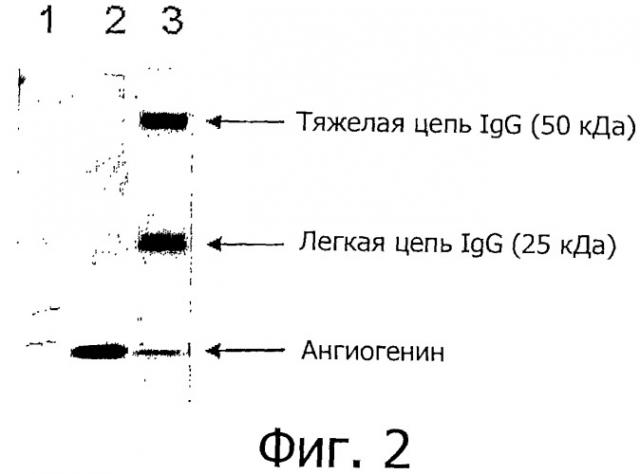
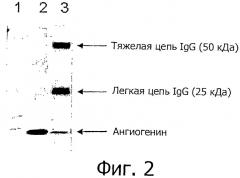
Фигура 2 показывает Вестерн-блот-анализ ангиогенина после иммуноаффинной очистки. Ангиогенин детектировали с использованием 0,5 мкг моноклональных мышиных антител против IgG коровы (клона 1B14D4), вторичным антителом было козье антитело против мышиного IgG IRDye 800CW (Licor), и изображение получали на устройстве для формирования изображения Odyssey infrared (Licor). Дорожки представляют 1) стандарт молекулярных масс, 2) полученную из молока фракцию и 3) элюат из меченых анти-ангиогенин-IgG Protein G Dynabeads после инкубации с полученной из молока фракцией.
Фигура 3 показывает электрофоретические разделения, сравнивающие истощенный в отношении ангиогенина ретентат и обогащенный ангиогенином пермеат, полученные посредством ультрафильтрации через мембрану 30 кДа. Содержимое дорожек: 1, стандарты молекулярных масс; 2, анализ 20-электрофореза ретентата в ДСН-ПААГ PAGE; 3, анализ lD-электрофореза пермеата в ДСН-ПААГ; 4, анализ 1D-электрофореза в ДСН-ПААГ обогащенного ангиогенином пермеата; 5, стандарты молекулярных масс; 6, анализ 2 В-электрофореза в ДСН-ПААГ обогащенного ангиогенином пермеата. Местоположение ангиогенина указано кружками.
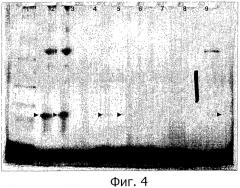
Фигура 4 показывает электрофорез в ПААГ в смеси Трис-трицин, показывающий разделение WGFE и фракций, полученных УФ-разделением WGFE или индуцируемым нагреванием осаждением WGFE (содержимое дорожек: 1, стандарты молекулярных масс; 2, нагретый WGFE; 3, нагретый WGFE; 4, пустой; 5, пермеат 100 кДа; 6, пермеат 50 кДа; 7, пермеат 30 кДа; 8, пермеат 10 кДа; 9, пустой; 10, нефракционированный WGFE). Местоположение ангиогенина указано .
Фигура 5 показывает разделение WGFE на Sephacryl S-100HR для выделения ангиогенина (сигнал оптической плотности при 280 нм, сигнал коллектора фракций, начало/конец пула).
Фигура 6 показывает разделение WGFE на Sephacryl S-300HR для выделения ангиогенина (сигнал оптической плотности при 280 нм, сигнал коллектора фракций, начало/конец пула).
Фигура 7 показывает разделение WGFE Superose 12 для выделения ангиогенина (сигнал оптической плотности при 280 нм, сигнал коллектора фракций, начало/конец пула).
Фигура 8 показывает электрофорез в ПААГ в смеси Трис-трицин, показывающий разделение WGFE и фракций, полученных SEC-разделением WGFE (содержимое дорожек: 1, нефракционированный WGFE; 2, пустой; 3, пул A S-100HR; 4, пул В S-100HR; 5, пул С S-100HR; 6, пул D S-100HR; 7, пустой; 8, пул Е S-100HR; 9, пустой; 10, стандарты молекулярных масс). Местоположение ангиогенина указано .
Фигура 9 показывает электрофорез в ПААГ в смеси Трис-трицин, показывающий разделение WGFE и фракций, полученных SEC-разделением WGFE (содержимое дорожек: 1, пустой; 2, пул А S-300HR; 3, пул С S-300HR; 5, пустой; 6, пул A Superose 12; 7, пул В Superose 12; 8, пустой; 9, нефракционированный WGFE; 10, стандарты молекулярных масс). Местоположение ангиогенина указано .
Фигура 10 показывает анализ с использованием двухмерного электрофореза разделения белков в экспериментах изоэлектрического фокусирования в растворе, где раствор полученного из молока белка фракционировали во фракции рН 3-5, рН 5-6,5, рН 6,5-8 и рН 8-11. Приблизительно 80% белка во фракции рН 8-11 идентифицируются как ангиогенин.
Подробное описание изобретения
Авторы этого изобретения осознали необходимость способов, которые делают возможным обогащение и выделение ангиогенина эффективным образом из легко доступного исходного материала, молока, в частности коровьего молока. Некоторые из этих способов обеспечивают высокоочищенную фракцию ангиогенина в масштабе, приемлемом для исследований, а другие способы обеспечивают коммерчески жизнеспособные способы обогащения фракций ангиогенином.
Первый и второй аспекты обеспечивают способ, в котором белок ангиогенин, присутствующий в пробе молока, отделяют от других белков и материала, присутствующего в этой пробе, с использованием захватывающего агента, который взаимодействует с белком ангиогенином.
В следующем варианте первого или второго аспекта, перед контактированием этой пробы молока с указанным контактирующим агентом, эту пробу молока добавляют к предварительному и особому носителю в отсутствие захватывающего агента или антитела, где материал, присутствующий в этой пробе молока, который взаимодействует неспецифически с этим носителем, удаляется из этой пробы молока.
В одном варианте первого или второго аспекта этот носитель является носителем на основе полимера или агарозы. Например, этим носителем может быть Белок G Dynabeads.
В следующем варианте первого или второго аспекта это антитело является поликлональным антителом или моноклональным антителом. Предпочтительно это антитело является моноклональным. Одним подходящим антителом против коровьего ангиогенина является моноклональное антитело с номером клона 1B14D4, полученное из Department of Biochemistry, Chungbuk National University, Cheongj'u, Chungbuk, Korea.
В следующем варианте первого или второго аспекта захватывающий агент или антитело иммобилизованы на носителе ковалентным присоединением к нему.
В данном контексте термин "захватывающий агент" относится к материалу, который способен "взаимодействовать" с белком ангиогенином с образованием комплекса ангиогенинзахватывающий агент. Предпочтительно, это взаимодействие делает белок ангиогенин иммобилизованным. В идеале этот захватывающий агент является специфическим только в отношении белка ангиогенина, присутствующего в пробе молока; однако квалифицированному в данной области специалисту должно быть понятно, что другие компоненты в этой пробе молока могут также взаимодействовать неспецифически с этим захватывающим агентом. Таким образом, предпочтительным захватывающим агентом является захватывающий агент, который проявляет минимальное неспецифическое связывание.
Подходящие захватывающие агенты могут включать, но не ограничиваются ими, антитела к ангиогенину, пептиды или белки (в том числе пептиды и белки, которые связывают ангиогенин, например фоллистатин), химические частицы, рецепторы, лиганды, аптамеры, полисахариды, липиды, гормоны или т.п. Предпочтительно, захватывающими агентами являются антитела или их функциональные фрагменты.
В одном варианте захватывающий агент способен различать между РНКазой 4 и ангиогенином, несмотря на 30%-ную идентичность их последовательностей.
Взаимодействие между захватывающим агентом и ангиогенином должно быть обратимым, так что ангиогенин может быть в конечном счете отделен от захватывающего агента. Это взаимодействие может быть прямым или может быть непрямым, так что взаимодействие захватывающего агента с ангиогенином опосредуется третьим (или более) агентом, например линкерной молекулой, пептидом или т.п., которые сводят захватывающий агент и ангиогенин вместе.
В одном варианте захватывающий агент соединен или "иммобилизован" с носителем. Термин "носитель" относится в этом контексте к материалу, на котором присоединены захватывающие агенты. Этот носитель может быть твердым носителем. Примеры подходящих носителей включают матриксные носители на основе полимеров или агарозы, такие как Сефароза, нитроцеллюлоза, найлон, поливинилидендифторид (PVDF), стекло, пластик, гели, золи, керамика, металлы и производные любых из них.
Захватывающие агенты могут быть присоединены к носителю прямо или опосредованно. Захватывающие агенты могут быть прямо или опосредованно депонированы при высокой плотности на этом носителе. Например, Белок А или белок G могут быть иммобилизованы на носителе. Затем захватывающие агенты, такие как антитела к ангиогенину, могут быть связаны с носителем посредством их взаимодействия с Белком А или G. Преимущество этого способа заключается в том, что посредством связывания константных областей антител с Белком А или G вариабельные районы этих антител будут полностью экспонированы для взаимодействия с ангиогенином.
Захватывающие агенты могут быть также присоединены к носителю, который является мембраной, изготовленной из полимерного, эластомерного или другого подходящего мембранного материала. Примеры таких материалов включают, но не ограничиваются ими, PVDF, нитроцеллюлозу, найлон или их модифицированные варианты. Это изобретение рассматривает применение любого такого материала, например, известного квалифицированным в данной области специалистам, для использования в Нозерн-, Саузерн- или Вестерн-блоттинге. Конкретные аспекты мембран, которые желательны для цели этого изобретения, включают способность связывания больших количеств белка ангиогенина, способность связывания белка ангиогенина с минимальной денатурацией и способность минимизации связывания не являющихся ангиогенином компонентов, присутствующих в пробе молока.
Первый и второй аспекты основываются на обратимом аффинном взаимодействии между ангиогенином и антителом к ангиогенину, которое действует в качестве захватывающего агента.
Способ этого изобретения, который использует антитела таким образом, обычно называют иммуноаффинной хроматографией. В этом отношении антитело, специфическое в отношении ангиогенина, иммобилизуют на носителе с получением активного иммуносорбента. Затем этот активный иммуносорбент упаковывают в колонку, готовую для получения подлежащей очистке пробы гетерогенного белка. К этому иммуносорбенту добавляют пробу молока, содержащую комплексную смесь белков, или пропускают эту смесь через иммуносорбент, посредством чего этот белок ангиогенин, присутствующий в этой пробе, взаимодействует с этим антителом с образованием комплекса ангиогенин-антитело, а другие белки и материал, присутствующие в этой пробе, вымываются в виде проходящей через колонку фракции. Затем это обратимое взаимодействие между антителом и ангиогенином разрушается с образованием высокоочищенного продукта в виде элюата из этой колонки, который обогащен ангиогенином.
В данном контексте термины "антитело к ангиогенину" или "антитело" включают типы поликлональных и моноклональных антител. Кроме того, термин "антитело" обозначает интактные молекулы иммуноглобулина, химерные молекулы иммуноглобулина или фрагменты Fab или F(ab')2. Антитела, определенные здесь, включают также одноцепочечные антитела (ScFv), которые содержат связанные домены vh и vl и которые сохраняют конформацию и удельную связывающую активность нативного идиотопа этого антитела. Такие одноцепочечные антитела хорошо известны в данной области и могут быть получены стандартными способами. Эти антитела могут быть антителами любого изотипа, IgG, IgA, IgD, IgE и IgM. Будет хорошо понятно, что эти антитела или их фрагменты включают антитела или фрагменты, известные в настоящее время, или антитела, которые могут стать известными в будущем.
Поликлональные антитела к ангиогенину могут быть получены способами, известными в данной области. Например, поликлональные антитела к ангиогенину могут быть получены иммунизацией кролика или козы и очисткой фракции иммуноглобулина из полученной сыворотки. Полученные антитела представляют собой смесь антител с различными специфичностями, способных связываться с различными частями белка ангиогенина, который использовался в качестве иммуногена.
Поликлональные антитела к ангиогенину могут быть также приобретены коммерчески (например, из Calbiochem, USA; Lifespan Biosciences, USA; R&D Systems, USA).
Хотя поликлональные антитела могут быть легко получены, они страдают от нескольких недостатков для использования в иммуноаффинной хроматографии. Например, они являются гетерогенными в отношении специфичности эпитопа и связывающих свойств, и должен использоваться антиген, который является совершенно чистым, во избежание возникновения нежелательных антител к минорным примесям в препарате белка. Кроме того, препарат антитела не является полностью воспроизводимым от одного иммунизированного животного к другому, затрудняя получение больших количеств согласующегося материала. Таким образом, хотя поликлональные антитела к ангиогенину могут быть использованы в способах этого изобретения, они не являются предпочтительными антителами.
Могут быть использованы моноклональные антитела к ангиогенину. Моноклональные антитела к ангиогенину могут быть получены с использованием любого способа, который обеспечивает получение молекул антител непрерывными клеточными линиями в культуре. Они включают, но не ограничиваются ими, гибридомные способы, способ В-клеточной гибридомы человека и способ EBV-гибридомы, как будет известно квалифицированному в данной области специалисту. Моноклональные антитела к ангиогенину могут быть также приобретены коммерчески (например, Abeam, UK; GeneTex, USA; BACHEM, USA).
Моноклональные антитела могут быть получены с использованием меньших количеств ангиогенина в качестве иммуногена, причем ангиогенин не должен быть чистым. Сразу после установления линии гибридомных клеток эта линия может быть использована для получения потенциально неограниченного запаса антитела с воспроизводимыми свойствами. Кроме того, моноклональное антитело будет связываться с единственным эпитопом и будет иметь гомогенные свойства связывания и элюции.
Производительность иммуносорбента зависит от характера носителя, к которому иммобилизовано это антитело. Лицу, квалифицированному в данной области, будет понятно, что эффективные иммуносорбенты должны в идеале иметь механическую и физическую стабильность, подходящие свойства текучести, приемлемый перепад давления, минимальное неспецифическое связывание, большую площадь поверхности для взаимодействия белок-антитело и химическую стабильность.
В этом отношении обычно используют матриксные носители на основе полимеров и/или агарозы, такие как Сефароза, и они являются коммерчески доступными. Примеры подходящих матриксов для носителя, который может быть использован в способе иммуноаффинной хроматографии этого изобретения, включают CNBr-активированную Сефарозу (GE Healthcare), Етрпа2е™-активированную хроматографическую смолу (Pierce Chemical), гель CM Bio-Gel A (Bio-Rad), ЕСН Сефарозу 4B (GE Healthcare), Reacti-Gel 6X (Pierce Chemical), гранулы Белок А и G Сефарозы CL 4B (Pierce Chemical), HiTrap NHS-активированный (GE Healthcare) и AffiPrep 10 (Bio-Rad).
Эффективное функционирование иммуносорбентной колонки зависит от способа химической активации, используемого для связывания антитела с матриксом, с иммобилизацией посредством этого антитела. Обычно используют ковалентное связывание. Как должно быть известно квалифицированному в данной области специалисту, имеется ряд различных протоколов для ковалентного связывания антител с твердофазным матриксом; однако самым легким является связывание антител с гранулами Белка А или Белка G. Матриксы Белок А или Белок G связываются специфически с Fc-доменом антител. После связывания этого антитела это взаимодействие стабилизируют ковалентным сшиванием этого антитела с Белком А или Белком G с бифункциональным связующим реагентом.
Другим способом является связывание этого антитела с гранулами матрикса, которые были химически модифицированы для содержания активной группы. Этот способ предоставляет преимущества над применением матриксов Белка А или Белка G, заключающиеся в том, что эти гранулы могут быть активированы в гораздо более жестких условиях, чем условия, которые могут выдерживать белки, что позволяет использовать диапазон протоколов активации, которые известны в данной области (см. также Porath and Axen, 1976, Methods Enzymol. 44: 19 to 45; Scouten WH, 1987, Methods Enzymol. 135: 30 to 65). Дополнительные преимущества этого подхода включают широкий диапазон активированных гранул, которые являются коммерчески доступными, как было показано выше, и тот факт, что многие из этих способов связывания дает связь, которая является стабильной в отношении широкого диапазона денатурирующих условий.
Химическая модификация гранул этого матрикса для генерирования активных групп может быть достигнута рядом способов, включающих обработку карбонилдиимидозолом, цианогенбромидом, N-гидроксисукцинимидом, (NHS), иодацетил- и тресилхлоридом.
Связывание между активированными гранулами и антителом к ангиогенину преимущественно опосредовано через первичные аминогруппы или сульфгидрильные группы, присутствующие на этом антителе. В качестве примера, связывание антитела (через аминогруппы) с NHS-активированным матриксом, таким как AffiPrep, для генерирования функционирующего иммуносорбента может быть достигнуто следующим образом. Подходящее количество активированного матрикса AffiPrep matrix, поставляемого в виде суспензии гранул, суспендированных в этаноле (50% о/о), выливают на воронку из спекшегося стекла и эту жидкость аспирируют посредством слабого вакуума. Оставшуюся суспензию перемешивают стеклянной палочкой и хранят во влажном виде в любое время. Эти активированные гранулы промывают охлажденной на льду дистиллированной водой для гарантии удаления всего этанола. Воду дренируют из этих гранул слабым вакуумом и эти влажные гранулы переносят в колбу, содержащую 3-5 мг/мл раствора антитела ангиогенина в буфере для связывания (0,1 М 4-морфолинпропанолсульфоновой кислоты (MOPS), 0,1 М Nad, pH 7,2). Затем содержимое этой колбы смешивают при низкой скорости в течение ночи в холодной камере или в течение 4 часов при комнатной температуре. Связывание включает реакцию между активированным эфиром на этих гранулах и реакционно-способным амином на этом антителе, которая в конечном счете приводит к образованию стабильной амидной (ковалентной) связи. После завершения этой стадии связывания гранулам дают осадиться при комнатной температуре и затем супернатант удаляют аспирацией или декантированием. Затем к этому иммуносорбенту добавляют блокирующий раствор (1 М этаноламин, рН 8,0) и перемешивают при низкой скорости в течение 1 часа при комнатной температуре. После завершения стадии блокирования этим гранулам опять дают осадиться и супернатант удаляют. Для гарантии полного блокирования неиспользованных активированных сайтов эту блокирующую стадию повторяют дополнительно два раза.
Затем к связанным с антителом гранулам добавляют лигандсвязывающий буфер (10 мМ Трис-HCl, 50 мМ NaCl, рН 6,8) и содержимое смешивают при низкой скорости в течение 1 часа при комнатной температуре. Эту стадию предпочтительно повторяют еще четыре-пять или более раз для гарантии, что весь блокирующий раствор удален из этих гранул. Затем этот иммуносорбент ресуспендируют в подходящем количестве лигандсвязывающего буфера и хранят при 4°С до использования. После этого иммуносорбент является готовым для использования и может быть упакован в колонках под действием силы тяжести для связывания ангиогенина.
Перед добавлением пробы молока в колонку приготовленных гранул, эта колонка может быть "уравновешена" подходящим промывочным буфером. Примеры подходящих промывочных буферов включают, но не ограничиваются ими, буферы, содержащие 10 мМ Трис-НСl и 50 мМ NaCl при рН 7,0, буферы, содержащие 10 мМ Трис-HCl, 140 мМ NaCl, 0,5% Тритон Х-100 и 0,5% деоксихолат натрия при рН 8,0, буферы, содержащие 10 мМ Трис-HCl, 140 мМ NaCl и 0,5% Тритон Х-100 при рН 8,0, буферы, содержащие 10 мМ Трис-HCl, 140 мМ NaCl и 0,5% Тритон Х-100 при рН 9,0, и буферы, содержащие 150 мМ NaCl, 0,1% Тритон Х-100 и 50 мМ триэтаноламин. Эта колонка может быть уравновешена одним или несколькими из перечисленных выше буферов.
Обычной, но необязательной практикой является то, что перед добавлением пробы молока на содержащую уравновешенный иммуносорбент (антителосодержащую) колонку пробу сначала пропускают через предварительную и отдельную "пре-колонку"; которая содержит тот же самый носитель, что и иммуносорбентная колонка, но которая не имеет антитела, связанного с этим носителем. Это делается для того, чтобы эта проба очищалась от материала, который, возможно, связывается неспецифически с иммуносорбентной колонкой. Эту пре-колонку уравновешивают перед добавлением пробы молока таким же образом, что и иммуносорбентную колонку, с использованием промывочных буферов, описанных выше.
Кроме того, предпочтительно, перед добавлением этой пробы молока к уравновешенной иммуносорбентной колонке и пре-колонке (если она используется) из этой пробы молока удаляют жир (что часто называют делипидированием). Однако это не является обязательным. Жир может быть удален любыми подходящими способами, известными в данной области, включающими низкоскоростное центрифугирование, разделение или микрофильтрацию. Необязательно перед способом иммуноаффинной хроматографии могут быть также удалены казеины, например микрофильтрацией через 1 мкм-мембрану, сычужным свертыванием молока или осаждением кислотой. При выборе микрофильтрации казеины будут удерживаться на этой мембране, а белки молочной сыворотки, в том числе ангиогенин, будут перемещаться в пермеат.
При удалении казеинов микрофильтрацией или другим мембранным процессом этот пермеат наносят непосредственно на уравновешенную иммуносорбентную колонку и пре-колонку (если она используется), или, необязательно, этот пермеат может быть сконцентрирован перед нанесением. Подходящие способы концентрирования включают фильтрование (например, ультрафильтрацию с мембраной 0,5-10 кДа, нанофильтрацию с мембраной 150-500 Да или обратный осмос, позволяющий только воде проникать через эту мембрану) или лиофилизацию с последующим ресуспедированием в промывочном буфере, как описано выше.
Пробу молока (неочищенную или предварительно кондиционированную) обычно добавляют в пре-колонку и/или загрунтованную иммуносорбентную колонку (т.е. твердый носитель) при скорости потока 0,2-2 колоночных объемов в час. Однако скорость потока до 5 колоночных объемов в час также является подходящей. Сразу же после добавления всей пробы следует ряд промывочных стадий с использованием любого одного или нескольких промывочных буферов, описанных выше. Эти промывочные буферы наносят до тех пор, пока промывка, которая проходит через колонку, не будет находиться при оптической плотности фона при 280 нм. Это указывает на то, что нет дополнительного несвязанного белка, который подлежит вымыванию из колонки.
Выделение ангиогенина, который связан с твердым носителем через антиген (захватывающий агент), может достигаться различными путями в зависимости от природы используемого твердого носителя. Важно избежать условий выделения, которые могут денатурировать ангиогенин. Как будет понятно квалифицированному в данной области специалисту, при выборе подходящего протокола выделения может быть рассмотрен некоторый диапазон доступных протоколов выделения. Эти протоколы могут включать кислотное выделение, основное выделение и применение хаотропных агентов.
Кислотное выделение является наиболее широко распространенным способом и обычно является очень эффективным. Обычно используемые кислоты включают глицин-НСl, рН 2,5, 0,02 М НСl и цитрат натрий, рН 2,5. Однако, во избежание индуцируемой кислотой денатурации, после выделения рН выделенной пробы должен быть быстро нейтрализован до рН 7,0 2 М Трисом-основанием, рН 8,5. Основное выделение обычно основано на отделяющих агентах, состоящих из 1 М NH4ОН, 50 мМ диэтиламина, рН 11,5, или 50 мМ раствора триэтаноламина, содержащего 150 мМ NaCl и 0,1% Тритон Х-100.
Хаотропные агенты разрушают третичную структуру белков и, следовательно, могут быть использованы для разрушения комплекса ангиогенин-антитело. Применимы хаотропные соли, так как они разрушают взаимодействия ионов, образование водородных связей и иногда гидрофильные взаимодействия. Эффективные хаотропные анионы включают SCN-, ClO4 -, I-, Br- и Сl-. Эффективные хаотропные катионы включают Mg, К и Na. Отделяющие агенты (сепаранты), такие как 8 М мочевина, 6 М гуанидин-НСl и 4 М NaSCN, являются эффективными в разрушении большинства взаимодействий антитело-ангиогенин. Однако для минимизации индуцируемой хаотропной солью денатурации белка рекомендуется быстрое обессоливание или диализ этого отделяющего агента.
Пробу, отделенную от твердого носителя, собирают и анализируют на присутствие ангиогенина и для определения степени обогащения ангиогенином. Подходящие стадии анализа включают денситометрический анализ окрашенного электрофореза в ДСН-ПААГ для сравнения относительного содержания специфической полосы белка ангиогенина с любым присутствующим загрязняющим белком, масс-спектрометрию, такую как MALDI-TOF/TOF MS, иммуноаффинное детектир