Терапевтическая комбинация, включающая легочный сурфактант и антиоксидантные ферменты
Иллюстрации
Показать всеИзобретение относится к области фармацевтики. Применение комбинации экзогенного легочного сурфактанта, CuZn-супероксиддисмутазы и каталазы для одновременного, последовательного или раздельного использования в предотвращении бронхолегочной дисплазии (BPD). Лекарственное средство для предотвращения BPD. Набор для предотвращения BPD, содержащий: а) экзогенный легочный сурфактант и фармацевтически приемлемый носитель или разбавитель в первой стандартной лекарственной форме; b) CuZn-супероксиддисмутазу и, необязательно, фармацевтически приемлемый носитель или разбавитель во второй стандартной лекарственной форме; с) каталазу и, необязательно, фармацевтически приемлемый носитель или разбавитель в третьей стандартной лекарственной форме; d) контейнер для хранения указанных первой, второй и третьей лекарственных форм. Использование комбинации повышает эффективность лечения BPD за счет синергетического эффекта совместного действия компонентов. 4 н. и 11 з.п. ф-лы, 3 ил., 2 пр.
Реферат
ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к композициям для лечения недоношенных детей. В частности, изобретение относится к применению экзогенного легочного сурфактанта в сочетании с антиоксидантными ферментами для снижения оксидативных повреждений легких и риска развития бронхолегочной дисплазии у недоношенных детей.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Легкое человека состоит из большого числа небольших воздушных мешков, называемых альвеолами, в которых происходит газообмен между кровью и воздушными полостями легких. У здоровых индивидуумов данный обмен опосредован наличием содержащего белок сурфактантного комплекса, предохраняющего легкие от спадания в конце выдоха.
Легочный сурфактантный комплекс, главным образом, состоит из липида и содержит незначительные количества различных белков. Отсутствие достаточных уровней данного комплекса приводит к нарушению функционирования легких. Данный синдром называют респираторный дистресс-синдром (RDS), и, как правило, он поражает недоношенных детей.
Основным направлением лечения RDS является заместительная терапия препаратами экзогенного легочного сурфактанта.
В настоящее время экзогенные легочные сурфактанты вводят в качестве суспензий в физиологическом растворе посредством эндотрахеальной инстилляции интубированным недоношенным детям, находящимся на искусственной вентиляции легких с применением кислорода.
Хотя указанный способ терапии значительно повышает постнатальную выживаемость, перенесшие RDS дети обладают высоким риском развития бронхолегочной дисплазии (BPD), осложнения, нарушающего развитие легких и, в конечном итоге, приводящего к нарушению дыхания.
Данные свидетельствуют о том, что оксидативные повреждения тканей легких играют важную роль в патогенезе BPD, и снижение активности антиоксидантных ферментов приводит к повышению предрасположенности к бронхолегочной дисплазии.
Для противодействия эффектам активных форм кислорода предлагают препараты дополнительного сурфактанта с антиоксидантными ферментами, такими как супероксиддисмутаза и каталаза, количество которых зачастую недостаточно в легких недоношенных детей.
Однако до сих пор не предоставляли критериев терапевтически эффективной дозы указанных ферментов у людей без изменения поверхностной активности сурфактанта или возникновения других побочных эффектов. Например, сообщали, что устранение активных форм кислорода супероксиддисмутазой может нарушать фагоцитарную бактерицидную активность.
Таким образом, в настоящее время существует потребность в разработке безопасного лекарственного средства, эффективно снижающего маркеры оксидативного стресса и, таким образом, риск BPD у детей, страдающих RDS.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте настоящее изобретение относится к экзогенному легочному сурфактанту в комбинации с CuZn-супероксиддисмутазой в однократной дозе от 2000 до 10000 Ед/кг и каталазой в однократной дозе от 2000 до 4000 Ед/кг для применения в предотвращения бронхолегочной дисплазии (BPD).
Предпочтительно экзогенный легочный сурфактант является модифицированным природным легочным сурфактантом. Предпочтительным модифицированным природным легочным сурфактантом является порактант альфа, более предпочтительно вводимый в однократной дозе от 100 до 200 мг/кг.
Во втором аспекте изобретение относится к комбинации:
- экзогенного легочного сурфактанта;
- CuZn-супероксиддисмутазы в однократной дозе от 2000 до 10000 Ед/кг и каталазы в однократной дозе от 2000 до 4000 Ед/кг для одновременного, последовательного или раздельного введения для предотвращения бронхолегочной дисплазии (BPD), предпочтительно для одновременного введения.
В третьем аспекте изобретение относится к лекарственному средству, содержащему фиксированную комбинацию экзогенного легочного сурфактанта с CuZn-супероксиддисмутазой в однократной дозе от 2000 до 10000 Ед/кг и каталазой в однократной дозе от 2000 до 4000 Ед/кг.
Предпочтительно указанное лекарственное средство находится в форме, подходящей для ингаляции или интратрахеального введения.
В четвертом аспекте изобретение относится к набору, включающему: a) экзогенный легочный сурфактант и фармацевтически приемлемый носитель или разбавитель в первой стандартной лекарственной форме; b) CuZn-супероксиддисмутазу в однократной дозе от 2000 до 10000 Ед/кг и, необязательно, фармацевтически приемлемый носитель или разбавитель во второй стандартной лекарственной форме; c) каталазу в однократной дозе от 2000 до 4000 Ед/кг и, необязательно, фармацевтически приемлемый носитель или разбавитель в третьей стандартной лекарственной форме; d) контейнеры для хранения указанных первой, второй и третьей лекарственных форм.
Согласно конкретному аспекту супероксиддисмутаза и каталаза могут присутствовать в лекарственной форме для однократного введения, необязательно, с фармацевтически приемлемым носителем или разбавителем.
В пятом аспекте изобретение относится к применению экзогенного легочного сурфактанта в комбинации с CuZn-супероксиддисмутазой в однократной дозе от 2000 до 10000 Ед/кг и каталазой в однократной дозе от 2000 до 4000 Ед/кг для получения лекарственного средства для предотвращения бронхолегочной дисплазии (BPD).
В шестом аспекте изобретение относится к способу предотвращения бронхолегочной дисплазии посредством введения нуждающемуся в этом пациенту экзогенного легочного сурфактанта в комбинации с CuZn-супероксиддисмутазой в однократной дозе от 2000 до 10000 Ед/кг и каталазой в однократной дозе от 2000 до 4000 Ед/кг.
ОПРЕДЕЛЕНИЯ
Термин "антиоксидантные ферменты" относится к ферментам, катализирующим диспропорционирование супероксида, одной из основных активных форм кислорода в клетке, в кислород и пероксид водорода.
"CuZn-супероксиддисмутаза" обозначает белок, обладающий аминокислотной последовательностью, идентичной или по существу идентичной аминокислотной последовательности природной CuZn-супероксиддисмутазы, происходящей от человека, быка или другого млекопитающего, и обладающий биологической активностью такой природной CuZn-супероксиддисмутазы.
"Каталаза" обозначает белок, обладающий аминокислотной последовательностью, идентичной или по существу идентичной аминокислотной последовательности природной каталазы, происходящей от человека, быка или другого млекопитающего, и обладающий биологической активностью такой природной каталазы.
"Однократная доза" относится к количеству сурфактанта или фермента, вводимого пациенту в качестве однократно дозы.
Для ферментов дозы выражают как Ед на кг массы тела.
Одну Ед определяют как количество фермента, катализирующего превращение 1 микромоля субстрата в минуту.
Поскольку масса тела недоношенных детей находится в диапазоне приблизительно от 500 граммов до 1500 граммов, таким образом, можно вычислять однократную дозу.
Например, однократная доза CuZn-супероксиддисмутазы в диапазоне от 2000 до 10000 Ед/кг соответствует диапазону приблизительно от 1000 до 15000 Ед, в то время как однократная доза каталазы в диапазоне от 2000 до 4000 Ед/кг соответствует диапазону приблизительно от 1000 до 6000 Ед.
Термин "бронхолегочная дисплазия (BPD)" относится к хроническому легочному расстройству, также известному как хроническое заболевание легких (CLD), являющемуся следствием неразрешенного или аномально восстановленного повреждения легких.
Как правило, BPD наблюдают у детей с очень низкой массой тела при рождении (VLBW), перенесших повреждение легких как результат кислородной токсичности и баротравмы от примененной ранее, искусственной вентиляции легких.
Термин "экзогенный легочный сурфактант" относится к композициям, имитирующим эндогенный легочный сурфактант, применимым для предотвращения и/или лечения заболеваний, относящихся к дефициту или дисфункции сурфактанта.
По Wilson D (Expert Opin Pharmacother 2001, 2(9), 1479-1493) экзогенные легочные сурфактанты можно классифицировать на четыре различных типа:
i) "природные" сурфактанты, извлекаемые интактными из легких или амниотической жидкости без экстракции и обладающие липидным и белковым составом природного эндогенного сурфактанта. Они несут потенциальный риск инфицирования, поскольку их нельзя стерилизовать, т.к. нагревание вызывает денатурацию гидрофильных белков SP-A и SP-D. Данные сурфактанты не находятся в продаже;
ii) "модифицированные" сурфактанты, являющиеся липидными экстрактами измельченного легкого млекопитающего или смывов легких. Из-за способа экстракции липидов, применяемого в процессе производства, утрачивают гидрофильные белки SP-A и SP-D. Данные препараты содержат различные количества SP-B и SP-C и в зависимости от способа экстракции могут содержать несурфактантные липиды, белки или другие компоненты. Некоторые модифицированные природные сурфактанты, присутствующие на рынке, такие как Survanta (vide ultra), дополняют синтетическими компонентами, такими как трипальмитин, дипальмитоилфосфатидилхолин и пальмитиновая кислота.
iii) "искусственные" сурфактанты, являющиеся простыми смесями синтетических соединений, главным образом, фосфолипидов и других липидов, составляемыми для имитации липидной композиции и действия природного сурфактанта. Они не содержат апопротеины сурфактанта;
iv) "восстановленные" сурфактанты, являющиеся искусственными сурфактантами, к которым добавляют белки/пептиды сурфактанта, выделяемые из животных, или белки/пептиды, получаемые посредством рекомбинантной технологии, такие как получаемые в WO 95/32992, или синтетические аналоги белков сурфактанта, такие как описываемые в WO 89/06657, WO 92/22315 и WO 00/47623.
Термин "порактант альфа" относится к модифицированному природному сурфактанту, выделяемому из легких свиней, по существу, состоящему из полярных липидов, в основном фосфолипидов, и белков SP-B и SP-C. Порактант альфа доступен под торговой маркой CUROSURF®.
Термин "фиксированная комбинация" означает комбинацию, где активные вещества находятся в фиксированном количественном отношении.
"Фармацевтически приемлемый" относится к среде, не вызывающей при введении ребенку аллергической или сходной нежелательной реакции.
"Активность сурфактанта" для препарата легочного сурфактанта определяют как способность снижать поверхностное напряжение.
Эффективность in vitro препаратов экзогенного сурфактанта, как правило, тестируют измерением его способности снижать поверхностное напряжение с применением подходящего средства, такого как метод Вильгельми, пульсирующий пузырьковый сурфактометр, сурфактометр с захватом пузырьков и капиллярный сурфактометр.
Эффективность in vivo препаратов экзогенного сурфактанта тестируют измерением показателей внешнего дыхания на недоношенных моделях на животных известными способами.
Термин "тяжелый RDS" указывает на форму респираторного дистресс-синдрома новорожденных, обратно пропорциональную внутриутробному возрасту и/или массе тела при рождении, которую могут диагностировать известными способами клинически и/или рентгенографически.
Термин "синергичный" означает, что активность двух соединений является большей, чем можно ожидать при суммировании их соответствующих индивидуальных активностей в указанном анализе.
ФИГУРЫ
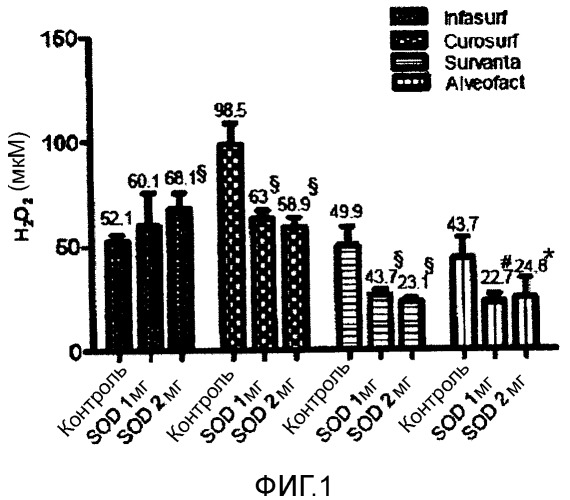
Фигура 1 - концентрация H2O2 1 в четырех исследуемых модифицированных природных легочных сурфактантах после добавления 100 мМ H2O2 (контроль) и 1 или 2 мг SOD.
Средние значения и SD. *p<0,05 по сравнению с контролем; # p<0,005 по сравнению с контролем; § p<0,0001 по сравнению с контролем.
1Данные представляют собой разницу между концентрацией H2O2 во время 0 и в конце эксперимента.
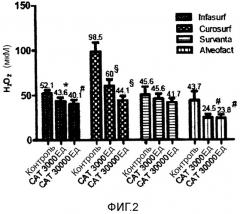
Фигура 2 - концентрация H2O2 1 в четырех исследуемых модифицированных природных легочных сурфактантах после добавления 100 мМ H2O2 (контроль) и 3000 или 30000 Ед CAT.
Средние значения и SD. *p<0,05 по сравнению с исходным уровнем; # p<0,005 по сравнению с исходным уровнем; § p<0,0001 по сравнению с исходным уровнем.
1Данные представляют собой разницу между концентрацией H2O2 во время 0 и в конце эксперимента.
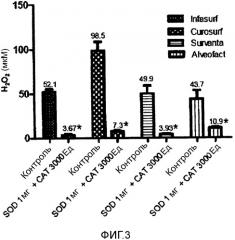
Фигура 3 - концентрация H2O2 1 в четырех исследуемых модифицированных природных легочных сурфактантах после добавления 100 мМ H2O2 (контроль) и 1 мг SOD и 3000 Ед CAT.
Средние значения и SD. *p<0,0001 по сравнению с исходным уровнем.
1Данные представляют собой разницу между концентрацией H2O2 во время 0 и в конце эксперимента.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основывается на неожиданных данных о том, что CuZn-супероксиддисмутаза и каталаза в конкретных дозах действуют синергично на утилизационную активность экзогенных легочных сурфактантов по отношению к активным формам кислорода.
Таким образом, настоящее изобретение относится к экзогенному легочному сурфактанту в комбинации с CuZn-супероксиддисмутазой в однократной дозе от 2000 до 10000 Ед/кг и каталазой в однократной дозе от 2000 до 4000 Ед/кг для применения в предотвращении бронхолегочной дисплазии (BPD).
В отличие от предшествующего уровня техники применение указанных антиоксидантных ферментов в заявленных однократных дозах не инактивирует модифицированный природный легочный сурфактант.
Кроме того, применение комбинации ферментов позволяет повышать утилизационную активность всех сурфактантов, в то время как эффект добавления отдельных ферментов, как показано в Примере 1, по-видимому, зависит от их композиции.
Для применения в настоящем изобретении может подходить любой экзогенный легочный сурфактант, предпочтительно экзогенный легочный сурфактант, выбранный из группы модифицированных природных легочных сурфактантов, искусственных сурфактантов и восстановленных сурфактантов. Более предпочтительно, можно применять модифицированные природные легочные сурфактанты, в настоящее время доступные для лечения системы респираторных расстройств и других легочных состояний. Они включают, в качестве неограничивающих примеров, бычий липидный сурфактант BLES® (BLES Biochemicals, Inc. London, Ont), кальфактант (Infasurf®, ONY, Inc. Amherst, NY, USA), бовактант (Alveofact®, Boehringer Ingelheim Pharma, Ingelheim, Germany), Сурфактант TA (Surfacten®, Tokyo Tanabe, Japan), порактант альфа (Curosurf®, Chiesi Farmaceutici SpA, Parma, Italy), берактант (Survanta®, Abbott Laboratories, Inc., Abbott Park, IL).
Предпочтительно модифицированный природный легочный сурфактант является порактантом альфа. Предпочтительно однократная доза сурфактанта находится в диапазоне приблизительно от 20 мг/кг до приблизительно 300 мг/кг, предпочтительно - от 80 до 200 мг/кг.
Конечно, следует понимать, что конкретная доза сурфактанта будет зависеть от факторов, таких как путь введения, возраст и состояние пациента, тяжесть подвергаемого лечению состояния и других факторов, известных специалисту в данной области.
По предпочтительному варианту осуществления изобретения порактант альфа вводят в однократной дозе от 100 до 200 мг/кг.
Антиоксидантные ферменты CuZn-супероксиддисмутаза и каталаза могут обладать различным происхождением и являются коммерчески доступными, например, из Sigma Chemical Co., St Luis, MO, USA.
В другом случае их можно получать известными рекомбинантными способами.
Предпочтительно применяют CuZn-супероксиддисмутазу человека в дозе от 2000 до 10000 Ед/кг, предпочтительно - от 2500 до 8000 Ед/кг, более предпочтительно - от 2500 до 6000 Ед/кг.
Предпочтительно применяют CuZn-супероксиддисмутазу человека из эритроцитов или печени или рекомбинантную CuZn-супероксиддисмутазу человека.
Предпочтительно применяют каталазу человека, вводимую в дозе от 2000 до 4000 Ед/кг, предпочтительно - от 2500 до 3500 Ед/кг, более предпочтительно - 3000 Ед/кг.
Предпочтительно применяют каталазу человека из эритроцитов или печени или рекомбинантную каталазу человека.
При условии анализа ферментов специалист в данной области может определять соответствие между специфической активностью, выраженной в Ед, и мг белка (фермента).
Комбинацию экзогенного легочного сурфактанта с CuZn-супероксиддисмутазой и каталазой в заявленных дозах можно вводить последовательно, раздельно или совместно.
Предпочтительно, когда три компонента вводят совместно, их вводят в качестве фиксированной комбинации.
Таким образом, настоящее изобретение также относится к лекарственному средству, содержащему указанные три активных компонента в качестве фиксированной комбинации в форме фармацевтической композиции, например в форме растворов, дисперсий, суспензий или сухих порошков. Предпочтительно указанные композиции содержат заявленную комбинацию, суспендированную в подходящем физиологически приемлемом растворителе.
Более предпочтительно состав содержит водный раствор, предпочтительно стерильный, который также может содержать буферные средства и другие фармацевтически приемлемые эксципиенты, такие как полисорбат 20, полисорбат 80 или сорбитанмонолаурат, в качестве увлажнителей и хлорид натрия в качестве изотонического средства.
Составы могут находиться в контейнерах для однократной дозы или доз для многократного введения, например запаянных ампулах и сосудах, или их можно хранить в замороженном или высушенном заморозкой (freeze-dried) (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя непосредственно перед применением.
Предпочтительно состав поставляют в качестве стерильной суспензии в буферном физиологическом (0,9% масс./об. хлорида натрия) водном растворе в сосудах для однократной дозы.
По предпочтительному варианту осуществления изобретения состав содержит порактант альфа в концентрации от 40 до 80 мг/мл, предпочтительно - 80 мг/мл.
Введение заявленной комбинации можно осуществлять известным способом, например эндотрахеальной инстилляцией, введением посредством спрея или распылением посредством ультразвукового небулайзера или небулайзера на основе технологии вибрирующего сита, как правило, доступных на рынке.
Предпочтительно заявленную комбинацию вводят эндотрахеально.
В действительности обнаруживали, что при введении данным путем в данных дозах CuZn-супероксиддисмутаза и каталаза не снижают транскрипцию мРНК эндогенных антиоксидантных ферментов.
При введении комбинации посредством эндотрахеальной инстилляции могут подходить различные способы в зависимости от тяжести респираторного дистресс-синдрома. Например, заявленный состав можно вводить посредством эндотрахеальной инстилляции недоношенным детям, подвергающимся постоянной или периодической вентиляции с положительным давлением.
Альтернативно, комбинацию можно вводить совместно с неинвазивной легочной респираторной терапией, включающей введение положительного давления в дыхательных путях. Термин "неинвазивная легочная респираторная терапия" относится к респираторной терапии без применения искусственной вентиляции легких и может включать постоянное положительное давление в дыхательных путях (CPAP), двухфазную вентиляцию в дыхательных путях (BiPAP), синхронизированную перемежающуюся принудительную вентиляцию (SIMV) и т.п. в соответствии со способами и с применением устройств, известных специалисту в данной области.
В конкретном варианте осуществления введение можно осуществлять, как описано в WO 2008/148469, т.е. с применением тонкого катетера, помещенного в трахею, и дыхания пациента, поддерживаемого через специально сконструированные назальные устройства, такие как маски, канюли или трубки в соответствии со способом, известным как назальное постоянное положительное давление в дыхательных путях (nCPAP).
Другие способы доставки включают лаваж, бронхолегочный лаваж и т.п. в соответствии со способами, известными специалисту в данной области.
Объем водного раствора, в котором суспендируют объединенные активные компоненты, будет зависеть от желаемой концентрации.
Предпочтительно объем состава не должен превышать 5,0 мл, предпочтительно - от 4,5 до 2,0 мл, более предпочтительно - от 3,5 до 2,5 мл.
Альтернативно, когда экзогенный легочный сурфактант и два антиоксидантных фермента вводят раздельно, каждый отдельный активный компонент можно составлять раздельно. В данном случае отдельные активные компоненты не должны обязательно принимать в одно и то же время.
В случае раздельного введения состав каждого отдельного активного компонента можно упаковывать в одно и то же время в подходящий контейнер для получения набора.
Таким образом, настоящее изобретение также относится к набору, включающему: a) экзогенный легочный сурфактант и фармацевтически приемлемый носитель или разбавитель в первой стандартной лекарственной форме; b) CuZn-супероксиддисмутазу в однократной дозе от 2000 до 10000 Ед/кг и, необязательно, фармацевтически приемлемый носитель или разбавитель во второй стандартной лекарственной форме; c) каталазу в однократной дозе от 2000 до 4000 Ед/кг и, необязательно, фармацевтически приемлемый носитель или разбавитель в третьей стандартной лекарственной форме; d) контейнеры для хранения указанных первой, второй и третьей лекарственных форм.
По конкретному аспекту супероксиддисмутаза и каталаза могут присутствовать в лекарственной форме для однократного введения, необязательно, с фармацевтически приемлемым носителем или разбавителем.
Предпочтительно первая стандартная лекарственная форма является сосудом для одноразового применения, наполненным 2,5 мл стерильного состава 80 мг/мл порактанта альфа, суспендированного в буферном физиологическом (0,9% масс./об. хлорида натрия) водном растворе.
Комбинация по изобретению, которую можно вводить ребенку после рождения, в соответствии с состояниями, которые должен установить специалист в данной области, пригодна для предотвращения, задержки, облегчения, прекращения или ингибирования развития бронхолегочной дисплазии.
Подходящая дозировка комбинации по изобретению (дозы, частота введения) будет зависеть от возраста пациента и тяжести нарушения, и ее можно легко устанавливать при посещении врача.
Частоту введения дозы можно варьировать, но, как правило, она составляет один раз в 2-3 дня. В других вариантах осуществления пациенту вводят дозу чаще, например каждые 6-8 часов, дважды в сутки или один раз в сутки, или реже, например дважды в неделю или даже один раз в неделю. В других вариантах осуществления пациенту можно вводить дозу чаще вначале схемы лечения и со снижением частоты ближе к концу схемы лечения, например однократно каждый день в течение недели с последующим введением дважды в неделю до конца периода лечения. В зависимости от лекарственной формы, например аэрозоль или сухой порошок по сравнению с жидкой суспензией, пациенту можно вводить дозу непрерывно в течение части или всего периода лечения.
Предпочтительно комбинация по изобретению пригодна для предотвращения развития бронхолегочной дисплазии у недоношенных детей, страдающих тяжелой формой респираторного дистресс-синдрома (RDS).
Однако ее также можно применять для профилактики и/или лечения других заболеваний, относящихся к недостаточности или дисфункции эндогенного сурфактанта, таких как респираторный дистресс-синдром взрослых (ARDS), синдром острого повреждения легких (ALI) и синдром аспирации мекония (MAS).
Следующие примеры иллюстрируют изобретение более подробно.
ПРИМЕР 1 - ОЦЕНКА IN VITRO УТИЛИЗАЦИОННОЙ АКТИВНОСТИ МОДИФИЦИРОВАННЫХ ПРИРОДНЫХ СУРФАКТАНТОВ ПОСЛЕ ДОБАВЛЕНИЯ CuZn-СУПЕРОКСИДДИСМУТАЗЫ, КАТАЛАЗЫ ИЛИ ОБЕИХ
Целью данного исследования in vitro являлась оценка изменения утилизационной активности модифицированных природных легочных сурфактантов после добавления различных количеств CuZn-супероксиддисмутазы человека, каталазы человека или обеих. Применяли четыре модифицированных природных коммерчески доступных легочных сурфактанта:
- Infasurf® (Кальфактант; ONY, Inc. Amherst, NY, USA) является экстрактом легких теленка, содержащим 35 мг/мл фосфолипидов;
- Curosurf® (Порактант; Chiesi SpA., Parma, Italy) является липидным экстрактом измельченной ткани целого легкого свиньи, содержащим 80 мг/мл фосфолипидов.
- Survanta® (Берактант; Abbott Laboratories, Abbott Park, IL, USA) получают из экстракта измельченного легкого быка с добавлением дипальмитоилфосфатидилхолина, триацилглицерина и пальмитиновой кислоты. Он содержит 45 мг/мл фосфолипидов.
- Alveofact® (Бовактант; Boehringer Ingelheim Pharma, Ingelheim, Germany) получают экстракцией липидов из лаважа легких быка, и он содержит 45 мг/мл фосфолипидов.
Cu/Zn-супероксиддисмутазу эритроцитов человека (далее в настоящем документе SOD) и каталазу эритроцитов человека (далее в настоящем документе CAT) получали от Sigma Chemical Co., St. Louis, MO, USA. Дозу SOD выражают в мг. Применяемая SOD обладает специфической активностью 2500-6000 Ед на мг белка (фермента).
Активность SOD и CAT измеряли в выбранных природных сурфактантах. Активность SOD измеряли с применением Superoxide Dismutase Assay Kit® (Cayman Chemical, Ann Arbor, MI, USA) по инструкциям производителя. Для определения радикалов супероксида, получаемых посредством ксантиноксидазы и гипоксантина, в анализе применяют соли тетразолия. Активность SOD оценивали измерением диспропорционирования получаемых радикалов супероксида в 96-луночном планшете с применением спектрофотометра для чтения планшетов с фильтром 450 нм. Одну единицу SOD определяют как количество фермента, необходимое для ингибирования 50% диспропорционирования радикала супероксида. Активность SOD выражают как Ед/мг фосфолипидов.
Активность каталазы определяли с применением Catalase Assay Kit® (Cayman Chemical, Ann Arbor, MI, USA), в котором применяют пероксидную функцию CAT для определения активности фермента. Он основывается на ферментативной реакции с метанолом в оптимальной концентрации H2O2. Получаемый формальдегид измеряют спектрофотометрически с применением 4-амино-3-гидразино-5-меркапто-1,2,4-триазола (Purpald; Aldrich chemical company, Milwaukee, WI, USA) в качестве хромогена. Концентрацию формальдегида в образцах получали из стандартной кривой. Одну единицу активности CAT определяют как количество фермента, вызывающего образование 1,0 нмоль формальдегида в минуту на миллиграмм белка при 25°C. Активность CAT записывали как нмоль/мин/мг фосфолипидов.
Для тестирования утилизационной активности по сравнению с H2O2 одно и то же количество фосфолипидов (4,72 мг = 100 мкмоль фосфолипидов) из каждого природного сурфактанта инкубировали с 25, 50, 100, 250 мкМ H2O2 при 37°C в течение 2 часов. Затем образцы центрифугировали при 16000g в течение 45 минут. Концентрацию H2O2 измеряли посредством контроля образования катиона радикала ABTS [2,2'-азинобис-(3-этилбензотиазолин-6-сульфоновой кислоты)], как описано Casella et al. (Inorg Biochem 2000, 79, 31-40).
Кроме того, тестировали утилизационную активность четырех модифицированных природных легочных сурфактантов после добавления SOD или CAT. В частности, оценивали утилизационную активность 0,60 мл Infasurf®, 0,50 мл Curosurf®, 0,80 мл Survanta® и 0,44 мл Alveofact® после добавления соответственно 1 мг или 2 мг SOD и 3000 Ед или 30000 Ед CAT.
Данные образцы инкубировали с 100 мкМ H2O2 при 37°C в течение 2 часов и затем измеряли концентрацию H2O2, как указано выше.
Результаты добавления SOD представлены на фигуре 1, а результаты после добавления CAT представлены на фигуре 2.
Для оценки потенциального синергического действия SOD и CAT оценивали утилизационную активность 0,60 мл Infasurf, 0,50 мл Curosurf, 0,80 мл Survanta и 0,44 мл Alveofact после добавления 1 мг SOD и 3000 единиц CAT. Результаты представлены на фигуре 3.
Собранные данные выражали как среднее значение и стандартное отклонение. Данные анализировали на наличие статистически значимых различий тестом ANOVA внутри групп и t-критерием Стьюдента между группами. Статистически значимым считали p<0,05.
Как видно из фигуры 1, за добавлением SOD к сурфактантам, как ожидалось, следует повышение утилизационной активности Curosurf®, Survanta® и Alveofact®. Однако, утилизационная активность значимо не варьировалась в диапазоне от 1 до 2 мг SOD.
Неожиданно снижалась утилизационная активность Infasurf. Без ограничения в теории, мы предполагаем, что данное конкретное действие Infasurf® можно объяснять тем, что сверхэкспрессия SOD может приводить к повышению оксидативного стресса через различные механизмы, такие как повышение концентрации H2O2, образование гидроксильного радикала и супероксид-опосредованное ингибирование перекисного окисления мембран, действуя как средство обрыва цепи радикала.
Как видно из фигуры 2, после добавления CAT наблюдали ожидаемое повышение утилизационной активности Infasurf®, Curosurf®, Alveofact® и Survanta®, хотя повышение последнего не достигло уровня статистической значимости.
Однако также в данном случае утилизационная активность значимо не варьировалась в диапазоне от 3000 до 30000 Ед CAT.
В конечном итоге, как видно из фигуры 3, когда к сурфактантам добавляют и SOD, и CAT, наблюдают очень значимое повышение утилизационной активности по сравнению с H2O2 во всех исследуемых сурфактантах. Кроме того, данное повышение, по-видимому, является более высоким, чем наблюдаемое после отдельного добавления SOD и CAT, свидетельствуя о том, что их действие является синергичным.
ПРИМЕР 2 - ОЦЕНКА CUROSURF® IN VIVO В КОМБИНАЦИИ С CuZn-СУПЕРОКСИДДИСМУТАЗОЙ И КАТАЛАЗОЙ
Исследование in vivo проводят для оценки оксидативного стресса в ткани легкого у недоношенных ягнят с RDS, подвергавшихся лечению модифицированным природным легочным сурфактантом Curosurf® после добавления SOD и CAT.
Для исследования оксидативного стресса тканей легкого определяют общие гидропероксиды (TH), белковые продукты усовершенствованного окисления (AOPP), изопростан (F2-IP) и несвязанное с трансферрином железо (NTBI) в бронхиальной аспирационной жидкости (BAL).
Изучали 12 недоношенных ягнят (внутриутробный возраст 126+3 дней) с RDS. Их интубируют непосредственно после доставки. Исходными настройками вентилятора являются следующие: FiO2 100%, RR 60/мин, PIP 16-18 см вод. ст., PEEP 4 см вод. ст. Затем регулируют искусственную вентиляцию легких для поддержания pH>7,20, pCO2 35-65 мм рт. ст., pO2 55-80 мм рт. ст., SaO2 85-95%). Животных оснащают приборами и рандомизируют для получения природного экзогенного сурфактанта (Curosurf®, Chiesi, Parma, Italy: 200 мг/кг) или того же количества сурфактанта в комбинации с SOD (1 мг/кг) и CAT (3000 Ед/кг).
Период исследования составляет 6 часов. Через заданные интервалы записывают изменения pH, pCO2, pO2, SaO2 и BE, настройки вентилятора, показатели внешнего дыхания (дыхательный объем, растяжимость легкого, сопротивление дыхательных путей), среднее системное и легочное давление.
Для исследования оксидативного стресса тканей легких в бронхиальную аспирационную жидкость добавляют общие гидропероксиды (TH), белковые продукты усовершенствованного окисления (AOPP), изопростан (F2-IP) и несвязанное с трансферрином железо (NTBI). TH измеряют с набором d-ROMs Kit (Diacron srl, Italy) с применением спектрофотометрического способа, описанного в Buonocore G et al. Pediatr Res 2000, 47, 221-224.
Результаты выражают в общепринятых единицах (единицы Карр: значение 1 единицы Карр равно концентрации 0,08 мг/дл пероксида водорода). AOPP измеряют способом, приведенным в Witko-Sarsat V et al. Kidney Int 1996, 49, 1304-1313, с применением спектрофотометрии на микроспектрофотометре для чтения планшетов. Концентрацию AOPP выражают как мкмоль/л эквивалентов хлорамина-T. Уровни NTBI определяют ВЭЖХ с применением способа, описываемого Kime et al. Clin Sci 1996, 91, 633-638, частично модифицированного. Оценивают F2-IP в BAL после добавления бутилированного гидрокситолуола (BHT) для предотвращения окисления при обработке, как ранее описывали в Grosso S et al. Brain Dev 2008, 30, 391-395.
F2-IP определяют в едином растворе. Добавляют этанол для удаления осажденных белков и добавляют ацетатный буфер до достижения pH 4,0 для определения 15-F2t-IsoP. Образцы очищают от метаболитов с помощью картриджей с C18 и диоксидом кремния Sep-Paks (Waters Co., Milford, MA) до применения колориметрического иммуноферментного анализа (Cayman Chemical, Ann Arbor, MI). Антитело является высокоспецифичным для 15-F2t-IsoP (8-Iso PGF2). Диапазон стандартной кривой составляет от 3,9 до 500 пг/мл, и предел чувствительности составляет 2 пг/мл.
Образцы бронхиального аспирата получали из животных следующим способом: вливают 1 мл/кг стерильного 0,9% физиологического раствора с применением шприца 10 мл через 8F калибровочный катетер для кормления, помещенный в эндотрахеальную трубку таким образом, что конец выступает на 1 см за дистальный конец трубки. Физиологический раствор вливают и немедленно отсасывают обратно в шприц.
Все образцы очищают посредством центрифугирования (1000 об/мин ×5 мин) и немедленно замораживают супернатант при -70°C, и хранят для последующего анализа. Образцы бронхиального аспирата получают из каждого животного до введения сурфактанта и через 1, 2, 4 и 6 часов после его введения.
Животные убивали передозировкой пентобарбитала. После смерти осторожно вскрывают грудную клетку и удаляют трахею и легкие, и помещают в ванночку с буферным 10% формалином в течение 24 часов. Получают два случайных образца легких из верхней и нижней долей обоих легких. Для подготовки тканей к заливке в парафин применяют общепринятые способы. Срезы толщиной пять микрометров окрашивают гематоксилин-эозином, и два патолога вслепую осуществляют микроскопическое исследование.
Собранные данные анализировали и выражали как среднее значение и стандартное отклонение. Данные анализировали на наличие статистически значимых различий тестом ANOVA внутри групп и t-критерием Стьюдента между группами. Статистически значимым считали p<0,05.
Результаты подтверждали синергичное взаимодействие комбинации сурфактанта с каталазой в тестируемых дозах.
1. Применение экзогенного легочного сурфактанта в комбинации с CuZn-супероксиддисмутазой в однократной дозе от 2000 до 10000 Ед/кг и каталазой в однократной дозе от 2000 до 4000 Ед/кг для предотвращения бронхолегочной дисплазии (BPD).
2. Применение по п.1, где указанный сурфактант является модифицированным природным легочным сурфактантом, выбранным из группы, состоящей из порактанта альфа, кальфактанта, бовактанта и берактанта.
3. Применение по п.2, где указанный сурфактант является порактантом альфа.
4. Применение по п.3, где порактант альфа вводят в однократной дозе от 100 до 200 мг/кг.
5. Применение по любому из пп.1-4, где однократная доза CuZn-супероксиддисмутазы составляет от 2500 до 6000 Ед/кг.
6. Применение по любому из пп.1-4, где однократная доза каталазы составляет от 2500 до 3500 Ед/кг.
7. Комбинация:экзогенного легочного сурфактанта;CuZn-супероксиддисмутазы в однократной дозе от 2000 до 10000 Ед/кг; икаталазы в однократной дозе от 2000 до 4000 Ед/кгдля одновременного, последовательного или раздельного применения в предотвращении бронхолегочной дисплазии (BPD).
8. Лекарственное средство для предотвращения бронхолегочной дисплазии (BPD), содержащее:экзогенный легочный сурфактант;CuZn-супероксиддисмутазу в однократной дозе от 2000 до 10000 Ед/кг;и каталазу в однократной дозе от 2000 до 4000 Ед/кг в качестве фиксированной комбинации.
9. Лекарственное средство по п.8, где сурфактант является модифицированным природным сурфактантом, выбранным из группы, состоящей из порактанта альфа, кальфактанта, бовактанта и берактанта.
10. Лекарственное средство по п.9, где сурфактант является порактантом альфа.
11. Лекарственное средство по любому из пп.8-10 в форме, подходящей для ингаляции или интратрахеального введения.
12. Лекарственное средство по п.11 в форме стерильной суспензии в буферном физиологическом (0,9% масс./об. хлорида натрия) водном растворе.
13. Набор для предотвращения бронхолегочной дисплазии, включающий: a) экзогенный легочный сурфактант и фармацевтически приемлемый носитель или разбавитель в первой стандартной лекарственной форме; b) CuZn-супероксиддисмутазу в однократной дозе от 2000 до 10000 Ед/кг и, необязательно, фармацевтически приемлемый носитель или разбавитель во второй стандартной лекарственной форме; с) каталазу в однократной дозе от 2000 до 4000 Ед/кг и, необязательно, фармацевтически приемлемый носитель или разбавитель в третьей стандартной лекарственной форме; d) контейнер для хранения указанных первой, второй и третьей лекарственных форм.
14. Набор по п.13, где сурфактант является модифицированным природным легочным сурфактантом, выбранным из