Стабильные фармацевтические композиции и способы их применения
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой фармацевтическую композицию для лечения или предупреждения заболевания, связанного с сердечно-сосудистой системой, у субъекта, нуждающегося в этом, включающую, по меньшей мере, 95% этилэйкозапентаеноата (этил-ЕРА), заключенного в оболочку капсулы, включающую желатин, глицерин, сорбит, мальтит и очищенную воду, где композиция имеет исходное пероксидное число не более 5 мэкв/кг и при хранении композиции при 25°C и относительной влажности (ОВ) 60% в течение 6 месяцев композиция имеет второе пероксидное число не более 8 мэкв/кг. Изобретение также относится к способу лечения или предупреждения заболеваний, связанных с сердечно-сосудистой системой, включающему введение субъекту, нуждающемуся в этом, терапевтически эффективного количества такой композиции. 2 н. и 16 з.п. ф-лы, 4 пр., 4 табл., 3 ил.
Реферат
ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
Настоящая заявка претендует на приоритет предварительной заявки на патент США 61/173763, поданной 29 апреля 2009, содержание которой полностью включено в настоящую заявку посредством ссылки.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Сложные эфиры смесей омега-3 жирных кислот, как правило, помещают в желатиновые капсулы типа 2a, включающие желатин (~43,4%), глицерин (~20%) и воду (~36,6%), что не вызывает проблем со стабильностью на протяжении всего срока хранения. В то же время для инкапсулирования реакционноспособных ингредиентов применяли химически модифицированные желатины, например сукцинированный/сукцинилированный желатин, причем применение таких производных желатина не получило одобрения в США и на рынках других стран.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы изобретения неожиданно обнаружили, что эйкозапентаеновая кислота (EPA) высокой степени чистоты в большей степени подвержена окислительному разрушению, чем смеси этиловых эфиров омега-3-кислот. В различных вариантах осуществления настоящее изобретение относится к фармацевтическим композициям, включающим жирную кислоту или ее производное, заключенные в оболочку капсулы, которая противостоит, затрудняет, ослабляет или предотвращает окисление жирной кислоты или производного жирной кислоты, например, в большей степени, чем это обеспечивает стандартная оболочка капсулы типа IIa. В родственном варианте осуществления в число жирных кислот входят эйкозапентаеновая кислота (EPA) или производные EPA, например этил эйкозапентаеноат (этил-EPA или E-EPA). В другом варианте осуществления в число жирных кислот входит ультрачистая EPA.
В одном из вариантов осуществления изобретение относится к фармацевтической композиции, включающей ультрачистую EPA, инкапсулированную в оболочку капсулы, где ультрачистая EPA имеет исходное пероксидное число не более 5 мэкв/кг, и при хранении композиции при 23°C и относительной влажности 50% в течение определенного периода времени вторичное пероксидное число ультрачистой EPA не превышает примерно 20 мэкв/кг.
В других вариантах осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую EPA), инкапсулированную в оболочку капсулы, включающую пленкообразующий материал и гигроскопичный пластификатор, где соотношение масс пленкообразующего материала и гигроскопичного пластификатора составляет не менее чем примерно 2,5:1. Кроме того, оболочка капсулы может необязательно включать негигроскопичный пластификатор. В одном из вариантов осуществления капсула не содержит химически модифицированного желатина, например сукцинированного или сукцинилированного желатина.
В еще одной группе вариантов осуществления настоящее изобретение относится к способам лечения или предупреждения заболеваний, связанных с сердечно-сосудистой системой, с применением композиций по настоящему изобретению.
Эти и другие варианты осуществления настоящего изобретения будут более подробно раскрыты ниже по тексту заявки.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
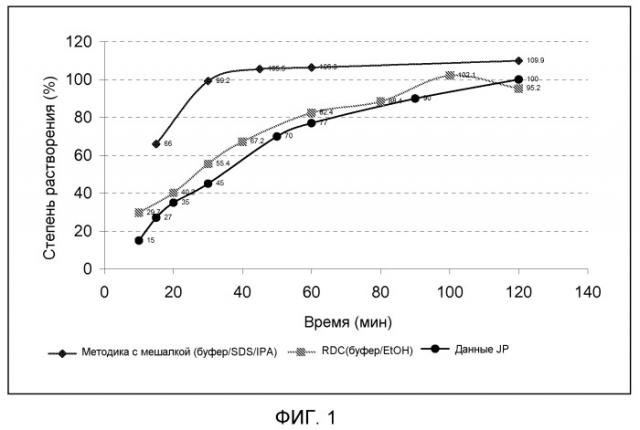
На фиг.1 показан профиль растворения композиции, заключенной в капсулу по настоящему изобретению, содержащей ~500 мг E-EPA, по сравнению с композицией, содержащей EPA в капсуле из сукцинированного желатина.
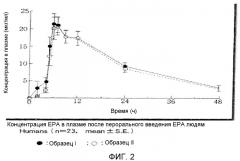
На фиг.2 показана биодоступность 300 мг EPA в капсулах из сукцинированного желатина.
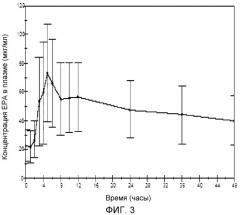
На фиг.3 показана биодоступность композиции в капсулах AMR101 по настоящему изобретению, содержащей ~500 мг E-EPA.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Хотя имеется возможность воплощения настоящего изобретения в различных формах, приведенное ниже описание ряда вариантов осуществления осуществлено с пониманием того, что настоящий текст следует рассматривать как описание типовых вариантов осуществления изобретения, и он не преследует цель ограничить изобретение конкретными вариантами осуществления, приведенными в описании. Разделы текста созданы только для удобства, и их не следует считать каким-либо ограничением объема изобретения. Варианты осуществления, приведенные в любых разделах, могут быть скомбинированы с вариантами осуществления, приведенными в любых других разделах.
Считается, что использованные в настоящей заявке численные значения, описывающие различные количественные величины, если иное не указано в явном виде, являются приближенными, как если бы минимальные и максимальные значения указанных диапазонов предварялись словом «примерно». Вследствие этого могут применяться незначительные отклонения от указанных величин для достижения практически тех же результатов, как и в случае указанных величин. Кроме того, приведенные диапазоны считаются непрерывными и включают все значения между указанными минимальным и максимальным значением, а также любые диапазоны, которые могут быть образованы такими значениями. Помимо этого в настоящем описании раскрыты все без исключения соотношения (и диапазоны этих соотношений), которые могут быть получены при делении приведенных числовых значений на другие приведенные числовые значения. Соответственно, специалист в данной области поймет, что многие из таких соотношений, диапазонов и диапазонов соотношений могут быть однозначно получены из приведенных в заявке численных значений, и во всех случаях эти соотношения, диапазоны и диапазоны соотношений представляют собой различные варианты осуществления настоящего изобретения.
Полиненасыщенные жирные кислоты
В одном из вариантов осуществления композиции по настоящему изобретению включают в качестве действующего ингредиента полиненасыщенные жирные кислоты. В другом варианте осуществления композиции по настоящему изобретению включают в качестве действующего ингредиента EPA. Термин «EPA» в настоящей заявке относится к эйкозанпентаеновой кислоте (например, эйкоза-5,8,11,14,17-пентаеновой кислоте) и/или к ее фармацевтически приемлемым эфирам, производным, конъюгатам или солям или смесям любых из перечисленных соединений.
В одном из вариантов осуществления EPA включает полностью цис эйкоза-5,8,11,14,17-пентаеновую кислоту. В другом варианте осуществления EPA имеет форму эфира эйкозанпентаеновой кислоты. В следующем варианте осуществления EPA включает C1-C5 алкиловый эфир EPA. В другом варианте осуществления EPA включает этиловый эфир эйкозанпентаеновой кислоты, метиловый эфир эйкозанпентаеновой кислоты, пропиловый эфир эйкозанпентаеновой кислоты или бутиловый эфир эйкозанпентаеновой кислоты. В еще одном варианте осуществления EPA включает этиловый эфир полностью цис эйкоза-5,8,11,14,17-пентаеновой кислоты.
В других вариантах осуществления EPA включает этил-EPA, литиевую соль EPA, моно-, ди- или триглицериды EPA, или любые другие сложные эфиры или соли EPA, или EPA в форме свободной кислоты. EPA может также иметь форму 2-замещенного производного или другого производного, для которого характерна меньшая скорость окисления, но отсутствуют другие существенные изменения его биологического действия.
Термин «фармацевтически приемлемый» в контексте настоящего изобретения означает, что вещество, определяемое этим термином, не оказывает неприемлемого токсического действия на субъекта и не вступает во взаимодействие с другими компонентами композиции.
В одном из вариантов осуществления EPA, входящая в композицию по настоящему изобретению, включает ультрачистую EPA. Термин «ультрачистый», используемый в настоящей заявке в отношении EPA, относится к композиции, содержащей не менее 96 масс.% EPA (где термин «EPA» определен и проиллюстрирован в тексте заявки). Ультрачистая EPA может включать еще более чистую EPA, например содержащую не менее 97 масс.% EPA или не менее 98 масс.% EPA, где EPA означает любую форму EPA, описанную в тексте заявки. Ультрачистую EPA можно дополнительно определить (например, профилем загрязнений) в соответствии с любым из описаний EPA, приведенных в тексте заявки.
В других вариантах осуществления EPA присутствует в композиции по настоящему изобретению в количестве от примерно 50 мг до примерно 5000 мг, от примерно 75 мг до примерно 2500 мг, от примерно 100 мг до примерно 1000 мг, например, примерно 75 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 225 мг, примерно 250 мг, примерно 275 мг, примерно 300 мг, примерно 325 мг, примерно 350 мг, примерно 375 мг, примерно 400 мг, примерно 425 мг, примерно 450 мг, примерно 475 мг, примерно 500 мг, примерно 525 мг, примерно 550 мг, примерно 575 мг, примерно 600, примерно 625 мг, примерно 650 мг, примерно 675 мг, примерно 700 мг, примерно 725 мг, примерно 750 мг, примерно 775 мг, примерно 800 мг, примерно 825 мг, примерно 850 мг, примерно 875 мг, примерно 900 мг, примерно 925 мг, примерно 950 мг, примерно 975 мг, примерно 1000 мг, примерно 1025 мг, примерно 1050 мг, примерно 1075 мг, примерно 1100 мг, примерно 1125 мг, примерно 1150 мг, примерно 1175 мг, примерно 1200 мг, примерно 1225 мг, примерно 1250 мг, примерно 1275 мг, примерно 1300 мг, примерно 1325 мг, примерно 1350 мг, примерно 1375 мг, примерно 1400, примерно 1425 мг, примерно 1450 мг, примерно 1475 мг, примерно 1500 мг, примерно 1525 мг, примерно 1550 мг, примерно 1575 мг, примерно 1600 мг, примерно 1625 мг, примерно 1650 мг, примерно 1675 мг, примерно 1700 мг, примерно 1725 мг, примерно 1750 мг, примерно 1775 мг, примерно 1800 мг, примерно 1825 мг, примерно 1850 мг, примерно 1875 мг, примерно 1900 мг, примерно 1925 мг, примерно 1950 мг, примерно 1975 мг, примерно 2000 мг, примерно 2025 мг, примерно 2050 мг, примерно 2075 мг, примерно 2100 мг, примерно 2125 мг, примерно 2150 мг, примерно 2175 мг, примерно 2200 мг, примерно 2225 мг, примерно 2250 мг, примерно 2275 мг, примерно 2300 мг, примерно 2325 мг, примерно 2350 мг, примерно 2375 мг, примерно 2400 мг, примерно 2425 мг, примерно 2450 мг, примерно 2475 мг или примерно 2500 мг.
В различных вариантах осуществления в EPA (например, E-EPA или ультрачистой E-EPA) могут присутствовать один или несколько антиоксидантов. Не ограничивающие примеры подходящих антиоксидантов включают токоферол, лецитин, лимонную кислоту и/или аскорбиновую кислоту. Один или несколько антиоксидантов, если их присутствие желательно, как правило, содержатся в EPA в количестве от примерно 0,01% до примерно 0,1% по массе или от примерно 0,025% до примерно 0,05% по массе.
В одном из вариантов осуществления композиция по настоящему изобретению в общей сложности содержит не более примерно 10 масс.%, не более примерно 9 масс.%, не более примерно 8 масс.%, не более примерно 7 масс.%, не более примерно 6 масс.%, не более примерно 5 масс.%, не более примерно 4 масс.%, не более примерно 3 масс.%, не более примерно 2 масс.%, не более примерно 1 масс.%, не более примерно 0,5 масс.% докозагексаеновой кислоты или ее производных, например, E-DHA, от общего количества жирных кислот, если DHA или ее производные вообще присутствуют в композиции. В другом варианте осуществления композиция по настоящему изобретению практически не содержит докозагексаеновой кислоты или ее производных, например E-DHA. В еще одном варианте осуществления композиция по настоящему изобретению не содержит докозагексаеновой кислоты или E-DHA.
В другом варианте осуществления EPA присутствует в количестве по меньшей мере примерно 60 масс.%, по меньшей мере примерно 70 масс.%, по меньшей мере примерно 80 масс.%, по меньшей мере примерно 90 масс.%, по меньшей мере примерно 95 масс.%, по меньшей мере примерно 97 масс.%, по меньшей мере примерно 98 масс.%, по меньшей мере примерно 99 масс.% или 100 масс.% от общего количества всех жирных кислот, присутствующих в композиции по настоящему изобретению.
В другом варианте осуществления композиция по настоящему изобретению содержит в общей сложности менее 30 масс.%, менее 20 масс.%, менее 10 масс.%, менее 9 масс.%, менее 8 масс.%, менее 7 масс.%, менее 6 масс.%, менее 5 масс.%, менее 4 масс.%, менее 3 масс.%, менее 2 масс.%, менее 1 масс.%, менее 0,5 масс.% или менее 0,25 масс.% от общей массы композиции или от общего содержания жирных кислот, любых жирных кислот, которые не являются EPA или ее производными. Иллюстративные примеры «жирных кислот, не являющихся EPA», включают линоленовую кислоту (LA) или ее производные, например этиллиноленовую кислоту, арахидоновую кислоту (AA) или ее производные, например этил-AA, докозагексаеновую кислоту (DHA) или ее производные, например этил-DHA, альфа-линоленовую кислоту (ALA) или ее производные, например этил-ALA, стеаридоновую (6,9,12,15-октатетраеновую кислоту) (STA) или ее производные, например этил-STA, эйкозатриеновую кислоту (ETA) или ее производные, например этил-ETA и/или докозапентаеновую кислоту (DPA) или ее производные, например этил-DPA.
В другом варианте осуществления композиция по настоящему изобретению обладает одним или несколькими из перечисленных ниже признаков: (a) этиловый эфир эйкозапентаеновой кислоты составляет по меньшей мере 96 масс.%, по меньшей мере 97 масс.% или по меньшей мере 98 масс.% от всех жирных кислот, присутствующих в композиции; (b) композиция в общей сложности содержит не более 4 масс.%, не более 3 масс.% или не более 2 масс.% жирных кислот, которые не являются этиловым эфиром эйкозапентаеновой кислоты; (c) композиция содержит не более 0,6 масс.%, 0,5 масс.% или 0,4 масс.% любой отдельной жирной кислоты, которая не является этиловым эфиром эйкозапентаеновой кислоты; (d) композиция имеет показатель преломления (при 20°C) от примерно 1 до примерно 2, от примерно 1,2 до примерно 1,8 или от примерно 1,4 до примерно 1,5; (e) композиция имеет плотность (при 20°C) от примерно 0,8 до примерно 1,0, от примерно 0,85 до примерно 0,95 или от примерно 0,9 до примерно 0,92; (f) композиция содержит не более 20, 15 или 10 частей на млн тяжелых металлов; (g) композиция содержит не более 5, 4, 3 или 2 частей на млн соединений мышьяка и/или (h) пероксидное число композиции составляет не более 5, 4, 3 или 2 мэкв/кг.
В другом варианте осуществления композиция, применимая в настоящем изобретении, включает, состоит в основном из или состоит из, по меньшей мере, 95 масс.% этил эйкозапентаеноата (EPA-E), от примерно 0,2 масс.% до примерно 0,5 масс.% этил октадекатетраеноата (ODTA-E), от примерно 0,05 масс.% до примерно 0,25 масс.% этил нонадекапентаеноата (NDPA-E), от примерно 0,2 масс.% до примерно 0,45 масс.% этил арахидоната (AA-E), от примерно 0,3 масс.% до примерно 0,5 масс.% этил эйкозатетраеноата (ETA-E) и от примерно 0,05 масс.% до примерно 0,32 масс.% этилгенэйкозапентаеноата (HPA-E). В другом варианте осуществления композиция находится в оболочке капсулы. В еще одном варианте осуществления оболочка капсулы не содержит химически модифицированного желатина.
В следующем варианте осуществления композиция, применимая в настоящем изобретении, включает, состоит в основном из или состоит из, как минимум, 95, 96 или 97 масс.% этил эйкозапентаеноата, от примерно 0,2 масс.% до примерно 0,5 масс.% этил октадекатетраеноата, от примерно 0,05 масс.% до примерно 0,25 масс.% этил нонадекапентаеноата, от примерно 0,2 масс.% до примерно 0,45 масс.% этил арахидоната, от примерно 0,3 масс.% до примерно 0,5 масс.% этил эйкозатетраеноата и от примерно 0,05 масс.% до примерно 0,32 масс.% этил генэйкозапентаеноата. Необязательно, композиция содержит не более примерно 0,06 масс.%, примерно 0,05 масс.% или примерно 0,04 масс.% DHA или ее производных, например этил-DHA. В одном из вариантов осуществления композиция практически не содержит или не содержит DHA или ее производных, например этил-DHA. Кроме того, композиция необязательно включает один или несколько антиоксидантов (например, токоферол) в количестве, не превышающем примерно 0,5% или не превышающем 0,05%. В другом варианте осуществления композиция включает от примерно 0,05% до примерно 0,4%, например, приблизительно 0,2 масс.% токоферола. В другом варианте осуществления от примерно 500 мг до примерно 1 г композиции заключено в оболочку капсулы. В еще одном варианте осуществления оболочка капсулы не содержит химически модифицированного желатина.
В следующем варианте осуществления композиция, применимая в настоящем изобретении, включает, состоит в основном из или состоит из, как минимум, 96 масс.% этил эйкозапентаеноата, от примерно 0,22 масс.% до примерно 0,4 масс.% этил октадекатетраеноата, от примерно 0,075 масс.% до примерно 0,20 масс.% этил нонадекапентаеноата, от примерно 0,25 масс.% до примерно 0,40 масс.% этил арахидоната, от примерно 0,3 масс.% до примерно 0,4 масс.% этил эйкозатетраеноата и от примерно 0,075 масс.% до примерно 0,25 масс.% этил генэйкозапентаеноата. Необязательно, композиция содержит не более примерно 0,06 масс.%, примерно 0,05 масс.% или примерно 0,04 масс.% DHA или ее производных, например этил-DHA. В одном из вариантов осуществления композиция практически не содержит или не содержит DHA или ее производных, например этил-DHA. Кроме того, композиция необязательно включает один или несколько антиоксидантов (например, токоферол) в количестве, не превышающем примерно 0,5% или не превышающем 0,05%. В другом варианте осуществления композиция включает от примерно 0,05% до примерно 0,4%, например, приблизительно 0,2 масс.% токоферола. В другом варианте осуществления изобретение относится к дозированной форме, включающей от примерно 500 мг до примерно 1 г описанной выше композиции в оболочке капсулы. В одном из вариантов осуществления эта дозированная форма представляет собой капсулу, содержащую гель или жидкость, которая упакована в блистерную упаковку от примерно 1 до примерно 20 капсул на лист.
В еще одном варианте осуществления композиция, применимая в настоящем изобретении, включает, состоит в основном из или состоит из, по меньшей мере, 96, 97 или 98 масс.% этил эйкозапентаеноата, от примерно 0,25 масс.% до примерно 0,38 масс.% этил октадекатетраеноата, от примерно 0,10 масс.% до примерно 0,15 масс.% этил нонадекапентаеноата, от примерно 0,25 масс.% до примерно 0,35 масс.% этил арахидоната, от примерно 0,31 масс.% до примерно 0,38 масс.% этил эйкозатетраеноата и от примерно 0,08 масс.% до примерно 0,20 масс.% этил генэйкозапентаеноата. Необязательно, композиция содержит не более примерно 0,06 масс.%, примерно 0,05 масс.% или примерно 0,04 масс.% DHA или ее производных, например этил-DHA. В одном из вариантов осуществления композиция практически не содержит или не содержит DHA или ее производных, например этил-DHA. Кроме того, композиция необязательно включает один или несколько антиоксидантов (например, токоферол) в количестве, не превышающем примерно 0,5% или не превышающем 0,05%. В другом варианте осуществления композиция включает от примерно 0,05% до примерно 0,4%, например, приблизительно 0,2 масс.% токоферола. В другом варианте осуществления изобретение относится к дозированной форме, включающей от примерно 500 мг до примерно 1 г описанной выше композиции в оболочке капсулы. В другом варианте осуществления эта оболочка капсулы не содержит химически модифицированного желатина.
В различных вариантах осуществления изобретение относится к полиненасыщенной жирной кислоте, например EPA (например, E-EPA или ультрачистой E-EPA), инкапсулированной в оболочку фармацевтической капсулы. В одном из вариантов осуществления капсула будет препятствовать, затруднять, ослаблять или предотвращать окисление жирной кислоты или производного жирной кислоты. В другом варианте осуществления капсула будет препятствовать, затруднять, ослаблять или предотвращать окисление полиненасыщенной жирной кислоты или ее производного в большей степени, чем стандартная желатиновая капсула типа IIa. В еще одном варианте осуществления капсула не содержит химически модифицированного желатина, например сукцинированного, сукцинилированного, фталированного, карбанилированного и/или фенол карбанилированного желатина.
В другом варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, описанной в настоящем изобретении и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, причем при хранении композиции при 23°C и относительной влажности 50% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число ультрачистой EPA не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
«Исходное пероксидное число» и «вторичное пероксидное число» могут быть измерены любым подходящим способом, например с применением нормативных методик U.S, PhEur или JP. Как правило, готовят большое количество инкапсулированных композиций EPA, где каждую композицию, содержащую EPA, инкапсулируют примерно в одно и то же время. Сразу же после изготовления из полученной партии отбирают одну или несколько капсул, капсулы открывают и измеряют пероксидное число EPA, получая среднее исходное пероксидное число. Примерно в это же время из общей партии отбирают вторую группу образцов, состоящую из одной или нескольких капсул, и помещают их в желаемые условия хранения на желаемый период времени. В конце желаемого периода времени капсулы открывают и практически сразу же после этого определяют пероксидное число EPA, получая среднее значение вторичного пероксидного числа. Затем можно осуществить сравнение исходного и вторичного пероксидного чисел. В одном из вариантов осуществления «исходное пероксидное число» и «вторичное пероксидное число» определяют с использованием большого числа единиц дозированной лекарственной формы инкапсулированной EPA, где каждая из единиц дозированной лекарственной формы была инкапсулирована (т.е. капсула была заполнена EPA и запечатана) в течение одного и того же 60-дневного периода, одного и того же 30-дневного периода, одного и того же 20-дневного периода, одного и того же 10-дневного периода, одного и того же 5-дневного периода или одного и того же 1-дневного периода.
В другом варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, описанной в настоящем изобретении и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, причем при хранении композиции при 25°C и относительной влажности 60% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число указанной композиции не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
В следующем варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, описанной в настоящем изобретении, и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, причем при хранении композиции при 30°C и относительной влажности 65% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число указанной композиции не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
В следующем варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, описанной в настоящем изобретении, и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, причем при хранении композиции при 40°C и относительной влажности 75% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число указанной композиции не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
В еще одном варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, где капсула включает пленкообразующий материал и пластификатор в массовом соотношении не менее 1,75:1 и где при хранении композиции при 23°C и относительной влажности 50% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число указанной композиции не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
В другом варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, где капсула включает пленкообразующий материал и пластификатор в массовом соотношении не менее 1,75:1 и где при хранении композиции при 25°C и относительной влажности 60% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число указанной композиции не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
В следующем варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, где капсула включает пленкообразующий материал и пластификатор в массовом соотношении не менее 1,75:1 и где при хранении композиции при 30°C и относительной влажности 65% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число указанной композиции не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
В еще одном варианте осуществления изобретение относится к фармацевтической композиции, включающей EPA (например, E-EPA или ультрачистую E-EPA), инкапсулированной в оболочку капсулы, и имеющей исходное пероксидное число не более примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг, где капсула включает пленкообразующий материал и пластификатор в массовом соотношении не менее 1,75:1 и где при хранении композиции при 40°C и относительной влажности 75% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, вторичное пероксидное число указанной композиции не превышает примерно 25 мэкв/кг, примерно 24 мэкв/кг, примерно 23 мэкв/кг, примерно 22 мэкв/кг, примерно 21 мэкв/кг, примерно 20 мэкв/кг, примерно 19 мэкв/кг, примерно 18 мэкв/кг, примерно 17 мэкв/кг, примерно 16 мэкв/кг, примерно 15 мэкв/кг, примерно 14 мэкв/кг, примерно 13 мэкв/кг, примерно 12 мэкв/кг, примерно 11 мэкв/кг, примерно 10 мэкв/кг, примерно 9 мэкв/кг, примерно 8 мэкв/кг, примерно 7 мэкв/кг, примерно 6 мэкв/кг, примерно 5 мэкв/кг, примерно 4 мэкв/кг, примерно 3 мэкв/кг или примерно 2 мэкв/кг.
В другом варианте осуществления изобретение относится к фармацевтической композиции, включающей инкапсулированную EPA (например, E-EPA или ультрачистую E-EPA), содержащую указанное на этикете количество (т.е. исходное количество) EPA или E-EPA, где в случае хранения композиции при 23°C и относительной влажности 50% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, указанная композиция содержит, как минимум, примерно 97 масс.%, примерно 98 масс.%, примерно 99 масс.%, примерно 99,5 масс.%, примерно 99,7 масс.%, примерно 99,9 масс.% или практически все или 100 масс.% указанного на этикетке количества EPA или E-EPA.
В другом варианте осуществления изобретение относится к фармацевтической композиции, включающей инкапсулированную EPA (например, E-EPA или ультрачистую E-EPA), содержащую указанное на этикете количество (т.е. исходное количество) EPA или E-EPA, где в случае хранения композиции при 25°C и относительной влажности 60% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, указанная композиция содержит, как минимум, примерно 97 масс.%, примерно 98 масс.%, примерно 99 масс.%, примерно 99,5 масс.%, примерно 99,7 масс.%, примерно 99,9 масс.% или практически все или 100 масс.% указанного на этикетке количества EPA или E-EPA.
В следующем варианте осуществления изобретение относится к фармацевтической композиции, включающей инкапсулированную EPA (например, E-EPA или ультрачистую E-EPA), содержащую указанное на этикете количество EPA или E-EPA, где в случае хранения композиции при 30°C и относительной влажности 65% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, указанная композиция содержит, как минимум, примерно 97 масс.%, примерно 98 масс.%, примерно 99 масс.%, примерно 99,5 масс.%, примерно 99,7 масс.%, примерно 99,9 масс.% или практически все или 100 масс.% указанного на этикетке количества EPA или E-EPA.
В еще одном варианте осуществления изобретение относится к фармацевтической композиции, включающей инкапсулированную EPA (например, E-EPA или ультрачистую E-EPA), содержащую указанное на этикете количество EPA или E-EPA, где в случае хранения композиции при 40°C и относительной влажности 75% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, указанная композиция содержит, как минимум, примерно 97 масс.%, примерно 98 масс.%, примерно 99 масс.%, примерно 99,5 масс.%, примерно 99,7 масс.%, примерно 99,8 масс.%, примерно 99,9 масс.% или практически все или 100 масс.% указанного на этикетке количества EPA или E-EPA.
В другом варианте осуществления изобретение относится к фармацевтической композиции, включающей инкапсулированную EPA, содержащей указанное на этикетке количество EPA или E-EPA, где при хранении композиции при 23°C и относительной влажности 50% в течение периода, равного примерно 1, примерно 2, примерно 3, примерно 4, примерно 5, примерно 6, примерно 7, примерно 8, примерно 9, примерно 10, примерно 11, примерно 12, примерно 13, примерно 14, примерно 15, примерно 16, примерно 17, примерно 18, примерно 19, примерно 20, примерно 21, примерно 22, примерно 23 или примерно 24 месяцам, указанная композиция содержит не более примерно 0,5%, не более примерно 0,25%, не более примерно 0,15%, не более примерно 0,125%, не более примерно 0,1%, не более примерно 0,075%, не более примерно 0,05% или практически не содержит продуктов распада и/или конкретно оговоренных продуктов распада. Термин «продукт распада» в контексте настоящей заявки означает «примесь, возникшую в результате химических превращений в композиции, произошедших при производстве и/или хранении композиции под действием, например