Способ получения (4е)-тридец-4-ен-1-илацетата
Иллюстрации
Показать всеИзобретение относится к области органической химии, в частности к способу получения (4E)-тридец-4-ен-1-илацетата. (4E)-Тридец-4-ен-1-илацетат является половым феромоном томатной моли (Keiferia lycopersicella), опасного вредителя пасленовых культур. Результаты изобретения могут быть использованы в химии и сельском хозяйстве. Способ получения (4E)-тридец-4-ен-1-илацетата включает алкилирование малонового эфира (E)-1,3-дихлорпропеном с получением диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата, декарбалкоксилирование диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата с получением этил(4E)-5-хлорпент-4-еноата, Fe-катализируемое кросс-сочетание этил(4E)-5-хлорпент-4-еноата с октилмагнийбромидом с получением этил(4E)-тридец-4-еноата, восстановление этил(4E)-тридец-4-еноата с получением (4E)-тридец-4-ен-1-ола, ацетилирование (4E)-тридец-4-ен-1-ола с получением (4E)-тридец-4-ен-1-илацетата, согласно изобретению Fe-катализируемое кросс-сочетание этил(4E)-5-хлорпент-4-еноата с октилмагнийбромидом с получением этил(4E)-тридец-4-еноата осуществляется в присутствии катализатора Fe(acac)2Cl в смеси тетрагидрофурана и N-метилпирролидона при следующем мольном соотношении реагентов [(этил(4E)-5-хлорпент-4-еноат]:[октилмагнийбромид]:[Fe(acac)2Cl]:[тетрагидрофуран]:[N-метилпирролидон]=1:1.15:0.01:12:7 в течение 30 мин при 0-5°C. Преимуществом предлагаемого способа является более высокий выход (4E)-тридец-4-ен-1-илацетата. 3 пр.
Реферат
Изобретение относится к области органической химии, в частности к способу получения (4E)-тридец-4-ен-1-илацетата.
(4E)-Тридец-4-ен-1-илацетат является половым феромоном томатной моли (Keiferia lycopersicella), опасного вредителя пасленовых культур.
Результаты изобретения могут быть использованы в химии и сельском хозяйстве.
Известен способ получения (4E)-тридец-4-ен-1-илацетата (Меликян Г.Г., Асланян Г.Х., Атанесян К.А., Мкртчян Д.А., Баданян Ш.О. // Химия природ. соед. 1990. Т.1. С.102-106), основанный на восстановлении-миграции (5Z)-тридец-5ен-4-олида. Способ базируется на труднодоступном сырье и характеризуется низким общим выходом целевого продукта (13%).
Известен способ получения (4E)-тридец-4-ен-1-илацетата (Одиноков В.Н., Вахидов P.P., Шахмаев Р.Н., Гильванова Н.В. // Химия природ. соед. 1995. Т.3. С.490-493), основанный на перегруппировке Кляйзена с низким общим выходом целевого продукта (10%).
Известен способ получения (4E)-тридец-4-ен-1-илацетата (Бикулова Л.М., Верба Г.Г., Абдувахабов А.А. // Химия природ. соед. 1991. Т.3. С.444), основанный на конденсации Кновенагеля. Способ основан на труднодоступном сырье ((3E)-1-бромдодец-3-ене) и характеризуется недостаточно высоким общим выходом целевого продукта (27%).
Известен способ получения (4E)-тридец-4-ен-1-ола - непосредственного предшественника (4E)-тридец-4-ен-1-илацетата (Seufert W., Buschamann Е., Becker R., Seppelt W., Mackenroth W., патент DE 4006919, 1991), основанный на изомеризации (4Z)-тридецен-1-ола в требуемый трансизомер. Способ базируется на труднодоступном сырье ((4Z)-тридецен-1-оле) и отличатся крайне низкой стереоселективностью (изомерный состав продукта E/Z=80/20). Поскольку уже 1-2% содержание (Z)-изомера ингибирует аттрактивные свойства (4E)-тридец-4-ен-1-илацетата, способ непригоден для практического применения.
Выбранный авторами за прототип способ получения (4E)-тридец-4-ен-1-илацетата (I) (Шахмаев Р.Н., Сунагатуллина А.Ш., Зорин В.В. Fe-катализируемый синтез [(4E)-тридец-4-ен-1-илацетата - полового феромона томатной моли (Keiferia lycopersicella) // Журнал органической химии. 2013. Т.49. №5. С.687) основан на доступном и дешевом сырье (E)-1,3-дихлорпропене (полученным ректификацией смеси изомеров 1,3-дихлорпропена - многотоннажного промышленного отхода хлорирования пропилена), отличается высокой стереоселективностью и включает следующие стадии:
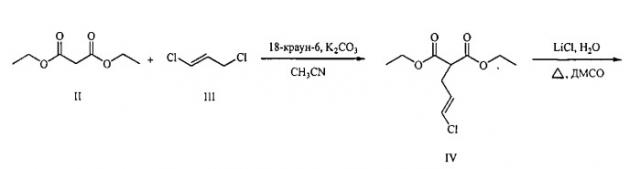
1. алкилирование малонового эфира (II) (E)-1,3-дихлорпропеном (III) в присутствии K2CO3 и каталитических количеств 18-краун-6 с получением диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата (IV);
2. декарбалкоксилирование диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата (IV) с получением этил(4E)-5-хлорпент-4-еноата (V);
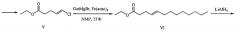
3. кросс-сочетание этил(4E)-5-хлорпент-4-еноата (V) с октилмагнийбромидом в присутствии 1.5 мол % Fe(acac)3 в смеси тетрагидрофурана и N-метилпирролидона при комнатной температуре с получением этил(4E)-тридец-4-еноата (VI);
4. восстановление этил(4E)-тридец-4-еноата (VI) литийалюминийгидридом с получением (4E)-тридец-4-ен-1-ола (VII);
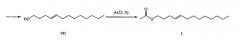
5. ацетилирование (4E)-тридец-4-ен-1-ола (VII) ацетилхлоридом в присутствии пиридина с получением (4E)-тридец-4-ен-1-илацетата (I).
Общий выход (4E)-тридец-4-ен-1-илацетата (I) на исходный (E)-1,3-дихлорпропен составляет 31%.
Недостатком способа является невысокий выход этил(4E)-тридец-4-еноата (VI) на стадии Fe-катализируемого кросс-сочетания этил(4E)-5-хлорпент-4-еноата (V) с октилмагнийбромидом.
Задачей изобретения является создание более эффективного способа получения (4E)-тридец-4-ен-1-илацетата (I) с более высоким выходом.
Указанная задача решается тем, что в способе получения (4E)-тридец-4-ен-1-илацетата (I), включающем алкилирование малонового эфира (II) (E)-1,3-дихлорпропеном (III) с получением диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата (IV), декарбалкоксилирование диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата (IV) с получением этил(4E)-5-хлорпент-4-еноата (V), Fe-катализируемое кросс-сочетание этил(4E)-5-хлорпент-4-еноата (V) с октилмагнийбромидом с получением этил(4E)-тридец-4-еноата (VI), восстановление этил(4E)-тридец-4-еноата (VI) с получением (4E)-тридец-4-ен-1-ола (VII), ацетилирование (4E)-тридец-4-ен-1-ола (VII) с получением (4E)-тридец-4-ен-1-илацетата (I), согласно изобретению Fe-катализируемое кросс-сочетание этил(4E)-5-хлорпент-4-еноата (V) с октилмагнийбромидом с получением этил(4E)-тридец-4-еноата (VI) осуществляется в присутствии катализатора Fe(acac)2Cl в смеси тетрагидрофурана и N-метилпирролидона при следующем мольном соотношении реагентов [(этил(4E)-5-хлорпент-4-еноат]:[октилмагнийбромид]:[Fe(acac)2Cl]:[тетрагидрофуран]:[N-метилпирролидон]=1:1.15:0.01:12:7 в течение 30 мин при 0-5°C.
Способ осуществляется следующим образом. К раствору этил(4E)-5-хлорпент-4-еноата (V), Fe(acac)2Cl в смеси тетрагидрофурана и N-метилпирролидона в атмосфере аргона приливали по каплям при 0°C раствор октилмагнийбромида в ТГФ и перемешивали 30 минут (0-5°C) при следующем мольном соотношении реагентов [этил(4E)-5-хлорпент-4-еноат]:[октилмагнийбромид]:[Fe(acac)2Cl]:[тетрагидрофуран]:[N-метилпирролидон]=1:1.15:0.01:12:7. Дальнейшие операции по выделению и очистке этил(4E)-тридец-4-еноата (VI) не отличаются от прототипа.
В результате изобретения выход этил(4E)-тридец-4-еноата (VI) повышается до 83% (у прототипа 72%). Общий выход (4E)-тридец-4-ен-1-илацетата (I) на исходный (E)-1,3-дихлорпропен (III) повышается до 36% (у прототипа 31%). Содержание (Z)-изомера в продукте менее 0.7%.
Пример 1. Получение этил(4E)-тридец-4-еноата (VI). К раствору 0.507 г (3.12 ммоль) этил(4E)-5-хлорпент-4-еноата (V), 9 мг (1 мол %) Fe(acac)2Cl в смеси 3 мл тетрагидрофурана и 2.1 мл N-метилпирролидона в атмосфере аргона приливали по каплям при 0°C 1 М раствор октилмагнийбромида в тетрагидрофуране (3.6 мл, 3.6 ммоль). Перемешивали 30 минут при 0-5°C. Затем приливали 10 мл 5% раствора HCl и 10 мл гексана, органический слой отделяли, а водный экстрагировали гексаном (2×10 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3, сушили Na2SO4 и концентрировали. Продукт выделяли методом колоночной хроматографии. Выход 0.624 г (83%), маслообразное вещество. ИК-спектр, ν, см-1: 2924, 2853, 1735, 1470, 1371, 1344, 1300, 1248, 1177, 1161, 1040, 968. Спектр ЯМР 1Н, δ, м.д.: 0.88 т (3Н, C13H3, J 7 Гц), 1.23-1.36 м (15Н, C H _ 3 C H 2 O , 6 СН2), 1.96 к (2Н, C3H2, J 6.7 Гц), 2.27-2.39 м (4H, C2H2, C6H2), 4.13 к (2H, CH2O, J7 Гц), 5.34-5.51 м (2H,=C4H,=C5H). Спектр ЯМР 13C, δС, м.д.: 14.03 (С13), 14.18 ( C H _ 3 C H 2 O ) , 22.63 (С12), 27.90 (С3), 29.10 (CH2), 29.25 (CH2), 29.43 (CH2), 29.67 (CH2), 31.85 (C11), 32.45 (C6), 34.47 (C2), 60.13 (CH2O), 127.87 (C5), 131.79 (C4), 173.22 (C1). Масс-спектр, m/z (Iотн, %): 152 (44), 110 (41), 109 (21), 101 (29), 98 (28), 97 (46), 95 (38), 88 (83), 84 (46), 83 (38), 82 (32), 81 (47), 71 (38), 70 (46), 69 (51), 68 (36), 67 (69), 61 (25), 60 (20), 57 (30), 55 (85), 54 (35), 43 (73), 41 (100).
Пример 2. Получение (4E)-тридец-4-ен-1-ола (VII). К раствору 0.54 г (2.2 ммоль) этил(4E)-тридец-4-еноата (VI) в 20 мл абсолютного эфира добавляли 0.08 г (1.5 ммоль) LiAlH4 при 0°C в атмосфере аргона. Перемешивали при комнатной температуре 3 ч до полной конверсии эфира (V) (контроль по ГЖХ). Затем приливали 10 мл 5% раствора HCl и 10 мл гексана, органический слой отделяли, а водный экстрагировали гексаном (2×10 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3, сушили Na2SO4 и концентрировали. Продукт выделяли методом колоночной хроматографии. Выход 0.385 г (88%), маслообразное вещество. ИК-спектр, ν, см-1: 3339 уш. (OH), 2955, 2926, 2853, 1466, 1454, 1059, 966, 909. Спектр ЯМР 1H, δ, м.д.: 0.88 т (3Н, C13H3, J7 Гц), 1.23-1.34 м (12Н, 6CH2), 1.62 кв (2Н, C2H2, J6.9 Гц), 1.90 уш. с (1H, C H 2 O H _ ), 1.97 к (2Н, С3Н2, J 6.8 Гц), 2.07 к (2Н, C6H2, J7 Гц), 3.63 т (2H, C1H2, J6.7 Гц), 5.37-5.48 м (2Н, =С4Н, =С5Н). Спектр ЯМР 13С, δС, м.д.: 14.03 (С13), 22.60 (С12), 28.83 (С3), 29.13 (CH2), 29.25 (CH2), 29.43 (CH2), 29.52 (CH2), 31.83 (C11), 32.40 (CH2), 32.52 (С6), 62.38 (С1), 129.30 (C5), 131.16 (C4). Масс-спектр, m/z (Iотн, %): 97 (16), 96 (31), 95 (30), 83 (23), 82 (63), 81 (73), 79 (30), 71 (23), 69 (34), 68 (84), 67 (81), 57 (36), 56 (18), 44 (14), 43 (57), 42 (15), 41 (100).
Пример 3. Получение (4E)-тридец-4-ен-1-илацетата (I). К раствору 0.24 г (1.21 ммоль) (4E)тридец-4-ен-1-ола (VII) в 3 мл абсолютного диэтилового эфира добавляли 0.115 г (1.45 ммоль) пиридина, 0.114 г (1.45 ммоль) ацетилхлорида при 0°C. Перемешивали в течение часа при комнатной температуре. Затем приливали 5 мл воды и 10 мл гексана, органический слой отделяли, а водный экстрагировали гексаном (2×10 мл). Объединенные органические слои промывали насыщенным раствором NaHCO3, сушили Na2SO4. Растворитель упаривали. Продукт выделяли методом колоночной хроматографии. Выход 0.270 г (93%), маслообразное вещество. ИК-спектр, ν, см-1: 3020, 2924, 2850, 1743, 1450, 1375, 1240, 1051, 965. Спектр ЯМР 1H, δ, м.д.: 0.88 т (3Н, C13H3, J7 Гц), 1.24-1.34 м (12H, 6CH2), 1.68 кв (2H, C2H2, J7 Гц), 1.97 к (2H, C6H2, J 6.9 Гц), 2.03-2.07 м (5H, C3H2, CH3C=O), 4.06 т (2H, C1H2, J 6.7 Гц), 5.34-5.47 м (2Н, =С4Н, =C5H). Спектр ЯМР 13С, δС, м.д.: 14.05 (C13), 20.95 ( C _ H 3 C = O ) , 22.62 (С12), 28.44 (C2), 28.79 (C3), 29.12 (CH2), 29.24 (CH2), 29.42 (CH2), 29.48 (CH2), 31.85 (C11), 32.51 (C6), 63.97 (C1), 128.56 (C5), 131.59 (C4), 171.16 ( C _ H 3 C = O ) . Масс-спектр, m/z (Iотн, %): 96 (20), 95 (17), 82 (39), 81 (48), 79 (16), 69 (19), 68 (87), 67 (63), 55 (37), 54 (32), 43 (100), 41 (49).
Преимуществом предлагаемого способа является более высокий выход (4E)-тридец-4-ен-1-илацетата (I).
Способ получения (4E)-тридец-4-ен-1-илацетата, включающий алкилирование малонового эфира (E)-1,3-дихлорпропеном с получением диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата, декарбалкоксилирование диэтил[(2E)-3-хлорпроп-2-ен-1-ил]пропандиоата с получением этил(4Е)-5-хлорпент-4-еноата, Fe-катализируемое кросс-сочетание этил(4E)-5-хлорпент-4-еноата с октилмагнийбромидом с получением этил(4E)-тридец-4-еноата, восстановление этил(4E)-тридец-4-еноата с получением (4E)-тридец-4-ен-1-ола, ацетилирование (4E)-тридец-4-ен-1-ола с получением (4E)-тридец-4-ен-1-илацетата, отличающийся тем, что Fe-катализируемое кросс-сочетание этил(4E)-5-хлорпент-4-еноата с октилмагнийбромидом с получением этил(4E)-тридец-4-еноата осуществляют в присутствии катализатора Fe(acac)2Cl в смеси тетрагидрофурана и N-метилпирролидона при следующем мольном соотношении реагентов [(этил(4Е)-5-хлорпент-4-еноат]:[октилмагнийбромид]:Fe(асас)2Сl]:[тетрагидрофуран]:[N-метилпирролидон]=1:1.15:0.01:12:7 в течение 30 мин при температуре 0-5°С.