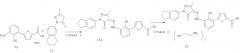
Соли бициклозамещенных производных азопиразолона, способ их получения и применение
Иллюстрации
Показать всеИзобретение относится к фармацевтически приемлемым солям, выбранным из группы, состоящей из соли натрия, соли лития, соли калия, соли кальция, соли магния, соли аргинина, соли лизина, соли метанамина, соли диметиламина, соли триметиламина, соли этиламина, соли диэтиламина, соли триэтиламина, соли этаноламина, соли пиперазина, соли дибензилэтилендиамина, соли меглумина, соли трометамина, соли четвертичного тетраметиламмония, соли четвертичного тетраэтиламмония и соли холина, бициклозамещенных производных азопиразолона общей формулы (I). Изобретение также относится к способу их получения, фармацевтической композиции, содержащей их, и их применению в качестве терапевтического агента, в частности в качестве миметиков тромбопоэтина (ТПО), и их применению в качестве агонистов ТПО. В общей формуле (I) Het выбран из группы, состоящей из фенила, фурила и тиенила; R1, R2, R3 и R4 каждый независимо выбран из группы, состоящей из водорода и алкила, n равно 0, 1 или 2. Технический результат - улучшение фармокинетических свойств соединения формулы (I) благодаря повышению растворимости. 6 н. и 13 з.п. ф-лы, 1 табл., 25 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится к фармацевтически приемлемым солям новых бициклозамещенных производных азопиразолона, к способам их получения, фармацевтическим композициям, содержащим их, и к их применению в качестве терапевтического агента, в частности в качестве миметиков тромбопоэтина (ТПО) и агонистов тромбопоэтинового рецептора.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Тромбопоэтин (ТПО), также называемый фактором роста и развития мегакариоцитов (MGDF), стимулирующим фактором тромбоцитопоэза (TSF), лигандом с-миелопролиферативной лейкемии (с-Мр1), лигандом mpl или мегапоэтином, представляет собой гликопротеин, который описан как продуцирующий тромбоциты. См. Wendling, F., et. al., Biotherapy 10(4): 269-77 (1998); Kuter D.J. et al., The Oncologist, 1: 98-106 (1996); Metcalf, Nature 369: 519-520 (1994).
При определенных обстоятельствах активность ТПО является результатом связывания ТПО с рецептором ТПО (также называемым Mpl). Рецептор ТПО клонирован, и его аминокислотная последовательность описана. См. Vigon et al., Proc. Nat. Acad. Sci., 89: 5640-5644 (1992).
ТПО представляет собой 332-аминокислотный гликозилированный полипептид, который играет ключевую роль в регуляции мегакариоцитопоэза и в процессе, при котором тромбоциты продуцируются мегакариоцитами костного мозга. См. Kuter et al., Proc. Nat. Acad. Sci. USA 91: 11104-11108 (1994); Barley et al., Cell 77:1117-1124 (1994); Kaushansky et al., Nature 369:568-571 (1994); Wendling et al., Nature 369: 571-574 (1994); и Sauvage et al., Nature 369: 533-538 (1994). ТПО продуцируется в печени, но функционирует в основном в костном мозге, где он стимулирует дифференциацию стволовых клеток в предшественники мегакариоцитов и стимулирует пролиферацию мегакариоцитов, их полиплоидизацию и в конечном счете поступает в циркуляцию тромбоцитов в организме. ТПО также является основным регулятором в ситуациях, включающих тромбоцитопению, и в ряде исследований, которые включают повышенное количество тромбоцитов, размер тромбоцитов и включение изотопов в тромбоциты животных-реципиентов. См. Metcalf Nature 369: 519-520 (1994). Конкретно считают, что ТПО влияет на мегакариоцитопоэз следующими путями: (1) он вызывает увеличение размера и числа мегакариоцитов; (2) он увеличивает содержание ДНК в форме полиплоидии и числа мегакариоцитов; (3) он повышает эндомитоз мегакариоцитов; (4) он увеличивает число зрелых мегакариоцитов; (5) он повышает процент клеток-предшественников, число малых клеток, положительных по ацетилхолинэстеразе, число клеток костного мозга.
Тромбоциты необходимы для свертывания крови. Когда количество тромбоцитов является очень низким, пациент имеет риск гибели в результате катастрофического кровотечения. Таким образом, ТПО применяют как для диагностики, так и для лечения различных гематологических расстройств, например заболеваний, первично вызванных дефектами тромбоцитов. Подобным образом, ТПО может быть полезен для лечения тромбоцитопенических состояний, в частности состояний, возникающих в результате химиотерапии, лучевой терапии или трансплантации костного мозга для лечения рака или лимфомы.
Медленное восстановление уровней тромбоцитов у пациентов, страдающих тромбоцитопенией, является серьезной проблемой, поэтому желательно получить соединение для лечения тромбоцитопении посредством его действия в качестве миметика ТПО. Эти пептиды были разработаны для связывания и активации рецептора ТПО (ТПО-R), но они не обладают гомологией последовательности с природным ТПО. В последние годы описан ряд активных низкомолекулярных миметиков ТПО, включая производные циклических полиаминов (WO 00/28987), тиазол-2-илбензамиды (WO 01/07423, WO 01/53267), производные азоарила (WO 00/35446, WO 01/17349), 2-арилнафтимидазолы (WO 01/39773, WO 01/53267) и производные семикарбазонов (WO 01/34585). В системах на основе клеток все эти молекулы могут активировать биохимические пути преобразования сигнала, которые являются зависимыми от присутствия рецептора ТПО на клеточной мембране. Определенные типы соединений могут действовать непосредственно на сам рецептор ТПО. Было обнаружено, что некоторые из наиболее предпочтительных соединений этой серии стимулируют пролиферацию и дифференциацию ТПО-реагирующих линий клеток человека и ТПО в культурах костного мозга человека при их концентрации ниже 100 нМ.
В нескольких патентах на имя GlaxoSmithKline описан аналог тромбопоэтина-элтромбопаг (WO-2003098992/WO-01089457), с хорошей активностью.
В настоящем изобретении предложен ряд фармацевтически приемлемых солей бициклозамещенных производных азопиразолона, которые являются более эффективными миметиками ТПО и агонистами ТПО рецептора.
В международной заявке PCT/CN2009/000001, поданной автором настоящего изобретения 4 января 2009, описаны новые бициклозамещенные производные азопиразолона и их применение в качестве миметиков тромбопоэтина (ТПО) и агонистов рецептора тромбопоэтина. В шести примерах (Пример 1, Пример 9, Пример 15, Пример 28, Пример 43 и Пример 52), описанных в этой международной заявке, предложены соответственно нижеследующие соединения:
2'-гидрокси-3'-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-дифенил-3-карбоновая кислота,
5-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-фуран-2-карбоновая кислота,
5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновая кислота,
4-(2-гидрокси-3-[N'-(3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден)-гидразино]дифенилфуран-2-карбоновая кислота,
5-(3-{N'-[1-(3,3-диметилиндан-5-ил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]-гидразино}-2-гидроксифенил)-фуран-2-карбоновая кислота,
4-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-тиофен-2-карбоновая кислота,
и их сложные эфиры.
Эти соединения были протестированы и показали хорошую активность в качестве агонистов ТПО рецептора. Поэтому данная международная заявка полностью включена в данную заявку посредством ссылки. Однако в международной заявке №PCT/CN2009/000001 не описаны фармацевтически приемлемые соли этих соединений.
Автор изобретения открыл, что форма свободной кислоты бициклозамещенных производных азопиразолона слаборастворима в общепринятых растворителях и, следовательно, непригодна для получения лекарственной формы, поскольку ограничена ее биодоступность in vivo. Необходимо разрабатывать новые формы бициклозамещенных производных азопиразолона, которые можно использовать при общепринятом получении лекарственных форм, чтобы улучшить их растворимость и фармакокинетическую абсорбцию.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
С целью преодоления недостатков предшествующего уровня техники в настоящем изобретении предложены фармацевтически приемлемые соли новых бициклозамещенных производных азопиразолона, способы их получения, фармацевтические композиции, содержащие их, и их применение в качестве терапевтического агента, в частности в качестве миметиков тромбопоэтина (ТПО) и агонистов тромбопоэтинового рецептора. Эти соли обладают хорошими активностями для лечения тромбоцитопении, улучшенной растворимостью, хорошими активностями in vivo, лучшей биодоступностью, более низкой токсичностью, являясь хорошим кандидатом для получения лекарственного средства для лечения тромбоцитопении.
"Соединения по настоящему изобретению" и "соли по настоящему изобретению" взаимозаменяемы, и оба эти термина представляют собой фармацевтически приемлемые соли бициклозамещенных производных азопиразолона формулы (I)
где:
Het выбран из группы, состоящей из фенила, фурила и тиенила;
R1, R2, R3 и R4 каждый независимо выбран из группы, состоящей из атома водорода и алкила;
n равно 0,1 или 2;
соли являются солями присоединения основания.
Кроме того, настоящее изобретение относится к солям соединений формулы (IA)
где:
Het выбран из группы, состоящей из фенила, фурила и тиенила;
R1, R2, R3 и R4 каждый независимо выбран из группы, состоящей из атома водорода и алкила;
M выбран из группы, состоящей из иона металла, иона аммония и основной аминокислоты;
m равно 1 или 2;
n равно 0,1 или 2;
соли являются солями присоединения основания.
Термин "свободная кислота" относится к бициклозамещенным производным азопиразолона формулы (I).
Понятие «эквивалент» относится к тем таутомерам соединений формулы (I), которые хорошо известны специалистам в данной области техники. Таутомеры соединений формулы (I) включают соединения формулы (II) и формулы (III), но не ограничены ими:
Все таутомеры соединений формулы (I) включены в объем настоящего изобретения, и все они включены в определение соединений формулы (I).
Термин "фармацевтически приемлемая соль" в настоящем изобретении относится к фармацевтически нетоксичным солям присоединения основания. Эти соли представляют собой соли, образованные между соединениями формулы (I) и подходящими основаниями, такими как гидроксид щелочного металла, основная аминокислота, амин или четвертичный аммоний, включая соль натрия, соль лития, соль калия, соль кальция, соль магния, соль аргинина, соль лизина, соль метанамина, соль диметиламина, соль триметиламина, соль этиламина, соль диэтиламина, соль триэтиламина, соль этаноламина, соль пиперазина, соль дибензилэтилендиамина, соль меглумина, соль трометамина, соль четвертичного тетраметиламмония, соль четвертичного тетраэтиламмония и соль холина, предпочтительно соль диэтиламина, соль этаноламина, соль холина, соль пиперазина, соль меглумина и соль трометамина, более предпочтительно соль этаноламина, соль холина, соль меглумина и соль трометамина, и наиболее предпочтительно соль этаноламина.
Фармацевтически приемлемые соли соединений формулы (I) настоящего изобретения предпочтительно включают следующие соединения, но не ограничены ими:
| Пример № | Структура | Название |
| 1 | (Z)-2'-гидрокси-3'-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-дифенил-3-карбоновой кислоты бис-(этаноламин) | |
| 2 | (Z)-2'-гидрокси-3'-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-дифенил-3-карбоновой кислоты бис-(диэтиламин) | |
| 3 | (Z)-2'-гидрокси-3'-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-дифенил-3-карбоновой кислоты бис-(пиперазин) | |
| 4 | (Z)-5-(3-{N'-[1-(3,3-диметилиндан-5-ил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]-гидразино}-2-гидроксифенил)-фуран-2-карбоновой кислоты бис-(этаноламин) |
| 5 | (Z)-5-(3-{N'-[1-(3,3-диметилиндан-5-ил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]-гидразино}-2-гидроксифенил)-фуран-2-карбоновой кислоты бис-(диэтиламин) | |
| 6 | (2)-5-(3-{N'-[1-(3,3-диметилиндан-5-ил)-3-метил-5-оксо-1,5-дигидропиразол-4-илиден]-гидразино}-2-гидроксифенил)-фуран-2-карбоновой кислоты бис-(пиперазин) | |
| 7 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(этаноламин) | |
| 8 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(холин) | |
| 9 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(диэтиламин) | |
| 10 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(меглумин) |
| 11 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(пиперазин) | |
| 12 | (Z)-5-(2-гидрокс-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(трометамол) | |
| 13 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(дибензилэтилендиамин) | |
| 14 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты динатриевая соль | |
| 15 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(1--аргинин) | |
| 16 | (Z)-5-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-фуран-2-карбоновой кислоты бис-(этаноламин) |
| 17 | (Z)-5-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-фуран-2-карбоновой кислоты бис-(диэтиламин) | |
| 18 | (Z)-5-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-фуран-2-карбоновой кислоты бис-(пиперазин) | |
| 19 | (Z)-4-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-тиофен-2-карбоновой кислоты бис-(этаноламин) | |
| 20 | (Z)-4-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-тиофен-2-карбоновой кислоты бис-(диэтиламин) | |
| 21 | (Z)-4-{2-гидрокси-3-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-фенил}-тиофен-2-карбоновой кислоты бис-(пиперазин) | |
| 22 | (Z)-4-(2-Гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафтал-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты бис-(этаноламин) |
| 23 | (Z)-5-(2-гидрокси-3-{N'-[3-метил-5-оксо-1-(5,6,7,8-тетрагидронафталин-2-ил)-1,5-дигидропиразол-4-илиден]-гидразино}-фенил)-фуран-2-карбоновой кислоты холин |
Настоящее изобретение относится к способу получения фармацевтически приемлемых солей соединений формулы (I), включающему стадии:
(a) растворение или суспендирование свободной кислоты по настоящему изобретению (соединения формулы (I)) в органическом растворителе, где органический растворитель выбран из группы, состоящей из метанола, этанола, ацетона, этилацетата и тетрагидрофурана, предпочтительно тетрагидрофурана;
(b) добавление основания к смеси при перемешивании, где основание может представлять собой органическое или неорганическое основание, такое как гидроксид щелочного металла или гидроксид щелочноземельного металла, основная аминокислота, амин или четвертичный аммоний;
(c) получение фармацевтически приемлемых солей соединения формулы (I),
где неорганические основания включают гидроксиды щелочных металлов, которые выбраны из группы, состоящей из гидроксида натрия, гидроксида лития, гидроксида калия, гидроксида кальция, гидроксида магния; основные аминокислоты выбраны из группы, состоящей из лизина и аргинина; амины выбраны из группы, состоящей из метанамина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, этаноламина, пиперазина, дибензилэтилендиамина, меглумина и трометамина; и четвертичные аммонии выбраны из группы, состоящей из четвертичного тетраметиламмония, четвертичного тетраэтиламмония, гидроксида холина, предпочтительно диэтиламин, этаноламин, гидроксид холина, пиперазин, меглумин и трометамин, более предпочтительно этаноламин, гидроксид холина, меглумин и трометамин, наиболее предпочтительно этаноламин.
На стадии (b) соотношение эквивалентов свободной кислоты и гидроксида щелочного металла, основной аминокислоты, амина и четвертичного аммония предпочтительно составляет 1:5~5:1, более предпочтительно 1:1~1:3 и наиболее предпочтительно 1:1~1:2.
На стадии (с) выделение солей предпочтительно включает прямое фильтрование из реакционной смеси, концентрирование из реакционной смеси и перекристаллизацию из органического растворителя. Соли можно высушивать в таких условиях, как вакуумная сушка или высокотемпературная воздушная сушка.
Реакции образования соли обычно проводят в условиях охлаждения, комнатной температуры или нагревания. Однако стоит отметить, что температура реакции связана с образованием соли, что хорошо известно специалистам в данной области техники.
Диапазон температур реакции по настоящему изобретению составляет диапазон от комнатной температуры до точки кипения растворителя реакционной смеси, предпочтительно 0~40°C. Специалист в данной области техники может легко определить наиболее предпочтительную температуру реакции для реакций образования соли общепринятыми методами.
Настоящее изобретение относится к применению фармацевтически приемлемых солей соединений формулы (I) для получения агониста тромбопоэтинового рецептора.
Настоящее изобретение относится к применению фармацевтически приемлемых солей соединений формулы (I) для получения лекарственного средства для лечения тромбоцитопении, где это лекарственное средство вводят совместно с лекарственным средством, выбранным из группы, состоящей из колониестимулирующего фактора, цитокина, хемокина, агониста или антагониста рецептора интерлейкина или цитокина, растворимого рецептора, агонистического или антагонистического антитела к рецептору или одного или более пептида или низкомолекулярного соединения, которое обладает одним и тем же механизмом с лекарственным средством.
Настоящее изобретение относится к фармацевтически приемлемым солям соединений формулы (I) для применения в качестве лекарственного средства для лечения тромбоцитопении, где это лекарственное средство вводят совместно с лекарственным средством, выбранным из группы, состоящей из колониестимулирующего фактора, цитокина, хемокина, агониста или антагониста рецептора интерлейкина или цитокина, растворимого рецептора, агонистического или антагонистического антитела к рецептору или одного или более пептида или низкомолекулярного соединения, которое обладает одним и тем же механизмом с лекарственным средством, где это лекарственное средство находится в форме пероральной лекарственной формы, либо лекарственное средство находится в форме парентеральной лекарственной формы.
Настоящее изобретение относится к способу лечения тромбоцитопении, включающему введение субъекту, нуждающемуся в этом, терапевтически эффективного количества фармацевтически приемлемой соли соединения формулы (I), где эту фармацевтически приемлемую соль вводят совместно с лекарственным средством, выбранным из группы, состоящей из колониестимулирующего фактора, цитокина, хемокина, агониста или антагониста рецептора интерлейкина или цитокина, растворимого рецептора, агонистического или антагонистического антитела к рецептору или одного или более пептида или низкомолекулярного соединения, которое обладает одинаковым механизмом действия с лекарственным средством, где фармацевтически приемлемая соль находится в форме пероральной лекарственной формы, либо фармацевтически приемлемая соль находится в форме парентеральной лекарственной формы.
Настоящее изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество фармацевтически приемлемой соли соединений формулы (I) и фармацевтически приемлемые носители или разбавители, где эту композицию вводят совместно с лекарственным средством, выбранным из группы, состоящей из колониестимулирующего фактора, цитокина, хемокина, интерлейкина и агониста рецептора цитокина. Настоящее изобретение также относится к применению этих композиций для получения лекарственного средства для лечения тромбоцитопении, где совместное введение включает применение лекарств по настоящему изобретению одновременно или последовательно.
Настоящее изобретение относится к способу получения фармацевтических композиций, содержащих терапевтически эффективное количество фармацевтически приемлемой соли соединений формулы (I) и фармацевтически приемлемые носители или разбавители, где этот способ включает стадию объединения соединений формулы (I) с фармацевтически приемлемыми носителями или разбавителями.
В способе получения фармацевтических композиций важно получить лекарственное средство в соответствующей форме, удобной в работе и в обращении, не только в плане коммерчески доступного препарата, но также в плане получения фармацевтических лекарственных форм, содержащих активные соединения.
В другом аспекте в способе получения фармацевтических композиций важно обеспечить надежную, воспроизводимую и постоянную кривую концентрации лекарства в плазме после введения субъекту.
Другие важные факторы включают химическую устойчивость, стабильность в твердом состоянии и срок хранения активного ингредиента. Лекарственные средства, содержащие эти композиции, можно предпочтительно хранить в течение относительно длительного времени без видимого изменения физических и химических свойств их активных ингредиентов, таких как химический состав, плотность, гигроскопичность и растворимость.
Важно также получить по возможности химически чистое лекарственное средство.
В типичном случае лекарственное средство может обеспечить следующие преимущества: удобную обработку, получение подходящих лекарственных форм и надежную растворимость, если это лекарственное средство может быть получено в стабильной форме, такой как стабильная кристаллическая форма, которая хорошо известна специалистам в данной области техники.
Эффективное количество активного ингредиента в фармацевтической стандартной лекарственной форме, как описано выше, должно быть нетоксичным, предпочтительно выбранным в интервале 0,001-100 мг/кг суммарной массы, более предпочтительно 0,001-50 мг/кг. При лечении субъекта, нуждающегося в миметиках ТПО, выбранную дозу предпочтительно вводят перорально или парентерально. Предпочтительные парентеральные формы включают формы местного, ректального, чрескожного введения, инъекции и непрерывной инфузии. Пероральные стандартные лекарственные формы для введения человеку предпочтительно содержат от 0,05 до 3500 мг активного ингредиента, наиболее предпочтительно от 0,5 до 1000 мг активного ингредиента. Предпочтительно пероральное введение, при котором используют более низкую дозировку. Парентеральное введение при высоких дозировках, однако, также можно применять, когда оно безопасно и приемлемо для пациента. Вышеописанные дозировки относятся к предпочтительному количеству активного ингредиента, в пересчете на свободную кислоту.
Специалистам в данной области техники понятно, что оптимальное количество и интервалы индивидуальных дозировок активного ингредиента зависят от природы и степени состояния, подлежащего лечению, формы, пути и сайта введения и от конкретного пациента, подлежащего лечению, и что такие оптимумы могут быть определены общепринятыми методами. Специалистам в данной области техники также понятно, что оптимальный курс лечения, то есть число доз активного ингредиента, даваемое за сутки в течение определенного числа суток, может быть определен специалистом в данной области техники при использовании общепринятых тестов определения курса лечения.
Соединения по настоящему изобретению можно вводить перорально или парентерально, причем эти соединения можно готовить в виде таблеток, пилюль, порошка и гранул, применяемых при различных путях введения. В вышеописанных твердых лекарственных формах активные ингредиенты смешаны по меньшей мере с одним видом инертного разбавителя. В соответствии с общепринятыми действиями, кроме инертного разбавителя, в пероральные лекарственные формы также включают другое вещество, такое как смазывающие вещества, глиданты и антиоксиданты. Приготовленные в виде капсул, таблеток и пилюль лекарственные формы содержат буферные агенты. Таблетки и пилюли можно готовить в лекарственных формах пролонгированного высвобождения.
Хотя можно использовать неводные эмульсии, парентеральные лекарственные формы по настоящему изобретению содержат стерильный водный раствор, и эти лекарственные формы также содержат адъюванты, например антисептики, увлажняющие агенты, агенты, способствующие проницаемости, буферные агенты, эмульгирующие агенты и диспергирующие агенты. В процессе стерилизации можно использовать фильтр, задерживающий бактерии, и в композиции, которые были подвергнуты облучению или нагреванию для стерилизации, можно добавлять стерилизующие агенты.
По сравнению со свободными кислотами соли по настоящему изобретению имеют описанные ниже преимущества:
(1) Соли по настоящему изобретению легко растворяются в общепринятых растворителях, таких как вода, метанол, 0,1% соляная кислота, и приспособлены для получения общепринятых лекарственных форм, где растворимость солей этаноламина заметно лучше в 0,1% соляной кислоте.
(2) Соли по настоящему изобретению обладают улучшенной стабильностью.
(3) Соли по настоящему изобретению обладают лучшей биологической активностью in vitro.
(4) Соли по настоящему изобретению обладают лучшими фармакокинетическими свойствами in vivo, лучшим всасыванием, более высокой биодоступностью и лучшей кривой фармакокинетики, где соль этаноламина, соль холина, соль пиперазина, соль меглумина и соль трометамина, предпочтительно соль этаноламина, обладают лучшими фармакокинетическими свойствами,.
(5) Способ получения солей по настоящему изобретению имеет преимущества высокого выхода, высокой чистоты, скорости, удобства и низких затрат, причем в способах получения более предпочтительны те соли этаноламина, соли холина, соли диэтиламина и соли пиперазина, которые можно кристаллизовать непосредственно.
По сравнению со свободными кислотами соли по настоящему изобретению, предпочтительно соль диэтиламина, соль этаноламина, соль холина, соль пиперазина, соль меглумина и соль трометамина, более предпочтительно соль этаноламина, соль холина, соль меглумина и соль трометамина, наиболее предпочтительно соль этаноламина, обладают лучшими свойствами растворимости, стабильности, биологической активности in vitro и фармакокинетики.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Если не указано иное, приведенные ниже термины, используемые в описании и формуле изобретения, имеют значения, описанные ниже.
Термин "этаноламин" относится к "2-аминоэтанолу".
Термин "холин" относится к "(2-гидроксиэтил)триметиламину".
Термин "меглумин" относится к "N-метил-D-меглумину".
Термин "фармацевтическая композиция" относится к смеси одной или более фармацевтически приемлемых солей соединения, описанного в данной заявке, или его пролекарств с другими химическими ингредиентами, такими как физиологически/фармацевтически приемлемые носители. Целью фармацевтической композиции является облегчение введения соединения в организм.
Термин "стабильность" относится к химической стабильности и стабильности твердого состояния.
Термин "химическая стабильность" относится к хранению соединений по настоящему изобретению, включая изолированные формы или лекарственные формы, смешанные с фармацевтически приемлемыми носителями или разбавителями (например, пероральные лекарственные формы, такие как таблетки, капсулы и т.д.), в стандартных условиях с незначительным химическим разложением или химическим распадом.
Термин "стабильность твердого состояния" относится к хранению соединений по настоящему изобретению, включая изолированные твердые формы или лекарственные формы, смешанные с фармацевтически приемлемыми носителями или разбавителями (например, пероральные лекарственные формы, такие как таблетки, капсулы и т.д.), в стандартных условиях с незначительным полиморфным превращением (например, кристаллизацией, перекристаллизацией, изменением твердофазного состояния, гидратацией, дегидратацией, сольватацией или удалением растворителя).
Примеры термина "хранимый в стандартных условиях" включают диапазон температуры от -80°C до +50°C (предпочтительно от 0°C до 40°C, более предпочтительно при комнатной температуре, такой как 15°C~30°C), диапазон давления от 0,1 Па до 2 Па (предпочтительно при атмосферном давлении), диапазон относительной влажности от 5% до 95% (предпочтительно 10%~60%) и/или воздействие 460 люкс УФ/видимого света в течение длительного времени (более длительного или равного шести месяцам).
Термин "парентеральное введение" включает внутривенное, внутримышечное, подкожное, интраназальное, интраректальное, интравагинальное или внутрибрюшинное введение, предпочтительно пероральное введение.
Термин "гигроскопичность" относится к свойству способности или степени, с которой вещество может поглощать воду при определенной температуре и влажности. Испытуемыми образцами являются твердые ингредиенты, удовлетворяющие стандарту контроля качества лекарственного средства. Упаковки лекарств и условия хранения могут относиться к результатам вышеописанного испытания.
СПОСОБ СИНТЕЗА СОЕДИНЕНИЯ ПО ИЗОБРЕТЕНИЮ
В целях достижения цели изобретения в изобретении используют описанные ниже технические решения:
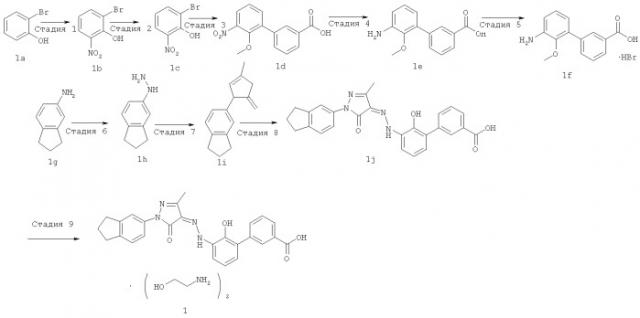
Способ синтеза соединения формулы (I) раскрыт в примерах 1, 9,15, 28, 43 и 52 международной заявки PCT/CN2009/000001, поданной 4 января 2009. Эта заявка полностью включена в данную заявку посредством ссылки.
Способ получения фармацевтически приемлемых солей соединений формулы (I) включает следующие стадии:
(a) растворение или суспендирование свободной кислоты по настоящему изобретению (соединения формулы (I)) в органическом растворителе, где органический растворитель выбран из группы, состоящей из метанола, этанола, ацетона, этилацетата и тетрагидрофурана, предпочтительно тетрагидрофурана;
(b) добавление к смеси основания при перемешивании, где основание может представлять собой органическое или неорганическое основание, такое как гидроксид щелочного металла или гидроксид щелочноземельного металла, основная аминокислота, амин или четвертичный аммоний;
(c) получение фармацевтически приемлемой соли соединения формулы (I), где неорганические основания включают гидроксиды щелочных металлов, которые выбраны из группы, состоящей из гидроксида натрия, гидроксида лития, гидроксида калия, гидроксида кальция, гидроксида магния; амины и четвертичные аммонии выбраны из группы, состоящей из четвертичного тетраметиламмония, четвертичного тетраэтиламмония, этаноламина, холина, лизина, аргинина, метанамина, диметиламина, триметиламина, этиламина, диэтиламина, триэтиламина, дибензилэтилендиамина, меглумина, пиперазина и трометамина; предпочтительно диэтиламина, этаноламина, пиперазина, гидроксида холина, меглумина и трометамина, более предпочтительно этаноламина, гидроксида холина, меглумина и трометамина, наиболее предпочтительно этаноламина.
На стадии (b) соотношение эквивалентов свободной кислоты и основания предпочтительно составляет 1:5~5:1, более предпочтительно 1:1~1:3 и наиболее предпочтительно 1:1~1:2.
На стадии (с) выделение солей предпочтительно включает прямое фильтрование из реакционной смеси, концентрированно из реакционной смеси и перекристаллизацию из органического растворителя. Соли можно высушивать при условиях, таких как вакуумная сушка или высокотемпературная воздушная сушка.
Вышеописанные реакции образования соли обычно проводят в условиях охлаждения, комнатной температуры или нагревания. Однако следует отметить, что температура реакции обладает влиянием на реакцию образования соли, что хорошо известно специалистам в данной области техники. Диапазон температуры реакции по настоящему изобретению составляет от комнатной температуры до точки кипения растворителя реакционной смеси, предпочтительно 0~40°C. Специалист в данной области техники может легко определить наиболее предпочтительную температуру реакции из реакций образования соли общепринятыми методами.
Настоящее изобретение далее описано приведенными ниже Примерами, которые не предназначены для ограничения объема изобретения.
ПРИМЕРЫ
Структуры всех соединений были идентифицированы с помощью ядерного магнитного резонанса (1Н ЯМР) или масс-спектрометрии (МС).
ЯМР проводили на спектрометре Bruker AVANCE-400. Соответствующие растворители включали дейтерированный метанол (CD3OD), дейтерированный хлороформ (CDCl3) и дейтерированный диметилсульфоксид (ДМСО-d6) с тетраметилсиланом (ТМС) в качестве внутреннего стандарта, и химические сдвиги регистрировали в виде млн-1 (10-6).
МС определяли на масс-спектрометре FINNIGAN LCQ Ad (ESI) (Thermo, Model: Finnigan LCQ усовершенствованный MAX).
EC50 определяли на NovoStar ELIASA (BMG Co. German).
Понятие «тонкослойный гель» относится к пластине силикагеля Yantai Huanghai HSGF254 или Qingdao GF254. Размер пластин, используемых при ТСХ, составляет от 0,15 мм~0,2 мм, и размер пластин, используемых при очистке препарата, составлял 0,4 мм~0,5 мм.
При колоночной хроматографии обычно использовали силикагель Yantai Huanghai 200-300 меш в качестве носителя.
ВЭЖХ на высокоэффективном жидкостном хроматографе Agilent 1200DAD (хроматографическая колонка Sunfire C18 150×4,6 мм) и высокоэффективном жидкостном хроматографе Waters 2695-2996 (хроматографическая колонка Gimini C18 150×4,6 мм).
Реакции гидрогенизации под давлением проводили с помощью гидрогенизатора Parr 3916EKX и генератора водорода QL. Микроволновые реакции проводили с помощью микроволнового реактора СЕМ Discover-S 908860.
При реакциях гидрогенизации реакционную систему обычно помещали в вакуум и заполняли водородом, повторяя операцию три раза.
Известный исходный материал по изобретению может быть получен способом, общепринятым в данной области техники, либо приобретен от фирмы ABCR GmbH & Со. KG, Acros Organics, Aldrich Chemical Company, Accela ChemBio Inc или Dari chemical Company и т.д.
Если не указано иное, нижеописанные реакции проводили в атмосфере азота.
Термин "атмосфера азота" относится к тому, что реакционная колба оборудована 1 л баллоном азота.
Термин "атмосфера водорода" относится к тому, что реакционная колба оборудована 1 л баллоном водорода.
Если не указано иное, раствор, используемый в нижеописанной реакции, относится к водному раствору.
Термин "ТСХ" относится к тонкослойной хроматографии.
Термин "ВЭЖХ" относится к высокоэффективной жидкостной хроматографии.
Опытные условия ВЭЖХ: время прогона: 30 мин, температура колонки: 30°C ФДМ: 230 нм, подвижная фаза: ацетонитрил: вода (0,1% трифторуксусная кислота)=25:75, скорость тока: 1,0 мл/минута.
Хроматографическая колонка: C18,150*4,6 мм Gemini.
Пример 1
(Z)-2'-Гидрокси-3'-[N'-(1-индан-5-ил-3-метил-5-оксо-1,5-дигидропиразол-4-илиден)-гидразино]-дифенил-3-карбоновой кислоты бис-(этаноламин)
Стадия 1
2-Бром-6-нитрофенол
Раствор 60 мл концентрированной серной кислоты, разведенной 186 мл воды, охлажд