Липохитоолигосахариды, стимулирующие арбускулярно-микоризный симбиоз
Иллюстрации
Показать всеГруппа изобретений относится к использованию липохитоолигосахарида формулы (I) для стимуляции микоризации растения, где n= 2 или 3, R1 представляет собой липидный заместитель, который является цепью жирной кислоты, содержащей от 16 до 18 атомов углерода, которая может быть насыщенной или моно- или диненасыщенной, a R2 представляет собой H или SO3H. Предложена также смесь липохитоолигосахаридов для стимуляции арбускулярно-микоризного симбиоза растения, для стимуляции прорастания семян растения или для стимуляции развития корневой системы растения и содержащая в эффективном количестве липохитоолигосахарид формулы (I), где R2 представляет собой H, и липохитоолигосахарид формулы (I), где R2 представляет собой SO3H. Группа изобретений эффективно стимулирует прорастание семян растений, арбускулярно-микоризный симбиоз растения и развитие корневой системы растения. 2 н. и 7 з.п. ф-лы, 16 ил., 9 пр.
Реферат
Настоящее изобретение относится к липохитоолигосахаридам, вовлеченным в арбускулярно-микоризный симбиоз, и к способам их применения.
Считается, что грибы арбускулярной микоризы (AM) установили симбиотические отношения с корнями растений более 400 миллионов лет назад, начиная с появления самых ранних наземных растений, что позволяет предположить, что АМ-грибы помогали растениям в освоении суши (Remy et al., 1994). Эта группа грибов, недавно переименованная в Glomeromycota, является одной из наиболее широко распространенных, и AM отношения широко встречаются по всему царству растений, включая покрытосеменные и голосеменные растения, папоротникообразные и некоторые мохообразные (Smith and Read., 2008). Среди покрытосеменных растений по меньшей мере 80% видов способны формировать AM симбиозы; единственными важными исключениями из этого являются Brassicaceae и Chenopodiaceae. АМ-грибы способны транспортировать редкие или плохо растворимые минеральные питательные вещества, такие как фосфор, цинк и медь, из почвы в растение, которое в свою очередь снабжает гриб углеводами. Этот обмен питательными веществами может иметь жизненно важное значение, когда плодородие почвы и доступность воды понижены, то есть в условиях, резко ограничивающих сельскохозяйственное производство в большинстве регионов мира (Smith and Read, 2008).
Другим примером известных симбиотических отношений между растениями и микроорганизмами почвы является ризобиальный симбиоз. В отличие от арбускулярно-микоризного симбиоза, который широко распространен среди растений, ризобиальный симбиоз встречается только у бобовых растений, и вместо грибов в нем участвуют азотфиксирующие бактерии, совокупно названные ризобиями, которые принадлежат к нескольким родам, включая Rhizobium, Bradyrhizobium, Azorhizobium и Sinorhizobium. Ризобиальный симбиоз приводит к формированию определенных структур - клубеньков - на корнях бобового растения-хозяина. Клубеньки обеспечивают соответствующую окружающую среду для ризобий, позволяя им фиксировать молекулярный азот и обеспечивать растение-хозяина связанным азотом. Инициация бобово-ризобиального симбиоза зависит от симбиотических сигналов, которые производят оба партнера-симбионта. Сигналы, испускаемые растением, обычно представляют собой флавоноиды, выделяемые в составе корневых экссудатов. Эти флавоноиды взаимодействуют с ризобиальными транскрипционными факторами семейства NodD, которые активизируют транскрипцию генов клубенькообразования (nod-генов), участвующих в выработке бактериальных сигнальных молекул, называемых Nod-факторами (Denarie et al., 1996). Nod-факторы имеют общую базовую структуру, включающую хитиновый остов из четырех или пяти остатков N-ацетилглюкозамина, связанных между собой бета-1,4-связями, N-ацилированный по нередуцирующему концу остатком жирной кислоты различной длины и степени ненасыщенности. Эта базовая структура может быть далее N-метилирована по нередуцирующему концу, а также может быть O-замещена по нередуцирующему и/или по редуцирующему концу. Это разнообразие заместителей обеспечивает широкое разнообразие Nod-факторов с различными структурами (разнообразные структуры Nod-факторов описаны в Denarie et al., 1996; D'Haeze et al., 2002). Специфичность бобово-ризобиального взаимодействия (то есть данный вид ризобий формирует клубеньки на определенных видах бобовых растений) является результатом этого разнообразия.
С помощью генетического анализа пути сигналинга Nod-факторов в корнях модельного бобового растения Medicago truncatula был идентифицирован ряд генов, вовлеченных в этот путь (Stacey et al., 2006). Растущее число фактов указывает на то, что рецепторы Nod-факторов представляют собой рецептороподобные киназы с внеклеточными связывающими сахар доменами LysM, такими как продукты генов NFP и LYK3 из M.truncatula. Взаимодействие Nod-фактора со своим рецептором запускает последующий сигнальный каскад, который включает быстрый приток ионов кальция, кальциевый спайк и экспрессию определенных генов нодулинов. Эти последующие события затрагивают определенные гены, кодирующие белки, вовлеченные в кальциевый сигналинг, такие как DMI1, DMI2 и DMI3 из M.truncatula, кодирующие соответственно кагионный канал, рецептороподобную киназу, содержащую богатые лейцином повторы, и Са2+/кальмодулин-зависимую протеинкиназу, а также гены, кодирующие белки, которые участвуют в контроле экспрессии генов, такие как NSP1 и NSP2, которые кодируют транскрипционные факторы.
Хотя AM-грибы с точки зрения сельского хозяйства и экологически чрезвычайно важны, клеточные и молекулярные механизмы, которые контролируют формирование микоризного симбиоза, намного менее известны, чем механизмы, вовлеченные в ризобиальный симбиоз.
На M.truncatula было показано, что клубеньковые и микоризные программы имеют по меньшей мере три общих компонента (Catoira et al. 2000), а именно, продукты генов DMI1, DMI2 и DMI3, участвующие в кальциевом сигналинге.
Однако события, как предшествующие, так и следующие за кальциевым сигналингом, все еще плохо охарактеризованы в случае арбускулярно-микоризного симбиоза, в особенности те, которые вовлечены в ранний сигналинг и приводят к взаимному распознаванию растительного и грибного партнеров. Исследование этих событий затруднял тот факт, что грибной партнер представляет собой облигатный симбионт, который не может быть выращен в чистой культуре в отсутствие живых растений, а также отсутствие генетических инструментов, доступных для этой группы грибов (Harrison, 2005). Однако недавно было показано, что между симбионтами до физического взаимодействия происходит обмен диффундирующими сигналами. Со стороны растения в составе корневых экссудатов могут выделяться вещества апокаротиноидного семейства, стриголактоны и стимулировать ветвление гиф прорастающих спор АМ-грибов, давая сигнал для переключения физиологического состояния гриба на активный пресимбиотический рост (Akiyama et al., 2005; Besserer et al., 2006). Сообщалось также и о существовании со стороны гриба диффундирующих веществ, производимых АМ-грибами и способных активизировать ответы растения, связанные с программой эндомикоризации (Kosuta et al., 2003; Weidmann et al., 2004; Navazio et al., 2007). Более конкретно, ряд экспериментов, выполненных на М.truncatula, недавно показал, что АМ-грибы вырабатывают диффундирующие вещества, способные стимулировать экспрессию разнообразных ответов растения. Три вида Gigaspora и один вид Glomus были способны через целлофановую мембрану вызывать индукцию экспрессии симбиотического гена MtENOD11 в корнях рассады (Kosuta et al., 2003). Три грибные патогена не вызывали подобный ответ, что говорит в поддержку гипотезы об индукции ответа определенной сигнальной молекулой АМ-гриба. Подобным образом AM-гриб Glomus intraradices, как было показано, активизировал через мембрану транскрипцию растительных генов, экспрессия которых зависит от симбиотического гена DMI3 (Weidmann et al. 2004). Кроме того, было обнаружено, что диффундирующий сигнал АМ-грибов вызывал временное повышение цитозольного уровня кальция в клеточных культурах сои и осуществлял повышающую регуляцию генов, связанных с DMI1, DMI2 и DMI3 (Navazio el al., 2007).
Olah et al. (2005) сообщали, что Nod-факторы из Sinorhizobium meliloli, ризобиального симбионта M.truncatula, были способны стимулировать микоризацию и формирование боковых корней у М.truncatula. Стимуляция формирования боковых корней также наблюдалась при использовании диффундирующих факторов из арбускулярно-микоризиых грибов (факторы Мус), но не Nod-факторов из ризобиальных видов {Sinorhizobium fredii и Rhizobium leguminosarum), которые не способны вызывать формирование клубеньков у видов рода Medicago. Сообщалось также, что все гены пути сигналинга Nod-фактора, идентифицированные на настоящий момент, в частности ген NFP, кодирующий предполагаемый рецептор Nod-фактора, как и гены DMI3 и NSP1, были необходимы для стимуляции формирования боковых корней Nod-факторами, но не факторами Мус, которым требовались только гены DMI1 и DMI2. На основе этих наблюдений данные авторы предложили модель, объясняющую стимуляцию микоризации и формирования боковых корней у бобовых факторами Мус и Nod-факторами. Согласно этой модели, факторы Мус и Nod-факторы, которые узнаются различными рецепторами на поверхности клеток, активизируют общий путь сигналинга DMI1/DMI2/DMI3; в случае факторов Мус, DMI1 и DMI2 были достаточны для стимуляции формирования боковых корней, в то время как DMI3 требовался для стимуляции микоризации. Olah et al. также обсуждали возможную химическую природу факторов Мус. Они выдвинули гипотезу о том, что эти факторы скорее всего не являются ауксин-подобными веществами, поскольку их эффект на развитие корня отличался от того, который наблюдался под воздействием этих веществ. Они также предположили, что их структура должна отличаться от структуры Nod-факторов, так как рецептор NFP, по-видимому, различал их.
Поэтому очевидно, что хотя существование диффундирующих "факторов Мус", выделяемых АМ-грибами и способных активизировать ответы растения, признано в данной области техники, химическая природа этих факторов не была идентифицирована до сих пор.
Авторам настоящего изобретения удалось очистить факторы Мус из экссудатов как микоризированных корней, так и прорастающих спор АМ-гриба Glomus intradices. Они также определили их химическую структуру и показали, что они эффективно стимулируют развитие корневой системы и колонизацию корня АМ-грибом.
Факторы Мус, очищенные авторами настоящего изобретения, представляют собой смесь сульфатированных и несульфатированных липохитоолигосахаридов (ЛХО); они и Nod-факторы имеют одинаковый хитиновый остов из остатков N-ацетилглюкозамина, связанных между собой бета-1,4-связями, N-ацилированный по нередуцирующему концу остатком жирной кислоты. Однако факторы Мус имеют более простые структуры по сравнению с Nod-факторами. Единственным О-замещением, которое наблюдали в факторах Мус, является О-сульфатирование по редуцирующему концу молекулы. Никакие другие О-замещения, такие как О-карбамоил на нередуцирующем конце или О-фукозил на редуцирующем конце, не были обнаружены. Единственным N-замещением по концевому нередуцирующему остатку GlcNAc у факторов Мус, очищенных из Glomus intradices, является ацилирование обычными жирными кислотами, главным образом олеиновой (C18:1) и пальмитиновой кислотами (C16:0). В отличие от этого, N-замещение Nod-факторов более сложно. Часто это двойное замещение N-метильной группой и N-ацильной группой (часто это вакценовая кислота), как у штаммов ризобий, которые образуют клубеньки на большинстве тропических бобовых и бобовых подсемейства Mimosoideae. N-метилирование определяется широко распространенным ризобиальным геном nods (Denarie et al., 1996). В качестве альтернативы, N-ацилирование определенной полиненасыщенной жирной кислотой является правилом среди ризобий, образующих клубеньки на бобовых умеренных широт, относящихся к кладе Galegoid (Denarie et al., 1996). Фактически, ЛХО, обладающие структурой столь же простой, как охарактеризованные изобретателями факторы Мус, не наблюдали среди Nod-факторов, синтезируемых различными штаммами ризобий, изученными до сих пор (Denarie et al., 1996; D'Haeze et al., 2002).
Согласно данному изобретению предложен способ получения факторов Мус из гриба группы Glomeromycota, при этом указанный способ включает получение экссудата из корней растений, микоризированных указанным грибом, или из прорастающих спор указанного гриба, экстракцию указанных экссудатов бутанолом и сбор бутанольного экстракта, содержащего указанные липохитоолигосахариды.
Согласно предпочтительному варианту реализации настоящего изобретения, указанный способ включает дальнейшие этапы твердофазной экстракции указанного бутанольного экстракта с помощью обращенно-фазной хроматографии на С18 с последовательными промывками 20%-ым, 50%-ым и 100%-ым ацетонитрилом и сбором фракции, элюированной в 50%-ом ацетонитриле, содержащей указанные факторы Мус.
Согласно еще более предпочтительному варианту реализации, указанный способ включает дальнейшие этапы очистки указанной фракции, элюированной в 50%-ом ацетонитриле, с помощью обращенно-фазной высокоэффективной жидкостной хроматографии на обращенно-фазной колонке С18 с использованием линейного градиента от 20% до 100% по ацетонитрилу и сбора фракции, элюированпой в 3,0-48% ацетонитрила, которая содержит сульфатированные липохитоолигосахариды, и/или фракции, элюированной в 64-72% ацетонитрила, которая содержит несульфатированные липохитоолигосахариды.
Согласно конкретному варианту реализации данного изобретения, указанный гриб из группы Glomeromycota представляет собой Glomus intraradices.
Однако грибные факторы Мус могут быть также получены из других видов Glomeromycota, продуцирующих их, с использованием вышеописанных этапов экстракции или их вариантов.
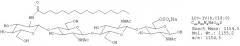
"Фактор Мус" определен в данном описании как липохитоолигосахарид, который соответствует приведенной ниже формуле (I):
где n=0, 1,2, 3, 4 или 5, предпочтительно 2 или 3;
R1 представляет собой липидный заместитель, содержащий от 12 до 22, предпочтительно от 14 до 20, атомов углерода, который может быть насыщенным, или моно-, ди-, три-, тетра-, пента- или гексаненасыщенным;
R2 представляет собой Н или SO3H.
Липидный заместитель R1 предпочтительно представляет собой цепь жирной кислоты. R1 также может представлять собой ароматический аналог цепи жирной кислоты, как в аналогах Nod-фактора, описанных, например, Grenouillat et al. (2004), или в РСТ WO/2005/063784.
Предпочтительно, R1 представляет собой цепь жирной кислоты, синтезируемой грибом арбускулярной микоризы, в частности цепь насыщенной, или моно- или диненасыщенной жирной кислоты, которая содержит 16 или 18 атомов углерода. Предпочтительно, чтобы в случае, если указанная цепь жирной кислоты является ненасыщенной, она включала по меньшей мере одну двойную связь в цис-конформации (например, С18:1 олеиновая кислота). Не ограничивающий список примеров предпочтительных цепей жирной кислоты включает С16:0, С18:0, С16:1ω5, С16:1ω7, С18:1ω5, С18:1ω7, С18:1ω9, 18:2ω6,9, С20:0 изо, С20:1ω9 и С20:4ω6, 9, 12, 15.
Факторы Мус можно также охарактеризовать и отличить от липохитоолигосахаридов родственной структуры, таких как Nod-факторы, по их биологическим свойствам. Эти биологические свойства можно протестировать с использованием соответствующих биотестов. В частности, можно использовать биотесты, основанные на способности факторов Мус стимулировать формирование боковых корней у модельного бобового растения M.truncaluta. Более конкретно, в то время как факторы Мус, подобно Nod-факторам, способны стимулировать формирование боковых корней у растений дикого типа, но не у дефектных по симбиозу мутантов dmi1, dmi2 и dmi3, факторы Мус также могут, в отличие от Nod-факторов, стимулировать формирование боковых корней у дефектного по симбиозу мутанта nsp1.
При необходимости, также доступны биотесты, позволяющие отличить несульфатированные факторы Мус от сульфатированных факторов Мус, (например, при необходимости разделить в грибном экстракте фракции, содержащие несульфатированные факторы Мус от тех, которые содержат сульфатированные факторы Мус): например, сульфатированные факторы Мус способны индуцировать экспрессию гена MtENODll в растущих корнях M.truncatula, в то время как несульфатированные факторы Мус способны вызывать ветвление корневых волосков у горошка посевного.
Факторы Мус можно очистить из грибов, как описано выше. Они также могут быть получены путем химического синтеза и/или произведены в генетически модифицированных бактериальных клетках. Например, хитоолигосахаридный остов, сульфатированный или нет, может быть синтезирован в рекомбинантных бактериях, как описано, например, Samain et al. (1997, 1999) для синтеза предшественников Nod-фактора, и впоследствии ацилирован по свободной аминогруппе нередуцирующего концевого сахара, как описано, например, Ohsten Rasmussen et al. (2004). Можно также использовать мутантный штамм бактерии Rhizobiaceae, продуцирующий факторы Мус вместо Nod-факторов, например, штамм, генетически модифицированный для экспрессии только тех из структурных генов биосинтетического пути Nod, которые участвуют в синтезе хитоолигосахаридного остова, и тех, что вовлечены в N-ацилирование нередуцирующего концевого глюкозамина соответствующей жирной кислотой С16 или С18, а также возможно и тех, которые участвуют в О-сульфатировании редуцирующего концевого глюкозамина, как описано, например, Ardourel et al. (1994) или Lugtenberg et al. (1995).
Настоящее изобретение также охватывает смеси различных факторов Мус формулы (I). и в частности смеси сульфатированных и несульфатированных факторов Мус, включающие один или более липохитоолигосахаридов формулы (I) таких, что R2 представляет собой H, и один или более липохитоолигосахаридов формулы (I) таких, что R2 представляет собой SO3H. Липохитоолигосахариды указанной смеси могут также отличаться между собой числом остатков N-ацетилглюкозамина и/или природой заместителя R1 (например, длиной и/или степенью ненасыщенности цепи жирной кислоты).
Смеси факторов Мус настоящего изобретения могут, например, быть получены путем экстракции факторов Мус из арбускулярно-микоризных грибов, как описано выше, и сбора грибного экстракта. Также они могут быть получены путем производства различных факторов Мус по отдельности и их смешивания.
Очищенные или синтетические липохитоолигосахариды, и более конкретно, очищенные или синтетические факторы Мус формулы (I) или их смеси, описанные здесь, могут применяться для стимуляции микоризообразования и таким образом иметь широкий диапазон применений в сельском хозяйстве, садоводстве и лесоводстве для наиболее культивируемых растений, способных образовывать микоризу и вследствие этого обладающих рецепторами фактора Мус.
В дополнение к их применению для стимуляции арбускулярно-микоризного симбиоза, очищенные или синтетические факторы Мус или их смеси можно также применять:
- для стимуляции прорастания семян, что может быть полезно при обработке семян с широким спектром применений в сельском хозяйстве, садоводстве и лесоводстве;
- для стимуляции развития корневой системы, что полезно для улучшения водного и минерального питания.
Их можно применять, например, для обработки семян или добавлять в инокулянты, содержащие грибы арбускулярной микоризы, или добавлять в почву либо культуральный субстрат растения. Очищенные или синтетические факторы Мус настоящего изобретения можно применять с любыми растениями, а именно с растениями, способными к образованию микоризы, включая как бобовые, так и не относящиеся к бобовым растения, как двудольные, так и однодольные растения, в том числе злаки. Их также можно применять для растений, выращиваемых как в вегетационной камере, так и в теплице или в полевых условиях.
Их также можно применять для стимуляции микоризной колонизации при производстве микоризных инокулянтов (то есть споры или гифы АМ-грибов, или фрагменты микоризированных корней), в качестве добавки в культуральную среду, используемую для производства этих инокулянтов растениями, выращиваемыми в почве или в гидропонных или аэропонных условиях, или путем кокультивирования микоризных грибов и вырезанных корней.
Настоящее изобретение также охватывает составы, содержащие очищенные или синтетические факторы Мус или их смеси и приемлемый в сельском хозяйстве носитель. Составы настоящего изобретения могут дополнительно содержать мутантные штаммы бактерий Rhizobiaceae, генетически модифицированные для продукции факторов Мус вместо Nod-факторов, как описано выше. Предпочтительными составами являются те, которые содержат смесь сульфатированных и несульфатированных факторов Мус.
Дополнительно, факторы Мус можно объединить с другими активными элементами, такими как флавоноиды, апокаротиноиды, например стриголактоны, или жасмонат, представляющие собой растительные вещества, которые, как сообщалось, действуют как симбиотические сигналы (Harrison, 2005; Akiyama et al., 2005; Bcsscrer et al., 2006).
Состав этих смесей зависит от намеченного способа применения (например, покрытие семян, добавление в культуральную среду для производства микоризных инокулянтов, обработка растения или почвы). Их можно, например, приготовить как диспергируемые в воде или водорастворимые твердые частицы, такие как порошки, гранулы, драже или пленки, как жидкие водные растворы, суспензии, эмульсии или гели.
Согласно предпочтительному варианту реализации, эти составы связаны с грибным и/или растительным материалом, например с инокулянтом арбускулярно-микоризного гриба или с семенами растения, способного образовывать микоризу; предпочтительно, чтобы указанные семена были покрыты этим составом.
Предпочтительно, факторы Мус используются в составе в концентрации от 10-3 M до 10-12 M. При добавлении в культуральную среду для производства спор АМ-грибов их можно применять в концентрации от 10-6 M до 10-10 M, предпочтительно в концентрации от 10-7 до 10-9 M в среде. При использовании для обработки семян или для стимуляции развития корневой системы, их можно применять в концентрации от 10-6 M до 10-10 M, предпочтительно в концентрации от 10-7 до 10-9 M. При использовании смеси сульфатированных и несульфатированных факторов Мус могут быть использованы концентрации от 10-8 до 10-10 M.
Суть настоящего изобретения станет более понята в свете дополнительного описания, заключающегося в приведенных ниже примерах и приложенных чертежах. Следует понимать, однако, что эти примеры и чертежи являются исключительно иллюстративными и не ограничивают настоящее изобретение каким-либо образом.
ПОДПИСИ К ЧЕРТЕЖАМ
Фиг.1. Биологические тесты, использованные для обнаружения
симбиотических сигналов АМ-грибов
a. Тест на MtENOD11. Корни трансгенной рассады M.truncatula Jemalong А17, несущей репортерную конструкцию pMtENODl 1-GUS. Активность GUS определяли с помощью гистохимического окрашивания 5-бром-4-хлор-3-индолил-β-глюкуронидом. (1) Корни в контроле, обработанные 2,5%-ым ацетонитрилом. (2) Фракция после ТФЭ и элюирования 50%-ым ацетонитрилом, разбавленная в 40 раз. (3) Та же самая фракция после дальнейшего десятикратного разбавления.
b. Тест на VsHab. Корневые волоски горошка посевного (Vicia saliva, подвид nigra), наблюдаемые под оптическим микроскопом после окрашивания метиленовым синим. (1) Корневые волоски, обработанные неактивной фракцией, являлись прямыми. (2) Корневые волоски, обработанные активными фракциями, демонстрировали заметное ветвление.
Фиг.2. Полупрепаративный профиль обращенно-фазной ВЭЖХ на С18 экстрактов из экссудатов микоризированных корней.
Начальная изократическая фаза с 20%-ым ацетонитрилом длилась 10 минут, после чего следовал 20-минутный 20-100%-ый градиент ацетонитрила. Профиль демонстрирует большое количество загрязняющего материала, присутствующего в экссудатах микоризированных корней. Сбор фракций производился каждые две минуты, и фракции были протестированы на биологическую активность с помощью MtENOD11 и VsHab. Горизонтальные столбики показывают время удерживания веществ из фракции A, активных по отношению к MtENOD11, и более гидрофобных веществ из фракции B, которые активны по отношению к VsHab.
Фиг.3. Полупрепаративный профиль обращенно-фазной ВЭЖХ на С18 экстрактов из экссудатов прорастающих спор.
Хроматографические условия те же, что и па Фиг.2. Профиль демонстрирует, что экссудаты спор содержат намного меньше загрязняющего материала по сравнению с экссудатами микоризированных корней. Сбор фракций производился каждые две минуты, и фракции были протестированы на биологическую активность с помощью MtENOD11 и VsHab. Горизонтальные столбики показывают время удерживания веществ из фракции A, активных по отношению к MtENOD11, и более гидрофобных веществ из фракции B, которые были активны по отношению к VsHab.
Фиг.4. Влияние мягкого метанольного гидролиза на биологическую активность фракции A.
Мягкий метанольный гидролиз, как сообщалось, удаляет сульфатную группу у сульфатированных ЛХО без изменения других структурных особенностей этих молекул. Фракция A, собранная во время полупрепаративной ВЭЖХ экссудатов прорастающих спор, была подвергнута мягкому гидролизу и проверена на биологическую активность в тестах на MtENOD11 и VsHab. Биологическая активность представлена вертикальными столбиками. В то время как негидролизованная фракция А являлась активной в отношении MtETMODll и неактивной в отношении VsHab, гидролизованная фракция потеряла активность в отношении MtENOD11 и приобрела активность в отношении VsHab. Эти данные свидетельствуют о том, что биологическая активность фракции А в тесте на MtENOD11 являлась результатом присутствия сульфатированных ЛХО.
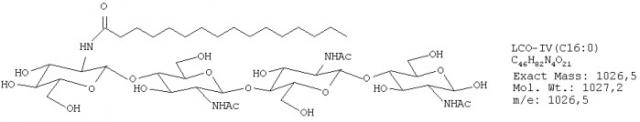
Фиг.5. Тетрамерные сульфатированные ЛХО, N-ацилированные жирными кислотами, содержащими 16 атомов углерода.
Масс-спектр УЭЖХ/МС, в режиме отрицательных ионов, фракции 4, изолированной после полупрепаративной ВЭЖХ на С18. Приведены экстрагированные ионные токи, соответствующие сульфатированным тетрамерам, и соответствующие им спектры. Эта фигура демонстрирует, что соединения, дававшие сигнал в области отношения массы к заряду, равного 1101,5, 1103,5 и 1105,5, фактически присутствовали в образцах. Эти значения отношения массы к заряду (m/z) соответствуют сульфатированным тетрамерным ЛХО, N-ацилированным, соответственно, C16:2, C16:1 и C16:0. Что касается относительной интенсивности этих трех сигналов, 1105,5 (ЛХО-IV-C1 6:0) являлся самым сильным, за которым следовал 1103,5 (ЛХО-IV-C16:1).
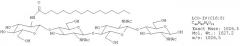
Фиг.6. Тетрамерные сульфатированные ЛХО, N-ацилированные жирной кислотой С18:1.
Масс-спектр УЭЖХ/МС, в режиме отрицательных ионов, фракции 5, изолированной после полупрепаративной ВЭЖХ на С18, демонстрирующий, что соединение, присутствовавшее в наибольшем количестве (отношение массы к заряду 1135,5), N-ацилирование жирной кислотой С18:1.
Этот профиль также показывает, что ЛХО, несущий жирную кислоту С18:0 (отношение массы к заряду 1133,5), отсутствовал в этой фракции, так как этот ион является единственным, превышающим на две единицы отношения массы к заряду ЛХО, несущий цепь С18:1. Как демонстрирует второй масс-спектр, диненасыщенный С18-ЛХО присутствовал в очень незначительном количестве.
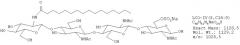
Фиг.7. Пентамерные сульфатированные ЛХО, N-ацилированные остатком жирной кислоты С18:1.
Этот профиль демонстрирует, что также присутствовали липохитопентамеры, но по сравнению с соответствующими тетрамерами (см. Фиг.5), их содержание было приблизительно в 30 раз ниже. Был обнаружен ЛХО-V-C18:1.
Фиг.8. Проверка на присутствие или отсутствие конкретного соединения.
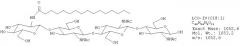
Когда расчетная масса не соответствовала ионам, присутствовавшим в образце, в профиле вместо единственного пика появлялось очень большое количество фоновых пиков. Очень сложный профиль, полученный при использовании ионного тока с отношением массы к заряду 1332.6, демонстрирует отсутствие в образце хитопентамера С18:2. Напротив, отчетливый единственный пик, наблюдавшийся при использовании ионного тока с отношением массы к заряду 1334.6, ясно указывает на присутствие пентамера С18:1.
Фиг.9. Сравнение характера фрагментации при ТМС основного сульфатированного фактора Мус и Nod-фактора из S.meliloti.
Демонстрация присутствия соединений, имеющих массу, соответствующую ожидаемому времени удерживания в ВЭЖХ, недостаточна для подтверждения их структуры. По этой причине был проведен анализ основного сульфатированного соединения Мус с помощью ТМС. На данной фигуре приведено сравнение, при ТМС в режиме отрицательных ионов, сульфатированного тетрамерного Nod-фактора из S.meliloti, N-ацилированного С16:2, с основным тетрамерным "фактором Мус", присутствовавшим в образце. Характерные ионы редуцирующего конца с отношением массы к заряду 503 (Y2), 605 и 706 (Y3) отчетливо обнаруживались в обоих случаях, как и характерная потеря нейтрального фрагмента массой 101 а.е.м. (внутрициклический разрыв), начинавшаяся на стадии молекулярного иона. Точное совпадение характера фрагментации указывает на структурное единство этих двух молекул.
Фиг.10. Эффект фракций экстракта Мус на формирование боковых корней у M.truncatula.
(A) Сигнал АМ-гриба, который стимулирует ФБК, является амфифильным.
Сравнение действия водного (Aq), бутанольного (ВиОН) и этилацетатного (ЕА) экстрактов из экссудатов прорастающих спор (GSP24) на M.truncatula А17. Бутанольный экстракт стимулировал ФБК, начиная с 5-го дня (статистически достоверно при P<0,05), тогда как водный и этилацетатный экстракты были неактивны.
(B) Стимуляция ФБК осуществляется через симбиотический путь сигналинга DMI.
Сравнение действия бутанольного экстракта экссудата микоризированных корней (MRE1), очищенного ТФЭ и элюированного 50%-ым ацетонитрилом, у M.truncatula дикого типа (A17) и у мутанта dmil (Y6). Экстракт Мус стимулировал ФБК у растения дикого типа, но не у мутанта dmil.
(C) Как фракция A, так и фракция B стимулировали ФБК.
Фракции A и B собирали после полупрепаративной ВЭЖХ экссудатов микоризированных корней (MRE-1). Фракция MRE-1A содержала сульфатированные ЛХО, а фракция MRE-1B - несульфатированные ЛХО. Обе фракции статистически достоверно стимулировали ФБК (P<0,05).
Фиг.11. Эффект смеси сульфатированных и несульфатированных факторов Мус на микоризацию Medicago truncatula.
a. Микоризация в аксенических условиях. Растения выращивали в пробирках на желированной скошенной питательной среде M, содержащей факторы Мус в концентрации 10-8 M. 50 стерильных спор (Glomus intraradices) были помещены вблизи от корней рассады. Степень микоризации была измерена путем подсчета единиц инфекции спустя шесть недель после инокуляции. Результаты были проанализированы с применением непараметрического статистического теста Крускала-Уоллиса.
b. Микоризация в нестерильных условиях. Растения выращивали на субстрате, состоящем из обожженных глиняных гранул и инокулированном 50 стерильными спорами G.intraradices; факторы Мус добавляли к питательному раствору в концентрации 10-8 M. Спустя три недели после инокуляции колонизацию корня оценивали методом пересечения решетки.
Фиг.12. Эффект факторов Мус на архитектуру корня Medicago truncatula.
a. Эффект на формирование боковых корней. Гистограмма, показывающая эффект смеси сульфатированных и несульфатированных факторов Мус (NS+S), сульфатированных факторов Мус (S) и несульфатированных факторов Мус (NS) в концентрации 10-8 M, 10-9 M и 10-10 M на формирование боковых корней M.truncatula дикого типа (A17) спустя восемь дней после обработки.
В эксперименте были использованы сорок растений, и статистический анализ был проведен с применением t-теста Стьюдента при сравнении контрольных и обработанных растений.
b. Эффект на общую длину корня. Гистограмма, показывающая эффект смеси сульфатированных и несульфатированных факторов Мус на общую длину корней рассады. Рассаду выращивали в течение восьми дней, затем корни отрезали и проводили сканирование и измерение корневой системы с помощью программного обеспечения WinRhizo. Данные были проанализированы с применением теста Крускала-Уоллиса.
(*) и (**) обозначают, соответственно, значимое (Р<0,05) или высоко значимое (Р<0,01) различие, а вертикальная черта обозначает стандартную ошибку среднего (СОС).
Фиг.13. Генетический анализ активируемого фактором Мус пути сигналинга, приводящего к стимуляции формирования боковых корней.
Гистограмма, показывающая эффект несульфатированного фактора Мус 10-8 M) на формирование боковых корней M.truncatula дикого типа (A17) и мутантов по симбиотическому пути сигналинга dmil, dmi2, dmi3 и nsp1. Средние значения представлены как процент от контрольной величины спустя восемь дней после обработки.
Для каждого генотипа были объединены данные по меньшей мере двух независимых экспериментов с 40 растениями в каждом, и статистические сравнения были сделаны с использованием t-теста Стьюдента при сравнении контроля и каждой из обработок. (**) указывает на высоко значимое (Р<0,01) различие, а вертикальная черта обозначает стандартную ошибку среднего (СОС).
Фиг.14. Эффект факторов Мус на микоризную колонизацию вырезанных трансформированных корней моркови in vitro.
a. Эффект смеси бактериальных сульфатированных и несульфатированных
факторов Мус. Корни инокулировали стерильными спорами G.intraradices (10 спор/мл питательной среды) и обрабатывали один раз в неделю в течение трех недель составом, в котором присутствовала или отсутствовала смесь факторов Мус в концентрации 10-8 M. Шесть недель спустя наблюдали уровень микоризной колонизации. (**) обозначает высоко достоверное различие с контролем (t-тест Стьюдента, значение Р<0,01). Вертикальная черта обозначает стандартную ошибку среднего (СОС).
b. Эффект смеси синтетических сульфатированных и несульфатированных факторов Мус. Корни инокулировали стерильными спорами G.intraradices (100 спор/мл питательной среды) и обрабатывали один раз в неделю в течение четырех недель составом, в котором присутствовала или отсутствовала смесь факторов Мус в концентрации 10-8 M. Восемь недель спустя наблюдали уровень микоризной колонизации. (*) обозначает достоверное различие с контролем (t-тест Стьюдента, значение P=0,0119).
Фиг.15. Эффект факторов Мус на микоризацию Tagetes patula.
a: Эффект смеси сульфатированных и несульфатированных факторов Мус на число единиц инфекции на растение (a1), длину корня (a2) и плотность инфекции (a3). Растения инокулировали приблизительно 100 стерильными спорами Glomus inlraradices и обрабатывали дважды в неделю в течение трех недель составом, в котором присутствовали или отсутствовали факторы Мус в концентрации 10-8 M. После четырех недель определяли число единиц инфекции, длину корня и плотность единиц инфекции. (**) обозначает высоко достоверное различие с контролем (t-тест Стьюдента, значение Р=0,004086).
b: Эффект сульфатированных (S), несульфатированных (NS) или смеси сульфатированных и несульфатированных (NS+S) факторов Мус на микоризную колонизацию корня. Растения инокулировали приблизительно 100 стерильными спорами Glomus intraradices и обрабатывали дважды в неделю в течение трех недель составом, в котором присутствовали или отсутствовали факторы Мус в концентрации 10-8 M. После четырех недель измеряли уровень колонизации.
Фиг.16. Эффект факторов Мус на прорастание семян томата.
a. Эффект несульфатированных (NS), сульфатированных (S) и смеси сульфатированных и несульфатированных (NS+S) факторов Мус на прорастание семян томата при 14°C. Факторы Мус добавляли в чашки для прорастания в концентрации 10-8 M, 10-9 M и 10-10 M. Уровень прорастания оценивали ежедневно. Результаты были проанализированы с помощью теста Крускала-Уоллиса. (***) и (**) обозначают, соответственно, очень высоко (значение Р<0,001) и высоко (<0,01) достоверное различие с контролем, а вертикальная черта обозначает стандартную ошибку среднего (СОС).
b. Эффект смеси сульфатированных и несульфатированных факторов Мус на прорастание семян при 14°C.
b1. Кинетика прорастания. Факторы Мус были добавлены в концентрации 10-10 M. Результаты были проанализированы с помощью непараметрического теста Крускала-Уоллиса. После 6-го дня различия были высоко значимыми. Вертикальная черта обозначает стандартную ошибку среднего (СОС).
b2. Фотография характерных чашек для прорастания с добавлением и без добавления факторов Мус спустя десять дней после засевания.
МАТЕРИАЛЫ И МЕТОДЫ
Естественные источники факторов Мус
Штамм DAOM 197198 АМ-гриба Glomus inlraradices, который поддерживался в совместной культуре с вырезанными корнями в течение многих лет (Chabot et al., 1992), хорошо охарактеризован, и его геном в настоящее время секвенируется. Этот штамм используется компанией PREMIER TECH для промышленного производства коммерческих инокулянтов и для производства очищенных спор в исследовательских целях. Например, эти очищенные споры были использованы в качестве источника ДНК для проекта секвенирования генома G.intraradices. Авторы настоящего изобретения использовали два вида экссудатов, оба из которых были приготовлены из материалов, приобретенных в PREMIER TECH BIOTECHNOLOGIES (Rivere-du-Loup, Quebec, Canada):
(i) Экссудаты микоризированных корней (ЭМК). Микоризу продуцировали совместным культивированием G.intraradices с вырезанными трансформированными корнями моркови. Питательная среда была отверждена с помощью Phytagel. После соответствующего роста микоризированных корней гель разжижали путем добавления цитрата натрия в качестве хелатирующего агента, и жидкие ЭМК выдерживали в 4-литровых контейнерах, которые хр