Профилактическая или терапевтическая полиэпитопная противотуберкулезная вакцинная конструкция, обеспечивающая индукцию клеточного иммунного ответа cd4+ или cd8+ т-лимфоцитов
Иллюстрации
Показать всеИзобретение относится к области генетической инженерии, молекулярной биологии и вакцинологии. Предложена полиэпитопная противотуберкулезная вакцинная конструкция для формирования иммунного ответа, обеспечивающая индукцию иммунного ответа CD8+ Т-лимфоцитов, состоящая из универсального полиэпитопного иммуногена, содержащего ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов М. tuberculosis, слитого с N-конца с убиквитином, и имеющая аминокислотную последовательность SEQ ID NO: 1. Вакцинная конструкция обеспечивает достижение эффективного терапевтического Т-клеточного иммунного ответа не только за счет антигенспецифических цитотоксических СD8+ Т-лимфоцитов, но и интенсивный ответ CD4+ Т-лимфоцитов. 1 табл., 11 ил.
Реферат
Изобретение относится к искусственным полиэпитопным конструкциям, включающим Т-клеточные эпитопы, выбранные из ряда иммунодоминантных антигенов Mycobacterium tuberculosis, и может быть использовано в молекулярной биологии, генетической инженерии и медицине, в частности в иммунологии, вакцинологии и клеточной терапии как основной компонент профилактической или терапевтической вакцины нового поколения для борьбы с таким тяжелым заболеванием человека, как туберкулез.
В настоящее время около трети всего человечества заражено туберкулезом. Ежегодно выявляется около 8-9 миллионов человек с активным туберкулезом. Каждый год от туберкулеза умирает около 1.5 миллионов человек. В 2006 году зарегистрировано 9.2 миллиона новых случаев инфекции и 1.2 миллиона человек умерли от туберкулеза (WHO Report 2008: Global Tuberculosis Control - surveillance, planning, financing), в 2007 году: 9.27 и 1.8 миллионов, соответственно (WHO Report 2009: Global Tuberculosis Control - epidemiology, strategy, financing). Кроме того, в настоящее время все большее распространение получают лекарственно-устойчивые формы туберкулеза, в том числе формы со множественной (MDR - multiple-drug-resistant) и широкой лекарственной устойчивостью (XDR - extensively drug-resistant). Доля MDR среди всех выявленных в 2008 году новых случаев туберкулеза составила около 2.9 %, т.е. она была практически в три раза выше, чем в 2004 году. В бывших советских республиках доля MDR среди новых выявленных случаев туберкулеза достигла 22 % (WHO 2008, Antituberculosis drug resistance in the world: fourth global report). На февраль 2008 года XDR туберкулез был зарегистрирован в 45 странах: доля форм с широкой лекарственной устойчивостью доходит до 10-20 % (и даже до 30 %) от всех форм со множественной лекарственной устойчивостью (Shenoi S. and Friedland G., 2008, Annu. Rev. Med., 60:307-320).
Лишь у 5-10% людей при инфекции развивается активный туберкулез. У большинства индивидуумов прогресс болезни эффективно подавляется иммунной системой (Barker L.F., 2009, Curr Opin Immunol, 21:331-338). У большинства из этих людей болезнь так и не разовьется, но примерно у 10 % из них при ослаблении организма неблагоприятными условиями жизни, другими инфекциями, развитием злокачественных новообразований или при реинфекции болезнь, не проявлявшая себя в течение многих лет, может реактивироваться. Риск развития активной формы туберкулеза очень сильно возрастает при заражении ВИЧ: у ВИЧ-инфицированных риск развития активной формы ТБ (при заражении Mycobacterium tuberculosis) составляет 5% в год (Hoft D.F. 2008, Lancet, 372:164-175; Barker L.F., 2009, Curr Opin Immunol, 21:331-338).
Для вакцинопрофилактики туберкулеза в настоящее время используется BCG - аттенуированный лабораторный штамм M. bovis. Однако эффективность данной вакцины сильно варьирует (от 40 до 80%). Заметно более эффективна вакцинация детей в раннем возрасте (до 90%). При вакцинации детей BCG они оказываются защищенными от развития милиарного туберкулеза и микобактериального менингита, но не от легочной инфекции в более позднем возрасте. Протективный иммунитет сохраняется на протяжении 12-15 лет, но ревакцинация оказывается неэффективной (Andersen P. and Doherty T.M., 2005, Nat Rev Microbiol, 3:656-662). Но вакцинация может оказаться не эффективной, если организм уже сенсибилизирован к микобактериальным антигенам, в ряде случаев при этом развивается Тх2-зависимый ответ, который не является протективным, и восприимчивость к инфекции усиливается. Кроме того, у индивидуумов с ослабленной иммунной системой BCG сама способна вызвать инфекцию.
В связи с увеличением случаев заражения лекарственно устойчивыми формами M. tuberculosis, с распространением ВИЧ все большее внимание уделяется развитию эффективных способов терапии туберкулеза, разработке профилактических и терапевтических вакцин и способов надежного диагностирования заболевания.
Многочисленные исследования показали, что важнейшую роль в развитии протективного иммунного ответа, направленного против M. tuberculosis, играют CD4+ Т-лимфоциты. У мышей, нокаутных по гену CD4, нарушено формирование гранулем, ограничивающих рост и распространение микобактерий (Ladel et al., 1995, Eur J Immunol, 25:377-384; Caruso et al., 1999, J Immunol, 162:5407-5416; Saunders et al., 2002, Cell Immunol, 216:65-72). Истощение популяции CD4+ Т-лимфоцитов перед заражением делает мышей крайне восприимчивыми к M. tuberculosis (Scanga et al., 2000, J Exp Med, 192:347-358; Cowley and Elkins, 2003, J. Immunol., 171:4689-4699). Адоптивный перенос CD4+ Т-лимфоцитов, специфичных к антигенам M. tuberculosis, защищает иммунологически наивных животных от инфекции (Feng and Britton, 2000, J Infect Dis, 181:1846-1849; Wangoo et al., 2001, J immunol, 166:3432-3439; Andersen and Smedegaard, 2000, 68:621-629). По мере развития инфекции все большую роль приобретают CD8+ Т-лимфоциты. Показано, что мыши, нокаутные по генам CD8 или MHC класса I, в высокой степени восприимчивы к инфекции M. tuberculosis (Flynn et al., 1992, PNAS, 89:12013-12017). Содержащийся в цитотоксических гранулах CD8+ Т-лимфоцитов гранулизин обладает бактерицидным действием, и поэтому CD8+ цитотоксические лимфоциты способны не только разрушать клетки, несущие микобактерии, но и убивать самих инфекционных агентов, в том числе и экстраклеточные бактерии (Stenger et al., 1998, Science, 282:121-125). На мышиной модели туберкулеза показано, что CD8+ цитотоксические лимфоциты играют существенную роль в предотвращении реактивации латентной инфекции (van Pinxteren et al., 2000, Eur J Immunol, 30:3689-3698).
Кроме того, важную роль в контроле за развитием инфекции играют Т-лимфоциты, рестриктированные CD1, и γ/δ-Т-клетки, распознающие небелковые антигены и липопротеины (Hoft D.F. 2008, Lancet, 372:164-175). В последнее время значительное внимание уделяется CD4+ Т-лимфоцитам, продуцирующим ИЛ-17, - так называемым, Тх17, роль которых в противостоянии организма M. tuberculosis представляется крайне важной (Cooper, 2009, Annu Rev Immunol, 27:393-422). Так, показано, что отсутствие Тх17 препятствует развитию вторичного иммунного ответа и приводит к большей восприимчивости организма к инфекции (Cooper, 2009, Annu Rev Immunol, 27:393-422; Khader and Cooper, 2008, Cytokine, 41:79-83).
Долгое время считалось, что гуморальный ответ не является протективным при туберкулезе из-за внутриклеточной локализации патогена. Однако показано, что введение микобактерий при экспериментальном туберкулезе одновременно с введением моноклональных антител к ManLAM или поверхностным белкам микобактерий вызывает усиленный фагоцитоз микобактериальных клеток, опсонизированных антителами через взаимодействие с Fc-рецепторами, что приводит к сильной активации макрофагов и быстрому уничтожению захваченных бактерий. Иммунизация животных ManLAM либо его конъюгатами с белковыми микобактериальными антигенами индуцировала протективный иммунный ответ (Maglione and Chan, 2009, Eur J Immunol, 39:676-686). Кроме того, существуют данные, указывающие на чрезвычайно важную роль B-лимфоцитов в регуляции активности эффекторных и регуляторных Т-лимфоцитов и в регуляции защитных и иммунопатологических реакций при туберкулезе (Maglione and Chan, 2009, Eur J Immunol, 39:676-686).
Известна конструкция рекомбинантной химерной ДНК, используемой для создания вакцины против туберкулеза, стимулирующей иммунный ответ у теплокровных животных (международная заявка WO, 2010010577, МПК А61К39/04, C12N15/30, опубл. 28.01.2010 г.).
Наиболее близким аналогом (прототипом) является полинуклеотид, индуцирующий при введении в ткань позвоночного один или более антимикобактериальных иммунных ответов, выбранных из ответов, опосредованных антителами, цитотоксическими Т-лимфоцитами, хелперными Т-лимфоцитами, и защитных иммунных ответов, содержащий промотор транскрипции, такой как промотор CMV, связанный с первым цистроном, таким как ген, кодирующий микобактериальный белок, выбранный из группы, содержащей 85А, В и С, связанным с подходящей контрольной последовательностью, включающей сигнал терминации транскрипции, такой как терминатор транскрипции BGH или IRES, при необходимости связанной со вторым цистроном, таким как ген, кодирующий GM-CSF, IL-12, интерферон или член семейства В7 Т-клеточных костимулирующих белков, при необходимости связанным с сигналом терминации транскрипции, таким как терминатор транскрипции BGH, связанным с геном устойчивости к антибиотику, таким как ген устойчивости к ампициллину или канамицину, связанным с участком, включающим точку начала репликации (патент РФ №2186109, МПК А61К 39/04, опубл. 27.06.1999 г.).
Однако вышеприведенные аналоги и прототип не обеспечивают достаточно надежного протективного иммунного ответа.
Техническим результатом является создание такой вакцинной конструкции, которая обеспечивала бы формирование эффективного протективного и терапевтического Т-клеточного иммунного ответа не только антигенспецифических цитотоксических CD8+ Т-лимфоцитов, но и интенсивный ответ CD4+ Т-лимфоцитов.
Указанный технический результат достигается получением следующих девяти вариантов профилактической и терапевтической полиэпитопной противотуберкулезной вакцинной конструкции.
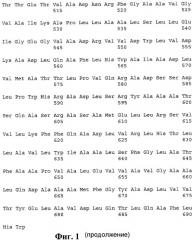
1. pTBUi, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 1 (SEQ ID NO 1).
2. pTBUi_a0201, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 2 (SEQ ID NO 2).
3. pTBUe, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 3 (SEQ ID NO 3).
4. pTBUe_a0201, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 4 (SEQ ID NO 4).
5. pTBUd, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 5 (SEQ ID NO 5).
6. pTBUd_a0201, обеспечивающая индукцию ответа CD8+ Т-лимфоцитов, представляющая собой специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином, с аминокислотной последовательностью, приведенной на фиг. 6 (SEQ ID NO 6).
7. pTBih, обеспечивающая индукцию ответа CD4+ Т-хелперных лимфоцитов, представляющая собой полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека, с аминокислотной последовательностью, приведенной на фиг. 7 (SEQ ID NO 7).
8. pTBeh, обеспечивающая индукцию ответа CD4+ Т-хелперных лимфоцитов, представляющая собой полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека, с аминокислотной последовательностью, приведенной на фиг. 8 (SEQ ID NO 8).
9. pTBdh, обеспечивающая индукцию ответа CD4+ Т-хелперных лимфоцитов, представляющая собой полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека, с аминокислотной последовательностью, приведенной на фиг. 9 (SEQ ID NO 9).
Данные соответствия заявленного технического решения критериям изобретения, основанные на новой стратегии вакцинации
Исходя из изложенного выше, можно придти к выводу, что важнейшей задачей для формирования протективного ответа является наработка мощного Т-клеточного ответа. Важно получить не только антигенспецифические цитотоксические CD8+ Т-лимфоциты, но и интенсивный ответ CD4+ Т-лимфоцитов, поскольку именно они вовлекаются в формирование гранулемы на более ранних стадиях. От того, насколько интенсивным будет Т-клеточный ответ, будет зависеть эффективность контроля за развитием инфекции. Из-за особенностей патогена невозможно избежать болезни с помощью профилактической вакцины, но можно эффективно блокировать развитие патологического процесса, значительно снизить степень поражения тканей и избежать генерализации инфекции. Кроме того, вероятно, что использование Т-клеточных иммуногенов необходимо сочетать с индукцией мукозального гуморального ответа на ряд микобактериальных антигенов, в том числе и на антигены небелковой природы.
Как было сказано выше, в настоящее время для вакцинопрофилактики туберкулеза у людей используется только BCG, живая вакцина, лабораторный аттенуированный штамм M. bovis. Несмотря на высокую эффективность вакцинации в раннем возрасте (новорожденные), при вакцинации в более позднем возрасте эффективность снижается. При ревакцинации может наблюдаться сенсибилизация. Кроме того, иммунологическая память сохраняется в течение примерно 15 лет и последующая ревакцинация неэффективна. BCG слабо эффективна в развивающихся странах. BCG также оказывается бессильной при заражении M. tuberculosis группы W-Beijing. В настоящее время ведутся работы по созданию новых вакцинных штаммов BCG или ауксотрофных и/или нокаутных по ключевым факторам вирулентности штаммов M. tuberculosis. Большое количество работ по разработке новых туберкулезных вакцин посвящено созданию субъединичных белковых вакцин в сочетании с адъювантами, эффективно стимулирующими развитие Тх1-зависимого иммунного ответа, ДНК-вакцин, кодирующих различные иммунодоминантные микобактериальные антигены, либо вирусных векторов, несущих гены, кодирующие микобактерианльные антигены. Разрабатываются новые протоколы иммунизации (Barker et al., 2009, Curr Opin Immunol, 21:331-338).
Предлагаемая нами в данной работе стратегия является уникальной, в настоящее время неизвестно ни одной кандидатной туберкулезной вакцинной конструкции, созданной на основе полиэпитопных конструкций. В результате использования искусственного полиэпитопного иммуногена можно добиться высокого уровня ответа не только на доминантные, но и на субдоминантные эпитопы. При этом мы предполагаем, что расширение спектра специфичности Т-лимфоцитов, стимулируемых при вакцинации, позволит покрыть большую часть антигенных детерминант и позволит создать пул антигенспецифичных клеток с широким спектром распознаваемых эпитопов. Наряду с использованием микобактериальных цитотоксических эпитопов необходимо использование специфических для M. tuberculosis Тх-эпитопов, поскольку CD4+ лимфоциты важны для формирования гранулем, для активации макрофагов для эффективного контроля за развитием инфекции. Важным условием для создания успешной полиэпитопной антигенной конструкции является необходимость учитывать чрезвычайно высокий полиморфизм генов HLA (лейкоцитарный человеческий антиген, human leukocyte antigen) или MHC (главный комплекс тканевой совместимости, major histocompatibility complex) человека. Эта задача может быть решена:
- за счет использования в полиэпитопной конструкции Т-клеточных эпитопов, способных связываться с приемлемым уровнем аффинности с широким спектром аллельных вариантов молекул MHC и в первую очередь с наиболее распространенными в мировой популяции аллельными вариантами молекул HLA, или
- путем создания «аллелеспецифических» антигенных конструкций, в состав которых включены эпитопы, взаимодействующие с определенными алломорфами HLA.
Предложенные полиэпитопные конструкции могут использоваться в качестве ДНК-вакцин; в качестве рекомбинантных встроек в геном векторного микроорганизма (например, вируса или бактерии) для получения кандидатного вакцинного штамма; для получения антиген-презентирующих клеток (АПК), экспрессирующих целевые полиэпитопные иммуногены и способных индуцировать формирование адекватного Т-клеточного иммунного ответа, с целью использования таких АПК в виде клеточной вакцины (или для клеточной терапии) либо для индукции эффекторных антигенспецифических Т-лимфоцитов in vitro с целью использования полученных иммунокомпетентных Т-лимфоцитов в качестве вакцины либо для терапевтических целей. Предложенные вакцинные конструкции могут использоваться в качестве терапевтических вакцин, в том числе для дополнения лечения туберкулеза фармакологическими препаратами.
По сравнению с живыми, инактивированными и субъединичными вакцинами полиэпитопные антигены обладают следующими преимуществами: они более безопасны, поскольку не содержат живых микроорганизмов и полноразмерных белков, которые могут обладать иммуносупрессирующим действием или другой нежелательной биологической активностью; в состав таких конструкций могут входить эпитопы из различных белковых антигенов; полиэпитопные антигены могут содержать эпитопы, покрывающие заданное разнообразие аллельных вариантов молекул MHC; для увеличения иммуногенности и для оптимизации MHC I- или MHC II-зависимой презентации эпитопов в состав полиэпитопных конструкций могут быть включены сигнальные последовательности: лидерный пептид, направляющий синтезируемый белок в ЭР; С-концевой фрагмент LAMP-1, обеспечивающий перенаправление полипептида из секреторного пути на лизосомную деградацию; N-концевой убиквитин, направляющий синтезированный полипептид на протеасомную деградацию, и т.д.
Изобретение иллюстрируется следующими графическими материалами. На фиг. 1 приведена аминокислотная последовательность универсального полиэпитопного иммуногена pTBUi, содержащего ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 2 приведена аминокислотная последовательность специфичного для аллеля HLA-A*0201 полиэпитопного иммуногена pTBUi_a0201, содержащего ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 3 приведена аминокислотная последовательность универсального полиэпитопного иммуногена pTBUe, содержащего ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 4 приведена аминокислотная последовательность специфичного для аллеля HLA-A*0201 полиэпитопного иммуногена pTBUe_a0201, содержащего ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 5 приведена аминокислотная последовательность универсального полиэпитопного иммуногена pTBUd, содержащего ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 6 приведена аминокислотная последовательность специфичного для аллеля HLA-A*0201 полиэпитопного иммуногена pTBUd_a0201, содержащего ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитого с N-конца с убиквитином. На фиг. 7 приведена аминокислотная последовательность полиэпитопного иммуногена pTBih, содержащего Т-хелперные эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитого с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека. На фиг. 8 приведена аминокислотная последовательность полиэпитопного иммуногена pTBeh, содержащего Т-хелперные эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитого с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека. На фиг. 9 приведена аминокислотная последовательность полиэпитопного иммуногена pTBdh, содержащего Т-хелперные эпитопы, выбранные из DosR антигенов M. tuberculosis, слитого с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека. На фиг. 10 представлены данные по оценке продукции γIFN для изучения Т-клеточного ответа (в качестве клеток-мишеней для каждого случая были использованы аутологичные ДК, инфицированные M. tuberculosis H37Rv). На фиг. 11 представлены данные по изучение цитотоксического ответа в результате лизиса клеток-мишеней (аутологичных макрофагов, инфицированных M. tuberculosis H37Rv).
Примеры получения заявляемых вакцинных конструкций
Поли-ЦТЛ конструкции на основе иммунодоминантных антигенов M. tuberculosis
Для выбранных антигенов с помощью TEpredict было проведено предсказание ЦТЛ-эпитопов, рестриктированных 35 различными аллельными вариантами молекул HLA-A и HLA-B. При этом проводилось предсказание протеасомного и иммунопротеасомного процессинга антигенов, а также эффективности связывания потенциально антигенных пептидов с TAP. Затем для составления «универсальной» полиэпитопной конструкции был произведен выбор минимального количества потенциальных Т-клеточных эпитопов из иммунодоминантных антигенов M. tuberculosis, покрывающих выбранное разнообразие алломорф HLA класса I с пятикратной избыточностью. Выбраны фланкирующие аминокислотные последовательности, оптимизирующие взаимодействие выбранных пептидов с TAP человека.
Проведен дизайн «универсальной» поли-ЦТЛ-эпитопной конструкции на основе иммунодоминантных антигенов M. tuberculosis (SEQ ID NO 1). Были подобраны спейсерные аминокислотные последовательности, оптимизирующие как протеасомное, так и иммунопротеасомное высвобождение эпитопов, включенных в состав полиэпитопа. Итоговая аминокислотная последовательность приведена на фигуре 1.
Из выбранных иммунодоминантных антигенов M. tuberculosis аналогичным образом была создана аллелеспецифичная поли-ЦТЛ конструкция для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 (SEQ ID NO 2). Итоговая аминокислотная последовательность приведена на фигуре 2.
Поли-ЦТЛ конструкции на основе ESAT-подобных антигенов M. tuberculosis
Для выбранных ESAT-подобных антигенов с помощью TEpredict было проведено предсказание ЦТЛ-эпитопов, рестриктированных 35 различными аллельными вариантами молекул HLA-A и HLA-B. Также проводилось предсказание протеасомного и иммунопротеасомного процессинга антигенов, а также эффективности связывания потенциально антигенных пептидов с TAP. Затем для составления «универсальной» полиэпитопной конструкции был произведен выбор минимального количества потенциальных Т-клеточных эпитопов из ESAT-подобных антигенов M. tuberculosis, покрывающих выбранное разнообразие алломорф HLA класса I с пятикратной избыточностью. Выбраны фланкирующие аминокислотные последовательности, оптимизирующие взаимодействие выбранных пептидов с TAP человека.
Проведен дизайн «универсальной» поли-ЦТЛ-эпитопной конструкции на основе ESAT-подобных антигенов M. tuberculosis (SEQ ID NO 3). Были подобраны спейсерные аминокислотные последовательности, оптимизирующие как протеасомное, так и иммунопротеасомное высвобождение эпитопов, включенных в состав полиэпитопа. Итоговая аминокислотная последовательность приведена на фигуре 3.
Из выбранных ESAT-подобных антигенов M. tuberculosis аналогичным образом была создана аллелеспецифичная поли-ЦТЛ-эпитопная конструкция для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 (SEQ ID NO 4). Итоговая аминокислотная последовательность приведена на фигуре 4.
Поли-ЦТЛ-эпитопные конструкции на основе DosR антигенов M. tuberculosis
Для выбранных DosR антигенов M. tuberculosis с помощью TEpredict было проведено предсказание ЦТЛ-эпитопов, рестриктированных 35 различными аллельными вариантами молекул HLA-A и HLA-B. Также проводилось предсказание протеасомного и иммунопротеасомного процессинга антигенов, а также эффективности связывания потенциально антигенных пептидов с TAP. Затем для составления «универсальной» полиэпитопной конструкции был произведен выбор минимального количества потенциальных Т-клеточных эпитопов из DosR антигенов M. tuberculosis, покрывающих выбранное разнообразие алломорф HLA класса I с пятикратной избыточностью. Выбраны фланкирующие аминокислотные последовательности, оптимизирующие взаимодействие выбранных пептидов с TAP человека.
Проведен дизайн «универсальной» поли-ЦТЛ-эпитопной конструкции на основе DosR антигенов M. tuberculosis (SEQ ID NO 5). Были подобраны спейсерные аминокислотные последовательности, оптимизирующие как протеасомное, так и иммунопротеасомное высвобождение эпитопов, включенных в состав полиэпитопа. Итоговая аминокислотная последовательность приведена на фигуре 5.
Из выбранных DosR антигенов M. tuberculosis аналогичным образом была создана аллелеспецифичная поли-ЦТЛ-эпитопная конструкция для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 (SEQ ID NO 6). Итоговая аминокислотная последовательность приведена на фигуре 6.
Поли-Т-хелперные конструкции на основе антигенов M. tuberculosis
Для выбранных антигенов с помощью TEpredict было проведено предсказание Т-хелперных эпитопов. При этом проводился выбор фрагментов, содержащих большое количество потенциальных эпитопов, взаимодействующих с наибольшим количеством алломорф молекул HLA класса II (HLA-DR). Из каждого антигена (из каждого набора) выбиралось по три наиболее перспективных антигенных фрагмента и затем из всего набора выбранных фрагментов отбиралось по 10 наиболее перспективных.
В соответствии с описанным выше алгоритмом был проведен дизайн поли-Т-хелперных конструкций на основе следующих наборов антигенов M. tuberculosis: из иммунодоминантных антигенов (SEQ ID NO 7), из ESAT-подобных антигенов (SEQ ID NO 8) и из антигенов DosR-регулона (SEQ ID NO 9). Итоговая аминокислотная последовательность поли-Т-хелперной конструкции на основе иммунодоминантных антигенов M. tuberculosis приведена на фигуре 7. Итоговая аминокислотная последовательность поли-Т-хелперной конструкции на основе ESAT-подобных антигенов M. tuberculosis приведена на фигуре 8. Итоговая аминокислотная последовательность поли-Т-хелперной конструкции на основе DosR антигенов M. tuberculosis приведена на фигуре 9.
Результаты проведенных исследований
Для разработанных полиэпитопных конструкций (SEQ ID NO 1, SEQ ID NO 2, SEQ ID NO 3, SEQ ID NO 4, SEQ ID NO 5, SEQ ID NO 6, SEQ ID NO 7, SEQ ID NO 8 и SEQ ID NO 9) были сконструированы кодирующие их искусственные гены. Последовательности генов были оптимизированы для экспрессии в клетках человека, для чего из них были исключены редко используемые кодоны. Дизайн генов проводился с таким расчетом, чтобы минимизировать сложность вторичной структуры матричной РНК.
Для создания ДНК-вакцинных конструкций с использованием полученных искусственных генов была выбрана плазмида pDNAVACC-Ultra (pDNAVACC5, NBC, USA, http://www.natx.com/). В качестве отрицательного контроля также использовалась плазмида pDNAVACC5.
Было создано девять конструкций:
1) pTBUi - плазмида pDNAVACC со встроенной последовательностью, кодирующей универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 1);
2) pTBUi_a0201 - плазмида pDNAVACC со встроенной последовательностью, кодирующей специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 2);
3) pTBUe - плазмида pDNAVACC со встроенной последовательностью, кодирующей универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 3);
4) pTBUe_a0201 - плазмида pDNAVACC со встроенной последовательностью, кодирующей специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 4);
5) pTBUd - плазмида pDNAVACC со встроенной последовательностью, кодирующей универсальный полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 5);
6) pTBUd_a0201 - плазмида pDNAVACC со встроенной последовательностью, кодирующей специфичный для аллеля HLA-A*0201 полиэпитопный иммуноген, содержащий ЦТЛ-эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с убиквитином (SEQ ID NO 6);
7) pTBih - плазмида pDNAVACC со встроенной последовательностью, кодирующей полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из иммунодоминантных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека (SEQ ID NO 7);
8) pTBeh - плазмида pDNAVACC со встроенной последовательностью, кодирующей полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из ESAT-подобных антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека (SEQ ID NO 8);
9) pTBdh - плазмида pDNAVACC со встроенной последовательностью, кодирующей полиэпитопный иммуноген, содержащий Т-хелперные эпитопы, выбранные из DosR антигенов M. tuberculosis, слитый с N-конца с сигнальным пептидом, а с C-конца - с C-концевым фрагментом белка LAMP-1 человека (SEQ ID NO 9).
Описание процессинга и презентации антигенов
Белковые антигены, синтезированные в цитоплазме клетки, как правило, презентируются молекулами MHC класса I. Эндогенные белковые антигены подвергаются протеолитическому разрезанию на олигопептидные фрагменты под действием протеасомы - крупного белкового комплекса, состоящего из регуляторных и протеолитических субъединиц (Rock KL and Goldberg AL, 1999, Annu. Rev. Immunol, 17:739-779; Niedermann G et al., 1999, Immunol. Rev, 172:29-48). Образованные в результате протеасомного процессинга олигопептиды с помощью гетеродимеров TAP1/TAP2 (Transporters associated with antigen processing) транспортируются в просвет эндоплазматического ретикулума (ЭР), где связываются с молекулами MHC класса I. Образовавшиеся комплексы антигенных пептидов с молекулами MHC класса I транспортируются на поверхность клетки для презентации специфическим CD8+ Т-лимфоцитам (Pamer E and Cresswell P, 1998, Ann. Rev. Immunol, 16:323-358). Процессинг антигенов в антигенпрезентирующих клетках может осуществляться иммунопротеасомой, несколько отличающейся от протеасомы по специфичности расщепления в результате включения в ее состав альтернативных протеолитических субъединиц, экспрессируемых клеткой под действием провоспалительных стимулов (Van den Eynde B. and Morel S. 2001. Curr Opin Immunol, 13:147-153; Rivett A. and Hearn A. 2004. Curr Prot Pept Sci, 5:153-161).
Молекулы MHC класса II, как правило, презентируют пептидные фрагменты белков, интернализованных клеткой в результате эндоцитоза. Это могут быть растворимые белки, белки клеточной поверхности или белки захваченных микроорганизмов (вирусов, бактерий или простейших). Образованные в ЭР комплексы молекул MHC класса II с инвариантной цепью транспортируются в комплекс Гольджи и затем направляются в мультивизикулярные компартменты эндосомной/лизосомной сети. Здесь происходит протеолитическая деградация инвариантной цепи, процессинг захваченных белковых антигенов и ассоциация антигенных пептидов с молекулами MHC класса II. Образовавшиеся комплексы антигенных пептидов с молекулами MHC класса II транспортируются на поверхность клетки для презентации специфическим CD4+ Т-лимфоцитам (Cresswell P, 1994, Ann. Rev. Immunol, 12:259-293; Watts C., 1997, Ann. Rev. Immunol, 15:821-850). Кроме того, показано, что экзогенные антигены могут презентироваться и молекулами MHC класса I в результате кросс-презентации (Guermonprez P. et al., 2002. Annu Rev Immunol, 20:621-667).
Описание алгоритма выбора ЦТЛ- и Тх-эпитопов и конструирования полиэпитопных Т-клеточных иммуногенов
Выбор антигенов. Было решено сформировать три различные выборки антигенов M. tuberculosis: 1) состоящая из иммунодоминантных антигенов (Ag85A, Ag85B, Ag85C, Hsp65, Esat-6, CFP-10 и др.), 2) состоящая из Esx-подобных антигенов (все они характеризуются небольшими размерами и являются секретируемыми белками и иммунодоминантными антигенами. Данные белки играют важную роль не только на ранних, но и на более поздних стадиях инфекции, а следовательно, должны обладать эффективностью не только при использовании в составе профилактической, но и в качестве терапевтической вакцины) и 3) объединяющая ряд белков латентной фазы и белков из DosR регулона.
Выбор Т-клеточных эпитопов. В настоящее время разработано большое количество алгоритмов для предсказания Т-клеточных эпитопов, обладающих высокой точностью. Некоторые из них уже доказали свою применимость для поиска новых эпитопов и дизайна вакцинных конструкций (Bian H et al., 2003, Methods. 29:299-309; Adotevi O et al., 2006, Clin. Cancer Res, 12:3158- 3167; Hundemer M et al., 2006, Exp. Hematol, 34:486-496; Mustafa AS and Shaban FA, 2006, Tuberculosis, 86:115-124;Sundar K et al., 2007, Virology, 360:257-263; Wen JS et al.,2008, Virus Res, 132:42-48). При разработке предложенных полиэпитопных конструкций мы использовали разработанное нами программное обеспечение TEpredict, предназначенное для предсказания Т-клеточных эпитопов и основных этапов процессинга антигенов (Антонец Д. и Максютов А. 2009. Мол Биол, 43:1-10). Дополнительно нами были использованы предсказательные модели веб-сервера NetMHC (Lundegaard C. et al. 2008. NAR, 36:W509-512).
Предсказание цитотоксических Т-клеточных эпитопов проводилось для 30 различных аллельных вариантов молекул HLA класса I (HLA-A*0101, A*0201, A*0202, A*0203, A*0206, A*0301, A*2301, A*2402, A*2403, A*2601, A*2902, A*3001, A*3002, A*3101, B*0702, B*0801, B*1501, B*1801, B*2705, B*3501, B*4001, B*4002, B*4402, B*4403, B*4501, B*5101, B*5301, B*5401, B*5701, B*5801). Пептиды, для которых предсказанное значение pIC50 (характеристика аффинности взаимодействия пептида с молекулой MHC) было больше 6.8, были отобраны для дальнейшего анализа.
Показано, что предсказание аффинности связывания пептидов с комплексом TAP (связанные с процессингом транспортные белки, transporter associated with antigen processing) перед предсказанием пептидов, способных связываться с молекулами MHC класса I, снижает количество ложноположительно предсказанных эпитопов (Peters B et al., 2003, J. Immunol, 171:1741-1749), следовательно, предсказание аффинности взаимодействия пептидов с TAP может быть использовано в качестве фильтра при выборе потенциальных Т-клеточных эпитопов или в качестве оценочной функции для ранжирования пептидов согласно эффективности их взаимодействия с TAP. Для предсказания аффинности связывания пептидов с TAP могут быть использованы алгоритмы, разработанные Петерсом и др. (Peters B et al., 2003, J. Immunol, 171:1741-1749) либо Дойчиновой и др. (Doitchinova I. et al., 2004, J. Immunol, 173:6813-6819), реализованные в программе TEpredict либо с использованием другого программного обеспечения. При дизайне полиэпитопных ЦТЛ иммуногенов мы использовали алгоритм, разработанный Петерсом и др.
C-конец большинства Т-клеточных эпитопов образуется под действием протеасомы (Craiu A et al., 1997, PNAS USA, 94:10850-10855; Stoltze L et al., 1998, Eur. J. Immunol, 28:4029-4036). Можно предположить, что предсказание протеасомного процессинга антигена также может увеличить точность предсказания Т-клеточных эпитопов, исключая из рассмотрения пептиды, не имеющие на своем С-конце сайта протеасомного расщепления. Однако было показано, что в результате специфичность предсказания эпитопов не увеличивается, а чувствительность предсказания может снижаться (Peters B et al., 2003, J. Immunol, 171:1741-1749). Тем не менее, мы предполагаем, что использование предсказания протеасомного процессинга в качестве фильтра позволит увеличить эффективность поиска эпитопов, более эффективно высвобождаемых протеасомой in vivo. Предсказание (иммуно)протеасомного процессинга проводилось с использованием моделей, разработанных Toes et al. (Toes RE et al., 2001, J. Exp. Med, 194:1-12). Определение пороговых значений для предсказания процессинга описано в работе Singh and Raghava (Singh H and Raghava GP, 2003, Bioinformatics, 19:1009-1014).
Предсказание Т-хелперных эпитопов (рестриктированных молекулами MHC класса II) проводилось с использованием программ TEpredict и NetMHC.
Далее производили выбор эпитопов для конструирования «универсальных» полиэпитопных иммуногенов: были сформированы выборки эпитопов, покрывающие разнообразие выбранных алломорф молекул MHC класса I и II с пятикратной избыточностью. Кроме того, для наиболее распространенного в человеческой популяции аллеля HLA-A*0201 были созданы выборки эпитопов для конструирования аллелеспецифичных полиэпитопных антигенов.
Конструирование полиэпитопных антигенов. Несмотря на то, что первые работы показали способность полиэпитопных конструкций, составленных в результате простого объединения эпитопов, индуцировать цитотоксический Т-клеточный ответ на все эпитопы, включенные в состав таких антигенов (Thomson et al., 1995), в дальнейшем было показано, что иммуногенность пептидов в составе полиэпитопа в значительной степени зависит от фланкирующих аминокислотных остатков, и что при конструировании полиэпитопных иммуногенов следует учитывать особенности протеасомного процессинга антигенов и взаимодействия пептидов с ТАР. Было показано, что введение в состав полиэпитопного антигена спейсерных аминокислотных последо