Способ лечения аутоиммунного заболевания (варианты)
Иллюстрации
Показать всеИзобретение относится к области биотехнологии и медицины. Описаны способы лечения аутоиммунного заболевания. Способы предусматривают введение фармацевтической композиции, содержащей гуманизированное антитело к CD4. При этом антитело способно активировать CD4+ СВ25+ регуляторные T-клетки. Предложенная группа изобретений может быть использована в медицине. 4 н. и 29 з.п. ф-лы, 41 ил., 20 табл., 5 пр.
Реферат
Настоящее изобретение относится к лечению аутоиммунных заболеваний. Изобретение относится к высокоэффективному средству, такому как гуманизированное моноклональное антитело, которое можно вводить пациенту в более низких дозировках, чем ранее известные дозировки. В частности, оно эффективно для пациентов, имеющих заболевания или характерные признаки, требующие более низких доз для эффективного их лечения. Изобретение относится к фармацевтической композиции, содержащей антитело в эффективной концентрации, а также к применению и способам лечения с использованием композиций и лекарственных средств, содержащих это антитело.
Аутоиммунитет представляет собой неспособность организма распознавать его собственные составные части (вплоть до субмолекулярных уровней) как "свое", что приводит к иммунному ответу против его собственных клеток и тканей. Любое заболевание, которое является следствием такого нарушенного иммунного ответа, называют аутоиммунным заболеванием. Аутоиммунные заболевания включают рассеянный склероз (MS), ревматоидный артрит (RA), псориаз, псориатический артрит, язвенный колит, болезнь Крона, миастению гравис (MG), аутоиммунный полигландулярный синдром типа II (APS-II), тиреоидит Хашимото (HT), диабет 1 типа (T1D), системную красную волчанку (SLE) и аутоиммунный лимфопролиферативный синдром (ALS).
Аутоиммунное заболевание возникает, когда T-клетки распознают "собственные" молекулы, т.е. молекулы, продуцируемые клетками хозяина, и реагируют с ними. Активация "аутореактивных" T-клеток путем представления аутоантигенов, процессированных антигенпредставляющими клетками (APC), приводит к их клональной экспансии и миграции в определенные ткани, где они индуцируют воспаление и разрушение ткани.
В норме T-клетки толерантны к аутологичной ткани и реагируют только на представление гетерологичных структур. Центральная толерантность и периферическая толерантность включает два механизма, посредством которых иммунная система препятствует индукции аутореактивными T-клетками их вредных функций. Центральная толерантность опосредуется негативной селекцией. Этот процесс включает элиминацию через клональную делецию аутореактивных T-клеток в процессе онтогенного развития тимуса.
Периферическая толерантность представляет собой резерв, доступный, если центральная толерантность является недостаточной и аутореактивные клетки покидают тимус. Этот механизм толерантности действует постоянно на протяжении жизни, сохраняя аутореактивные клетки под контролем путем иммунного безразличия (анергии), периферической делеции и/или активной супрессии.
Регуляторные T-клетки (Treg, ранее называемые "супрессорными клетками") в качестве части активной супрессии поддерживают периферическую толерантность и регулируют аутоиммунитет (Suri-Payer et al., J Immunol. 157: 1799-1805 (1996); Asano et al., J Exp. Med. 184:387-396 (1996); Bonomo et al., J. Immunol. 154: 6602-6611 (1995); Willerford et al., Immunity 3: 521-530 (1995); Takahashi et al., Int. Immunol. 10: 1969-1980 (1998); Salomon et al., Immunity 12: 431-440 (2000); Read et al., J Exp. Med. 192: 295-302 (2000)). Как правило, регуляторные T-клетки ингибируют активацию и/или функцию T-хелперов 1 типа (TH1) и эффекторных клеток TH2. Нарушение регуляции частоты или функционирования клеток Treg может привести к истощающим аутоиммунным заболеваниям (Baecher-Allan et al., Immunol. Review 212: 203-216 (2006); Shevach, Annu. Rev. Immunol. 18: 423-449 (2000); Salomon et al., Immunity 12: 431-440 (2000); Sakaguchi et al., Immunol. Rev. 182: 18-32 (2001)).
Охарактеризовано несколько подгрупп регуляторных T-клеток. Семейство Treg состоит из двух ключевых подгрупп: появляющиеся естественным образом, например CD4+CD25+ Treg, и периферически индуцированные, Tr1- и Th3-Treg. Более того, у человека и грызунов были описаны NKTreg и CD8+ Treg (Fehervari et al., J. Clin. Investigation 114: 1209-1217 (2004)).
Происходящие из тимуса клетки Treg (встречающиеся в природе CD4+CD25+Treg) являются главными регуляторными клетками, вовлеченными в регуляцию аутоиммунитета или патогенных иммунных ответов.
Основные признаки встречающихся в природе CD4+CD25+Treg являются следующими:
i) они представляют собой CD4+ T-клетки и составляют 5-10% от периферических CD4+ T-клеток;
ii) они созревают в тимусе;
iii) они, главным образом, характеризуются комбинированной экспрессией рецептора IL-2 (CD25), низкомолекулярной изоформы молекулы CD45, CD152 (CTLA-4) и фактора транскрипции FoxP3.
Роль Treg наилучшим образом иллюстрируется экспериментами, вовлекающими восстановление у иммунодефицитных мышей nude с помощью клеток CD4+ с истощением клеток CD25+. У мышей nude с восстановлением CD4+CD25- развиваются различные орган-специфические аутоиммунные заболевания, такие как гастрит, оофорит, орхит и тиреоидит (Suri-Payer et al.; J. Immunol. 160: 1212-1218 (1998)).
Включение подгруппы CD4+CD25+ в эксперименты по восстановлению с мышами nude препятствует возникновению этих заболеваний (Sakaguchi et al., J Immunol. 155: 1151-1164 (1995)). Защитное значение клеток CD4+CD25+ против орган-специфического аутоиммунитета также было показано в нескольких других моделях аутоиммунитета (например, аутоиммунный гастрит, простатит, оофорит, гломерулонефрит, эпидимит и тиреоидит), вызванного неонатальной тимэктомией, проведенной через 3 суток после рождения (d3Tx), или воспалительного заболевания кишечника, вызванного восстановлением у мышей SCID T-клетками CD45RBhigh, CD4+CD25-. Введение антитела к CD25 мышам in vivo также индуцирует локализованное в органе аутоиммунное заболевание.
Открытие важности регулятора транскрипции FoxP3 в функции регуляторных T-клеток CD4+CD25+ у мышей и предшествующие наблюдения, что пациенты с синдромом IPEX (нарушение иммунной регуляции, полиэндокринопатия, энтеропатия и X-сцепленное наследование), тяжелым воспалительным заболеванием, сходным с заболеванием, наблюдаемым у мышей с дефицитом регуляторных клеток CD4+CD25+ ("scurfy"-синдром), имеют мутации в FoxP3, обеспечило прямую корреляцию между аутоиммунной моделью на животных, регуляторными T-клетками мыши и аутоиммунным заболеванием у человека (Sakaguchi et al., J Immunol. 155: 1151-1164 (1995)).
Фармацевтический механизм регуляторных T-клеток не полностью ясен. Treg CD4+CD25+ ингибируют поликлональную и антиген-специфическую активацию T-клеток. Супрессия опосредуется зависимым от клеточных контактов механизмом, который требует активации Treg CD4+CD25+ через TCR, но Treg не демонстрируют пролиферативного ответа при активации или стимуляции TCR митогенными антителами (анергическими) (Shevach, Nature Rev. Immunol 2: 389 (2002)). После стимуляции они являются компетентными для супрессии независимым от антигена образом ответа CD4+ T-клеток и CD8+ T-клеток, а также ингибирования активации B-клеток и их клональной экспансии.
Существуют дополнительные данные, указывающие на то, что супрессорная активность CD4+CD25+ Treg частично также основана на противовоспалительных цитокинах, таких как TGF-β (Kingsley et al., J Immunol. 168: 1080 (2002); Nakamura et al., J Exp. Med. 194: 629-644 (2001)). Функциональное значение секреции TGF-β, более того, подтверждается данными, что у мышей с дефицитом TGF-β развивается аутоиммунное заболевание и что введение нейтрализующих антител к TGF-β препятствует in vivo предупреждению аутоиммунитета или индуцирующей толерантность активности CD4+ T-клеток в некоторых моделях.
В подгруппе CD4+ T-клеток могут существовать по меньшей мере 2 более отличающихся типа клеток с супрессивной функцией, которые индуцируются после воздействия специфического экзогенного антигена (называемые "адаптивными или индуцибельными регуляторными T-клетками"): регуляторные T-клетки 1 типа (Tr1) и клетки Th3. Эти типы клеток, по-видимому, отличаются от CD4+CD25+ Treg исходя из профилей продукции цитокинов. Однако взаимосвязь между этими различными типами неясна и способы действия являются перекрывающимися.
Tr1-клетки индуцируются повторяющейся стимуляцией TCR в присутствии IL-10, и было показано, что они, главным образом, подавляют иммунные ответы путем продукции высоких уровней IL-10 совместно с умеренными количествами TGF-β (Chen et al., J. Immunol. 171: 733-744 (2003)).
Th3-клетки (идентифицированные в модели EAE после пероральной доставки антигена) продуцируют высокие количества TGF-β и различные количества IL-4 и IL-10. Было показано, что IL-4 сам по себе является ключевым фактором для дифференцировки Th3-клеток в противоположность Tr1-клеткам, которые дифференцируются при помощи IL-10 (Chen et al., Science 265:1237-1240 (1994)).
Супрессия функции T-клеток с использованием иммуносупрессивных лекарственных средств является основной терапевтической стратегией, которую успешно использовали для лечения аутоиммунных заболеваний. Однако эти лекарственные средства индуцируют общую иммуносупрессию вследствие их плохой селективности, что приводит к ингибированию не только вредных функций иммунной системы, но также и полезных. Вследствие этого могут возникнуть различные типы риска, такие как риск инфекции, злокачественной опухоли и токсичности лекарственного средства.
Средства, препятствующие функции T-клеток, представляют собой основу терапии различных аутоиммунных заболеваний.
До настоящего времени было показано, что подход с использованием средств, нацеленных на активацию регуляторных T-клеток, для терапии аутоиммунных заболеваний, является крайне затруднительным. Активация Treg через TCR с использованием антитела-агониста к CD3 OKT-3 (Abramowicz et al., N Engl. J Med. 1992 Sep 3; 327(10):736) или через костимуляторную молекулу CD28 с использованием антитела-суперагониста к CD28 TGN1412 приводит к полному истощению популяции регуляторных T-клеток, а также других традиционных T-клеток и к системной индукции и высвобождению избыточных количеств провоспалительных цитокинов, включая IFN-γ, TNF-α, IL-1 и IL-2, что приводит к клинически выраженному синдрому высвобождения цитокинов (CRS) у человека (Suntharalingam et al., N Engl. J Med. 2006 Sep 7; 355(10):1018-28).
После первых двух или трех инъекций по 5 мг моноклонального антитела OKT3 у большинства пациентов развивается синдром высвобождения цитокинов с высокими уровнями фактора некроза опухоли-альфа, интерлейкина-2 и гамма-интерферона, появляющимися в кровотоке в течение 1-2 ч у реципиентов трансплантата почки. (Abramowicz et al., Transplantation. 1989 Apr; 47(4):606-8). Это приводит к узкому терапевтическому окну, которое ограничивает применимость этого антитела для лечения аутоиммунных заболеваний.
Лечение общей дозой 5-10 мг TGN1412 (0,1 мг антитела к CD28 на килограмм массы тела) приводит к системному воспалительному ответу с полиорганной недостаточностью в пределах 90 минут после введения однократной внутривенной дозы TGN1412 (Suntharalingam et al., N Engl. J Med. 2006 Sep 7; 355(10):1018-28).
Общепринято, что CD4 T-клетки играют основную роль в инициации и поддержании аутоиммунитета. Таким образом, было предложено применять mAb к поверхностным молекулам CD4 T-клеток и, в частности, mAb к CD4 в качестве иммуносупрессивных средств. Несмотря на то что множество клинических испытаний подтвердило потенциальный интерес этого подхода, они также выявили несколько проблем, которые необходимо решить для того, чтобы сделать mAb к CD4 более пригодными для применения в общепринятой клинической практике.
Было предложено несколько различных механизмов действия mAb к CD4, включая: (1) антагонизм взаимодействий CD4-MHC II, приводящий к ингибированию активации T-клеток, (2) модулирование рецептора CD4, определяемое по снижению экспрессии на клеточной поверхности CD4, (3) частичную передачу сигнала через рецептор CD4 в отсутствие связывания T-клеточного рецептора, которая может подавлять последующую активацию T-клеток и запускать апоптотическую гибель CD4 T-клеток, (4) Fc-опосредуемую комплементзависимую цитотоксичность (CDC) или антителозависимую клеточную цитотоксичность (ADCC), ведущую к истощению CD4 T-клеток, и (5) стимуляцию регуляторных T-клеток.
В клинике было разработано несколько нацеленных на T-клетки антител к CD4, (Schulze-Koops et al., J Rheumatol. 25(11): 2065-76 (1998); Mason et al., J Rheumatol. 29(2): 220-9 (2002); Choy et al., Rheumatology 39(10): 1139-46 (2000); Herzyk et al., Infect Immun. 69(2): 1032-43 (2001); Kon et al., Eur Respir J. 18(1): 45-52 (2001); Mourad et al., Transplantation 65(5): 632-41 (1998); Skov et al., Arch Dermatol. 139(11): 1433-9 (2003); Jabado et al., J Immunol. 158(1): 94-103 (1997)), главным образом, направленных на истощение CD4 клеток, среди которых только нескольким антителам к CD4 свойственен другой механизм, таким как TRX-1, TNX-355, IDEC-151, OKTcdr4A.
Клинический ответ при аутоиммунных заболеваниях коррелирует с блокадой CD4 традиционных CD4+ T-клеток прямо в области воспаления, но не с действием CD4+ T-клеток в периферической крови. Таким образом, для достижения клинической пользы необходимо использовать дозировки с высокими концентрациями антитела вплоть до 1000 мг в одном или нескольких курсах, предпочтительно в диапазоне 10-450 мг в одном или нескольких курсах (Schulze-Koops et al., J Rheumatol. 25(11): 2065-76 (1998); Mason et al., J Rheumatol. 29(2): 220-9 (2002); Choy et al., Rheumatology 39(10): 1139-46 (2000); Choy et al., Rheumatology 41: 1142-1148 (2002); Kon et al., Eur Respir J. 18(1): 45-52 (2001); Skov et al., Arch Dermatol. 139(11): 1433-9 (2003); Kuritzkes et al., J Infect Dis 2004, 189:286-91 (2004); Hepburn et al., Rheumatology 42(1):54-61 (2003)).
Антитело B-F5 (IgG1 мыши к CD4 человека) тестировали при различных аутоиммунных заболеваниях.
Антителом мыши B-F5 лечили небольшое количество пациентов с тяжелым псориазом, и были описаны некоторые положительные эффекты (Robinet et al., Eur J Dermatol. 1996; 6: 141-6, и Robinet et al., J Am Acad. Dermatol. 1997; 36: 582-8).
У пациентов с ревматоидным артритом результаты, наблюдаемые в плацебо-контролируемом испытании с суточной дозой B-F5, не показали значимого улучшения (Wendling et al. J Rheumatol; 25(8):1457-61, 1998).
У пациентов с рассеянным склерозом (MS) наблюдали некоторые положительные эффекты после лечения в течение 10 суток пациентов с ремитирующими формами, некоторые из которых не имели обострений в течение 6 месяцев после терапии (Racadot et al., J Autoimmun, 6(6):771-86, 1993). Сходные эффекты наблюдали Rumbach et al. (Mutt Scler; 1(4):207-12, 1996).
При тяжелой болезни Крона не наблюдали значимого улучшения у пациентов, получавших B-F5 в течение 7 последовательных суток (Canva-Delcambre et al., Aliment Pharmacol. Ther 10(5):721-7, 1996).
При профилактике отторжения аллотрансплантата было описано, что биодоступность B-F5 не была достаточной, чтобы позволить его применение для профилактики отторжения аллотрансплантата (Dantal et al. Transplantation, 27; 62(10): 1502-6, 1996).
Другим недостатком терапии моноклональными антителами у человека является то, что эти антитела, главным образом, получают из клеток мыши и вызывают противомышиные ответы у реципиентов-людей. Это приводит не только к более низкой эффективности лечения и, более того, какого-либо последующего лечения моноклональными антителами мыши, но также к повышенному риску анафилаксии.
Этого недостатка, в принципе, можно избежать путем применения гуманизированных антител, полученных пересадкой определяющих комплементарность областей (CDR) моноклонального антитела мыши, которые определяют антигенсвязывающую специфичность, в каркасные области (FR) молекулы иммуноглобулина человека. Целью гуманизации является получение рекомбинантного антитела, имеющего те же антигенсвязывающие свойства, что и моноклональное антитело мыши, из которого были получены последовательности CDR, и являющегося значительно менее иммуногенным у человека.
В некоторых случаях замена CDR человека на CDR из антитела мыши в каркасных областях человека является достаточной для переноса антигенсвязывающих свойств (включая не только специфичность, но также аффинность к антигену). Однако во многих антителах некоторые остатки FR важны для связывания антигена, поскольку они прямо контактируют с антигеном в комплексе антитело-антиген или поскольку они влияют на конформацию CDR и, таким образом, на их антигенсвязывающие характеристики.
Таким образом, в большинстве случаев также необходимо заменять один или несколько остатков FR человека соответствующими каркасными остатками из антитела мыши. Поскольку для предотвращения противомышиных реакций количество замещенных остатков должно быть настолько малым, насколько это возможно, задачей является определение того, какой аминокислотный остаток(ки) критичен для сохранения антигенсвязывающих свойств. Для предсказания более подходящих для замены участков были предложены различные способы. Несмотря на то что они обеспечивают общие принципы, которые могут несколько помочь на первых стадиях гуманизации, конечный результат варьирует от одного антитела к другому. Таким образом, для данного антитела очень трудно предсказать, какие замены обеспечат желаемый результат.
Ранее предпринимались попытки гуманизации B-F5 мыши, и был достигнут успех в продукции гуманизированного B-F5 (в дальнейшем в настоящем документе называемого hB-F5), имеющего сходные свойства связывания CD4 с исходным B-F5 мыши.
Таким образом, в WO 2004/083247 описано, что гуманизированное антитело BT061 (гуманизированное B-F5 или просто hB-F5) является пригодным для лечения ревматоидного артрита. В этой патентной заявке описаны композиции для парентерального введения в дозе 0,1-10 мг, предпочтительно 1-5 мг. Предусмотренные схемы дозирования представляют собой внутривенную дозу 1 мг в сутки и дозу 5 мг раз в двое суток для пациентов с ревматоидным артритом в течение 10 суток.
Это исследование также было описано Wijdenes et al. в реферате и постере, представленном на конференции EULAR в июне 2005 года. Было описано лечение 11 пациентов, страдающих ревматоидным артритом, 5 внутривенными инфузиями по 5 мг BT061 раз в двое суток с сопутствующим лечением 150 мг диклофенака (Wijdenes et al., Abstract and poster, EULAR conference, June 2005).
Антитело, описанное в этом исследовании, не раскрыто в качестве пригодного для применения в более низких дозах, и все еще является желательным нахождение способов лечения при более низких дозировках, так чтобы лечить большее количество пациентов.
Учитывая указанный выше уровень техники, целью настоящего изобретения является лечение пациентов, имеющих аутоиммунное заболевание, которые не отвечают удовлетворительно на существующие способы лечения. В частности, целью настоящего изобретения является поиск лекарственных средств от аутоиммунных заболеваний, которые можно применять у пациентов в более низких дозах, для повышения ответа на лечение у пациентов, которые не способны переносить существующие в настоящее время дозы.
Таким образом, настоящее изобретение относится к фармацевтической композиции для лечения аутоиммунного заболевания, содержащей фармацевтически приемлемый носитель и средство, способное активировать CD4+CD25+ регуляторные T-клетки, где композицию вводят субъекту в дозе от 0,2 мг до 30 мг средства.
Кроме того, изобретение относится к фармацевтической композиции для лечения аутоиммунного заболевания, содержащей фармацевтически приемлемый носитель и средство, способное активировать CD4+CD25+ регуляторные T-клетки, где композицию вводят субъекту в дозе средства от 0,10 до 20 мг/м2.
Кроме того, изобретение относится к фармацевтической композиции для лечения аутоиммунного заболевания, содержащей фармацевтически приемлемый носитель и средство, способное активировать CD4+CD25+ регуляторные T-клетки, где композицию вводят в дозе средства от 1 до 500 мкг/кг.
Кроме того, настоящее изобретение относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и средство, способное активировать CD4+CD25+ регуляторные T-клетки, где средство присутствует в концентрации от 10 мкг/мл до 150 мг/мл.
В предпочтительном аспекте изобретения средство представляет собой гуманизированное антитело к CD4 или его фрагмент или производное.
В частности изобретение относится к применению средства, определенного выше, для изготовления лекарственного средства для лечения аутоиммунного заболевания, где средство вводят субъекту в дозе, как определено выше. Кроме того, изобретение относится к средству, как определено выше, для применения при лечении аутоиммунного заболевания, где средство вводят субъекту в дозе, как определено выше.
Исходя из указанных выше дозировок понятно, что авторы изобретения неожиданно открыли, что низкие дозировки антитела BT061 обеспечивают эффективную и специфическую активацию встречающихся в природе регуляторных T-клеток (CD4+CD25+ Treg), обеспечивая in vivo клинический эффект при значительно более низких дозах, чем использованные ранее дозы, такие как дозы, раскрытые в WO 2004/083247. Кроме того, авторы изобретения неожиданно открыли, что гуманизированное антитело BT061 по существу не модулировало уровни провоспалительных цитокинов и не индуцировало их высвобождение по сравнению с другими взаимодействующими с T-клетками антителами, например антителами к CD3. Кроме того, антитело не вызывает существенного длительного истощения CD4+ лимфоцитов.
Концентрация средства по изобретению конкретно не ограничена, при условии что оно присутствует в концентрации, которая является низкой по сравнению с известными концентрациями. Однако предпочтительно концентрация средства составляет от 0,1 мкг/мл до 30 мг/мл или от 0,1 до 1000 мкг/мл и более предпочтительно 1-500 мкг/мл и 2-250 мкг/мл. Наиболее предпочтительно концентрация средства является (приблизительно) любой из 15 мкг/мл, 25 мкг/мл, 125 мкг/мл, 250 мкг/мл, 500 мкг/мл, 1 мг/мл, 12,5 мг/мл или 25 мг/мл.
Объем дозировки, вводимой субъекту с использованием композиции, конкретно не ограничен, при условии что он доставляет низкую общую дозировку по сравнению с уже известными дозировками, и, таким образом, пригоден для всех пациентов вследствие более низкого уровня побочных действий и особенно для лечения индивидуумов, которые не переносят дозы, описанные в WO 2004/083247. В частности, концентрация средства в объемах дозировок может варьировать для обеспечения требуемых доз, которые описаны в этой заявке.
Объем дозировки может варьировать в зависимости от способа введения. Предпочтительным является парентеральное введение. Примерами парентерального введения являются внутримышечное введение, внутривенное введение или подкожное введение. Когда композицию вводят внутривенной инфузией, объем дозировки может составлять от 0,1 или 0,5 мл до 500 мл, предпочтительно между 15 и 25 мл и, как правило, приблизительно 20 мл. Когда композицию вводят подкожной или внутримышечной инъекцией, объем дозировки может составлять между 0,1 и 3 мл, предпочтительно между 0,5 и 1,5 мл и, как правило, приблизительно 1 мл.
Однако в некоторых вариантах осуществления композиция может быть предоставлена в концентрированной форме и разбавлена до концентрации, требуемой для рассматриваемых индивидов. Предпочтительно в этих случаях композицию предоставляют в относительно небольших объемах приблизительно 1, 2, 3, 4 или 5 мл. В альтернативных вариантах осуществления композицию предоставляют в требуемой концентрации в объеме дозировки, описанном выше (т.е. в готовом для введения виде). В одном конкретном варианте осуществления фармацевтические композиции для подкожного введения предоставляют в готовой для введения форме, так что их может легко вводить лицо, не являющееся медицинским персоналом.
Как упоминалось, ранее не было известно, что средства, способные лечить аутоиммунное заболевание, можно вводить в низких дозировках, которые предусматриваются настоящим изобретением. Хотя известные дозы средств, способных лечить аутоиммунное заболевание, являются эффективными у некоторых индивидов или при некоторых типах заболеваний, понимание того, что они могут быть эффективны уже при более низких дозах, открыло путь для более эффективного лечения некоторых аутоиммунных заболеваний и классов пациентов.
Изобретение проиллюстрировано только в качестве примера с помощью следующих фигур.
На фиг.1 представлена зависимость от дозы связывания BT061 с периферическими лимфоцитами человека. Связывание BT061 в серии разведений выявляют с помощью меченного флуорохромом антитела против IgG человека. Средняя интенсивность флуоресцении определена проточным цитометрическим анализом.
На фиг.2 представлена схема очистки CD4+CD25+ регуляторных T-клеток и CD4+CD25- эффекторных клеток с помощью комбинированных стадий положительной и отрицательной селекции.
На фиг.3 показана нуклеотидная последовательность, кодирующая VH-область B-F5 мыши (SEQ ID NO:5).
На фиг.4 представлена нуклеотидная последовательность, кодирующая Vk-область B-F5 мыши (SEQ ID NO:6).
На фиг.5 представлена нуклеотидная последовательность (SEQ ID NO:3) фрагмента плазмиды, кодирующая VH-область гуманизированного BF-5. Последовательность, кодирующая V-область, подчеркнута, и соответствующая полипептидная последовательность (SEQ ID NO:17) указана ниже нуклеотидной последовательности.
На фиг.6 представлена нуклеотидная последовательность (SEQ ID NO:4) фрагмента плазмиды, кодирующая VK-область гуманизированного BF-5. Последовательность, кодирующая V-область, подчеркнута, и соответствующая полипептидная последовательность (SEQ ID NO:2) указана ниже нуклеотидной последовательности.
На фиг.7 представлены данные, полученные от свежих выделенных CD25+ Treg (донор-A) и СВ8+ T-клеток (донор-B), культивированных в присутствии облученных PBMC (донор-A) в присутствии/отсутствие различных mAb к CD4. Пролиферацию аллореактивных СВ8+ T-клеток определяли после культивирования в течение 4 суток путем добавления 37 кБк/лунка 3H-Tdr. Представлены средние значения cpm (в трех параллелях).
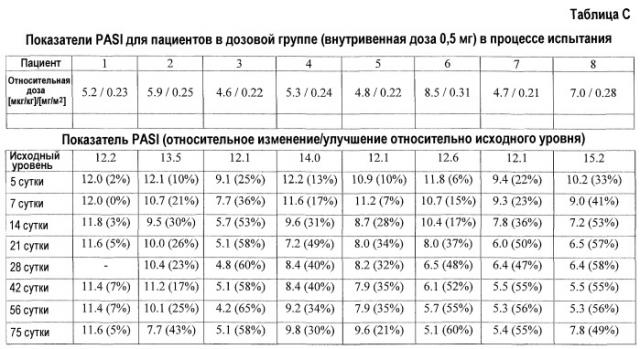
На фиг.8, части A-H, представлены графики, на которых показаны данные клинических испытаний у пациентов с псориазом дозовой группы I, как описано в примере 3, в которой пациентам проводили внутривенную инъекцию 0,5 мг BT061 или плацебо. В частях A-H фиг.8 предоставлены графики показателей PASI для пациентов 1-8 в дозовой группе I соответственно.
На фиг.9, части A-H, представлены графики, на которых показаны данные клинических испытаний у пациентов с псориазом дозовой группы II, как описано в примере 3, в которой пациентам проводили внутривенную инъекцию 2,5 мг BT061 или плацебо. В частях A-H фиг.9 предоставлены графики показателей PASI для пациентов 1-8 в дозовой группе II соответственно.
На фиг.10 соответственно представлено высвобождение TFNα и IL-6, наблюдаемое в клиническом испытании с BT061 (однократная внутривенная инфузия или подкожная инъекция) у здоровых добровольцев по сравнению с уровнями, описанными для моноклональных антител к CD3. В фигуры включены уровни доз и время до выздоровления. Результаты для TRX4, указанные на фигурах в качестве "2)", описаны в Keymeulen et al., 2005 N. Engl. J. Med. Type 1 Diabetes patients. Результаты для теплизумаба, указанные на фигурах в качестве "3)", описаны в Herold et al., 2002 N. Engl. J. Med. Type 1 Diabetes patients. Нормальные значения, указанные на фигурах в качестве "4)", описаны в Straub et al., 2007, Athr. & Rheumat. "*)" соответствует однократной дозе, "**)" соответствует совокупной дозе до достижения пиковой концентрации.
На фиг.11 представлены уровни IL-2 и IFN-γ в плазме после введения однократной внутривенной или подкожной дозы BT061 у здоровых добровольцев. ULN = верхняя граница нормы (вычисленная исходя из уровней цитокинов, определенных у 39 здоровых субъектов; ULN = среднее значение + 2 × стандартное отклонение).
На фиг.12 представлена кинетика количества CD4-клеток (количество клеток на мл плазмы) у добровольцев, которым ввели однократную внутривенную дозу BT061. Представлены средние значения для 3 пациентов на группу. Пунктирная линия указывает на верхнюю границу нормы (ULN) и нижнюю границу нормы (LLN).
На фиг.13 представлена кинетика количества CD4-клеток (количество клеток на мл плазмы) у добровольцев, которым ввели однократную подкожную дозу BT061. Представлены средние значения для 3 пациентов на группу. Пунктирная линия указывает на верхнюю границу нормы (ULN) и нижнюю границу нормы (LLN), обе из которых вычислены исходя из количества CD4-клеток, определенного у 5 здоровых субъектов в качестве средней величины до введения дозы плюс (или минус) 2 × стандартное отклонение.
На фиг.14, части A и B, предоставлены фотографии клинического испытания у пациентов с псориазом, как описано в примере 3. Фотографии являются фотографиями пациента, являющегося представителем дозовой группы II. Фотография, представленная в части A, получена перед введением. Фотография, представленная в части B, получена через 28 суток после введения.
На фиг.15 представлены результаты клинического испытания у пациентов с ревматоидным артритом, как описано в примере 5. На фигуре представлена гистограмма процента пациентов из дозовых групп, в которых подкожно вводили 1,25 мг, 6,25 мг, 12,5 мг и 25 мг BT061, достигших по меньшей мере ответа ACR20. Шести пациентам в каждой группе вводили дозу антитела, в то время как двум пациентам вводили плацебо.
На фиг.16A и 16B представлены результаты клинического испытания у пациентов с ревматоидным артритом, как описано в примере 5. На фиг.16A представлена гистограмма числа болезненных суставов у пациентов из дозовой группы, в которой подкожно вводили 25 мг BT061. На фиг.16B представлена гистограмма для числа увеличенных суставов у пациентов из той же дозовой группы. Шести пациентам в каждой группе вводили дозу антитела, в то время как двум пациентам вводили плацебо.
На фиг.17A и 17B представлены результаты клинического испытания у пациентов с ревматоидным артритом, как описано в примере 5. На фигурах представлены изменения индивидуальных параметров (в %) для одного отвечающего пациента (фиг.17A) и одного неотвечающего пациента (фиг.17B) из группы подкожной дозы 25 мг. На фигурах "Pat GA" и "Phy GA" относятся к общей оценке пациентом и общей оценке врачом соответственно. Термин "PA боли" относится к оценке пациентом боли.
На фиг.18A и 18B предоставлены дальнейшие результаты клинического испытания у пациентов с ревматоидным артритом, как описано в примере 5. На фигурах представлено количество болезненных суставов у пациентов из группы подкожной дозы 1,25 мг (фиг.18A) и из группы подкожной дозы 6,25 мг (фиг.18B).
На фиг.19A и 19B предоставлены дальнейшие результаты клинического испытания у пациентов с ревматоидным артритом, как описано в примере 5. На фигурах представлено количество болезненных суставов у пациентов из группы подкожной дозы 50 мг (фиг.19A) и из группы внутривенной дозы 6,25 мг (фиг.19B).
На фиг.20 представлено выравнивание полипептидных последовательностей VK B-F5 мыши (SEQ ID NO:8), FK-001 (SEQ ID NO:9, 10, 11 и 12), L4L (SEQ ID NO:18) и L4M (SEQ ID NO:2) при конструировании гуманизированной формы B-F5 (т.е. BT061).
На фиг.21 представлено выравнивание полипептидных последовательностей VH B-F5 мыши (SEQ ID NO:7), M26 (SEQ ID NO:13, 14, 15 и 16), H37L (SEQ ID NO:1) и H37V (SEQ ID NO:17) при конструировании гуманизированной формы B-F5.
Далее изобретение описано более подробно.
Средства, которые пригодны для применения в настоящем изобретении, представляют собой средства, способные активировать CD4+CD25+ регуляторные T-клетки. Средство может представлять собой полипептид, белок или антитело. Когда средство представляет собой антитело, оно может представлять собой моноклональное антитело. Предпочтительно антитело представляет собой моноклональное антитело к CD4. Также антитело может предпочтительно представлять собой IgG1-антитело, и оно может представлять собой немодифицированное IgG1-антитело.
В предпочтительном аспекте изобретения средство не вызывает существенного увеличения уровня провоспалительных цитокинов в плазме крови субъекта после введения по сравнению с антителами к CD3. В частности, уровни IFN-γ, TNF-α, IL-6 и/или IL-2 после введения средства по существу не повышаются по сравнению с уровнями плазмы, измеренными у здоровых субъектов (см. таблицу A1). Конкретно, если ULN для конкретного цитокина, приведенную в таблице A1, принять за X, тогда в пределах 96 часов после введения средства по изобретению X увеличивается менее чем в 20 раз. Предпочтительно X увеличивается менее чем в 10 раз. Более предпочтительно эти уровни представляют собой уровни в течение периода, составляющего от 10 минут после начала введения до 96 часов после завершения введения.
Возможно, что у пациентов с аутоиммунным заболеванием уровни цитокинов перед введением средства уже выше, чем уровни, наблюдаемые у здоровых субъектов (ULN, приведенная в таблице A1), например, вследствие модифицированного статуса активации иммунных клеток по сравнению со статусом активации клеток у здоровых субъектов. В этих случаях за X принимают концентрацию конкретного цитокина непосредственно перед введением, и в пределах 96 часов после введения средства по изобретению X увеличивается менее чем в 20 раз. Предпочтительно X увеличивается менее чем в 10 раз. Более предпочтительно эти уровни представляют собой уровни в течение периода, составляющего 10 минут после начала введения до 96 часов после завершения введения.
| Таблица A1 Уровни цитокинов, измеренные в плазме здоровых добровольцев. ULN (верхняя граница нормы) вычислена исходя из средних значений, измеренных для 39 отдельных субъектов + 2 × стандартное отклонение | |
| Цитокин | ULN (пг/мл) |
| IL-2 | 19,4 |
| IL-6 | 4,4 |
| TNF-альфа | 2,8 |
| IFN-гамма | 3,8 |
В следующем предпочтительном аспекте изобретения средство не вызывает существенного длительного снижения числа CD4+ лимфоцитов в плазме крови субъекта. Конкретно, в пределах периода от 72 до 96 часов после введения число CD4+ лимфоцитов в плазме крови субъекта может составлять более 250 клеток/мкл (или по меньшей мере 250 клеток/мкл).
Предпочтительно эффекты на цитокины и CD4+ лимфоциты, описанные выше, наблюдают по меньшей мере у 80% подвергаемых лечению пациентов.
Для предотвращения отрицательного влияния на иммунную систему, например снижения числа лимфоцитов или индукции высвобождения цитокинов, в данной области известно применение антител (особенно взаимодействующих с T-клетками антител) подкласса IgG2, IgG3 или IgG4, поскольку антитела подкласса IgG1 проявляют более высокие взаимодействия с Fc-рецептором. Также в данной области известна модификация антител (особенно взаимодействующих с T-клетками антител) путем мутации, дегликозилирования, модификации углеводной части или инженерии углеводной части Fc для уменьшения взаимодействий с Fc-рецептором.
В экспериментах, описанных в настоящем документе, авторы настоящего изобретения выявили, что для средства по настоящему изобретению не обязательны избежание антител подкласса IgG1 и модификации. В частности, данные, представленные в этой патентной заявке, указывают на то, что средство по настоящему изобретению не проявляет существенного или длительного истощения CD4+ клеток или не индуцирует существенного высвобождения цитокинов по сравнению с антителами к CD3.
Таким образом, в предпочтительном аспекте изобретения средство представляет собой немодифицированное антитело IgG1, т.е. антитело, которое не включает мутацию Fc и не подвергнуто дегликозилированию, модификации углеводной части или инженерии углеводной части для уменьшения взаимодействий с Fc-рецептором, или его фрагмент или производное.
Антитела, которые наиболее пригодны для применения в настоящем изобретении, представляют собой гуманизированные антитела к CD4 или их фрагменты или производные, которые способны активировать CD4+CD25+ регуляторные T-клетки. Примеры антител, которые способны активировать CD4+CD25+ регуляторные T-клетки, рассмотрены в Becker et al. (European Journal of Immunology (2007), Vol.37: pages 1217-1223).
Как правило, антитело, используемое в изобретении, содержит один или несколько вариабельных доменов, которые способы связываться с CD4. Антитело может содержать константную область (Fc) человека. Эту константную область можно выбирать из константных доменов любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и любого изотипа, включая IgG1, IgG2, IgG3 и IgG4. Предпочтительные константные области выбирают из константных доменов IgG, в частности IgG1.
Также настоящее изобретение включает любой фрагмент антитела, содержащий его V-области. Оно включает, в частности, Fab-, Fab'-, F(ab)'2-, Fv- и scFv-фрагменты.
В особенно предпочтительном аспекте настоящего изобретения антитело представляет собой гуманизированное антитело к CD4 или его фрагмент или производное, полученное из моноклонального антитела к CD4 мыши B-F5. Примером такого антитела является антитело BT061.
Антитело BT061, его фрагменты и производные
Гуманизированное антитело BT061 (hB-F5) происходит из mAb B-F5 мыши, и оно имеет V-домены, определенные следующими полипептидными последовательностями:
- V-домен H-цепи:
EEQLVESGGGLVKPGGSLRLSCAASGFSFSDCRMYWLRQAPGKGLEWIGVISVKSENYGANYAESVRGRFTISRDDSKNTVYLQMNSLKTEDTAVYYCSASYYRYDVGAWFAYWGQGTLVTVSS (SEQ ID NO:1)
- V-домен L-цепи:
DIVMTQSPDSLAVSLGERATINCRASKSVSTSGYSYIYWYQQKPGQPPKLLIYLASILESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQHSRELPWTFGQGTKVEIK (SEQ ID NO:2).
Производные этого антитела также пригодны для применения в настоящем изобретении. Производные включают производные с V-доменами, определенными полипептидными последовательностями