Высокодисперсная комбинированная фармацевтическая композиция беклометазона и сальбутамола с бета-глицином и способ ее получения
Иллюстрации
Показать всеИзобретение относится к области химико-фармацевтической промышленности, в частности к созданию аэрозольной композиции, используемой для введения лекарственных средств с помощью ингаляции. Фармацевтическая композиция включает в качестве лекарственных препаратов дипропионат беклометазона и сальбутамол, носителем служит бета-глицин. Композицию получают распылением в емкость с жидким азотом растворов исходных лекарственных препаратов в смешанном растворителе с последующим удалением из полученной распылением смеси твердых фаз растворителей в токе сухого азота при давлении 600±20 мторр до падения давления менее 8 мторр при отключении подачи азота путем ступенчатого повышения температуры: в интервале от -196°C до -15°C, затем от -15°C до +30°C. В качестве исходных веществ используют дипропионат беклометазона 1,9-5,1 мас.%, сальбутамол 1,9-10,2 мас.%, альфа-глицин до 100%. В состав смешанного растворителя входят тетрагидрофуран 5-15 мас.%, трет-бутиловый спирт 15-5 мас.%, вода 77-80 мас.%. Изобретение обеспечивает получение высокодисперсной фармацевтической композиции сальбутамола и дипропионата беклометазона. 2 н.п. ф-лы, 10 ил., 3 табл., 5 пр.
Реферат
Изобретение относится к области химико-фармацевтической промышленности, в частности к способам создания аэрозольных композиций, используемых для введения лекарственных средств с помощью ингаляции, в том числе фармацевтических аэрозольных композиций, которые включают в качестве лекарственных веществ беклометазон и сальбутамол.
Для заболеваний с локализацией патологического процесса в дыхательных путях наиболее логичным представляется местное применение лекарственных веществ путем ингаляций. Существенным преимуществом ингаляционной терапии является высокая концентрация медикаментов в дыхательных путях при незначительном общем количестве препарата и низкой его концентрации во всем организме за счет разбавления после поглощения. Ингаляционные формы препаратов являются более предпочтительными, поскольку клинический эффект наступает значительно быстрее при минимальных побочных эффектах терапии, т.е. ингаляцию можно сравнить с наружным применением медикаментов [Середа В.П., Свистов А.С. “Ингаляционная терапия хронических обструктивных заболеваний легких” // ФАРМиндекс: Практик, 2003, вып.4]. Для создания высокоэффективных ингаляционных форм необходимы исходные субстанции, содержащие микро- и наночастицы заданного размера [Chow A.H.L., Tong H.H.Y., Chattopadhyay P., Shekunov B.Y. Particle engineering for pulmonary drug delivery // Pharm Res. 2007, V.24(3), p.411-437], обладающие нужными технологическими свойствами (высокая сыпучесть, низкая насыпная плотность, отсутствие склонности к агрегации при хранении и транспортировке).
Настоящий уровень знаний и опыт международных клинических исследований не рекомендуют использование длительнодействующих β2-агонистов в качестве систематической монотерапии при бронхиальной астме, ибо такое лечение может маскировать хроническое воспаление в нижних дыхательных путях и увеличивать риск развития тяжелых обострений бронхиальной астмы [Середа В.П., Свистов А.С. “Ингаляционная терапия хронических обструктивных заболеваний легких” // ФАРМиндекс: Практик, 2003, вып.4]. Согласно современным представлениям наиболее оптимальным способом лечения бронхиальной астмы является создание комбинированных препаратов. Сочетание ингаляционных глюкокортикостероидов (иГКС) и β2-агонистов обладает синергизмом действия, связанным с особенностями механизма их действия на клеточном и молекулярном уровнях и приводит к снижению частоты обострений бронхиальной астмы.
Положительными сторонами комбинаций 2 препаратов являются удобство (отпадает необходимость одновременного использования 2 ингаляторов); экономический эффект (применение двух лекарственных форм раздельно стоит дороже), повышается эффективность (уменьшается необходимая доза каждого из действующих веществ); невозможность для пациентов использования длительнодействующих β2-агонистов изолированно, по своему усмотрению отказываясь от иГКС, что нередко бывает при раздельном употреблении лекарств. Перечисленные характеристики в сочетании с эффективными средствами доставки лекарственных препаратов (порошковые ингаляторы различных типов действия) значительно улучшают комплаентность (степень соответствия между поведением пациента и рекомендациями, полученными от врача) лечения, что имеет важное значение для повышения его эффективности. При комбинации двух действующих веществ необходимо получать однородные по составу порошки для ингаляционного введения, так как только в этом случае возможно равномерное распределение обоих препаратов в одних и тех же отделах бронхов. Причем совпадение точек локализации откладываемых препаратов приводит к синергизму, усилению суммарного взаимодействия иГКС и β2-агонистов в проявлении противовоспалительного действия.
Применение аэрозолей из порошковых ингаляторов имеет по сравнению с дозирующими ингаляторами то преимущество, что частички лекарства ингалируются постепенно за счет вдоха пациента. Они меньше оседают в ротоглотке в связи с отсутствием большого ускорения, которое наблюдается при высвобождении частиц из аэрозольных баллончиков. При этом сохранено такое важное преимущество лекарственной формы, как портативность, существенно повышающее комплаентность лечения. Кроме того, исключено раздражающее действие пропеллентов (газов-носителей) на слизистую оболочку дыхательных путей. В наибольшей степени это относилось к выпускаемым дозирующими ингаляторам, содержащим в качестве газа-носителя хладоны. К недостаткам этих лекарственных форм можно отнести потерю части дозы препарата в ингаляторе, наблюдаемый в редких случаях ирритативный эффект (раздражающее действие порошка на дыхательные пути, возникновение кашля и бронхоспазма) и более высокую стоимость лекарственных препаратов.
Известен способ получения комбинированных высокодисперсных композиций, содержащих одновременно сульфат сальбутамола и дипропионат беклометазона (прототип по лекарственным веществам - компонентам композиции) для использования в порошковых ингаляторах [T.P. Learoyd, J.L. Burrows, E. French, P.C. Seville. Sustained delivery of salbutamol and beclometasone from spray-dried double emulsions // Journal of Microencapsulation, 2010, 27(2), p.162-170], основанный на распылительной сушке двойных микроэмульсий, содержащие лейцин в качестве основного носителя (увеличивает дисперсность порошков для ингаляций), поли-лактид-ко-гликолид (50:50) (модификатор высвобождения лекарственных веществ) и низкомолекулярный хитозан (стабилизатор эмульсии). Получаемые по данному способу композиции представляют собой легкие (плотность утряски приготовленных композиций не зависит от содержания в них лекарственных веществ и составляет 0,17-0,25 г/см3), свободнотекучие и мало склонные к аггрегации порошки, состоящие из полых сферических частиц (диаметр 0,5-5 мкм). По данным экспериментов ДСК, полученные таким способом порошки являются аморфными и сохраняются в этом состоянии, по меньшей мере, в течение 1 месяца. Для них характерны высокие значения респирабельной фракции (около 60%) при значениях “выпущенной дозы” более 95% для всей серии полученных композиций.
Известен способ получения высокодисперсных композиций сальбутамола (прототип по способу получения) для использования в порошковых ингаляторах [Ekaterina G. Zevak, Audrey G. Ogienko, Elena V. Boldyreva, Svetlana A. Myz, Anna A. Ogienko, Yuliya E. Kovalenko, Boris A. Kolesov, Valery A. Drebushchak, Nikolay A. Trofimov, Alexander A. Krasnikov, Andrey Y. Manakov, Vladimir V. Boldyrev. Salbutamol-Glycine Composite Microballs for Pulmonary Drug Delivery // RDD Europe 2013 (2013), Vol 2, p.329-334], основанный на сублимационной сушке замороженных распылением в емкость с жидким азотом растворов, содержащих одновременно лекарственное вещество (сальбутамол) и носитель (глицин), в смешанном растворителе тетрагидрофуран-вода (~22.5 масс.% тетрагидрофурана). Получаемые по данному способу композиции представляют собой чрезвычайно легкие пушистые порошки, состоящие из пористых сферических агломератов (диаметр 30-70 мкм), состоящих из объединенных в перфорированные слои отдельных частиц, размер которых составляет несколько десятков нанометров. В этих композициях лекарственное вещество равномерно распределено на молекулярном уровне между наноразмерными блоками глицина. Для этих композиций характерны высокие значения удельной площадью поверхности (24,4-29,1 м2/г), низкая насыпная плотность (0,465 г композиции занимает объем ~25 мл, что составляет менее 0,02 г/см3) и чрезвычайно высокие значения респирабельной фракции (67,4±2,3%).
В качестве недостатков приведенных прототипов можно указать трудоемкость процесса приготовления двойных микроэмульсий и, как следствие, сложности при масштабировании процесса (прототип по лекарственным веществам - компонентам композиции). В случае использования метода сублимацинной сушки замороженных (распылением в емкость с жидким азотом) растворов (прототип по способу получения), необходимо приготовить исходный раствор, в котором были бы достаточные концентрации дипропионата беклометазона и сальбутамола, плохо растворимых в воде и обладающих различной растворимостью в различных смесях “легкокипящая жидкость-вода” со строго определенными концентрационными диапазонами, пригодных для использования по методу сублимационной сушки замороженных растворов в системах с клатратообразованием [Огиенко А.Г., Болдырева Е.В., Манаков А.Ю., Мызь С.А., Огиенко А.А., Юношев А.С., Зевак Е.Г., Кутаев Н.В., Красников А.А. “Получение высокодисперсных форм лекарственных препаратов с использованием сублимационной сушки замороженных растворов в системах с клатратообразованием” // Доклады Академии Наук, 2012, том 444, №5, с.514-518]. Дипропионат беклометазона не растворим в смешанном растворителе ТГФ-вода (до 25 масс.% ТГФ), поэтому получение комбинированной композиции по способу, описанному в [Ekaterina G. Zevak, Andrey G. Ogienko, Elena V. Boldyreva, Svetlana A. Myz, Anna A. Ogienko, Yuliya E. Kovalenko, Boris A. Kolesov, Valery A. Drebushchak, Nikolay A. Trofimov, Alexander A. Krasnikov, Andrey Y. Manakov, Vladimir V. Boldyrev. Salbutamol-Glycine Composite Microballs for Pulmonary Drug Delivery // RDD Europe 2013 (2013), Vol.2, p.329-334] (прототип по способу получения), с использованием данного двойного смешанного растворителя невозможно.
Сальбутамол и дипропионат белометазона хорошо растворимы в спиртах, однако вследствие плохой растворимости в спиртах простых аминокислот (глицина) необходимо использовать водно-спиртовые растворы. Однако в наших предварительных экспериментах было зафиксировано образование метастабильной жидкости при нагревании образующихся при быстром замораживании растворов “этиловый спирт-вода” стеклообразных фаз, что делает проведение сублимационной сушки практически невозможным, вследствие, главным образом, значительно более медленного удаления жидкости (испарением) из получающегося высоковязкого “раствора” при низких температурах. Кроме того, вследствие низкого положения тройных точек (температура, давление) метанола, этанола, н-пропанола и изо-пропанола, а также малой термической устойчивости соответствующих гидратов этих спиртов [W. Takaizumi, T. Wakabayashi. “The Freezing Process in Methanol-, Ethanol-, and Propanol-Water Syatems as Revealed by Differential Scanning Calorimetry” // Journal of Solution Chemistry, 1997, 26(10), p.927-939; A. Yu. Manakov, L.S. Aladko, A.G. Ogienko, A.I. Ancharov. ″Hydrate formation in the system n-propanol-water″ // J. Therm. Analys. Calorim., 2013, 111(1), p.885-890; Aladko L.S., Manakov A. Yu., Ogienko A.G., Ancharov A.I. ″New data on phase diagram and clathrate formation in the system water-isopropyl alcohol″ // J. Incl. Phenom., 2009, 63, p.151-157] и низкого (по температуре) положения эвтектик в перечисленных выше системах спирт - вода, использование указанных смесей растворителей мы считаем экономически нецелесообразным вследствие необходимости длительного выдерживания при температурах ниже температур плавления эвтектик в этих системах (ниже -70°C и ниже) при пониженном давлении для удаления спиртов сублимацией для предотвращения образования жидких фаз, приводящих к перекристаллизации первоначально образовавшихся дисперсных частиц, и их укрупнению.
Известен единственный случай целенаправленного применения системы с гидратообразованием типа спирт - вода (трет-бутанол - вода) для получения кристаллической формы антибиотика цепалотина [C. Telang, R. Suryanarayanan. ″Crystallization of Cephalothin Sodium During Lyophilization from tert-Butyl Alcohol-Water Cosolvent System″ // Pharmaceutical Research, 2005, 22(1), p.153-160] и стабилизации простогландинов [D.L. Teagarden, W.J. Petre, P.M. Gold. Stabilized prostaglandin E1. U.S. Patent No. 5741523, 1998]. В основе этих работ лежат работы группы профессора P.P. DeLuca, в которых с использованием метода ДСК была построена фазовая диаграмма системы трет-бутанол - вода [K. Kasraian, P.P. DeLuca. ″Thermal Analysis of the Tertiary Butyl Alcohol-Water System and Its Implications on Freeze-Drying″ // Pharmaceutical Research, 1995, 12(4), p.484-490] и показана целесообразность добавления небольших количеств трет-бутанола (5 масс.%), что существенно сокращает продолжительность первой стадии сушки (по сравнению с сублимационной сушкой водных растворов) при более чем 10-кратном увеличении удельной площади поверхности получаемого продукта [K. Kasraian, P.P. DeLuca. ″The Effect of Tertiary Butyl Alcohol on the Resistance of the Dry Product Layer During Primary Drying″ // Pharmaceutical Research, 1995, 12(4), p.491-495].
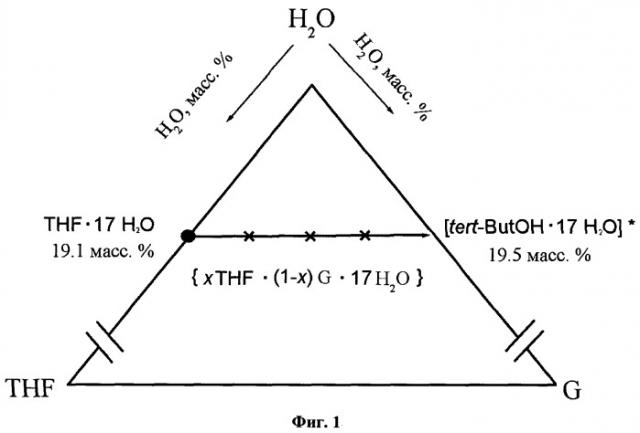
Известно, что клатратный гидрат, образующийся в системе тетрагидрофуран - вода, обладает наибольшей термической устойчивостью среди всех известных к настоящему времени гидратов кубической структуры II, образуемых легкокипящими жидкостями [Dyadin Y.A., Bondaryuk I.V., Zhurko F.V. Clathrate hydrates at high pressures. In: Inclusion compounds. V.5, Oxford University Press; 1991, p.214-275.]. Поэтому мы предположили (Фиг.1, Иллюстрация предложенной нами стратегии поиска двойных клатратных гидратов в тройных системах ТГФ - спирт (этиловый, трет-бутиловый) - вода. * - обозначен состав гипотетического гидрата КС-II трет-бутанола. Х - схематически обозначены составы образцов, выбранных для проведения предварительных экспериментов с использованием порошковой рентгеновской дифракции in situ, спектроскопии КР in situ и ДТА), что добавление некоторых количеств второго компонента (трет-бутанол) до требуемой стехиометрии (ТГФ + второй компонент)·17H2O (массовое содержание ТГФ в клатратном гидрате КС-II: 19,1%; трет-бутанола в гипотетическом клатратном гидрате КС-II: 19,5%) сделает возможным образование двойного клатратного гидрата кубической структуры II, с частичной заменой молекул ТГФ в больших полостях молекулами второго компонента, по аналогии с влиянием молекул вспомогательного газа на стабильность клатратных гидратов кубической структуры II и гексагональной структуры III [Dyadin Y.A., Bondaryuk I.V., Zhurko F.V. Clathrate hydrates at high pressures. In: Inclusion compounds. V.5, Oxford University Press; 1991, p.214-275.; Y. Park, M. Cha, W. Shin, Jong-Ho Cha, H. Lee, J. Ripmeester ″Thermodinamic and spectroscopic analysis of tertbutyl alcohol hydrate: application for the methane gas storage and transportation″ // Proceedings of the 6th International Conference on Gas Hydrates (ICGH 2008), Vanouver, British Columbia, CANADA, July 6-10, 2008], что даст возможность проводить удаление компонентов замороженной смеси сублимацией при достаточно высоких температурах. Однако до настоящего времени возможность образования двойных клатратных гидратов при охлаждении раствора с использованием чрезвычайно больших скоростей охлаждения (распылением в емкость с криогенной жидкостью) в сравнении с процессами, протекающими при медленном охлаждении растворов, вообще никак не исследовалась.
Таким образом, для создания системных комбинированных препаратов нового поколения для лечения бронхиальной астмы и купирования бронхоспазмов, с использованием метода сублимационной сушки замороженных растворов, необходимо создать рабочий раствор, в котором были бы достаточные концентрации ингаляционного глюкокортикостероида (дипропионата беклометазона) и β2-агониста (сальбутамола), одинаково плохо растворимых в воде и обладающих различной растворимостью в водно-спиртовых растворах и растворах ТГФ-вода. Для выполнения поставленной задачи необходимо не только исследовать влияние стабилизирующего каркас дополнительного компонента и диапазон устойчивости образующегося при этом соединения переменного состава, влияние концентрации стабилизирующего каркас компонента на термическую устойчивость образующегося соединения, с обобщением всех полученных данных построением модели фазовой диаграммы исследуемой трехкомпонентной системы и ее характеристических сечений.
В предлагаемом изобретении в качестве вещества-носителя используется бета-глицин вместо смешанного носителя, состоящего из лейцина, поли-лактид-ко-гликолида 50:50 (PLGA 50:50) и низкомолекулярного хитозана; в качестве способа получения вместо метода распылительной сушки двойных микроэмульсий предложен метод сублимационной сушки замороженных растворов (распылением в емкость с жидким азотом) компонентов (дипропионата беклометазона, сальбутамола и глицина) создаваемой композиции в смешанном растворителе тетрагидрофуран-трет-бутиловый спирт-вода.
Из уровня техники подобной фармацевтической композиции (сальбутамол + дипропионат беклометазона + бета-глицин) для создания ингаляционной лекарственной формы для лечения бронхиальной астмы и способа получения композиций не обнаружено.
Задачей настоящего изобретения является разработка способа получения и создание высокодисперсной комбинированной фармацевтической композиции сальбутамола и дипропионата беклометазона, где в качестве носителя выступает бета-глицин.
Технический результат состоит в том, что получаемые композиции представляют собой порошки, состоящие из пористых сферических агломератов (диаметр до 50 мкм) и отдельных фрагментов, образовавшихся при разрушении агломератов, которые представляют собой совокупность объединенных в перфорированные слои отдельных частиц, при этом сальбутамол и дипропионат беклометазона диспергированы между наноразмерными блоками хорошо растворимого вещества-носителя (бета-глицина). При этом, в отличие от композиций, представляющих собой микронизированные субстанции лекарственных веществ либо их смеси с грубодисперсными носителями, для получаемых по данному способу композиций характерно отсутствие слеживания при хранении.
Таким образом, достигается повышение однородности получаемой композиции, удобство при создании готовых форм и дозировании, вследствие уже имеющегося разбавления носителем, высокие скорости высвобождения лекарственного вещества в организме, отсутствие у композиций склонности к агломерации.
Поставленная задача была решена быстрым охлаждением растворов исходных веществ (сальбутамола, дипропионата беклометазона и глицина) в смешанном растворителе ″тетрагидрофуран-трет-бутиловый спирт-вода″ (5-15 масс.% ТГФ, 15-5 масс.% ТБС, 77-80 масс % воды), с последующим ступенчатым повышением температуры при пониженном давлении в токе сухого азота при давлении 600±20 мторр до падения давления менее 8 мторр: в интервале от -196°C до -15°C для разложения образующегося в системе тетрагидрофуран - трет-бутиловый спирт - вода двойного клатратного гидрата и удаления сублимацией других соединений (дигидрат трет-бутилового спирта ТБС·2H2O, клатратный гидрат тетрагидрофурана ТГФ·17H2O, лед Ih), образующихся при быстром охлаждении исходного раствора, затем от -15°C до +30°C для удаления остаточной влаги.
Обоснование введенных признаков
1. Выбор концентрационного диапазона используемой смеси растворителей.
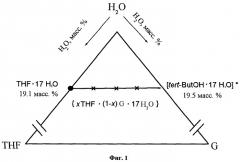
На основании нашего предположения об образовании двойного клатратного гидрата кубической структуры II в тройной системе ТГФ - ТБС - вода, мы провели моделирования возможных вариантов строения фазовой диаграммы системы в субсолидусной области. Таким образом, точка состава образующегося двойного клатратного гидрата лежит на отрезке, соединяющем состав клатратного гидрата ТГФ·17H2O (19,6 масс.% ТГФ) и состав гипотетического клатратного гидрата ″ТБС·17H2O″ (19,4 масс.% ТБС) в соответствующих двойных системах (Фиг.1). При этом часть больших полостей в структуре двойного клатратного гидрата заняты молекулами ТГФ, часть - молекулами ТБС (молекулы ТБС не встраиваются в водный каркас), общая формула «(ТГФ+ТБС)·17H2O». В случае, если двойной клатратный гидрат - фаза постоянного состава, соотношение ТГФ:ТБС остается постоянным; в случае же, если двойной клатратный гидрат - фаза переменного состава, соотношение ТГФ:ТБС может меняться в некотором интервале и состав соединения будет выражаться формулой «хТГФ (1-х)ТБС·17H2O». На Фиг.2 приведены варианты триангуляции системы ТГФ - ТБС - вода, Т - обозначение состава двойного клатратного гидрата. Видно, что в интересующей нас концентрационной области при любом способе триангуляции общий вид характеристического политермического сечения будет одинаков (т.к. во всех вариантах триангуляции присутствуют треугольники «ТГФ·17H2O, H2O, Т» и «Т, H2O, ТБС·2H2O (обозначение вершин)) и будет зависеть только от типа плавления (конгруэнтное/инконгруэнтное) образующегося в системе двойного клатратного гидрата (Фиг.3, принципиальный вид характеристического политермического сечения в случае конгруэнтного (А) и инконгурентного (Б) плавления двойного клатратного гидрата (Т)).
В случае, если двойной клатратный гидрат - фаза переменного состава, возможно образование как ограниченного твердого раствора на базе гидрата ТГФ·17H2O, с частичным замещение молекул ТГФ на молекулы ТБС в больших полостях гидрата до некоторого предельного значения, либо образование твердых растворов на базе двойного клатратного гидрата (тройного соединения) (Фиг.4, Принципиальные варианты характеристического политермического сечения в случае образования соединения переменного состава. H17 - фаза переменного состава двойного гидрата на базе гидрата ТГФ·17H2O, Ts - фаза переменного состава на базе тройного соединения).
Таким образом, интересующий нас диапазон концентраций смешанного растворителя относительно воды: 77-80 масс.%.
Известно [Огиенко А.Г., Болдырева Е.В., Манаков А.Ю., Мызь С.А., Огиенко А.А., Юношев А.С., Зевак Е.Г., Кутаев Н.В., Красников А.А. «Получение высокодисперсных форм лекарственных препаратов с использованием сублимационной сушки замороженных растворов в системах с клатратообразованием» // Доклады Академии Наук, 2012, том 444, №5, с.514-518], что при распылении раствора в емкость с жидким азотом с использованием сжатого воздуха происходит испарение некоторого количества легкокипящего органического растворителя, поэтому мы предполагаем использовать составы смешанного растворителя с несколько меньшим содержанием воды (77 масс.%), чем состав двойного клатратного гидрата (80,6-80,4 масс.%), однако дальнейшее уменьшение содержания воды нежелательно из-за возможности попадания фигуративной точки системы (после распыления) в область фазовой диаграммы, где одним из компонентов будет ТГФ (см. Фиг.2). В этом случае температура плавления тройной эвтектики в данной подсистеме будет ниже либо примерно равной -109°C (температура плавления эвтектики (ТГФ - гидрат ТГФ·17H2O) в двойной системе ТГФ - вода), что приведет к появлению некоторых количеств жидкой фазы с большим содержанием ТГФ при превышении этой температуры, что приведет к растворению и перекристаллизации действующих веществ композиции, драматическому уменьшению удельной площади поверхности и неравномерности распределения действующих веществ в композиции. Для предотвращения этого необходимо будет проводить первую стадию сушки при температурах ниже -109°C, что мы считаем нецелесообразным экономически. В свою очередь, большее содержание воды нецелесообразно вследствие уменьшения растворимости действующих компонентов (дипропионат беклометазона и сальбутамол) композиции в данном смешанном растворителе.
Относительно других компонентов растворителя (ТГФ: 5-15 масс.%, ТБС: 15-5 масс.%)
Суммарное содержание ТГФ и ТБС не может превышать 23 масс.%. При этом, снижение содержания ТБС ниже 5 масс.% в данном смешанном растворителе нецелесообразно вследствие критического снижения растворимости дипропионата беклометазона (Табл. 1); а при содержании ТБС выше 15 масс.% наблюдалось расслаивание жидкости вследствие существенного снижения растворимости глицина в полученном смешанном растворителе.
| Таблица 1 | ||||
| Растворимость дипропионата беклометазона в растворах ТГФ-ТБС-вода | ||||
| Соотношение ТГФ : ТБС : вода (масс. %) | 20 : 0 : 80 | 15 : 5 : 80 | 10 : 10 : 80 | 5 : 15 : 80 |
| Растворимость дипропионата беклометазона (мг/г растворителя) | Не растворим | 0,5 мг/г | 0,75 мг/г | 0,9 мг/г |
2. Определение температуры основной стадии сушки - изучение фазовых превращений в тройной системе тетрагидрофуран - трет-бутиловый спирт - вода в субсолидусной области.
Дифракционные исследования in situ проводили с использованием порошкового дифрактометра Bruker D8 Advance, оборудованного низкотемпературной приставкой ТТК 450 Anton Paar и ячейкой для исследований в условиях вакуума до 10-3 мм рт.ст. Запись порошковых дифрактограмм (в температурном интервале от -120°C до 20°C) проводилась в режиме 20 сканирования в интервале 5-45 градусов с шагом 0.02 градуса. Растворы ТГФ-ТБС-вода (Табл. 2) охлаждали на поверхности металлической ступки, охлажденной до температуры жидкого азота. Порошковые дифрактограммы образцов, записанные в температурном интервале от -100°C до 0°C, представлены на Фиг.5 (Порошковые дифрактограммы образцов замороженных растворов ТГФ-ТБС-вода: А - 15 масс.% ТГФ, 5 масс.% ТБС; Б - 10 масс.% ТГФ, 10 масс.% ТБС; В - 5 масс.% ТГФ, 15 масс.% ТБС при различных температурах (атмосферное давление); Г - сравнение параметров ячейки КС II для каждого из составов при различных температурах).
На порошковых дифрактограммах образцов «А» (15 масс.% ТГФ, 5 масс.% ТБС) и «Б» (10 масс.% ТГФ, 10 масс.% ТБС) при низких температурах (-100°C - (-70°C)) присутствуют только рефлексы, относящиеся к фазам гидрата КС-II и льда Ih. При дальнейшем повышении температуры было отмечено появление рефлексов (очень слабой интенсивности), относящихся к фазе гидрата ТБС·2H2O. На порошкограммах образца «В» (5 масс.% ТГФ, 15 масс.% ТБС) в температурном интервале от -100 и -70°C присутствуют рефлексы трех фаз: гидрата КС-II, льда Ih и гидрата ТБС·2H2O. При дальнейшем повышении температуры на порошкограммах, записанных при -30°C и -10°C появляются рефлексы, отвечающие фазе образующегося в системе ТБС - вода метастабильного гидрата ТБС·7H2O. На порошкограммах всех образцов, записанных при 0°C, присутствуют только рефлексы льда Ih малой интенсивности и наблюдается поднятие базовой линии, что свидетельствует о наличии жидкости в кювете дифрактометра. Сравнение параметров элементарной ячейки гидрата КС-II, рассчитанных для всех образцов (Фиг.5, Г), показало, что с увеличением содержания ТБС в образцах замороженных растворов происходит увеличение параметра элементарной ячейки гидрата КС-II и изменение угла наклона кривой термического расширения (коэффициента термического расширения), на основании чего можно предположить, что фазы гидратов КС-II, полученные при охлаждении образцов «А» и «В», имеют различный состав. Таким образом, мы предполагаем, что происходит частичное замещение молекул ТГФ на молекулы ТБС в больших полостях гидрата КС-II, что приводит к увеличению параметра элементарной ячейки.
| Таблица 2 | |||
| Составы растворов ТГФ-ТБС-H2O | |||
| Номер раствора | ТГФ, масс.% | ТБС, масс.% | H2O, масс.% |
| 1 | 5 | 15 | 80 |
| 2 | 10 | 10 | 80 |
| 3 | 15 | 5 | 80 |
Для проверки этой гипотезы нами были записаны спектры КР образов замороженных растворов при низких температурах. Спектры КР измерялись на спектрометре LabRAM HR, Horiba (Jobin Yvon), оснащенном многоканальным детектором. Для возбуждения спектра использовалась линия 488 нм Ar+-ионного лазера 35LAP431 ″Melles Griot″, USA. Лазерное излучение фокусировалось на поверхность образца с диаметром пятна около 1 мкм и мощностью на поверхности 0.3-3 мВт. Рассеянный свет собирался объективом MPlan ″Olympus″ с 50-кратным увеличением и апертурой 0.6. Спектры измерялись в геометрии обратного рассеяния с применением микроскопа для направления возбуждающего света на образец и сбора рассеянного излучения. Измерения выполнялись со спектральным разрешением в 2.0 см-1. Образец извлекали из контейнера, где он хранился при температуре жидкого азота, растирали в охлажденной до температуры жидкого азота дюралевой ступке, помещали в ячейку приставки для низкотемпературной съемки КР-спектров с регулятором температуры («Термодат 10М5») при температуре жидкого азота и накрывали пенопластовой крышкой. К окошку подводили поток сжатого воздуха для предотвращения конденсации влаги из окружающей среды.
Для детального рассмотрения выбрана область колебаний 730-780 см-1, так как в этой области не наблюдается колебаний молекулы ТГФ и присутствуют внутримолекулярные колебания ТБС C3C-O 752 см-1 [Kipkemboi P.K., Kiprono P.C., Sanga J.J. ″Vibrational spectra of t-butyl alcohol, t-butylamine and t-butyl alcohol + t-butylamine binary liquid mixtures″ // Bull Chem Soc Ethiop., 2003, 17(2), p.211-218] (Фиг.6, Спектры КР образцов замороженных растворов при -196°C в области 730-780 см-1. А - 20.4 масс.% ТГФ в воде; Б - 15 масс.% ТГФ и 5 масс.% ТБС в воде; В - 10 масс.% ТГФ и 10 масс.% ТБС в воде; Г - 5 масс.% ТГФ и 15 масс.% ТБС в воде; Д - 20 масс.% ТБС в воде; Е - ТБС). В случае замороженного раствора 20 масс.% ТБС в воде наблюдается смешение колебательной моды в длинноволновую область (761 см-1), что свидетельствует об образовании водородной связи OH-группы ТБС и молекулы воды в структуре ТБС·2H2O. В случае смешанных растворов ТГФ-ТБС-H2O смешение колебания C3C-O происходит в коротковолновую область (747 см-1), что говорит об изменении окружения молекулы ТБС в исследуемых образцах, что подтверждает гипотезу об образовании смешанного клатратного гидрата. Следует также отметить, что на спектрах образцов «В» и «Г» (содержание ТБС в растворе ТГФ-ТБС-вода 10 и 15 масс.%) наблюдается небольшое поднятие базовой линии в области 761 см-1. Это свидетельствует о присутствии в образцах молекул ТБС, которые связаны водородной связью с молекулами воды, то есть фазы ТБС·2H2O, что также наблюдалось в дифракционном эксперименте. Итак, нами было впервые обнаружено образование фазы двойного клатратного гидрата в тройной системе ТГФ - ТБС - вода. Образование уже на стадии охлаждения исходного раствора соединения переменного состава - двойного клатратного гидрата, связывающего при этом все компоненты раствора (вода и легкокипящие органические растворители), стабильность которого (следовательно, и предельную температуру сушки) можно будет варьировать концентрацией компонента, стабилизирующего каркас клатратного гидрата, сделает возможным создание высокоэффективных лекарственных форм нового поколения с использованием метода сублимационной сушки замороженных растворов в системах с клатратообразованием.
Определение температур фазовых переходов для построения характеристического политермического сечения (см. Фиг.1) и определения предельной температуры первой стадии сушки, использовали метод дифференциально-термического анализа (ДТА). Принципиальная схема установки описана в [A. Yu. Manakov, L.S. Aladko, A.G. Ogienko, A.I. Ancharov. ″Hydrate formation in the system n-propanol - water″ // J. Therm. Analys. Calorim., 2013, 111(1), p.885-890; Aladko L.S., Manakov A. Yu., Ogienko A.G., Ancharov A.I. ″New data on phase diagram and clathrate formation in the system water-isopropyl alcohol″ // J. Incl. Phenom., 2009, 63, p.151-157]. Калибровка термопар (хромель-алюмель) была взята из литературы и проверялась по температурам плавления ртути, воды и индия. В ампулы из молибденового стекла с углублением в дне для термопары запаивались образцы растворов различных составов, лежащих на отрезке «гидрат ТГФ·17H2O - гипотетический гидрат ТВС·17H2O» (см. Фиг.1), приготовленных взвешиванием из ТГФ, ТБС и воды. Для установления равновесия ампулы выдерживались при -25°C в течение одной-двух недель, затем для каждой ампулы записывались термические кривые нагревания от -25°C.
На основании анализа результатов экспериментов ДТА, РФА, спектроскопии КР и моделирования различных вариантов строения фазовой диаграммы системы ТГФ - ТБС - вода нами было построено характеристическое политермическое сечение (Фиг.7, Характеристическое политермическое сечение, построенное на основании результатов экспериментов с использованием ДТА, РФА и КР-спектроскопии при низких температурах). Таким образом, образующийся в данной системе двойной клатратный гидрат является фазой переменного состава на базе тройного соединения.
Температура плавления тройной эвтектики (является область на фазовой диаграмме, где равновесии находятся фазы двойного клатратного гидрата (обозначение Ts на Фиг.7), льда Ih и гидрата ТВС·2H2O) была нами определена и составляет -12,4°C, которая, таким образом, является критической температурой первой стадии сушки. Однако, принимая во внимание допустимую погрешность (±2,5°C), обычно используемых в технике для измерения температур в указанном интервале некалиброванных термопар (хромель-копель, хромель-алюмель; класс точности 2 и 3) [ГОСТ Р 8.585-2001. Термопары. Номинальные статические характеристики преобразования.], мы будем использовать температуру -15°C для первой стадии сушки. 3. Выбор соотношения компонентов композиции.
Соотношение дипропионат беклометазона : сальбутамол : бета-глицин в композиции и, следовательно, диапазон используемых концентраций глицина в используемом смешанном растворителе ТГФ-ТБС-вода выбирали таким образом, чтобы содержание дипропионата беклометазона/сальбутамола в одной дозе композиции (5 мг либо 2.5 мг в капсуле для ингаляторов сухого порошка) находилось в диапазоне используемых терапевтических доз (от 50 мкг в 2,5 мг до 250 мкг в 5 мг). Итак, поскольку максимальное количество сухих веществ лимитируется растворимостью дипропионата беклометазона в используемом смешанном растворителе, то для композиций с содержанием дипропионата беклометазона около 2 масс.% и менее целесообразно использовать концентрацию глицина 25 мг/г смешанного растворителя (при этом концентрация дипропионата беклометазона составляет от 0,5 мг/г растворителя). Для создания композиций с содержанием дипропионата беклометазона от 2 до 5 масс.% необходимо снижать концентрацию глицина (до 10 мг/г растворителя) при использовании максимально возможной концентрации дипропионата беклометазона в растворе (0,5 мг/г растворителя). Снижение одновременно концентрации дипропионата беклометазона (от максимально возможной) и глицина для создания фармацевтической композиции с содержанием дипропионата беклометазона от 2 до 5 масс.% экономически нецелесообразно.
Содержание сальбутамола в композициях лимитируется менее строго вследствие лучшей растворимости в используемом смешанном растворителе (Табл. 3), однако при повышении соотношения сальбутамол : дипропионат беклометазона более чем в 2 раза, снижается растворимость и скорость растворения дипропионата беклометазона (см. Табл. 1).
| Таблица 3 | |||
| Совместная растворимость сальбутамола и дипропионата беклометазона в растворах ТГФ-ТБС-вода | |||
| ТГФ : ТБС : вода | 15 : 5 : 80 | 10 : 10 : 80 | 5 : 15 : 80 |
| Максимальная растворимость, мг в 20 г смешанного растворителя | 200 мг сальбутамола 10 мг дипропионата беклометазона | 200 мг сальбутамола 10 мг дипропионата беклометазона | 200 мг сальбутамола 10 мг дипропионата беклометазона |
Таким образом, содержание дипропионата беклометазона в композиции: от 2 до 5 масс.%., сальбутамола от 2 до 10 масс.%, бета-глицин до 100%.
Примеры реализации способа
Материалы и методы
В работе использовали беклометазон дипропионат; сальбутамол (основание); очищенный согласно [Boldyreva E.V., Drebushchak V.A., Drebushchak T.N., Paukov I.E., Kovalevskaya Y.A., Shutova E.S. Polymorphism of glycine. Thermodinamic aspects. Part I. Relative stability of the polymorphs // Journal of Thermal Analysis and Calorimetry, 2003, V.73, p.409-418] α-глицин; трет-бутиловый спирт; очищенный от перекисей тетрагидрофуран; дистиллированную воду.
Пример 1
Комбинированная фармацевтическая композиция с содержанием 1,9 масс.% дипропионата беклометазона, 1,9 масс.% сальбутамола, 96,2 масс.% бета-глицина.
В 20,3 г раствора ТГФ-ТБС-вода (10,3 масс.% ТГФ; 10,8 масс.% ТБС) при перемешивании и небольшом подогревании раствора (до +30°C) растворяли 500 мг α-глицина (25 мг/г растворителя; 96,2 масс.% сухих веществ), 10 мг дипропионата беклометазона (0,5 мг/г растворителя; 1,9 масс.% сухих веществ) и 10 мг сальбутамола (0,5 мг/г растворителя; 1,9 масс.% сухих веществ). Раствор распыляли через пульверизатор (избыточное давление распыляющего газа 1.1 атм) в емкость с жидким азотом. Образующуюся после охлаждения смесь твердых фаз помещали в охлажденный до температуры жидкого азота держатель, который помещали при температуре жидкого азота в вакуумную камеру, камеру закрывали и затем понижали давление в ней до Р<8 мторр. Затем вакуумную камеру помещали в ванну термостата с температурой теплоносителя -15°C. Сушку проводили в токе сухого азота (Т=-15°C, Р=600±20 мторр) при постоянном откачивании до падения давления в камере до Р<8 мторр при отключении подачи азота. Затем температуру теплоносителя повышали +30°C, с выдерживанием в течение 3 часов при этой температуре. После этого давление в камере повышали до Р=1 атм заполнением камеры сухим азотом, камеру открывали, доставали держатель с образцом, образец помещали в предварительно взвешенный бюкс, взвешивали и помещали в эксикатор с сухой атмосферой для дальнейшего хранения.
Пример 2
Комбинированная фармацевтическая композиция с содержанием 1,9 масс.% дипропионата беклометазона, 1,9 масс.% сальбутамола, 96,2 масс.% бета-глицина.
В 20,3 г раствора ТГФ-ТБС-вода (15,3 масс.% ТГФ; 5,0 масс.% ТБС) при перемешивании и небольшом подогревании раствора (до +30°C) растворяли 500 мг α-глицина (25 мг/г растворителя; 96,2 масс.% сухих веществ), 10 мг дипропионата беклометазона (0,5 мг/г растворителя; 1,9 масс.% сухих веществ) и 10 мг сальбутамола (0,5 мг/г растворителя; 1,9 масс.% сухих веществ). Раствор ра