Полимерные композиции модифицированной гиалуроновой кислоты и способы их применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине. Описаны композиции, включающие гиалуроновую кислоту с низкой степенью модификации функциональных групп, и смеси, получаемые в результате регулируемой реакции такой слегка модифицированной гиалуроновой кислоты с подходящими дифункциональными или многофункциональными сшивающими реагентами. Композиции обладают низкими противовоспалительными свойствами при инъекции in vivo и могут быть использованы в качестве медицинских устройств, биомедицинских адгезивов и герметиков, а также для доставки в строго определенное место биоактивных веществ. 10 н. и 39 з.п. ф-лы, 14 ил., 24 табл., 45 пр.
Реферат
ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
Эта заявка испрашивает приоритет Предварительной заявки на Патент США № 61/230074, зарегистрированной 30 июля 2009 года, и Предварительной заявки на Патент США № 61/311953, зарегистрированной 09 марта 2010 года, содержание которых приводится здесь путем ссылки на них.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
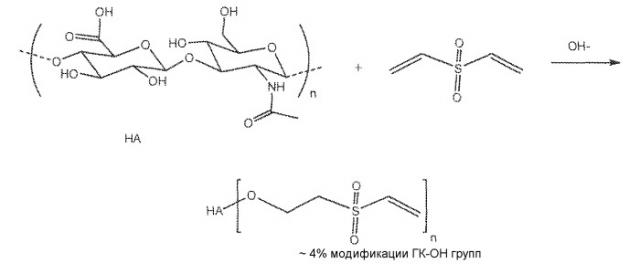
Изобретение в целом относится к гиалуроновой кислоте, имеющей низкий уровень модификации функциональных групп, к смесям, образуемым в результате контролируемой реакции такой слегка модифицированной гиалуроновой кислоты с подходящими дифункциональными или многофункциональными реагентами, и имеющим отношение к ним композициям гидрогеля и предшественника гидрогеля. Описываемые в изобретении композиции являются слегка сшитыми и обладают низкими провоспалительными свойствами при введении in vivo, и могут быть использованы, наряду с другими областями применения, например, в качестве медицинских устройств, биомедицинских адгезивов и герметиков, и для доставки в строго определенное место биоактивных веществ.
УРОВЕНЬ ТЕХНИКИ
Гиалуроновая кислота является природным анионным несульфатированным гликозаминогликаном, который широко распространен в соединительных, эпителиальных и нервных тканях. В среднем, в организме человека с массой тела 70 кг (154 фунтов) содержится приблизительно 15 граммов гиалуроновой кислоты, треть из которой обновляется (разлагается и синтезируется) каждый день (Stern R., Euro J Cell Biol 83 (7): 317-25, (2004)). Так как гиалуроновая кислота обнаруживается в качестве природного вещества во многих тканях организма и, в силу этого, является биологически совместимой, считается, что она хорошо подходит для применения в биомедицине. И на самом деле, многие полимерные материалы, включающие гиалуроновую кислоту (также называемую гиалуронаном), ее дериватизированные формы, и ее конъюгаты, могут быть использованы в качестве инъецируемых биоматериалов, а также в медицинских устройствах и имплантируемых материалах. Применения включают доставку молекул лечебного средства в строго определенное место, использование в качестве адгезивов или герметиков, в тканевой инженерии, в качестве вязкоупругих добавок, и для заживления ран. Гиалуроновая кислота, при введении и использовании в качестве терапевтического средства в ее природной форме, обычно быстро выводится из организма, что делает необходимым ее частые инъекции. Обычно, полимерный гель или предшественник геля может проявлять подходящие свойства, с точки зрения химизма реакции и состояний, характеристик гелеобразования, и/или терапевтического эффекта в одной или более in-vitro моделях, но в конкретных случаях не удается добиться положительных свойств таких эффектов in vivo или в лечебных целях.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте, предлагается гиалуроновая кислота, модифицированная на 10% или менее в результате реакции с дивинилсульфоном. В частности, гиалуроновая кислота содержит 10% или менее ее гидроксильных групп, дериватизированных путем проведения реакции присоединения с дивинилсульфоном.
В конкретном варианте осуществления, гиалуроновая кислота имеет 1-10% ее гидроксильных групп, дериватизированных в 2-(винилсульфонил)этокси группы. Получаемую активированную гиалуроновую кислоту, имеющую низкий уровень активации дивинилсульфоном, в описании изобретения обычно называют (2-(винилсульфонил)этокси)1-10%гиалуроновой кислотой или "ВС-ГК".
В еще одном варианте осуществления, гиалуроновая кислота имеет степень конверсии гидроксильных групп в 2-(винилсульфонил)этокси группы, выбранную из 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9% и 10%.
В еще более конкретном варианте осуществления, гиалуроновая кислота имеет степень конверсии гидроксильных групп в 2-(винилсульфонил)этокси группы около 4-5% на повторяющееся звено дисахарида.
В еще одном варианте осуществления, (2-(винилсульфонил)этокси)1-10%гиалуроновая кислота имеет молекулярную массу приблизительно от 700 до приблизительно 3 миллионов дальтонов.
Во втором аспекте, предлагается гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, имеющим две или более тиольных групп.
В родственном варианте осуществления, тиольный сшивающий реагент имеет от двух до приблизительно 8 тиольных групп. В еще одном варианте осуществления, тиольный сшивающий реагент имеет число тиольных групп, выбранных из 2, 3, 4, 5, 6, 7 и 8.
В еще одном варианте осуществления, относящемся ко второму аспекту, тиольным сшивающим реагентом является функционализированный тиолом полиэтиленгликоль (ПЭГ) (то есть, ПЭГ-тиол).
В дополнительном варианте осуществления вышеизложенного, полиэтиленгликольтиол имеет молекулярную массу приблизительно от 250 до приблизительно 20000 дальтонов.
В родственном варианте осуществления, функционализированный тиолом полиэтиленгликоль является линейным и имеет тиольную группу на каждом конце, то есть, является полиэтиленгликольдитиолом (ПЭГ дитиолом).
В еще одном варианте осуществления, функционализированный тиолом полиэтиленгликоль является полимером с четырьмя цепочками в виде расходящихся лучей и имеет ядро пентаэритрита.
В еще одном варианте осуществления, функционализированный тиолом полиэтиленгликоль имеет полиольное ядро, выбранное из глицерина, димера глицерина (3,3'-оксидипропан-1,2-диола)триметилолпропана, сорбита, пентаэритрита, и гексаглицерина.
В дополнительном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10% гиалуроновой кислоты и тиольным сшивающим реагентом, содержит менее чем десять процентов непрореагировавшего тиола и менее чем 10% непрореагировавших винилсульфоновых групп. Количество оставшихся непрореагировавших тиольных групп может быть определено, например, с помощью метода с реактивом Эллмана.
В еще одном дополнительном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, содержит массовый процент полимера в воде приблизительно от 0,5 до 5,0 процентов. В одном или более вариантах осуществления, в качестве иллюстрации содержаний полимера в воде в массовых процентах для получаемого гидрогеля выбирают 0,5, 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 и 5 процентов.
В еще одном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, существует в форме частиц с размером приблизительно от 0,10 до 3,0 миллиметров.
В еще одном варианте осуществления, вышеупомянутые частицы гидрогеля находятся в форме водной суспензии.
В еще одном дополнительном варианте осуществления, гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, диспергирован в водном растворе немодифицированной гиалуроновой кислоты.
В еще одном дополнительном и более конкретном варианте осуществления, предлагается композиция, включающая сшитые частицы гидрогеля в растворе гиалуроновой кислоты в физиологическом растворе, в котором частицы гидрогеля образуются в результате реакции полиэтиленгликольдитиола (ПЭГ-дитиола) с гиалуроновой кислотой, имеющей 1-10% гидроксильных групп, дериватизированных с помощью 2-(винилсульфонил)этокси групп.
В еще одном дополнительном варианте осуществления, гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, включает биоактивный агент. В конкретном варианте осуществления, биоактивным агентом является кортикостероид. В еще одном более конкретном варианте осуществления, биоактивным агентом является ацетонид триамцинолона.
В еще одном альтернативном варианте осуществления, гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, включает живые клетки.
В дополнительном варианте осуществления, гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10% гиалуроновой кислоты с бифункциональным или многофункциональным тиольным сшивающим реагентом, проявляет низкие провоспалительные свойства при внутрисуставной инъекции в экспериментальной модели на козах.
В конкретном варианте осуществления, гидрогель проявляет низкие провоспалительные свойства, на что указывает ответная лейкоцитарная реакция в связанной синовиальной жидкости.
В еще одном конкретном варианте осуществления, гидрогель проявляет низкие провоспалительные свойства при внутрисуставной инъекции в экспериментальной модели на козах, на что указывает подсчет суммарных баллов при проведении наблюдений.
В еще одном дополнительном варианте осуществления, гидрогель является стерильным.
В еще одном дополнительном варианте осуществления, предлагаемый изобретением гидрогель расфасовывают в шприц.
В еще одном дополнительном варианте осуществления, предлагается способ введения любой из описанных в изобретении композиций гидрогеля во внутрисуставное пространство сустава субъекта.
Кроме того, в третьем аспекте, предлагается способ получения (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты. Способ включает реакцию гиалуроновой кислоты с дивинилсульфоном при реакционных условиях, которые обеспечивают реакцию не более чем приблизительно 10% гидроксильных групп на повторяющихся звеньях дисахарида в гиалуроновой кислоте с дивинилсульфоном с образованием (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты.
В родственном варианте осуществления, реакция включает взаимодействие гиалуроновой кислоты с мольным избытком дивинилсульфона.
В дополнительном варианте осуществления, стадию реакции проводят в условиях окружающей среды.
В еще одном варианте осуществления, стадию реакции проводят в течение от 10 секунд до приблизительно 120 секунд в условиях окружающей среды.
В еще одном варианте осуществления, стадию реакции проводят в водном растворе основания.
В дополнительном варианте осуществления, способ дополнительно включает прерывание реакции путем добавления кислоты. В родственном варианте осуществления, добавляют соответствующее количество кислоты для корректировки величины pH в интервале приблизительно от 4 до 6,5.
В четвертом аспекте, описываемым в изобретении способом является способ получения гидрогеля. Способ включает реакцию (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с тиольным сшивающим реагентом, имеющим две или более тиольных групп при реакционных условиях, которые обеспечивают образование сшитого гидрогеля. Подходящие тиольные сшивающие реагенты включают функционализированный тиолом полиэтиленгликоль, алкандитиолы и другие подобные реагенты.
В родственном варианте осуществления, реакцию проводят при физиологической величине pH.
В еще одном варианте осуществления, реакцию проводят в отсутствии инициатора полимеризации.
В еще одном варианте осуществления, реакцию проводят без использования источника внешней энергии.
В еще одном варианте осуществления, реакцию проводят при температуре в интервале от 20°C до 45°C.
В еще одном дополнительном варианте осуществления, гидрогель включает 10% или менее непрореагировавших винилсульфоновых или тиольных групп. Предпочтительно, чтобы гидрогель включал 5% или менее непрореагировавших сульфоновых или тиольных групп. В конкретном варианте осуществления, гидрогель практически не включает обнаруживаемые непрореагировавшие винилсульфоновые или тиольные группы.
В пятом аспекте, предлагается набор, включающий шприц, где шприц включает гидрогель, образуемый путем реакции (2-(винилсульфонил)этокси)1-10%гиалуроновой кислоты с описанным выше тиольным сшивающим реагентом.
В еще одном родственном варианте осуществления, шприц включает гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, где гидрогель диспергируют в водном растворе немодифицированной гиалуроновой кислоты. В родственном варианте осуществления, водным раствором является физиологический раствор.
В родственном варианте осуществления, шприц имеет форму, подходящую для внутрисуставной инъекции гидрогеля с использованием иглы с размером 18-21.
В еще одном родственном варианте осуществления, шприц включает гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, где гидрогель дополнительно включает биоактивный агент. В родственном варианте осуществления, биоактивный агент выбирают из группы, состоящей из стероидов, факторов роста, антипролиферативных средств, и антибиотиков. В еще более конкретном варианте осуществления, гидрогель включает приблизительно от 0,01% до приблизительно 20% по массе биоактивного агента, разумеется, в зависимости от эффективности биоактивного агента. Другими словами, содержание менее активного агента в гидрогеле будет обычно определяться верхней границей приведенного выше интервала, например, приблизительно 10-20% по массе, в то время как содержание сильнодействующего биоактивного агента будет определяться нижней границей интервала, например, приблизительно от 0,01 до 3% по массе. В конкретном варианте осуществления, в котором биоактивным агентом является ацетонид триамцинолона, гидрогель включает приблизительно от 0,1 до 1% по массе биоактивного агента.
В еще одном варианте осуществления, шприц включает гидрогель, описанный в любом одном или более из приведенных выше вариантов осуществления, где гидрогель дополнительно включает живые клетки. Примеры живых клеток включают стволовые клетки, паренхимальные стволовые клетки, полученные из крови клетки и клетки костного мозга.
В шестом аспекте, предлагается способ доставки плохо растворимого в воде биоактивного агента путем введения субъекту описанного в изобретении гидрогеля, включающего плохо растворимый в воде биоактивный агент, диспергированный в гидрогеле.
В седьмом аспекте, описывается способ лечения острого и хронического воспаления, связанного с остеоартритом, ревматоидным артритом, другими воспалительными артритами, и с периодическим применением, путем инъекции субъекту гидрогеля в соответствии с любым одним или более описанными в изобретении аспектами или вариантами осуществления во внутрисуставное пространство сустава, такого как колено. В конкретном варианте осуществления, то есть, когда гидрогель включает добавленный в него кортикостероид, способ является эффективным с точки зрения повреждения хряща, которое уменьшается по сравнению с повреждением хряща, происходящим при введении эквивалентного количества кортикостероида, не включенного в гидрогель, как это показано при внутрисуставной инъекции в экспериментальной модели на козах с помощью суммы баллов по системе оценки Мэнкина через 28 дней после инъекции. В родственном варианте осуществления, упомянутый выше способ, то есть, инъекция гидрогеля во внутрисуставное пространство сустава, является эффективным для облегчения боли у субъекта по сравнению с болью, испытываемой субъектом до инъекции ему гидрогеля. Обычно, субъект начинает испытывать облегчение боли в течение приблизительно от одного часа до приблизительно одной недели после инъекции, более предпочтительно, в течение приблизительно от одного часа до приблизительно 3 дней после инъекции. Другими словами, облегчение боли обычно наступает в течение приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 часов после инъекции, или, если не в течение первых двадцати четырех часов, то в течение 1, 2, 3, 4, 5, 6, или 7 дней после инъекции. Обычно, предполагается, что период облегчения боли составляет приблизительно от 3 до 9 месяцев, то есть, от 3, 4, 5, 6, 7, 8, 9 месяцев или даже более.
В восьмом аспекте, предлагается способ снижения степени повреждения хряща при введении страдающему от остеоартрита субъекту кортикостероида во внутрисуставное пространство сустава путем добавления кортикостероида в сшитый гидрогель до введения или при введении субъекту. Сшитым гидрогелем обычно является гидрогель на основе гиалуроновой кислоты, который будет описан более подробно ниже. Примером сшитого гидрогеля является гидрогель, который является гиалуроновой кислотой, модифицированной до степени 10% или менее путем реакции с дивинилсульфоном и затем сшитой с помощью тиольного сшивающего реагента, имеющего две или более тиольных групп. Как ни удивительно, но в результате включения кортикостероида в сшитый гидрогель происходит меньшее повреждение хряща, чем в случае введения эквивалентной дозы кортикостероида, без включения его в гидрогель.
В девятом аспекте, относящемся к вышеприведенным аспектам, в способе лечения остеоартрита путем введения субъекту терапевтически эффективного количества кортикостероида во внутрисуставное пространство сустава, изобретение предлагает усовершенствование, включающее введение кортикостероида в форме композиции сшитого гидрогеля, включающей кортикостероид, в результате чего уменьшается степень повреждения хряща, чем в случае введения эквивалентной дозы кортикостероида, без включения его в гидрогель.
В конкретном варианте осуществления, относящемся к седьмому, восьмому и девятому аспектам, кортикостероид выбирают из группы, состоящей из гидрокортизона, ацетата гидрокортизона, ацетата кортизона, пивалата тиксокортола, преднизолона, метилпреднизолона, преднизона, триамцинолона, солей триамцинолона, таких как триамцинолона ацетонид, триамцинолона бенетонид, триамцинолона фуретонид, триамцинолона гексацетонид, триамцинолона диацетат, триамцинолонового спирта, мометазона, амцинонида, будезонида, дезонида, флуоцинонида, флуоцинолона ацетонида, хальцинонида, бетаметазона, бетаметазона натрий фосфата, дексаметазона, дексаметазона натрий фосфата, флуокортолона, гидрокортизон-17-бутирата, гидрокортизон-17-валерата, аклометазона дипропионата, бетаметазона валерата, бетаметазона дипропионата, предникарбата, клобетазон-17-бутирата, клобетазол-17-пропионата, флуокортолона капроата, флуокортолона пивалата, флупреднидена ацетата, моногидрата беклометазона дипропионата, флунизолида, флутиказона пропионата, моногидрата мометазона фуроата и флутиказона фуроата.
В еще более конкретном варианте осуществления, кортикостероидом является ацетонид триамцинолона.
В десятом аспекте, предлагается лекарственная форма, включающая плохо растворимое в воде лекарственное средство, такое как стероид, заключенное в трехмерную структуру описываемого в изобретении гидрогеля, и инъекция такой лекарственной формы во внутрисуставное пространство сустава.
В одном варианте осуществления, относящемся к вышеприведенным аспектам, включение частиц стероида внутрь гидрогеля является эффективной мерой для предотвращения непосредственного контакта большинства частиц стероида с тканями сустава.
В еще одном родственном варианте осуществления, включение частиц стероида внутрь гидрогеля является эффективной мерой для максимизации локализованной концентрации стероида в суставе и минимизации его общей концентрации в организме.
В еще одном дополнительном варианте осуществления, включение частиц стероида внутрь гидрогеля является эффективной мерой для защиты частиц стероида от преждевременного удаления из сустава.
В еще одном дополнительном варианте осуществления, в результате включения стероида в гидрогель, терапевтическая эффективность стероида достигается при более низкой суммарной дозе, чем в случае, когда не используют включения стероида в гидрогель, и при этом минимизируются нежелательные местные и системные побочные эффекты.
В родственном аспекте, предлагается применение описываемого в изобретении гидрогеля для инъекции или имплантации рядом или в кость, зубы, нервы, хрящ, кровеносные сосуды, мягкие ткани или другие ткани млекопитающего.
Дополнительные варианты осуществления композиций, способов, наборов, и других осуществлений станут понятными из следующего описания, примеров и пунктов формулы изобретения. Из приведенного выше и последующего описания является очевидным, что все, без исключения, описанные в изобретении отличительные признаки и все, без исключения, комбинации двух или более таких отличительных признаков, входят в объем настоящего изобретения, при условии, что отличительные признаки, включенные в такую комбинацию, не являются взаимно несовместимыми. Кроме того, любой отличительный признак или комбинация отличительных признаков может быть специально исключена из любого варианта осуществления настоящего изобретения. Дополнительные аспекты и преимущества настоящего изобретения излагаются в последующем описании, в частности, при рассмотрении в сочетании с сопровождающими описание примерами и чертежами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
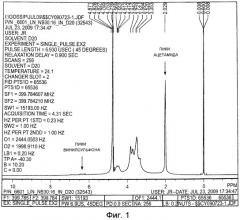
На ФИГ. 1 приведен спектр 1H ЯМР модифицированной винилсульфоном гиалуроновой кислоты (ГК-ВС), полученной как описано в Примере 1. С помощью ЯМР было определено, что гиалуроновая кислота имеет степень винилсульфонового замещения приблизительно четыре процента на дисахарид.
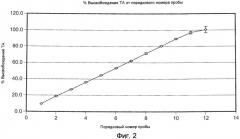
На ФИГ. 2 приведена графическая зависимость процента высвобождения плохо растворимого в воде модельного лекарственного средства, ацетонида триамцинолона, от порядкового номера образцов, приготовление которых описано в Примере 16.
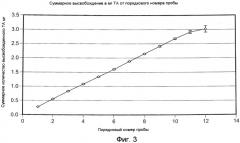
На ФИГ. 3 приведена графическая зависимость высвобожденной суммарной массы плохо растворимого в воде модельного лекарственного средства, ацетонида триамцинолона, от порядкового номера образцов, приготовление которых описано в Примере 16.
На ФИГ. 4 приведена графическая зависимость количества высвобождаемого триамцинолона ацетонида от порядкового номера образцов, приготовление которых описано в Примере 16.
На ФИГ. 5 графически представлено количество лейкоцитов в синовиальной жидкости (число клеток в кубическом миллиметре) в колене коз, в которое инъецировали Испытуемый материал 1, относительно группы, подвергнутой лечению другими испытуемыми материалами, оцененное через 24 часа после инъекции 1,5 мл, описанными в Примере 17. Испытуемый материал 1=ГК-ВС/ПЭГ-(SH)2 гель.
На ФИГ. 6 графически представлено абсолютное количество лейкоцитов в синовиальной жидкости (абсолютное количество=суммарный объем × количество лейкоцитов в синовиальной жидкости) в колене коз, в которое инъецировали Испытуемый материал 1, относительно группы, подвергнутой лечению другими испытуемыми материалами, оцененное через 24 часа после инъекции 1,5 мл, описанными в Примере 17. Испытуемый материал 1=ГК-ВС/ПЭГ-(SH)2 гель.
На ФИГ. 7 графически представлено дифференциальное распределение лейкоцитов с синовиальной жидкости (среднее для групп) в колене подвергнутых инъекции коз относительно группы, подвергнутой лечению другими испытуемыми материалами, оцененное через 24 часа после инъекции 1,5 мл, описанными в Примере 17. Для каждого испытуемого материала показано распределение полиморфоядерных лейкоцитов (PMN), лимфоцитов, моноцитов и эозинофилов (Eos).
На ФИГ. 8 графически представлено среднее суммарное количество баллов для синовиальной жидкости, тканей сустава, и объединенные баллы синовиальной жидкости и тканей сустава (Таблица 6) для колен подвергнутых инъекции коз для каждого типичного испытуемого материала, описанных в Примере 17, где Общее суммарное количество баллов=Количество баллов для синовиальной жидкости+суммарное количество баллов для сустава. Максимальное количество баллов для синовиальной жидкости или суммарное количество баллов для сустава составляет 8 при величине 0 в норме; максимальное количество баллов для общего суммарного количества баллов составляет 16 при величине 0 в норме.
На ФИГ. 9 приведена оценка в баллах степени окрашивания красителем сафранином О для образцов хряща суставов коз, подвергнутых лечению с помощью испытуемых материалов, описанных подробно в Примере 34, через 14 дней после инъекции. Испытуемый материал 1: ГК-ВС-ПЭГ-(SH)2, Испытуемый материал 2: ГК-ВС-ПЭГ-(SH)2-TA.
На ФИГ. 10 приведена оценка в баллах степени окрашивания красителем сафранином О для образцов хряща суставов коз, подвергнутых лечению с помощью испытуемых материалов, описанных подробно в Примере 34, через 28 дней после инъекции.
На ФИГ. 11 приведены результаты начисления количества баллов по системе оценки Мэнкина для образцов хряща суставов коз, подвергнутых лечению с помощью испытуемых материалов, описанных подробно в Примере 34, через 28 дней после инъекции.
На ФИГ. 12 и ФИГ. 13 представлены характерные гистологические препараты медиального бедренного мыщелка, окрашенные сафранином О (40X), через 14 дней (Фиг. 12) и 28 дней (Фиг. 13) после инъекции, соответственно, описанные подробно в Примере 34.
На ФИГ. 14 графически представлено среднее количество лейкоцитов в синовиальной жидкости (среднее+стандартное отклонение) для всех животных относительно Испытуемого материала и Контрольного материала, оцененное через 24 часа после внутрисуставной инъекции объемом 1,5 мл, как это описано подробно в Примере 45.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Далее настоящее изобретение описывается более подробно. Однако это изобретение может быть осуществлено во множестве различных форм, и приведенные в описании изобретения варианты осуществления не следует истолковывать в качестве ограничений для изобретения; более того, эти варианты осуществления приводятся для того, чтобы полностью и исчерпывающе раскрыть для специалистов в этой области сущность и объем изобретения.
Содержание всех цитируемых выше или ниже в описании изобретения публикаций, патентов и заявок на патенты, приводится в описании изобретения путем ссылки на них, если не указано иначе. В случае, когда один и тот же термин определяется как в публикации, патенте, или заявке на патент, содержание которых приводится путем ссылки на них, так и в описании настоящего изобретения, предпочтение следует отдавать определению, приводимому в описании настоящего изобретения. Для публикаций, патентов, и заявок на патенты, упоминаемых в связи с описанием конкретного типа соединения, химизма, и так далее, части документа, относящиеся к таким соединениям, химизму, и так далее, являются такими частями, содержание которых приводится в описании изобретения путем ссылки на них.
Определения
Следует отметить, что используемые в этом описании изобретения формы единственного числа включают и обозначение множественных объектов, если это явно не противоречит смыслу содержания. Так, например, ссылка на "полимер" включает не только один полимер, но также и два или более одинаковых или отличных друг от друга полимеров.
Если специально не указано иначе, то определения терминов в изобретении являются стандартными определениями, используемыми в области органического синтеза, в области полимеров и в области фармацевтики.
В описании и в пунктах формулы настоящего изобретения будет использоваться следующая терминология в соответствии с описываемыми ниже определениями.
"Биосовместимый полимер" является полимером, чьи продукты разложения совместимы с живой тканью, или который может обладать полезными биологическими свойствами. Биосовместимый полимер может быть биосовместимым сам по себе, и/или может быть синергетически биосовместимым при использовании в сочетании с биологически активным средством.
Термин "полимер гиалуроновой кислоты" относится к полимеру, включающему повторяющиеся дисахаридные подзвенья гиалуронана, где повторяющиеся звенья могут быть дериватизированы в одном или более положениях D-глюкуроновой кислоты и/или D-N-ацетилглюкозаминового звена повторяющегося дисахаридного субзвена. Предполагается, что термин "полимер гиалуроновой кислоты" включает в себя гиалуроновую кислоту (называемую также гиалуронаном), дериватизированную гиалуроновую кислоту, солевые формы, комплексы гиалуроновой кислоты со сшивающими реагентами, и конъюгаты гиалуроновой кислоты. Предполагается, что термин "гиалуроновая кислота" относится к немодифицированной или недериватизированной гиалуроновой кислоте.
Термины "производное гиалуроновой кислоты" или "дериватизированная гиалуроновая кислота" или "модифицированная гиалуроновая кислота" относятся к гиалуроновой кислоте, которая была дериватизирована в результате реакции, например, с одним или более небольшими химическими звеньями, такими как дивинилсульфон или другие подобные звенья.
Дериватизированный тиолом полимер гиалуроновой кислоты относится к описанному выше полимеру гиалуроновой кислоты, имеющему три или более повторяющихся звеньев дисахарида и включающему, по меньшей мере, одну сульфгидрильную (тиольную) группу.
Термин "реакционноспособная" относится к функциональной группе (например, присутствующей в полимере), которая при обычных условиях проведения органического синтеза легко вступает в реакцию или участвует в реакции с приемлемой скоростью. Эта группа противопоставляется тем группам, которые либо вообще не реагируют, либо требуют использование активных катализаторов или создания практически нереальных условий реакции для осуществления взаимодействия (то есть, "нереакционноспособной" или "инертной" группе).
Используемый в описании изобретения термин "молекулярная масса" или молекулярный вес применительно к водорастворимому полимеру, такому как гиалуроновая кислота, относится к условной среднечисленной молекулярной массе полимера, определенной с помощью метода многоуглового рассеяния света. Молекулярная масса может быть выражена либо как среднечисленная молекулярная масса, либо как средневесовая молекулярная масса. Если не указано иначе, то все упоминания в изобретении о молекулярной массе относятся к среднечисленной молекулярной массе.
Термин "гидрогель" относится к водосодержащей трехмерной гидрофильной полимерной структуре или гелю, в котором вода является диспергирующей фазой и в котором содержание воды составляет более чем 50 масс.%. Описываемые в изобретении гидрогели обычно не требуют введения инициаторов или ускорителей сшивания для достижения требуемой степени сшивки.
"Стерильной" композицией является композиция, которая не содержит жизнеспособных микробов, что определяется с помощью пробы на стерильность в соответствии с требованиями Фармакопеи США. Смотрите документ "The United States Pharmacopeia", 30th Revision, The United States Pharmacopeial Convention: 2008.
Используемый в описании изобретения термин "слегка сшитый" или "имеющий низкую степень сшивания" означает, что при протекании реакции сшивания с образованием конечных сшитых гелей в реакции обычно участвуют приблизительно от 40% до приблизительно 100% доступных для сшивания мест, тогда как модифицированная гиалуроновая кислота, используемая в качестве исходного материала для образования геля, имеет 10% или менее ее гидроксильных групп в активированной/дериватизированной форме для образования гидрогеля, который рассматривается в целом как слегка сшитый.
Гидрогель, который проявляет низкие провоспалительные свойства при внутрисуставной инъекции в экспериментальной модели на козах, является гидрогелем, который при исследовании описываемой в изобретении внутрисуставной инъекции в экспериментальной модели на козах характеризуется количеством лейкоцитов в синовиальной жидкости менее чем 20000 клеток на кубический миллиметр через 24 часа после инъекции, и предпочтительно, чтобы количество лейкоцитов в синовиальной жидкости составляло менее чем 15000 клеток на кубический миллиметр через 24 часа после инъекции, где число лейкоцитов является средним числом из трех проб, взятых у трех индивидуально инъецированных животных.
Содержащий кортикостероид гидрогель, который "снижает повреждение хряща" или "который приводит к меньшему повреждению хряща", чем эквивалентная доза кортикостероида, вводимая субъекту в отсутствии гидрогеля, обычно характеризуют с помощью любой подходящей модели для оценки повреждения хряща, но предпочтительно проводить его оценку с помощью описанной подробно в изобретении инъекции в колено в экспериментальной in-vivo модели на козах. Данные эксперимента обычно собирают, по меньшей мере, через 7 дней после инъекции, но не более чем через 28 дней после инъекции. Предпочтительной системой оценки является суммарное количество баллов по системе оценки Мэнкина; материал, который снижает повреждение хряща, оцениваемое как описано выше, по сравнению с применением лишь одного лекарственного средства, является материалом, который характеризуется улучшенной средней суммой баллов по сравнению с лекарственным средством (то есть, кортикостероидом), которое вводят в эквивалентном количестве. Предпочтительно, чтобы суммарное количество баллов по системе оценки Мэнкина для включенного в гидрогель лекарственного средства улучшалось, по меньшей мере, на один или более баллов по сравнению с суммарным количеством баллов по системе оценки Мэнкина для лекарственного средства, вводимого без его включения в гидрогель.
Используемые равнозначно термины "лекарственное средство" или "фармацевтически активное средство" или "биоактивный агент" или "активный агент" обозначают любое органическое или неорганическое соединение или вещество, обладающее биоактивностью и приспособленное или применяемое для терапевтических целей. Более широкое понятие "лекарственного средства" включает белки, гормоны, противораковые средства, синтезированные химические соединения и миметики, олигонуклеотиды, ДНК, РНК и препараты генной инженерии. Предполагается, что ссылка на используемое в описании изобретения лекарственное средство, также как и ссылка на другие химические соединения, в соответствующих случаях включает соединение в любой из его фармацевтически приемлемых форм, включая изомеры, такие как диастереомеры и энантиомеры, соли, сольваты и полиморфы, конкретные кристаллические формы, а также рацемические смеси и чистые изомеры описываемых в изобретении соединений.
Используемый в описании изобретения термин "твердое вещество" обозначает нетекучее вещество, включающее кристаллические формы, их полиморфы, некристаллические аморфные вещества, осадки, и частицы, или другие подобные твердые вещества. Каждая из этих твердых форм может иметь различные размеры, приблизительно от 0,01 микрон до 2000 микрон, например, приблизительно от 0,01 микрон до 1 микрона, от 1 микрона до 100 микрон, от 100 микрон до 1000 микрон, от 1000 микрон до 2000 микрон, от 1100 микрон до 1500 микрон, и от 1500 микрон до 2000 микрон.
Приводимые в описании изобретения размеры частиц относятся к диаметрам частиц и обычно определяются с помощью ситового анализа. Описываемые размеры или интервалы обычно соответствуют размеру отверстия в сите или сетке. Можно использовать таблицу для перевода размера частиц из одной системы в другую, например, в миллиметры из соответствующего конкретного значения меш или номера сита. Смотрите, например, Примеры 39 и 40.
"Нерастворимым в воде лекарственным средством" или "плохо растворимым в воде лекарственным средством" является лекарственное средство, имеющее растворимость в воде ниже 10 мг/мг.
Приводимые в описании изобретения термины "эффективное количество" или "фармацевтически эффективное количество" или "терапевтически эффективное количество" композиции (или гидрогеля или полимера), относятся к нетоксичному, но достаточному количеству композиции для обеспечения требуемой ответной реакции, такой как предотвращение, уменьшение, или исключение боли у субъекта. Точное требуемое количество будет отличаться от субъекта к субъекту, в зависимости от вида, возраста и общего состояния здоровья субъекта, тяжести состояния, подвергаемого лечению, используемого конкретного лекарственного средства или средств, специфических особенностей композиции, способа введения и других подобных факторов. В любом конкретном случае соответствующее "эффективное" количество может быть определено обычным специалистом в этой области путем проведения соответствующего эксперимента.
"Лечение" или "проведение лечения" острой или подострой боли включает: подавление боли, то