Серосодержащие производные резорцина, способ их получения и косметическое применение
Иллюстрации
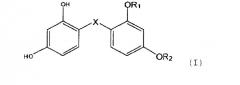
Показать всеНастоящее изобретение относится к новым соединениям общей формулы (I), где Х=S, SO или SO2, и один из радикалов R1 и R2 представляет собой атом водорода, а другой имеет значения, перечисленные в формуле изобретения, которые используют для депигментации кожи, и/или волос на голове, и/или волосяного покрова и для дезинфекции кожи, к косметическому применению предложенных соединений, а также соединений формулы (I), в которой R1 и R2 могут также одновременно представлять собой атом водорода. Кроме того, изобретение относится к косметической и фармацевтической композициям на основе предложенных соединений и к способам получения данных соединений. 6 н. и 13 з.п. ф-лы, 2 табл., 30 пр.
Реферат
Изобретение относится к новым аналогам резорцинсульфида, резорцинсульфоксида и резорцинсульфона, соответствующим общей формуле (I):
в которой:
Х=S, SO или SO2, и
один из радикалов R1 и R2 представляет собой атом водорода, а другой радикал:
- C1-C18 нормальный или разветвленный алкил, необязательно замещенный одним или более чем одним атомом галогена,
- C2-C18 нормальный или разветвленный алкенил, в частности аллильную группу, либо 3,3-диметилаллильную группу, либо геранильную группу, либо фарнезильную группу, необязательно замещенный одним или более чем одним атомом галогена,
- аралкил, в частности бензил, необязательно замещенный одной или более чем одной группой C1-C6алкокси, или
- COR3 или CONHR3, но не одновременно, где R3 представляет собой радикал:
- C1-C18 нормальный или разветвленный алкил, необязательно замещенный одним или более чем одним атомом галогена,
- C2-C18 нормальный или разветвленный алкенил, необязательно замещенный одним или более чем одним атомом галогена,
- аралкил, в частности бензил, необязательно замещенный одной или более чем одной группой C1-C6алкокси,
- аралкенил, необязательно замещенный одной или более чем одной группой C1-C6алкокси и/или ОН группой, либо вместо этого
- арильный радикал, в частности фенил, необязательно замещенный одной или более чем одной группой C1-C6алкокси.
Термин "алкил" представляет собой нормальные или разветвленные насыщенные алифатические углеводородные цепи и содержит указанное число атомов углерода.
Термин "алкенил" представляет собой нормальные или разветвленные ненасыщенные алифатические углеводородные цепи и содержит указанное число атомов углерода, например аллильную группу, либо 3,3-диметилаллильную группу, либо геранильную группу, либо фарнезильную группу.
Термин "алкокси" представляет собой нормальную или разветвленную углеводородную цепь, содержащую указанное число атомов углерода и атом кислорода, например метоксигруппу или этоксигруппу, либо пропоксигруппу или бутоксигруппу.
Термин "арил" представляет собой моноциклическое или бициклическое ароматическое углеродное кольцо, такое как, например, фенил или нафтил.
Термин "аралкил" обозначает арил, связанный алкилом, например бензил, этилфенил, пропилфенил. Термин "аралкенил" обозначает арил, связанный алкенилом, например фенилакрилат, или (4-метоксифенил)акрилат, или (3,4-диметоксифенил)акрилат.
Термин "галоген" представляет собой фтор, хлор, бром или йод.
Термин "олеоил" представляет собой одновалентный радикал, образованный из олеиновой кислоты в результате утраты ОН группы.
Термин "линолеоил" представляет собой одновалентный радикал, образованный из линолевой кислоты в результате утраты ОН группы.
Термин "альфа-линолеоил" представляет собой одновалентный радикал, образованный из альфа-линолевой кислоты в результате утраты ОН группы.
Термин "гамма-линолеоил" представляет собой одновалентный радикал, образованный из гамма-линолевой кислоты в результате утраты ОН группы.
Термин "кумароил" представляет собой 4-гидроксициннамоил.
Термин "каффеоил" представляет собой 3,4-дигидроксициннамоил.
Термин "феруоил" представляет собой 4-гидрокси-3-метоксициннамоил.
Термин "синапоил" представляет собой 4-гидрокси-3,5-диметоксициннамоил.
Среди соединений общей формулы (I), принадлежащих к настоящему изобретению, особенно приемлемый класс соединений соответствует соединениям общей формулы (I), в которых X=S. Подобным образом, настоящее изобретение, в частности, относится к соединениям общей формулы (I), в которых Х=S и R2=H.
Предпочтительно соединения в соответствии с изобретением соответствуют соединениям формулы (I), в которых X=S, R2=H, и R1 выбран из группы, состоящей из: C1-C18 нормального или разветвленного алкила или C2-C18 нормального или разветвленного алкенила либо COR3 и CONHR3.
В соответствии с формой осуществления настоящего изобретения соединения общей формулы (I) представляют собой те соединения, для которых R1 представляет собой:
- C1-C8 нормальный или разветвленный алкил и, в частности, C4-C8; либо
- C2-C18 нормальный или разветвленный алкенил, выбранный из аллильной группы, или 3,3-диметилаллильной группы, или геранильной группы, или фарнезильной группы; либо
- бензил.
В соответствии с изобретением особенно приемлемый класс соединений общей формулы (I) соответствует соединениям, для которых R3 представляет собой:
- C7-C15 нормальный или разветвленный алкил и, в частности, C11-C15; либо
- C10-C18 нормальный или разветвленный алкенил, либо
- бензил; либо
- аралкенил, выбранный из фенилакрилата или (4-метоксифенил)акрилата или (3,4-диметоксифенил)акрилата; либо
- фенил.
В соответствии с конкретной формой осуществления изобретения соединения общей формулы (I) представляют собой те соединения, в которых COR3 представляет собой:
- олеоил, либо линолеоил, либо альфа-линолеоил, либо гамма-линолеоил.
В соответствии с другой конкретной формой осуществления изобретения соединения общей формулы (I) представляют собой те соединения, в которых COR3 представляет собой:
- циннамоил, замещенный одной или более чем одной группой C1-C6алкокси и/или ОН группой, выбранный из кумароила или 4-метоксициннамоила, либо 3,4-диметоксициннамоила, либо каффеоила, либо феруоила, либо синапоила.
В соответствии с формой осуществления изобретения соединения общей формулы (I) могут быть выбраны из приведенных ниже соединений:
- 4-(4-гидрокси-2-((2Е,6Е)-3,6,11-триметилдодека-2,6,10-5-триенилокси)фенилтио)бензол-1,3-диола,
- 4-(4-гидрокси-2-(3-метилбут-2-енилокси)фенилтио)бензол-1,3-диола,
- (Е)-4-(2-(3,7-диметилокта-2,6-диенилокси)-4-гидроксифенилтио)бензол-1,3-диола,
- 4-(2-бутокси-4-гидроксифенилтио)бензол-1,3-диола,
- 4-(4-бутокси-2-гидроксифенилтио)бензол-1,3-диола,
- 4-(4-гидрокси-2-(октилокси)фенилтио)бензол-1,3-диола,
- 4-(2-гидрокси-4-(октилокси)фенилтио)бензол-1,3-диола,
- 4-(2-(бензилокси)-4-гидроксифенилтио)бензол-1,3-диола,
- 4-(4-(бензилокси)-2-гидроксифенилтио)бензол-1,3-диола,
- 4-(4-гидрокси-2-(4-метоксибензилокси)фенилтио)бензол-1,3-диола,
- 4-(2-(децилокси)-4-гидроксифенилтио)бензол-1,3-диола,
- 4-(2-(гексадецилокси)-4-гидроксифенилтио)бензол-1,3-диола,
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенилдодеканоата,
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенилпальмитата,
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенилоктаноата,
- 4-(2,4-дигидроксифенилтио)-3-гидроксифенилоктаноата,
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенил-3-фенилпропаноата,
- 4-(2,4-дигидроксифенилтио)-3-гидроксифенил-3-фенилпропаноата,
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенил-3-метилбутаноата,
- 4-(2,4-дигидроксифенилтио)-3-гидроксифенил-3-метилбутаноата,
- (9Z,12Z)-2-(2,4-дигидроксифенилтио)-5- гидроксифенилоктадека-9,12-диеноата,
- (Е)-2-(2,4-дигидроксифенилтио)-5-гидроксифенил-3-(4-метоксифенил)акрилата,
- (Е)-2-(2,4-дигидроксифенилтио)-5-гидроксифенил-3-(3,4-диметоксифенил)акрилата,
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенилоктилкарбамата,
- 2-(2,4-дигидроксифенилсульфинил)-5-гидроксифенилдодеканоата,
- (9Z,12Z)-2-(2,4-дигидроксифенилсульфинил)-5-гидроксифенилоктадека-9,12-диеноата,
- 4-(2-(децилокси)-4-гидроксифенилсульфинил)бензол-1,3-диола,
- 4-(2-(децилокси)-4-гидроксифенилсульфонил)бензол-1,3-диола.
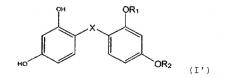
Изобретение также относится к косметическому применению соединений формулы (I'), которые включают, кроме того, новые аналоги формулы (I), резорцинсульфида, резорцинсульфоксида и резорцинсульфона, и, в частности, к
их применению для депигментации кожи, к применению в способе косметического лечения старения кожи. Общая формула (I'):
в которой радикалы X, R1 и R2 имеют значения, идентичные приведенным выше для формулы (I), но где R1 и R2 могут также одновременно представлять собой атом водорода.
Настоящее изобретение относится к косметическому применению соединений общей формулы (I') или формулы (I) в качестве антиоксидантного активного ингредиента или в качестве депигментирующего активного ингредиента.
Объектом настоящего изобретения также является применение соединений общей формулы (I) в качестве лекарства и, в частности, в качестве антибактериального активного ингредиента.
Изобретение также относится к фармацевтическим или косметическим композициям, содержащим по меньшей мере одно из соединений формулы (I) или формулы (I') в сочетании по меньшей мере с одним фармацевтически или косметически приемлемым эксципиентом.
В настоящем изобретении "фармацевтически или косметически приемлемый" рассматривают как обозначающий, что он является полезным при получении фармацевтической или косметической композиции, которая в целом безопасна, нетоксична и не является ни биологически, ни иначе нежелательной и которая приемлема для терапевтического или косметического применения, в частности, путем местного нанесения.
Объект изобретения относится к косметической композиции, характеризующейся тем, что количество соединения формулы (I) или формулы (I') варьирует от 0,01% до 10% и предпочтительно от 0,1% до 5 масс.% в отношении суммарной массы композиции.
Настоящее изобретение относится к способу отбеливания и/или осветления кожи, и/или волосяного покрова, и/или волос на голове человека, включающему нанесение на кожу, и/или волосяной покров, и/или волосы на голове косметической композиции, содержащей по меньшей мере одно соединение формулы (I) или формулы (I').
Настоящее изобретение относится к способу косметического лечения и/или предупреждения старения кожи, включающему нанесение на кожу косметической композиции, содержащей по меньшей мере одно соединение формулы (I) или формулы (I').
Объект изобретения также распространяется на способ синтеза новых соединений формулы (I).
В соответствии с другим отличительным признаком настоящего изобретения оно также относится к способу получения соединения общей формулы (I), характеризующемуся тем, что 4,4'-тиодибензол-1,3-диол или 4,4'-сульфинилбис-1,3-бензолдиол подвергают взаимодействию с галогенидом формулы II:
в которой:
Hal представляет собой атом галогена, и R1 имеет такое же значение, как приведено выше в отношении формулы (I), за исключением атома водорода.
В соответствии с другим отличительным признаком настоящего изобретения оно также относится к способу получения производного резорцина формулы (I), в котором Х представляет собой SO или SO2, характеризующемуся тем, что соединение формулы (I), в котором Х представляет собой атом серы, окисляют, в частности, водным раствором пероксида водорода.
Настоящее изобретение будет лучше понято в отношении примеров, приведенных ниже в исключительно иллюстративных целях.
I. Синтез соединений по изобретению
1) Синтез аналогов резорцинсульфида
Пример 1 (резорцинсульфид):
- 4,4'-тиодибензол-1,3-диол
1H ЯМР (400 МГц, ДМСО-d6): δ: 6.19 (dd, 2Н); 6.34 (d, 2H); 6.87 (d, 2H); 9.41 (широкий s, 2H); 9.50 (широкий s, 2H).
13C ЯМР (100 МГц, ДМСО-d6): δ: 102.58; 107.52; 111.46; 133.90; 157.04; 158.37.
МС(ИЭР-): 249.1 [М-Н]-
А) Синтез простых эфиров: Синтез простых эфиров путем сочетания резорцинсульфида с алкилгалогенидом
К суспензии 4,4'-тиодибензол-1,3-диола (резорцинсульфида, 3 г, 12 ммоль, 4 экв.) и карбоната калия (497 мг, 3,6 ммоль, 1,2 экв.) в 20 мл безводного ДМФ (=диметилформамида) в атмосфере азота добавляют 856 мг фарнезилбромида (3 ммоль, 1 экв.), затем смесь перемешивают при 80°C в течение 6 часов. За реакцией следят по ТСХ (=тонкослойной хроматографии).
После возврата к комнатной температуре растворитель выпаривают, затем остаток экстрагируют смесью этилацетата/воды. Органическую фазу дважды промывают водой, затем насыщенным раствором NaCl. После высушивания над сульфатом магния получают твердое вещество после выпаривания растворителя. Это твердое вещество промывают ДХМ (=дихлорметаном), затем собирают с получением 2 г исходного резорцинсульфида, который не прореагировал.
Затем фильтрат (ДХМ) выпаривают с получением масла, которое очищают на силикагеле смесью гептана/этилацетата (от 95/5 до 50/50) или препаративной ВЭЖХ. Продукт, полученный в форме бесцветного масла, высушивают в вакууме в течение ночи. Затем получают 730 мг при выходе 55%.
Структуру определяют с помощью протонного ЯМР, углеродного ЯМР, анализов НМВС (гетероядерной спиновой корреляции с дальними атомами), HMQC (гетероядерной многоквантовой корреляции) и NOESY (спектроскопии ядерного эффекта Оверхаузера).
Пример 2:
- 4-(4-гидрокси-2-((2Е,6Е)-3,6,11-триметилдодека-2,6,10-триенилокси)фенилтио)бензол-1,3-диол
1Н ЯМР (500 МГц, CDCl3): δ: 1.58 (s, 3Н); 1.60 (s, 3Н); 1.66 (s, 3H); 1.73 (s, 3Н); 1.96 (m, 2H); 2.04 (m, 2H); 2.09 (m, 2H); 2.14 (m, 2H); 4.56 (d, J=6.4 Гц, 2Н); 5.01 (s, 1H, ОН пара S); 5.06 (s, 1H, ОН пара S); 5.07 (m, 1H); 5.11 (m, 1H); 5.51 (t, 1H); 6.29 (d, J=8.5-2.4 Гц, 1H); 6.32 (d, J=8.2-2.7 Гц, 1H); 6.38 (d, J=2.4 Гц, 1H); 6.42 (d, J=2.7 Гц, 1H); 7.08 (d, J=8.5 Гц, 1H); 7.33 (s, 1H, ОН орто S); 7.38 (d, J=8.5 Гц, 1H).
13С ЯМР (125 МГц, CDCl3): δ: 16.04; 16.75; 17.69; 25.70; 26.20; 26.70; 39.54; 15 39.66; 65.99; 100.68; 102.31; 108.18; 108.33; 110.79; 115.32; 118.49; 123.62; 124.34; 131.38; 133.99; 135.50; 137.54; 142.24; 156.88; 158.09; 158.48; 158.73.
МС (АРС1): 455.2 [М+Н]+
Rf (1/1; Гептан/EtOAc): 0,75
Пример 3:
- 4-(4-гидрокси-2-(3-метилбут-2-енилокси)фенилтио)бензол-1,3-диол
Из 1-бром-3-метилбут-2-ена (=алкилгалогенида)
1H ЯМР (400 МГц, CDCl3): δ: 1.76 (s, 3H); 1.82 (s, 3H); 4.56 (d, 2H); 5.07 (m, 2H, 2×OH пара S); 5.53 (t, 1Н); 6.30-6.45 (m, 4H); 7.09 (d, 1H); 7.32 (s, 1H); 7.40 (d, 1H).
МС (химическая ионизация при атмосферном давлении, APCI+): 319.0 [М+Н]+
Пример 4:
- (Е)-4-(2-(3,7-диметилокта-2,6-диенилокси)-4-гидроксифенилтио)бензол-1,3-диол
Из геранилхлорида.
1H ЯМР (400 МГц, CDCl3): δ: 1.62 (s, 3H); 1.68 (s, 3H); 1.75 (s, 3H); 2.13 (m, 2H); 4.59 (d, 2H); 4.80 (s, 1H); 4.85 (s, 1H); 5.11 (s, 1H); 5.53 (t, 1H); 6.30-6.45 (m, 4H); 7.09 (d, 1H); 7.32 (s, 1H); 7.41 (d, 1H).
МС (APCI+): 386.9 [М+H]+
Пример 5:
- 4-(2-бутокси-4-гидроксифенилтио)бензол-1,3-диол
Из 1-бромбутана. Основной продукт (590 мг)
1H ЯМР (400 МГц, CDCl3): δ: 1.01 (t, 3H); 1.53 (m, 2H); 1.88 (m, 2H); 4.02 (t, 2H); 4.78 (широкий s, 2H, 2 ОН пара S); 6.32 (m, 2H); 6.36 (s, 1H); 6.45 (s, 1H); 7.08 (d, 1H); 7.29 (s, 1Н, ОН орто S); 7.40 (d, 1H).
MC (APCI+): 307,0 [М+H]+
Пример 6:
- 4-(4-бутокси-2-гидроксифенилтио)бензол-1,3-диол
Из 1-бромбутана. Минорный продукт (18 мг).
1H ЯМР (400 МГц, CDCl3): δ: 1.02 (t, 3H); 1.44 (m, 2H); 1.72 (m, 2H); 3.90 (t, 2H); 6.34 (d, 1 H); 6.41 (d, 1 H); 6.43 (s, 1 H); 6.49 (s, 1 H); 7.25 (m, 3H).
MC (APCI+): 307,1 [М+Н]+
Пример 7:
- 4-(4-гидрокси-2-(октилокси)фенилтио)бензол-1,3-диол Из 1-бромэтана. Основной продукт (1,3 г).
1H ЯМР (400 МГц, CDCl3): δ: 0.91 (t, 3H); 1.30 (m, 8H); 1.47 (m, 2H); 1.88 (m, 2H); 3.99 (t, 2H); 4.90 (широкий s, 2H); 6.30 (d, 1H); 6.35 (d, 1H); 6.36 (s, 1H); 6.45 (s, 1H); 7.07 (d, 1H); 7.32 (широкий s, 1H); 7.41 (d, 1H).
MC (APCI+): 363,2 [М+Н]+
Пример 8:
- 4-(2-гидрокси-4-(октилокси)фенилтио)бензол-1,3-диол Из 1-бромоктана. Минорный продукт (100 мг).
1H ЯМР (400 МГц, CDCl3): δ: 0.87 (t, 3H); 1.27 (m, 8H); 1.41 (m, 2H); 1.72 (m, 2H); 3.90 (t, 2H); 6.34 (d, 1H); 6.41 (d, 1H); 6.44 (s, 1H); 6.48 (s, 1H); 7.25 (m, 3H).
МС (APCI+): 363,1 [M+H]+
Пример 9:
- 4-(2-(бензилокси)-4-гидроксифенилтио)бензол-1,3-диол
Из бензилбромида. Основной продукт (600 мг).
1H ЯМР (400 МГц, CDCl3): δ: 4.80 (m широкий, 2H); 5.14 (s, 2H); 6.34 (m, 2H); 6.44 (s, 2H); 7.02 (d, 1 H); 7.08 (s, 1 H); 7.34 - 7.41 (m, 6H).
МС (APCI+): 341,1 [М+Н]+
Пример 10:
- 4-(4-(бензилокси)-2-гидроксифенилтио)бензол-1,3-диол Из бензилбромида. Минорный продукт (28 мг).
1H ЯМР (400 МГц, CDCl3): δ: 5.00 (s, 2H); 6.34-6.57 (m, 4H); 7.28-7.39 (m, 7H).
МС (APCI+): 341,1 [М+Н]+
Пример 11:
-4-(4-гидрокси-2-(4-метоксибензилокси)фенилтио)бензол-1,3-диол Из 4-метоксибензилбромида. Основной продукт (600 мг).
1H ЯМР (400 МГц, CDCl3): δ: 3.82 (s, 3H); 5.04 (s, 2H); 5.24 (m широкий, 2Н); 6.34 (m, 2H); 6.44 (m, 2H); 6.92 (d, 2H); 7.03 (d, 1H); 7.14 (широкий s, 1Н); 7.37 (m, 3H).
МС(АРС1+): 371,0 [М+Н]+
Пример 12:
- 4-(2-(децилокси)-4-гидроксифенилтио)бензол-1,3-диол
Методика примера 2, но с 2 эквивалентами резорцинсульфида, 1 эквивалентом 1-йододекана, 16 часов при комнатной температуре. Продукт получили в форме белого твердого вещества после очистки при выходе 83%.
1H ЯМР (400 МГц, CDCl3): δ: 0.91 (t, 3H); 1.25 (m, 12H); 1.47 (m, 2H); 1.88 (m, 2H); 3.99 (t, 2H); 4.90 (широкий s, 2H); 6.30 (d, 1H); 6.35 (d, 1H); 6.36 (s, 1H); 6.45 (s, 1H); 7.07 (d, 1H); 7.32 (широкий s, 1H); 7.41 (d, 1H).
13С ЯМР (100 МГц, ДМСО): δ: 13.89; 22.04; 25.39; 28.56; 28.65; 28.70; 28.89; 28.94; 31.24; 67.76; 100.18; 102,66; 107.47; 107.62; 107.98; 113.65; 130.42; 135.21; 156.83; 157.34; 158.20; 158.81.
MC(APCI+): 391,1 [М+Н]+
Пример 13:
- 4-(2-(гексадецилокси)-4-гидроксифенилтио)бензол-1,3-диол
Такой же синтез, как SP02-131, из 1-йодогексадекана.
Продукт получен в форме белого твердого вещества при выходе 84%.
1H ЯМР (400 МГц, CDCl3): δ: 0.88 (t, 3H); 1.2 (m, 24H); 1.47 (m, 2H); 1.84 (m, 2H); 3.92 (t, 2H); 5.31 (широкий s, 2H); 6.27 (dd, 1H); 6.33 (s, 1H); 6.36 (d, 1H); 6.45 (s, 1H); 7.05 (d, 1H); 7.38 (широкий s, 1H); 7.41 (d, 1H).
13C ЯМР (100 МГц, CDCl3): δ: 14.11; 22.68; 25.95; 28.89; 29.35; 29.56; 29.61; 29.66; 29.70; 31,91; 69.22; 100.39; 102,29; 108.19; 108.54; 110.89; 115.01; 133.93; 137.49; 156.88; 158.19; 158.40; 158.44.
МС (ИЭР-): 473,2 [М-Н]
В) Синтез сложных эфиров
а) Путь 1: сочетание из резорцинсульфида
К раствору 4,4'-тиодибензол-1,3-диола (резорцинсульфида, 1 г, 4 ммоль, 4 экв.) и триэтиламина (177 мкл, 1,2 ммоль, 1,2 экв.) в 20 мл безводного ТГФ (тетрагидрофурана) в атмосфере азота добавляют по каплям 219 мг лауроилхлорида (1 ммоль, 1 экв.), затем смесь перемешивают при комнатной температуре в течение 1 часа. За реакцией следят по ТСХ.
После возврата к комнатной температуре растворитель выпаривают, затем остаток экстрагируют смесью этилацетата/воды. Органическую фазу дважды промывают водой, затем насыщенным раствором NaCl. После высушивания над сульфатом магния твердое вещество получают после выпаривания растворителя. Это твердое вещество промывают ДХМ, затем собирают с получением 510 мг исходного резорцинсульфида, который не прореагировал.
Затем фильтрат (ДХМ) выпаривают с получением масла, которое очищают на силикагеле смесью циклогексана/этилацетата (9/1) или препаративной ВЭЖХ (высокоэффективной жидкостной хроматографией). Продукт, полученный в форме бесцветного масла, высушивают в вакууме в течение ночи. Продукт затвердевает при охлаждении, затем получают 260 мг в форме белого твердого вещества при выходе 60%.
Пример 14:
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенилдодеканоат
1H ЯМР (500 МГц, CDCl3): δ: 0.86 (t, J=7 Гц, 3H); 1.32 (m, 17H); 1.79 (q, J=7.6 Гц, 2H); 2.63 (t, J=7.5 Гц, 2H); 5.30 (s, 1H); 5.35 (s, 1H); 6.38 (dd, J=8.4 и 2.6 Гц, 1Н); 6.45 (d, J=2.7 Гц, 1H); 6.48 (dd, J=8.5 и 2.7 Гц, 1Н); 6.50 (d, J=2.4 Гц, 1Н); 6.73 (d, J=8.5 Гц, 1 Н); 6.76 (s, 1 H); 7.35 (d, J=8.5 Гц, 1 Н).
13С ЯМР (125 МГц, CDCl3): δ: 14.12; 22.67; 24.83; 29.13; 29.22; 29.32; 29.44; 29.59; 31.89; 34.24; 103.01; 107.84; 108.72; 110.12; 114.67; 120.06; 130.45; 137.96; 148.93; 155.48; 158.48; 159.03; 172.98.
MC (APCI): 43371 [M+H]+
Rf (7/3; Гептан/EtOAc): 0,58
Пример 15:
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенилоктаноат
Из октаноилхлорида.
1H ЯМР (400 МГц, CDCl3): δ: 0.82 (t, 3H); 1.29 (m, 8H); 1.63 (m, 2H); 2.35 (t, 2H); 6.41 (d, 1Н); 6.49 (s, 1Н); 6.56 (s, 1Н); 6.57 (d, 1Н); 6.81 (d, 1Н); 7.39 (d, 20 1Н).
MC(APCI+): 377,1 [M+H]+
Пример 16:
- 4-(2,4-дигидроксифенилтио)-3-гидроксифенилоктаноат
Из октаноилхлорида.
1H ЯМР (400 МГц, CDCl3): δ: 0.88 (t, 3H); 1.33 (m, 8H); 1.72 (m, 2H); 2.3 (t, 2H); 6.36 (d, 1Н); 6.41 (s, 1Н); 6.58 (d, 1Н); 6.71 (s, 1Н); 7.31 (m, 2H).
MC(APCI+): 377,1 [М+Н]+
Пример 17:
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенил 3-фенилпропаноат Из гидроциннамоилхлорида.
1H ЯМР (400 МГц, CDCl3): δ: 2.98 (t сист. АВ, 2Н); 3.13 (t сист. АВ, 2Н); 5.40 (широкий s, 2Н); 6.41 (d, 1Н); 6.46 (s, 1Н); 6.48 (s, 1H); 6.54 (d, 1H); 6.79 (d, 1H); 7.22-7.38 (m, 6H).
MC (APCI+): 383,1 [М+Н]+
Пример 18:
- 4-(2,4-дигидроксифенилтио)-3-гидроксифенил 3-фенилпропаноат Из гидроциннамоилхлорида.
1H ЯМР (400 МГц, CDCl3): δ: 2.86 (t сист. АВ, 2Н); 3.04 (t сист. АВ, 2Н); 6.36 (d, 1Н); 6.42 (s, 1H); 6.50 (d, 1H); 6.61 (s, 1H); 7.22-7.38 (m, 7H).
MC (APCI+): 383,1 [М+Н]+
Пример 19:
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенил 3-метилбутаноат Из изовалероилхлорида.
1Н ЯМР (400 МГц, CDCl3): δ: 1.10 (d, 6H); 2.31 (m, 1H); 2.53 (d, 2Н); 4.79 (широкий s, 1H); 4.87 (широкий s, 1H); 6.42 (d, 1H); 6.49 (s, 1H); 6.56 (s, 1H); 6.58 (d, 1H); 6.76 (s, 1H); 6.82 (d, 1H); 7.40 (d, 1H).
MC (APCI+): 335,0 [M+H]+
Пример 20:
-4-(2,4-дигидроксифенилтио)-3-гидроксифенил-3-метилбутаноат Из изовалероилхлорида.
1H ЯМР (400 МГц, CDCl3): δ: 1.03 (d, 6H); 2.22 (m, 1H); 2.40 (d, 2H); 4.75 (широкий s, 2H); 6.38 (d, 1H); 6.46 (s, 1H); 6.57 (d, 1H); 6.69 (s, 1H); 7.30 (m, 3Н).
МС (APCI+): 335,1 [М+Н]+
Пример 21:
(9Z, 12Я)-2-(2,4-дигидроксифенилтио)-5-гидроксифенилоктадека-9,12-диеноат
Из линолеоилхлорида.
1H ЯМР (400 МГц, CDCl3): δ: 0.88 (t, 3H); 1.32 (m, 14Н); 1.80 (m, 2H); 2.04 (m, 4H); 2.63 (t, 2H); 2.79 (t, 2H); 5.35 (m, 4H); 6.38 (d, 1H); 6.45 (s, 1H); 6.51 (m, 2H); 6.73 (d, 1H); 7.35 (d, 1H).
МС(ИЭР):513,2[М+НГ
Rf (1/1; Гептан/EtOAc): 0,75
б) Путь 2: Сочетание посредством карбодиимида
К раствору N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорида (960 мг, 5 ммоль) и 4-DMAP (4-диметиламинопиридина) (0,5 ммоль) в 20 мл безводного ДМФ в атмосфере N2 добавляют 620 мг 4-метоксикоричной кислоты (3,5 ммоль), затем смесь перемешивают в течение 15 минут. Добавляют 3,5 г 4,4'-тиодибензол-1,3-диола (резорцинсульфида, 14 ммоль, 4 экв.), затем смесь перемешивают при комнатной температуре в течение 4 суток.
Растворитель выпаривают, затем остаток очищают на силикагеле CHO3/МеОН (95/5) с получением 320 мг чистого продукта в форме белого твердого вещества после выпаривания и высушивания в вакуумной печи. Выход: 22%.
Пример 22:
- (Е)-2-(2,4-дигидроксифенилтио)-5-гидроксифенил-3-(4-метоксифенил)акрилат
1H ЯМР (400 МГц, CDCl3): δ: 3.86 (s, 3H); 5.00 (широкий s, 1H); 5.07 (широкий s, 1H); 6.40 (dd, 1H); 6.48 (d, 1H); 6.60 (m, 2H); 6.64 (d, 1H); 6.85 (d, 1H); 6.95 (d, 2H); 7.40 (d, 1H); 7.58 (d, 2H); 7.91 (d, 1H).
MC (APCl+): 411,0 [M+H]+
Rf (1/1; Гептан/EtOAc):0,14
Пример 23:
- (Е)-2-(2,4-дигидроксифенилтио)-5-гидроксифенил-3-(3,4-диметоксифенил)акрилат
Из 3,4-диметоксикоричной кислоты.
1H ЯМР (400 МГц, ДМСО-d6): δ: 3.82 (s, 3H); 3.84 (s, 3H); 6.22 (d, 1H); 6.37 (d, 1H); 6.61 (s, 1H); 6.64 (d, 1H); 6.77 (d, 1H); 6.92 (m, 2H); 7.01 (d, 1H); 7.31 (d, 1H); 7.43 (s, 1H); 7.72 (d, 1H); 9.58 (m, 2H); 9.78 (m, 1H).
МС (ИЭР+) 441,0 [M+H]+
Rf (95/5; ДХМ/МеОН): 0,66
С. Синтез карбаматов
К раствору 4,4'-тиодибензол-1,3-диола (резорцинсульфида, 5 г, 20 ммоль, 4 экв.) в 40 мл безводного ТГФ в атмосфере азота добавляют по каплям 0,88 мл октилизоцианата (5 ммоль, 1 экв.), затем смесь перемешивают в течение 9 часов при кипячении с обратным холодильником. За реакцией следят по ТСХ.
После возврата к комнатной температуре растворитель выпаривают, затем остаток экстрагируют смесью этилацетата/воды. Органическую фазу дважды промывают водой, затем насыщенным раствором NaCl. После высушивания над сульфатом магния твердое вещество получают после выпаривания растворителя. Это твердое вещество промывают ДХМ, затем собирают с получением исходного резорцинсульфида, который не прореагировал.
Затем фильтрат (ДХМ) выпаривают с получением масла, которое очищают на силикагеле смесью циклогексана/этилацетата или препаративной ВЭЖХ. Продукт, полученный в форме бесцветного масла, высушивают в вакууме в течение ночи. Затем получают 540 мг в форме бесцветного масла при выходе 27%.
Пример 24:
- 2-(2,4-дигидроксифенилтио)-5-гидроксифенилоктилкарбамат
1H ЯМР (400 МГц, CDCl3): δ: 0.86 (t, 3H); 1.26 (m, 8H); 1.35 (m, 2H); 1.59 (m, 2H); 3.32 (m, 2H); 5.30 (t, 1H); 5.93 (широкий s, 1H); 6.23 (широкий s, 1H); 6.35 (m, 2H); 6.41 (s, 1H); 6.52 (s, 1H); 6.63 (d, 1H); 7.32 (широкий s, 1H); 7.35 (d, 1H).
MC (ИЭР+): 406,1 [М+Н]+
2) Синтез аналогов резорцинсульфоксида
Пример 25 (резорцинсульфоксид):
- 4,4'сульфинилдибензол-1,3-диол
1H ЯМР (400 МГц, ДМСО-d6): δ: 6.32 (m, 4H); 7.10 (d, 2H); 9.82 (широкий s, 2H); 10.13 (широкий s, 2H).
MC (APCI): 267,0 [М+Н]+
А) Синтез сложных эфиров
Суспензию 4,4'-сульфинилбис-1,3-бензолдиола (резорцинсульфоксида, 2,66 г, 10 ммоль, 4 экв.) в 100 мл безводного ТГФ солюбилизируют в горячем состоянии и в атмосфере азота, затем через 5 минут при комнатной температуре добавляют 420 мкл триэтиламина (12 ммоль, 1,2 экв.). Наблюдают быстрое осаждение, затем добавляют по каплям 547 мг лауроилхлорида (2,5 ммоль, 1 экв.). Смесь перемешивают в течение 2 часов при комнатной температуре. За реакцией следят по ТСХ.
После возвращения к комнатной температуре твердое вещество отфильтровывают, затем фильтрат выпаривают с получением масла, которое очищают на силикагеле смесью гептана/этилацетата (от 80/20 до 50/50) или препаративной ВЭЖХ. Продукт, полученный в форме белого твердого вещества, высушивают в вакууме в течение ночи. Затем получают 511 мг при выходе 46%.
Пример 26:
-2-(2,4-дигидроксифенилсульфинил)-5-гидроксифенилдодеканоат
1H ЯМР (400 МГц, ДМСО-d6): δ: 0.86 (t, ЗН); 1.24 (m, 16H); 1.53 (m, 2H); 2.45 (m, 2H); 6.28 (d, 1H); 6.33 (dd, 1H); 6.53 (s, 1H); 6.83 (dd, 1H); 7.12 (d, 1H); 7.43 (d, 1H); 9.88 (s1, 1H); 10.19 (s1, 1H); 10.27 (s1, 1H).
MC (APCI+): 449,2 [М+Н]+
Rf (1/1; Гептан/EtOAc): 0,42
Пример 27:
- (9Z,127)-2-(2,4-дигидроксифенилсульфинил)-5-гидроксифенилоктадека-9,12-диеноат
Из линолеоилхлорида.
1H ЯМР (400 МГц, ДМСО-d6): δ: 0.84 (t, ЗН); 1.29 (m, 14H); 1.55 (m, 2H); 2.00 (m, 4H); 2.42 (t, 2H); 2.76 (t, 2H); 5.33 (m, 4H); 6.28 (s, 1H); 6.35 (ds, 1H); 6.53 (s, 15 1H); 6.82 (d, 1H); 7.12 (d, 1H); 7.43 (d, 1H); 9.88 (s, 1H); 10.19 (s, 1H); 10.27 (s, 1H).
MC (ИЭР): 529,2 [М+Н]+
Rf (7/3; Гептан/EtOAc): 0.45
В) Синтез простых эфиров путем окисления аналогов резорцинсульфида
К раствору примера 12 (=4-(2-(децилокси)-4-гидроксифенилтио)бензол-1,3-диола) (320 мг) в 10 мл уксусной кислоты добавляют 260 мкл раствора 30% пероксида водорода в H2O (2,5 ммоль, 3 экв.), затем смесь перемешивают в течение 3 часов при комнатной температуре.
Добавляют 50 мл воды, чтобы осадить продукт. Полученное твердое вещество собирают, затем растворяют в этилацетате, затем эту органическую фазу промывают водой, затем насыщенным раствором хлорида натрия. После высушивания над MgSO4 растворитель выпаривают с получением бежевого твердого вещества, которое высушивают в течение ночи в вакуумной печи (50 мбар, 50°C). Получают 310 мг продукта при выходе 90%.
Пример 28:
- 4-(2-(децилокси)-4-гидроксифенилсульфинил)бензол-1,3-диол
1H ЯМР (400 МГц, ДМСО-d6): δ: 0.86 (t, 3H); 1.23 (m, 14H); 1.54 (m, 2H); 3.77-3.92 (m, 2H); 6.26 (d, 1H); 6.29 (s, 1H); 6.40 (d, 1H); 6.49 (dd, 1H); 6.98 (d, 1H); 6.76 (s, 1H); 7.28 (d, 1H); 9.80 (s, 1H); 9.98 (s, 1H); 10.06 (s, 1H).
13С ЯМР (100 МГц, ДМСО-d6): δ: 13.89; 22.03; 25.14; 25.38; 28.29; 28.64; 28.66; 28.90; 28.93; 31.25; 67.86; 99.86; 102,38; 107.12; 107.49; 120.17; 121.72; 127.19; 127.68; 156.82; 157.07; 160.95; 161.18.
МС (ИЭР+): 407,2 [М+Н]+
Rf (1/1;Гептан/EtOAc): 0,12
3) Синтез аналогов резорцинсульфона
А) Синтез резорцинсульфона
К раствору 4,4'-тиодибензол-1,3-диола (резорцинсульфида, 10 ммоль, 2,5 г) в смеси ацетона/уксусной кислоты (1/1, 60 мл) добавляют 5,12 мл 30% раствора пероксида водорода в H2O (30 ммоль), затем смесь перемешивают в течение 72 часов при комнатной температуре.
Растворитель выпаривают, затем полученное твердое вещество растворяют в этилацетате с получением белого твердого вещества. После фильтрования твердого вещества фильтрат выпаривают, затем полученный посредством этого остаток очищают на силикагеле с получением 320 мг белого твердого вещества.
Пример 29:
- 4,4'-сульфонилдибензол-1,3-диол (резорцинсульфон)
1H ЯМР (400 МГц, ДМСО-d6): δ: 6.24 (d, 2H); 6.33 (dd, 2H); 7.61 (d, 2H); 10.06 5 (s, 1H); 10.16 (s, 1H).
13С ЯМР (100 МГц, ДМСО-d6): δ: 102.73; 106.41; 117.98; 131.54; 157.14; 162.86.
Rf(9/1; AXM/MeOH):0,6
В) Синтез аналогов резорцинсульфона путем окисления аналогов резорцинсульфида до резорцинсульфона
К раствору примера 12 (=4-(2-(децилокси)-4-гидроксифенилтио)бензол-1,3-диола) (195 мг, 0,5 ммоль) в 10 мл уксусной кислоты добавляют 2,8 мл 30% раствора пероксида водорода в H2O (25 ммоль, 50 экв.), затем смесь перемешивают в течение 48 часов при комнатной температуре.
Добавляют 50 мл воды, чтобы осадить продукт. Полученное твердое вещество собирают на агломерате, затем дважды промывают водой, затем дважды н-пентаном. Затем твердое вещество высушивают в течение ночи в вакуумной печи (50 мбар, 50°C) с получением белого твердого вещества. Получают 135 мг продукта при выходе 64%.
Пример 30:
- 4-(2-(децилокси)-4-гидроксифенилсульфонил)бензол-1,3-диол
1H ЯМР (400 МГц, ДМСО-d6): δ: 0.87 (t1, ЗН); 1.26 (m, 14H); 1.44 (мл, 2Н); 3.77 (мл, 2Н); 6.22 (s, 1H); 6.30 (d, 1H); 6.35 (s, 1H); 6.44 (d, 1H); 7.59 (d, 1H); 7.74 (d, 1H); 9.97 (s, 1H); 10.10 (s, 1H); 10.30 (s, 1H).
13C ЯМР (100 МГц, ДМСО-d6): δ: 13.89; 22.02; 25.29; 28.25; 28.64; 28.75; 28.88; 28.92; 31.24; 67.96; 99.78; 102.66; 106.04; 106.28; 117.91; 119.88; 131.65; 131.82; 156.97; 157.69; 162.77; 163.15.
II Результаты биологических тестов
1) Протоколы
А) Определение депигментирующей активности в бесклеточном тесте in vitro: тест на ингибирование тирозиназы
- Принцип:
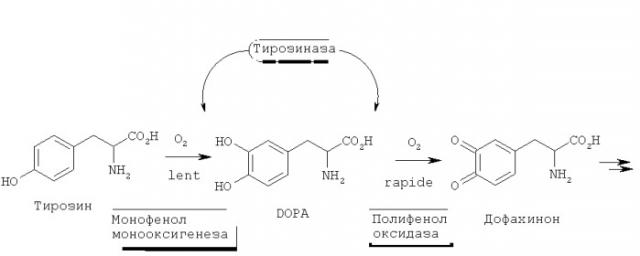
Данный тест используют, чтобы оценивать депигментирующую активность тестируемых молекул. Тирозиназа является ограничивающим ферментом в меланиногенезе.
Она принадлежит к семейству оксидоредуктаз. Она, в частности, обладает функциями: монофенолмонооксигеназы (МРМО) и полифенолоксидазы (РРО).
Этот фермент синтезируется на уровне меланоцитов. Он активируется в процессе его миграции в направлении меланосом кератиноцитов. Он преобразует тирозин в ДОФА, затем в дофахинон, который приводит в конце к полимеризации, то есть к продуцированию пигментов (см. диаграмму ниже).
| Тирозиназа | |||
| O2 | O2 | ||
| Медленный | Быстрый Полифенол оксидаза | ||
| Тирозин | Монофенол ДОФА монооксигеназа | Дофахинон | |
| МРМО | РРО |
Субстрат L-тирозин функцией монофенолмонооксигеназы преобразуется в L-ДОФА, который преобразуется функцией полифенолоксидазы тирозиназы в дофахинон. Последний претерпевает самоокисление до дофахрома, который измеряется спектрофотометрией при 490 нм.
Точнее, измеряется именно общая активность тирозиназы (МРМОд), поскольку в конце анализируют именно дофахром. Таким образом, продукты, тестируемые на МРМОд (=измерение активности на РРО и МРМО), могут объединять ингибирование 2 функций,
- уникальное ингибирование функции МРМО в строгом смысле (преобразования тирозина в ДОФА) как дополнение к тесту РРО,
- может уникально ингибировать РРО.
- Общие экспериментальные условия:
Считывающее устройство: программа Synergy HT: кинетика тирозиназы 280-490: кинетика за 45 мин, считывание при t=10 минут. Тесты в 96 прозрачных лунках, фосфатный буфер - pH 6,8, фермент: тирозиназа грибов - Sigma=Т-3824, субстрат: L-тирозин - Sigma=Т- 3754, положительный контроль: койевая кислота (КА) - Пика=60890 (референсный ингибитор)
- Референсные молекулы для теста:
Койевая кислота: 9 мкМ<IC50<20 мкМ (РРО), 3 мкМ<IC50<7 мкМ (МРМО)
Витамин С: 20 мкМ<IC50<40 мкМ (РРО)
Восстановленный глутатион: 55% ингибирование при 25 мкМ (РРО), IC50=1-2 мкМ(МРМО)
Гидрохинон: IC50=3-4 мкМ (МРМО)
Арбутин: 57% ингибирование при 88 мкМ (МРМО)
Известно, что эти экзогенные молекулы отрицательно регулируют меланиногенез. Гидрохинон ингибирует синтез меланина посредством его презентирования в качестве субстрата тирозиназы с целью отвлечения ее активности. Арбутин, содержащий гидрохинон, действует тем же путем. Койевая кислота снижает активность тирозиназы посредством ингибирования повышенной пигментации, индуцированной УФ светом. Витамин С не будет ингибировать тирозиназу, но будет вести себя как мощный восстановитель посредством предотвращения окрашивания меланина в результате окисления. Витамин А снижает экспрессию тирозиназы.
В) Количественный анализ меланина в клетках B16-F10:
Принцип:
В данный тест вовлечено измерение синтеза меланина путем колориметрического анализа на клеточной линии меланомы мыши: линии B16-F10. Данный тест дает возможность оценить депигментирующую способность активных ингредиентов.
Клетки B16-F10 культивируют в 96-луночных планшетах в среде DMEM с добавлением ФСТ (фетальной сыворотки теленка) и инкубируют в течение 24 часов при 37°C, 5% CO2. Затем клетки стимулируют 0,1 мкМ а-меланотропина (для стимуляции синтеза меланина, наблюдаемая стимуляция составляет примерно 150%) и обрабатывают в течение 72 часов тестируемыми активными ингредиентами. Каждую концентрацию активного ингредиента тестируют по меньшей мере в трех повторах. Затем суммарный меланин, а затем внутриклеточный меланин, растворенный в буфере для лизиса, анализируют путем считывания поглощения при 405 нм. Суммарные белки анализируют в лизате и результаты выражают в мг меланина/мг белков. Процент активности вычисляют, как описано ниже:
Отрицательное значение указывает на ингибирование, тогда как положительное значение указывает на индукцию синтеза меланина.
- Общие экспериментальные условия:
- Оборудование:
CO2 инкубатор клеток (Heraeus), Oven, Centrifuge (Heraeus), вытяжное устройство с ламинарным потоком воздуха, 96-луночные планшеты с прозрачным дном - Falcon, стерильные конические пробирки - Treff Lab, Polylabo, Mithras LB940 (Berthold Technologies)- 154/MIPA/003
- Биологическое оборудование:
- Линия клеток B16-F10 между Р10 и Р20 (меланоциты мыши) (АТСС, CRL-6475)
- Реагенты:
- DMEM без фенолового красного (GibcoBRL, 31053-028), добавка 200 мМ Glutamax-l (GibcoBRL, 35050-038), D-ФСБ (GibcoBRL, 14190-094), фетальная сыворотка теленка (Invitrogen, 10270-098), Трипсин - ЭДТА (GibcoBRL, 25300-054), NaOH (Sigma, S8045-500G), ДМСО (Sigma, 471267-1 L), NIe, Phe - меланотропин (Sigma, M-8764), меланин (Sigma, M-0418), BCA-Copper (Sigma, B9643 и С2284), BCA(Sigma,P0914).
С) Тест на исследование антиоксидантной способности с помощью хемилюминесценции (Photochem Analytik Jena)
- Принцип:
Данный тест используют, чтобы определить антиоксидантную способность молекул. Он представляет собой метод, который образует свободные радикалы в результате фотохимического сигнала. Интенсивность окисления является в 1000 раз более высокой, чем полученная в нормальных условиях.
Обнаружение осуществляют с помощью хемилюминесценции. Оно обеспечивает оценку водорастворимых и жирорастворимых антиоксидантных молекул или экстрактов.
Результаты выражают соответственно в эквивалентном количестве витамина С или тролокса (6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновой кислоты). Порядок чувствительности является наномолярным.
Антиоксидантная активность, исследуемая в данном тесте, представляет собой способность специфично улавливать супероксид-анионы путем хемилюминесценции.
Количественные результаты выражают в эквиваленте тролокса (стандарта), то есть в "мкг продукта на 1 мкг тролокса". Это означает, что количество образца x необходимо, чтобы получить активность, эквивалентную активности, определенной для 1 мкг стандарта. Это количество представляет собой антиоксидантную способность относительно стандарта, что дает возможность не учитывать тестируемую концентрацию.
- Генерирование оксигенированных свободных радикалов:
Супероксидный радикал: O2 0- генерируют путем фотохимической реакции:
L+hv (UV)+O2 → L*O2 →L0++O2 0-
L*: люминол в возбужденном состоянии
L0+: люминол радикал
- Обнаружение сигнала:
Часть супероксид-анионов гасится антиоксидантами. Остальные свободные радикалы количественно определяют с помощью хемилюминесценции.
L0++О2 0- → N2+АР*2- → АР2-+hv (люминесценция)
АР*2-: аминофталат в возбужденном состоянии
| Название | Условия | Фотосенсибилизация | Антиоксидант |
| Чистый контроль | 100% генерированного O2 | + |