Моноклональные антитела против активированного протеина с
Иллюстрации
Показать всеИзобретение относится к области иммунологии и биотехнологии. Представлено моноклональное антитело или его функциональный фрагмент, где указанные антитело и фрагмент связываются с активированным протеином С и ингибируют антикоагулянтную активность, но не связываются и не ингибируют активацию неактивированного протеина С, где указанное антитело получают иммунизацией млекопитающего APC и скринингом связывающей способности указанного антитела с APC, но не с протеином С. Также описана фармацевтическая композиция для лечения заболеваний, связанных с антикоагулянтной активностью APC, включающая указанное антитело в эффективном количестве и фармацевтически приемлемый носитель. Предложены: способ ингибирования антикоагулянтной активности активированного протеина С у субъекта; способ ингибирования амидолитической активности активированного протеина С у субъекта; способ лечения субъекта, который нуждается в коагуляции крови; способ лечения субъекта с гемофилией; способ модулирования гемостаза у субъекта; а также способ модулирования тромбообразования у субъекта, которые включают введение эффективного количества указанного антитела субъекту. Кроме того, описан способ лечения субъекта с сепсисом, включающий введение эффективного количества указанного антитела и активированного протеина С. Изобретение позволяет получить моноклональное антитело или его функциональный фрагмент, где указанные антитело и фрагмент связываются с активированным протеином С и ингибируют антикоагулянтную активность, но не связываются и не ингибируют активацию неактивированного протеина С. 9 н. и 8 з.п. ф-лы, 11 ил., 6 пр.
Реферат
Настоящее изобретение заявляет приоритет предварительной заявки США No. 60/983092, поданной 26 октября 2007, все содержимое которой включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится в целом к области антител. Конкретнее, настоящее изобретение описывает идентификацию и применение моноклональных антител и фрагментов антител, избирательно направленных против активированного протеина С (APC).
Описание предшествующего уровня техники
Свертывание крови является процессом, состоящим из сложного взаимодействия различных компонентов крови или факторов, который приводит в результате к образованию фибринового сгустка. В целом, компоненты крови, участвующие в каскаде реакций свертывания, являются проферментами или зимогенами - ферментативно неактивными белками, которые переходят в активную форму под действием активатора. Регулирование свертывания крови преимущественно осуществляется ферментативно путем протеолитической инактивации факторов прокоагуляции Va и VIIIa, достигаемой с помощью активированного протеина C (APC) (Esmon, 1989).
Протеин C является предшественником APC, мощным природным антикоагулянтом. Протеин С активируется тромбином в комплексе с тромбомодулином (TM). Активация усиливается эндотелиальным рецептором протеина С (EPCR). TM и EPCR могут быть деактивированы с помощью медиатора воспаления, такого как фактор некроза опухоли, рассмотренный Esmon (1999). Также обнаружено, что TM и EPCR снижены при некоторых формах септического шока, в частности при менингококкемии. Поскольку EPCR и TM экспрессируются на эндотелии, невозможно определить, непосредственно как они функционируют, не удаляя кровеносные сосуды.
APC действует как антикоагулянт путем протеолитического расщепления и понижающей регуляции прокоагуляционных факторов. APC также выполняет важные функции в качестве антиапоптотического агента, противовосполительной молекулы и цитопротективного агента. Нарушения свертываемости, при которых регуляция гемостатического статуса нарушена в результате потери ключевого фактора, как, например, отсутствие фактора VIII при гемофилии, или у травматологических пациентов, в тех случаях, когда раневой процесс приводит к временной потере гемостаза, можно лечить путем удаления APC. Однако такое лечение может привести к нежелательным вредным последствиям, связанным с удалением благоприятных функций APC помимо удаления антикоагулянтного действия. Поэтому желательно иметь лекарство, которое избирательно направлено на антикоагулянтную активность APC и в то же время оставляет другие функции молекулы неповрежденными.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Создан и описан в настоящем документе способ лечения нарушений свертываемости, включающий в себя применение моноклонального антитела, которое распознает активированный протеин С, но не распознает неактивированный протеин С. В этой связи настоящее изобретение также предоставляет моноклональные антитела, которые избирательно связываются и/или блокируют протеолитический активный центр активированного протеина С. Указанные антитела могут ингибировать антикоагулянтную активность активированного протеина С, но не могут повлиять на какую-либо активность неактивированного протеина С в определенных воплощениях. Указанные антитела также могут поддерживать цитопротективные эффекты активированного протеина С в определенных воплощениях. Таким образом, способы настоящего изобретения также включают в себя лечение с применением указанных моноклональных антител, в тех случаях, когда желательно избирательно ингибировать антикоагулянтную активность активированного протеина С.
Соответственно, некоторые общие аспекты настоящего изобретения предполагают моноклональное антитело, где указанное антитело связывается и ингибирует активированный протеин С, но не связывается или не ингибирует неактивированный протеин С. Например, определенные воплощения настоящего изобретения предусматривают моноклональное антитело, где указанное антитело связывается и ингибирует антикоагулянтную активность активированного протеина С, но не связывается или не ингибирует активацию неактивированного протеина С. В определенных воплощениях моноклональное антитело настоящего изобретения представляет собой HAPC1573. Антитела настоящего изобретения могут связываться и ингибировать активированный протеин С и его антикоагулянтные активности in vivo и/или in vitro.
Предусмотрены другие моноклональные антитела настоящего изобретения, такие как антитело, которое ингибирует связывание активированного или неактивированного протеина С эндотелиальным рецептором протеина С (EPCR) или фосфолипидами и ингибирует активацию неактивированного протеина С. В определенных аспектах указанное антитело связывается с Gla-доменом неактивированного протеина С мыши. Указанные антитела могут быть использованы в контекстах in vitro или in vivo.
Антитело настоящего изобретения может представлять собой, например, антитело мыши, антитело настоящего изобретения может представлять собой, например, гуманизированное антитело. Антитело настоящего изобретения может быть включено в фармацевтическую композицию, где фармацевтическая композиция также включает в себя фармацевтически приемлемый носитель. Антитело настоящего изобретения также может быть использовано в способах, где антитело контактирует с клеткой in vitro или in vivo.
Также настоящим изобретением предусматривается способ ингибирования антикоагулянтной активности активированного протеина С у субъекта, включающий в себя введение эффективного количества антитела настоящего изобретения указанному субъекту (например, млекопитающему, такому как человек). В указанном способе или в любом другом способе настоящего изобретения, включающем в себя введение антитела настоящего изобретения, цитопротективные эффекты активированного протеина С в определенных воплощениях могут быть не описаны или могут оставаться в пределах нормальных значений.
Также предусмотрены способы ингибирования амидолитической активности активированного протеина С у субъекта, включающие в себя введение эффективного количества антитела настоящего изобретения указанному субъекту.
Настоящим изобретением также предусмотрен способ лечения субъекта, который нуждается в коагуляции крови, включающий в себя введение эффективного количества антитела настоящего изобретения указанному субъекту. Указанный субъект может болеть, например, гемофилией или геморрагией.
В настоящем описании также предусмотрен способ лечения субъекта, имеющего сепсис, который включает в себя введение эффективного количества антитела настоящего изобретения. Указанные способы также могут включать в себя введение активированного протеина С.
Также предусмотрены способы лечения субъекта, имеющего гемофилию, которые включают в себя введение эффективного количества антитела настоящего изобретения.
Антитела настоящего изобретения также могут быть использованы, например, в способах модулирования гемостаза у субъекта или модулирования тромбообразования у субъекта, включающих в себя введение эффективного количества антитела настоящего изобретения. Указанные способы также могут включать в себя введение активированного протеина С.
Определенные способы настоящего изобретения предполагают способ ингибирования активации неактивированного протеина С, включающий в себя введение субъекту эффективного количества моноклонального антитела настоящего изобретения. Антитела, применяемые в указанных способах, также могут ингибировать связывание активированного или неактивированного протеина С эндотелиальным рецептором протеина С (EPCR) или фосфолипидами.
Согласно настоящему изобретению субъект может представлять собой, например, млекопитающее, такое как мышь, крыса, кролик, собака, лошадь или человек.
Если не указано иначе, любое антитело, описанное в настоящем документе, может быть фрагментом антитела. Например, антитело дополнительно может быть определено как Fab', Fab, F(ab')2, однодоменное антитело, Fv или scFv, которые являются хорошо известными типами фрагментов антител. Если не указано иначе, антитело настоящего изобретения также включает указанные фрагменты.
Термин "антитело" используют для обозначения любого антитела как молекулы, которая имеет антиген-связывающий участок, и термин включает в себя фрагменты антител, такие как Fab', Fab, F(ab')2, однодоменные антитела (DABs), Fv, scFv (одноцепочечный Fv) и т.д., описанные далее. Технические приемы получения и применения различных конструкций на основе антител и фрагментов антител хорошо известны в данной области техники. Средства для получения и характеристики антител также хорошо известны в данной области техники (см., например, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, 1988; включенный в описание посредством ссылки).
Другой аспект изобретения предполагает вариабельный участок, который включает в себя изменяющиеся гипервариабельные участки или CDR и каркасные области или FR. CDR представляют собой последовательности в пределах вариабельной области, которые в целом дают антигенную специфичность.
Изобретение также охватывает фрагменты антител, которые включают в себя последовательность вариабельного участка, достаточную, чтобы обеспечить антигенное связывание. Фрагменты антител включают в себя без ограничения Fab, Fab', F(ab')2, Fv, SFv, scFv (одноцепочечный Fv), полученные либо путем протеолитического расщепления интактных антител, например расщепление папаином или пепсином, либо с помощью рекомбинантных методов, в которых воздействуют на кДНК интактных тяжелых и легких цепей для получения фрагментов тяжелых и легких цепей либо по отдельности, либо в виде части одного и того же полипептида.
В пределах объема изобретения mAb также включают в себя последовательности, соответствующие антителам человека, антителам животных и их комбинации. Термин "химерное антитело", используемый в описании, включает в себя антитела, которые имеют вариабельные участки, полученные из антитела животного, такие как антитела крысы или мыши, слитые с другой молекулой, например с константными доменами, полученными из антитела человека. Один тип химерных антител, "гуманизированные антитела", имеет вариабельные участки, измененные (посредством мутагенеза или переноса CDR) для соответствия (насколько возможно) известной последовательности человеческих вариабельных участков. Перенос CDR включает в себя перенос CDR из антитела с желаемой специфичностью на FR антитела человека, при этом значительную часть нечеловеческой последовательности замещают человеческой последовательностью. Поэтому гуманизированные антитела больше соответствуют (по аминокислотной последовательности) последовательности известных антител человека. С помощью гуманизации мышиных моноклональных антител уменьшают тяжесть ответа на человеческое антимышиное антитело, или HAMA. Изобретение далее включает в себя полностью человеческие антитела, которые бы предотвращали, насколько возможно, ответ на HAMA. Получение гуманизированных антител описано более подробно далее.
Применяемый в описании термин "фармацевтически приемлемый носитель" включает в себя любой и все растворители, дисперсионные среды, покрытия, сурфактанты, антиоксиданты, консерванты (например, антибактериальные средства, противогрибковые средства), изотонические агенты, агенты, задерживающие абсорбцию, соли, консерванты, лекарства, стабилизаторы лекарств, гели, связующие вещества, эксципиенты, дезинтегрирующие агенты, лубриканты, подсластители, вкусовые добавки, красители, подобные материалы и их комбинации, которые должны быть известны специалисту в данной области техники (см., например, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). Кроме случаев, когда любой общепринятый носитель несовместим с активным ингредиентом, предусматривается его применение в терапевтических или фармацевтических композициях.
Термин "контакт", применительно к клетке, используется в настоящем документе для описания процесса, с помощью которого соединение изобретения доставляется в клетку-мишень или располагается в прямом соприкосновении с клеткой-мишенью.
Термин "эффективный", в том виде, как данный термин используется в настоящем описании и/или формуле изобретения (например, "эффективное количество"), означает достаточный для достижения желаемого, ожидаемого или намеченного результата.
Термин "в основном" и его разновидности обозначают в значительной степени, но не обязательно полностью, что очевидно для специалиста в данной области техники, и в одном не ограничивающем воплощении в основном относится к диапазонам в пределах 10%, в пределах 5%, в пределах 1% или в пределах 0,5%
Термины "ингибирование", "снижение" или "предотвращение" или любая разновидность указанных терминов, когда они используются в формуле изобретения и/или в описании, включают в себя любое измеряемое снижение или полное ингибирование для достижения желаемого результата. Например, может быть снижение активности, по сравнению с нормальным состоянием, на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 99% или больше, или снижение активности в любом диапазоне, получаемом с указанными здесь значениями.
В настоящей заявке термин "приблизительно" используют, чтобы показать, что значение включает в себя неустранимое отклонение ошибки устройства или способа, применяемого для определения значения, или отклонение, которое есть среди субъектов исследования. Например, "приблизительно" может быть в пределах 10%, предпочтительно в пределах 5%, более предпочтительно в пределах 1% и наиболее предпочтительно в пределах 0,5%.
Термин, представленный в единственном числе, если он применяется в сочетании с термином "включающий" в формуле изобретения и/или в описании, может означать "один", но также он согласуется со значением "один или более", "по меньшей мере один" и "один или более чем один".
Термин "или" в пунктах формулы изобретения применяют в значении "и/или", если не указано особо, что ссылка относится только к альтернативным вариантам, или если альтернативные варианты являются взаимоисключающими, хотя раскрытие изобретения поддерживает определение, которое относится только к альтернативным вариантам и вариантам "и/или".
Применяемые в данном описании и в пункте (пунктах) формулы изобретения слова "состоящий из" (и любая форма "состоящий из", такая как "состоят из" и "состоит из"), "имеющий" (и любая форма “имеющий”, такая как "имеют" и "имеет"), "включающий" (и любая форма “включающий”, такая как "содержит" и "содержат") или "содержащий" (и любая форма “содержащий”, такая как "содержит" и "содержат") являются инклюзивными или с открытым концом и не исключают дополнительных, не перечисленных элементов или стадий способа.
Предполагается, что любое воплощение, обсуждаемое в настоящем описании, может быть осуществлено в отношении любого соединения, способа или композиции изобретения, и наоборот.
Другие объекты, особенности и преимущества настоящего изобретения становятся очевидными из последующего подробного описания. Однако следует понимать, что подробное описание и конкретные примеры, которые показывают предпочтительные воплощения изобретения, даны только с иллюстративной целью, поскольку различные изменения и модификации, соответствующие духу и изобретению, будут очевидны для специалиста в данной области техники из настоящего подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующие чертежи являются частью настоящего описания и включены, чтобы продемонстрировать далее определенные аспекты настоящего изобретения. Изобретение может быть лучше понято с помощью ссылки на один или более из указанных чертежей в комбинации с подробным описанием конкретных воплощений, представленных в настоящем документе.
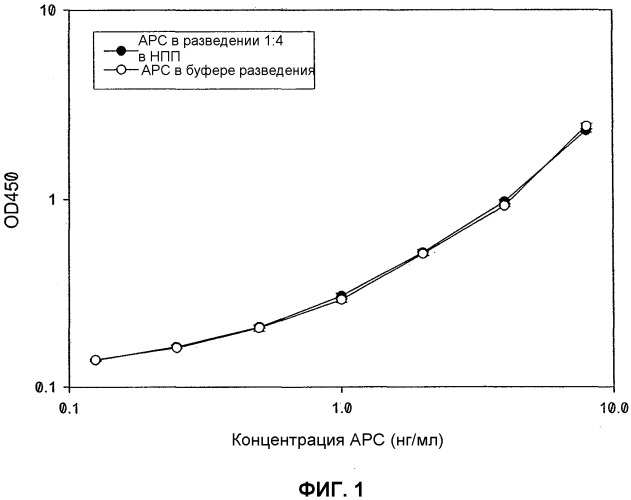
ФИГ.1. Стандартная кривая APC ELISA.
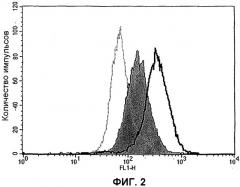
ФИГ.2. HAP1573 усиливает связывание APC на эндотелии.
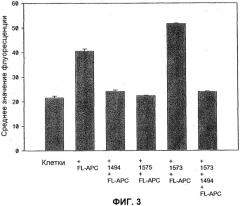
ФИГ. 3. HAPC1573 способствует интернализации APC в клетки EA.
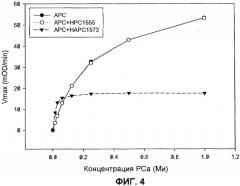
ФИГ.4. HAPC1573 изменяет амидолитическую активность APC по отношению к хромогенному субстрату.
ФИГ.5. HAPCl573 блокирует антикоагулянтную активность APC в анализе (коагулирующей активности) плазмы крови.
ФИГ.6. HAPCl573 усиливает расщепление гистонов APC.
ФИГ.7A-B. Эффект HAPC1573 на APC-цитопротекцию против гистонов.
ФИГ.8A-C. MPC1609 и MAPC1591 ингибируют антикоагулянтную активность APC. (ФИГ.8A) Клетки bEnd3 инкубировали с 100 нМ FL-APC без или в присутствии 125 нМ MPC1609 или MAPC1591 в течение 15 мин на льду и проводили анализ методом проточной цитометрии. (ФИГ.8B) Клетки bEnd3 инкубировали с 100 нМ протеина C и 5 нМ тромбина в присутствии или без 100 нМ MPC 1609 или MAPCl 591 в течение 15 мин при 37°C и измеряли активность APC с помощью хромогенного субстрата PCa. (ФИГ.8C) Время одностадийной коагуляции плазмы крови измеряли с 200 нг/мл, без или в присутствии 5 мкг/мл MPC1609 или MAPC1591. Тесты активации протеина С и свертывания крови выполняли в дупликатах, и все ошибки находились в пределах 5%.
ФИГ.9. MPC1609, но не MAPCl591 увеличивал летальность у мышей при введении вместе с сублетальной дозой LPS. Мышам BL6 вводили внутривенную инъекцию 10 мг/кг LPS с 10 мг/кг MPC1609 или MAPC1591 и регистрировали показатели выживаемости.
ФИГ.10A-D. Температура тела, концентрации в сыворотке крови IL-6, мочевины и креатинина у мышей, перенесших инъекцию LPS и MPC1609 или MAPCl 591. Мышам BL6 (4 мыши в каждой группе) вводили внутривенную инъекцию физиологического раствора, 10 мг/кг LPS или 10 мг/кг LPS с 10 мг/кг MPC1609 или MAPC1591. (ФИГ.10A) Температуру тела мыши (ФИГ.10B), концентрации в сыворотке крови IL-6 (ФИГ. 10C-D), мочевины и креатинина измеряли через 3 часа или через 18 часов после инъекции.
ФИГ.11A-C. MAPC1591 усиливает APC-расщепление гистонов. (ФИГ.11A) 100 мг/мл гистона H3 тимуса теленка (левая панель) или H4 (правая панель) инкубировали в Opti-MEM с добавлением или без добавления 100 нМ APC, без или в присутствии 200 нМ MAPC1591 в течение 1 часа при 37°C. Затем проводили анализ образцов методом электрофореза в ДСН-ПААГ с окраской Кумасси голубым. (ФИГ.11B) Клетки EA.hy926 культивировали с гистонами тимуса теленка (50 мкг/мл) без или в присутствии APC (100 нМ) и MAPC1591 (200 нМ) в течение 1 часа при 37°C. Количество погибших клеток измеряли с помощью проточной цитометрии по положительному окрашиванию PI (FL3). (ФИГ.11C) Мышам BL6 вводили внутривенную инъекцию физиологического раствора, 10 мг/кг LPS или 10 мг/кг LPS с 10 мг/кг MAPC1591 или MPC1609. Образцы плазмы получали через 18 часов после введения и проводили анализ методом электрофореза ДСН-ПААГ и вестерн-блоттинга с применением козьего антитела против гистона H3.
ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВОПЛОЩЕНИЙ
Настоящее изобретение относится к раскрытию моноклональных антител, которые избирательно связываются с активированным протеином С, но не связываются с неактивированным протеином С, и специфически ингибируют антикоагуляционную активность активированного протеина С. Указанные и другие аспекты изобретения подробно описаны ниже.
А. Структура антитела
Антитела составляют большое семейство гликопротеинов с общими структурными особенностями. Антитело включает в себя четыре полипептида, которые образуют трехмерную структуру, которая похожа на букву Y. Обычно антитело включает в себя два различных полипептида, тяжелую цепь и легкую цепь. Молекула антитела состоит из одной или более Y-единиц, каждая единица Y включает в себя две тяжелые цепи и две легкие цепи.
Молекула антитела обычно состоит из трех функциональных доменов: Fc, Fab и антигенсвязывающего участка. Домен Fc расположен в основании Y. “Плечи” Y содержат Fab-домены. Антигенсвязывающий участок расположен на конце каждого “плеча”. Область точки опоры “плеч” Y представляет собой шарнирную область.
Существует пять различных типов полипептидов тяжелых цепей, обозначаемых как α, δ, ε, γ и μ. Существуют два различных типа полипептидов легких цепей, обозначаемых κ и λ. Антитело обычно имеет в своем составе только один тип тяжелой цепи и только один тип легкой цепи, хотя любая легкая цепь может соединяться с любой тяжелой цепью.
Карбоксильный конец полипептида каждой тяжелой цепи называется константной (Fc) областью. Аминоконец полипептида каждой тяжелой и легкой цепи называется вариабельной (V) областью. Внутри вариабельных участков цепей находятся гипервариабельные участки, называемые участками, определяющими комплементарность (CDR). Вариабельные участки одной тяжелой цепи и одной легкой цепи соединяются с образованием антигенсвязывающего участка. Каждая тяжелая цепь и каждая легкая цепь включает в себя три CDR. Шесть CDR антигенсвязывающего участка определяют аминокислотные остатки, которые формируют фактически существующий участок связывания антигена. Вариабельность CDR обуславливает разнообразие распознаваемых антигенов.
B. Получение моноклональных антител настоящего изобретения
Настоящее изобретение имеет отношение к получению и применению молекул, которые способны к "специфическому связыванию" с другой молекулой. В настоящем описании молекулу называют способной к "специфическому связыванию" с другой молекулой, если указанное связывание зависит от соответствующих структур молекул. Известная способность антитела связываться с иммуногеном представляет собой пример "специфического связывания". Указанные взаимодействия являются противоположными неспецифическому связыванию, в которое вовлечены классы соединений независимо от их химической структуры (например, связывание белков нитроцеллюлозой и т.д.) Наиболее предпочтительно, антитело настоящего изобретения будет демонстрировать "высокоспецифическое связывание" такое, что антитело будет неспособно или в основном неспособно к связыванию близкородственных гетерологичных молекул. Действительно, предпочтительные моноклональные антитела настоящего изобретения демонстрируют способность связываться с активированным протеином C, но в основном не способны связываться с неактивированным протеином C. В других воплощениях моноклональные антитела специфически ингибируют только антикоагулянтные активности APC путем связывания и блокирования протеолитического активного участка APC.
Таким образом, в одном воплощении указанные молекулы включают в себя фрагменты (такие как (F(ab'), F(ab')2), которые получены, например, путем протеолитического расщепления mAb, или одноцепочечные иммуноглобулины, получаемые, например, рекомбинантными способами. Указанные производные антител являются моновалентными. В одном воплощении указанные фрагменты могут быть соединены друг с другом или с другими фрагментами антител или с лигандами рецепторов, с образованием "химерных" связывающих молекул. Такие химерные молекулы в значительной степени могут содержать заместители, способные к связыванию с различными эпитопами одной и той же молекулы, или они могут быть способны к связыванию с эпитопом активированного протеина C и с эпитопом "неактивированного протеина C".
Моноклональное антитело может быть легко получено с помощью хорошо известных методов, таких как методы, представленные в качестве примера в патенте США 4196265, который включен в описание посредством ссылки. Обычно способ включает в себя первое иммунизирование подходящего животного выбранным антигеном (например, полипептид или полинуклеотид настоящего изобретения), с помощью способа, достаточного, чтобы обеспечить иммунный ответ. Грызуны, например мыши и крысы, являются предпочтительными. Клетки селезенки иммунизированного животного затем соединяют с клетками иммортализованной миеломной клеточной линии. Если иммунизированное животное является мышью, то предпочтительная миеломная клеточная линия представляет собой клеточную линию NS-I миеломы мышей.
Слитые клетки “селезенка/миелома” культивируют в селективной среде, чтобы отделить слитые клетки “селезенка/миелома” от родительских клеток. Слитые клетки выделяют из смеси неслитых родительских клеток, например, с помощью добавления агентов, которые блокируют синтез нуклеотидов de novo в среде тканевой культуры. Типичными и предпочтительными агентами являются аминоптерин, метотрексат и азасерин. Аминоптерин и метотрексат блокируют синтез de novo пуринов и пиримидинов, тогда как азасерин блокирует только синтез пуринов. Если используют аминоптерин или метотрексат, среду дополняют гипоксантином и тимидином в качестве источника нуклеотидов. Если используют азасерин, то среду дополняют гипоксантином.
Указанное культивирование обеспечивает получение популяции гибридом, из которых отбирают специфические гибридомы. Обычно отбор гибридом производят путем культивирования клеток с разведением одного клона в титрационных микропланшетах, с последующим тестированием супернатантов индивидуальных клонов на реактивность с антигенами-полипептидами. Выбранные клоны затем можно размножать неопределенно долго для получения моноклонального антитела.
В качестве конкретного примера, чтобы получить моноклональное антитело, мышам вводят внутрибрюшинно приблизительно 1-200 мкг антигена, содержащего полипептид. B-лимфоциты стимулируют для роста введением антигена совместно с адъювантом, например с полным адъювантом Фрейнда (неспецифический стимулятор иммунного ответа, содержащий убитую Mycobacterium tuberculosis). В какой-то момент (например, две недели) спустя после первой инъекции мышей повторно иммунизируют с помощью инъекции второй дозы антигена, смешанного с неполным адъювантом Фрейнда.
Через несколько недель после второй инъекции у мышей забирают кровь из хвостовой вены и сыворотку титруют с помощью метода иммунопреципитации с меченным изотопом антигеном. Предпочтительно, процесс повторной иммунизации и титрования повторяют до достижения подходящего титра. Выделяют селезенку мыши с самым высоким титром и лимфоциты селезенки получают путем гомогенизации селезенки с помощью шприца. Обычно селезенка иммунизированного животного содержит приблизительно от 5×10 до 2×10 лимфоцитов.
Мутантные лимфоцитарные клетки, известные как миеломные клетки, получают от лабораторных животных, у которых индуцируют рост указанных клеток с помощью ряда хорошо известных способов. Миеломные клетки не имеют "реутилизационного" пути биосинтеза нуклеотидов. Поскольку миеломные клетки представляют собой опухолевые клетки, они могут расти неопределенно долго в тканевой культуре и поэтому называются бессмертными. Установлены многочисленные клеточные линии миеломных клеток мышей и крыс, например клетки миеломы мышей NS-I.
Миеломные клетки соединяют в условиях, способствующих слиянию с нормальными антитело-продуцирующими клетками, полученными из селезенки мыши или крысы, которым ввели антиген/полипептид. Условия слияния включают в себя, например, присутствие полиэтиленгликоля. Получаемые слитые клетки представляют собой гибридомные клетки. Подобно клеткам миеломы, клетки гибридомы могут расти в культуре неопределенно долго.
Гибридомные клетки выделяют из неслитых миеломных клеток путем культивирования в селективной среде, например среде HAT (гипоксантин, аминоптерин, тимидин). Неслитые миеломные клетки не имеют ферментов, необходимых для синтеза нуклеотидов по "реутилизационному" пути, поскольку они погибают в присутствии аминоптерина, метотрексата или азасерина. Неслитые лимфоциты также не могут продолжать расти в тканевой культуре. Таким образом, только клетки, которые успешно слиты (гибридомные клетки), могут расти в селективной среде.
Каждая из выживших гибридомных клеток производит одно антитело. Затем проводят скрининг указанных клеток на продукцию специфического антитела, иммунореактивного по отношению к антигену/полипептиду. Методом серийных разведений выделяют отдельные гибридомы. Гибридомы серийно разводят много раз, после разведений оставляют для роста, супернатант тестируют на наличие моноклональных антител. Клоны, продуцирующие указанное антитело, затем культивируют в больших количествах, чтобы получить антитело в подходящем количестве.
Liaw et al. (2003), в работе, включенной в настоящее описание во всей полноте посредством ссылки, описаны способы получения определенных мышиных моноклональных антител против активированного и неактивированного протеина C человека.
Если антитела или их фрагменты предназначены для терапевтических целей, может быть желательно "гуманизировать" их, чтобы смягчить какой-либо иммунный ответ. Указанные гуманизированные антитела могут быть изучены в контексте in vitro или in vivo. Гуманизированные антитела могут быть получены, например, путем замены иммуногенной части антитела на соответствующую, но неиммуногенную часть (т.е. химерные антитела). Robinson et al., патентная заявка США согласно PCT PCT/US86/02269; Akira et al., Европейская патентная заявка 184187; Taniguchi, Европейская патентная заявка 171496; Morrison et al., Европейская патентная заявка 173494; Neuberger et al., Международная патентная заявка согласно PCT WO 86/01533; Cabilly et al., Европейская патентная заявка 125023; Better et al. (1988); Liu et al. (1987); Liu et al. (1987); Sun et al. (1987); Nishimura et al. (1987); Wood et al. (1985); Shaw et al. (1988); которые включены в описание посредством ссылки. Общие обзоры "гуманизированных" химерных антител предоставлены Morrison (1985) и Oi et al. (1986); указанные обзоры включены в описание посредством ссылки).
Подходящие "гуманизированные" антитела альтернативно могут быть получены путем замены CDR или CEA. Jones et al. (1986); Verhoeyan et al. (1988); Beidler et al. (1988); все указанные документы включены в описание посредством ссылки.
D. Фармацевтические композиции
Фармацевтические композиции настоящего изобретения включают в себя эффективное количество одного или более антител, терапевтических агентов или дополнительного агента, растворенных или диспергированных в фармацевтически приемлемом носителе. Водные композиции настоящего изобретения включают в себя эффективное количество антитела, растворенного или диспергированного в фармацевтически приемлемом носителе или водной среде. Выражения "фармацевтически или фармакологически приемлемый" относятся к молекулярным субстанциям и композициям, которые не вызывают побочную, аллергическую или другую неблагоприятную реакцию при введении животному или человеку соответствующим образом.
Применяемый в описании термин "фармацевтически приемлемый носитель" включает в себя один или все растворители дисперсионные среды, покрытия, сурфактанты, антиоксиданты, консерванты (например, антибактериальные средства, противогрибковые средства), изотонические агенты, агенты, задерживающие абсорбцию, соли, консерванты, лекарства, стабилизаторы лекарств, гели, связующие вещества, эксципиенты, дезинтегрирующие агенты, лубриканты, подсластители, вкусовые добавки, красители, подобные материалы и их комбинации, которые должны быть известны специалисту в данной области техники (см., например, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329, включенный в настоящее описание посредством ссылки). Применение указанных сред и агентов для фармацевтических активных субстанций хорошо известно в данной области техники. Использование любой традиционной среды или агента в составе терапевтических композиций рассматривается лишь в тех случаях, когда они не являются несовместимыми с активным ингредиентом. Дополнительные активные ингредиенты также могут быть включены в композиции. Для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты согласно требованиям службы FDA по биологическим стандартам.
Биологический материал должен быть тщательно диализирован для удаления нежелательных молекул с низким молекулярным весом и/или лиофилизирован для более легкого приготовления лекарственного средства в желаемом носителе, когда это целесообразно. Затем активные соединения обычно включают в композиции для парентерального введения, например включают в композиции для инъекций, вводимых внутривенным, внутримышечным, подкожным, интраназальным, внутрираневым или даже внутрибрюшинным путем. Обычно такие композиции могут быть приготовлены в виде препаратов для инъекций или в виде жидких растворов или суспензий; также могут быть приготовлены твердые формы, удобные для приготовления растворов или суспензий при добавлении жидкости перед введением инъекции; и препараты также могут быть эмульгированными.
Фармацевтические формы, подходящие для инъекционного применения, включают в себя стерильные водные растворы или суспензии; композиции, содержащие кунжутное масло, арахисовое масло или водный раствор пропиленгликоля; и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсионных систем. Во всех случаях лекарственная форма должна быть стерильной и должна быть жидкой при условии, что существует возможность легкого введения лекарственной формы через шприц. Лекарственная форма должна быть стабильна в условиях производства и хранения и должна быть защищена от контаминирующего действия микроорганизмов, таких как бактерии и грибки.
Растворы активных соединений в виде свободных оснований или фармакологически приемлемых солей могут быть приготовлены в воде, соответственно смешанной с сурфактантом, например с гидроксипропилцеллюлозой. Дисперсионные системы также могут быть приготовлены в глицерине, жидких полиэтиленгликолях и в их смесях и в маслах. В обычных условиях хранения и применения указанные препараты содержат консерванты для предотвращения роста микроорганизмов.
Антитела настоящего изобретения могут быть включены в композицию в форме свободного основания, в нейтральной форме или в форме соли. Фармацевтически приемлемые соли включают в себя кислые соли присоединения (образованные со свободными аминогруппами протеина) и соли, которые образованы с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или с органическими кислотами, такими как уксусная, щавелевая, винная, миндальная кислоты и т.п. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или гидроксид железа, и таких органических оснований как изопропиламин, триметиламин, гистидин, прокаин и т.п.
Носитель также может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и т.д.), их подходящие смеси и растительные масла. Соответствующую текучесть можно поддерживать, например, с помощью применения покрытия, такого как лецитин, путем сохранения требуемого размера частиц в случае дисперсной системы и с помощью применения сурфактантов. Защита от действия микроорганизмов может быть осуществлена с помощью различных антибактериальных и противогрибковых агентов, например парабенов, хлорбутанола, фенола, сорбиновой кислоты, тимеросала и т.п. Во многих случаях предпочтительно включать в состав изотонические агенты, например сахара или хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может быть осуществлена с помощью применения в композициях агентов, задерживающих абсорбцию, например моностеарата алюминия и желатина.
Стерильные инъецируемые растворы получают путем соединения активных соединений в необходимом количестве в подходящем растворителе с различными другими ингредиентами, приведенными выше, по мере необходимости, с последующей стерилизацией фильтрованием. В целом, дисперсные системы получают путем введения различных стерилизованных активных ингредиентов в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые ингредиенты, из градиентов, приведенных выше. В случае стерильных порошков для приготовления стерильных инъецируемых растворов, предпочтительные способы приготовления представляют собой высушивание в вакууме или замораживание-оттаивание, которые дают в результате порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из его ранее стерильно-фильтрованного раствора. Также предусмотрено приготовление более или высококонцентрированных растворов для прямого введения в тех случаях, когда предпо