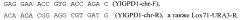Дрожжи рода yarrowia, обладающие способностью внутриклеточно накапливать сложные эфиры жирных кислот, и способ микробиологического синтеза таких эфиров
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет способ получения сложных эфиров жирных кислот с использованием дрожжей, принадлежащих к роду Yarrowia, обладающих способностью внутриклеточно накапливать сложные эфиры жирных кислот в условиях лимита по азоту или фосфору при добавлении в среду культивирования спирта дополнительно к основному источнику углерода, характеризующихся отсутствием активности или сниженной активностью фермента глицерол-3-фосфат дегидрогеназы и экспрессией гена, кодирующего фермент неспецифичную СоА-зависимую ацилтрансферазу. Изобретение относится также к штамму дрожжей Yarrowia lipolytica ВКПМ Y-4042, способному внутриклеточно накапливать сложные эфиры жирных кислот. Изобретение позволяет эффективно получать сложные эфиры жирных кислот. 3 н. и 5 з.п. ф-лы, 4 ил., 4 табл.
Реферат
Область техники
Изобретение относится к микробиологической промышленности и представляет собой способ внутриклеточного получения сложных эфиров жирных кислот с использованием в качестве продуцента штамма дрожжей рода Yarrowia, модифицированного методами генной инженерии.
Предшествующий уровень техники
В последние десятилетия активно обсуждаются вопросы, связанные с разработкой технологий получения биотоплива из возобновляемого сырья для двигателей внутреннего сгорания, как альтернативы традиционным видам топлива.
При разработке новых видов топлива для дизельных двигателей большинство усилий на сегодняшний день сосредоточены на получении биодизеля - биотоплива, состоящего из сложных эфиров жирных кислот (метиловые, этиловые эфиры жирных кислот). В промышленных масштабах биодизель производят в основном за счет химической трансэтерификации (щелочной и кислотный катализ) растительных масел, таких как рапсовое, соевое, пальмовое.
В качестве альтернативного сырья для получения биодизеля в настоящее время рассматривают микробные масла, продуцируемые рядом маслянистых микроорганизмов (дрожжами, мицелиальными грибами, микроводорослями). Дрожжи, будучи одноклеточными микроорганизмами, лишенными эндотоксинов, поддающиеся генно-инженерным улучшениям и крупномасштабной ферментации, являются особенно привлекательными для использования в биотехнологических процессах [1, 2]. Из 600 описанных видов дрожжей 30 способны накапливать масла в значительных количествах [3]. Такие дрожжи составляют группу так называемых маслянистых дрожжей. К ним относятся представители родов Candida, Cryptococcus, Rhodotorula, Rhizopus, Trichosporon, Lipomyces, and Yarrowia [3, 4] способные накапливать до 40% липидов от сухого веса клетки, более 95% из которых представлены триацилглицеридами. Некоторые из них в условиях голодания по азоту или фосфору накапливают до 70% липидов. Представляет интерес технология экстракции микробных внутриклеточных липидов, с целью осуществления дальнейшей реакции переэтерификации жирных кислот и получения биодизеля.
Источники информации содержат сведения о возможности внутриклеточного синтеза этерифицированных жирных кислот (биодизеля) некоторыми генетически модифицированными микроорганизмами. Известен продуцент, разработанный на базе бактерий Escherichia coli, который накапливает 1,28 г/л этиловых эфиров жирных кислот за 72 часа, что составляет 26% от сухого веса клеток [5], а при культивировании в пилотной установке объемом 20 л - 14,8 г/л эфиров за 47 часов культивирования [6]. Продуцент, полученный на базе дрожжей Saccharomyces cerevisiae, позволяет получить 0,52 г/л этиловых эфиров жирных кислот за 72 часа культивирования [7].
В вышеприведенных работах для получения рекомбинантных штаммов микроорганизмов, способных накапливать этиловые эфиры жирных кислот, в метаболизм клетки методами генной инженерии были внесены изменения, направленные на увеличение продукции внутриклеточного этилового спирта и осуществлена экспрессия гетерологичной неспецифичной CoA-зависимой ацилтрансферазы. При культивировании полученных штаммов на среде, содержащей жирные кислоты дополнительно к основному источнику углерода (глюкоза или глицерин), ацильные группы жирных кислот проникают в клетку, и переносятся на молекулу биосинтезированного этилового спирта благодаря активности неспецифичной CoA-зависимой ацилтрансферазы, что приводит к внутриклеточному образованию этиловых эфиров жирных кислот. Однако, необходимость использовать при культивировании достаточно дорогие свободные жирные кислоты высокой чистоты делает использование таких штаммов практически бесперспектвным.
Краткое описание изобретения
Технической задачей, на решение которой направлено представленное изобретение является расширения арсенала микроорганизмов, способных к внутриклеточному синтезу сложных эфиров жирных кислот и микробиологических способов синтеза сложных эфиров жирных кислот.
Решение поставленной задачи основано на следующих предпосылках.
Известно, что метаболизм синтеза липидов в маслянистых дрожжах (в том числе, дрожжах принадлежащих к роду Yarrowia) в условиях лимита по азоту или фосфору можно описать, схемой, представленной на фиг. 1 [3, 8]. Как видно из представленной схемы снижение активности фермента глицерол-3-фосфат дегидрогеназы должно приводить к нарушению синтеза липидов и к увеличению пула ацил-СоА (тиоэфиров кофермента А и жирных кислот) в клетке.
Если в клетке, характеризующейся сниженной активностью глицерол-3-фосфат дегидрогеназы, экспрессировать ген, кодирующий фермент неспецифичную СоА-зависимую ацилтрансферазу, способную использовать в качестве субстрата иной, нежели глицерин, спирт, то при подаче такого спирта со средой культивирования, образовавшиеся жирные кислоты из пула ацил-СоА будут переноситься на молекулу экзогенного спирта с образованием сложных эфиров жирных кислот.
Поставленная задача решена тем, что получены дрожжи, принадлежащие к роду Yarrowia, характеризующиеся отсутствием активности или сниженной активностью фермента глицерол-3-фосфат дегидрогеназы и экспрессией гена, кодирующего фермент неспецифичную СоА-зависимую ацилтрансферазу, и обладающие способностью внутриклеточно накапливать сложные эфиры жирных кислот в условиях лимита по азоту или фосфору при добавлении в среду культивирования, дополнительно к основному (расходуемому) источнику углерода, спирта, который может быть использован в качестве субстрата выбранной неспецифичной СоА-зависимой ацилтрансферазой.
При этом
- активность фермента глицерол-3-фосфат дегидрогеназы может отсутствовать вследствие внесения в геном культуры изменений любым приемлемым методом, например, инактивации гена YlGPD1 (YALI0B02948g), внесения изменений в его нуклеотидную последовательность или за счет строгой регуляции указанного гена, а также активность фермента глицерол-3-фосфат дегидрогеназы может быть снижена любым приемлемым методом, например, за счет внесения изменений в нуклеотидную последовательность гена YIGPD1 (YALI0B02948g) или за счет ослабления экспрессии указанного гена;
- в качестве неспецифичной СоА-зависимой ацилтрансферазы может быть использована любая неспецифичная СоА-зависимая ацилтрансфераза, способная использовать в качестве субстрата иной, нежели глицерин, спирт, например, неспецифичная СоА-зависимая диацилглицерид ацилтрансфераза из грамотрицательных бактерий Acinetobacter baylyi WS/DGAT, которая способна использовать в качестве субстрата широкий спектр спиртов (первичные алифатические как низкомолекулярные, так и высокомолекулярные (от метанола С1 до триаконтанола С30); многоатомные (например, глицерин); циклические с фенольными и тиоловыми группами [9, 10]. Для внутриклеточного получения сложных эфиров жирных кислот, в питательную среду при культивировании дрожжей по настоящему изобретению добавляют спирт, отличный от глицерина и нетоксичный для культивируемой клетки.
Поставленная задача решена также тем, что получен штамм дрожжей Yarrowia lipolytica ВКПМ Y-4042, способный внутриклеточно накапливать сложные эфиры жирных кислот при культивировании в жидкой питательной среде в условиях лимита по азоту или фосфору при добавлении в среду культивирования спирта дополнительно к основному источнику углерода. Указанный штамм сконструирован путем инактивации гена глицерол-3фосфат дегидрогеназы YlGPD1 в штамме Yarrowia lipolytica W29 и гетерологичной экспрессией в полученном штамме гена неспецифичной СоА-зависимой диацилглицерид ацилтрансферазы WS/DGAT из грамотрицательных бактерий Acinetobacter baylyi.
Полученный штамм Y. lipolytica ВКПМ Y-4042 характеризуется следующими признаками:
Культурально-морфологические признаки
Суточная культура в жидкой среде YPG представлена овальными, удлиненно-овальными, округлыми клетками размером 4,6-6,0×4,5-12,5 мкм. Почкование полярное или латеральное, на узком основании. К третьим суткам большинство клеток почкуются и образуют псевдомицелий.
Колонии на мальто-агаре кремового цвета, пастообразные, слегка приподнятые в центре, морщинистые, с фестончатым краем. Штрих на мальто-агаре непрерывный, плоский, блестящий, кремово-белого цвета, пастообразный, края ровные, со временем становится складчатым. Спор не образует.
Физиолого-биохимические признаки
Облигатный аэроб. Сахара не сбраживает. Ассимилирует глицерин, оливковое, соевое масла. Ассимилирует сахарозу, глюкозу, D-галактозу (медленно), L-сорбозу, янтарную, лимонную, глюконовую кислоты, декан, додекан, гексодекан, олеиновую кислоту только в присутствии небольших количеств глицерина (0.01 масс. %). Не ассимилирует: мальтозу, лактозу, целлобиозу, трегалозу, мелибиозу, раффинозу, мелицитозу, инулин, крахмал, D-ксилозу, L- и D-арабинозу, раммозу, дульцит, инозит, D-глюкозамин и глюкуроновую, 2-кетоглюконовую, 5-кетоглюконовую кислоты. Не ассимилирует нитраты. Не растет в безвитаминной среде, требует тиамин, не требует биотин.
Оптимальное значение pH для роста 5,5-7,0. Не растет при 37°C. Максимальная температура роста 35°C.
Поставленная задача решена также тем, что разработан способ биологического синтеза сложных эфиров жирных кислот, включающий культивирование дрожжей по настоящему изобретению в жидкой питательной среде в условиях лимита по азоту или фосфору при добавлении в среду культивирования спирта дополнительно к основному источнику углерода.
Краткое описание чертежей
Изобретение проиллюстрировано следующими фигурами графического изображения:
Фиг. 1 - Схема синтеза триацилглицеридов в дрожжах рода Yarrowia [8]. YlGPD1 - глицерол-3-фосфат дегидрогеназа, DGA - диацилглицерид ацилтрансфераза.
Фиг. 2 - Схема встраивания генетической конструкции FlYlGPD1-URA3 в гомологичный локус на хромосоме и инактивация гена YlGPD1 по механизму гомологичной рекомбинации.
Фиг. 3 - Схема плазмиды pARS-Cre.
Фиг. 4 - Схема генетической конструкции php4d-WS/DGAT-TXPR2-URA3.
Примеры
Возможность получения заявленных дрожжей рода Yarrowia, показана на примере штамма Yarrowia lipolytica ВКПМ Y-4042, конструирование и свойства которого подробно описаны ниже.
Однако приведенный пример не ограничивает каким-либо образом рамки настоящего изобретения. При использовании другого исходного штамма, а также других генно-инженерных манипуляций (например, снижение активности фермента глицерол-3-фосфат дегидрогеназы посредством изменения промоторной или кодирующей эти ферменты областей, использование иных, нежели описанные в данных примерах, генетических элементов для экспрессии неспецифичной СоА-зависимой ацилтрансферазы), могут быть получены иные штаммы рода Yarrowia, также способные накапливать эфиры жирных кислот в условиях лимита по азоту или фосфору при добавлении в среду культивирования спирта дополнительно к основному источнику углерода.
Пример 1. Конструирование штамма Y. lipolytica W29(dYlGPD1) с инактивированным геном глицерол-3-фосфат дегидрогеназы YlGPD1.
Инактивацию генов в дрожжах Y. lipolytica осуществляют с помощью механизма гомологичной рекомбинации по двойному кроссинговеру [11], для чего конструируют генетическую кассету flYlGPDl-URA3, содержащую нуклеотидную последовательность селективного маркера URA3 (оротидин-5-фосфат декарбоксилазы), экранированного фрагментами ДНК размером более 700 п.н., гомологичными хромосомальным областям, расположенным в промоторной (YlGPD1-Up) и терминаторной (YlGPD1-Down) частях выключаемого гена YlGPD1, которую затем используют для генетической трансформации штамма Y. lipolytica W29 URA-.
1.1. Конструирование генетической кассеты flYlGPDl-URA3
Нуклеотидную последовательность YlGPD1-Up размером 1067 п.н. амплифицируют с помощью метода ПЦР по праймерам
Нуклеотидную последовательность YIGPD1-Down размером 826 п.н. амплифицируют с помощью метода ПЦР по праймерам
Нуклеотидную последовательность гена URA3, кодирующего фермент оротидин-5-фосфат декарбоксилазу, размером 1473 п.н. амплифицируют с помощью метода ПЦР по праймерам
Все используемые в работе праймеры синтезированы фирмой «Синтол», Москва.
В качестве матрицы для ПЦР используют тотальную геномную ДНК, выделенную из штамма Y. lipolytica W29 (CLIB (Collection de Levures d′lnteret Biotechnologique, Thiverval Grignon, France (Коллекция дрожжей биотехнологического применения), номер CLIB89) методом, описанным ранее [12].
Три ДНК франмента очищают после электрофореза в 1% агарозном геле методом экстракции ДНК (Kit #K0513, «Fennentas», Литва). Очищенные ДНК фрагменты YlGPD1-Up и URA3 соединяют методом ПЦР-сшивки [13] по праймерам YlGPD1-Up-Eco72I-F и Lox71-URA3-R. Полученную нуклеотидную последовательность YlGPD1-Up-URA3 размером 2540 п.н. вырезают после электрофореза из геля и очищают методом экстракции ДНК. Далее данный фрагмент соединяют методом ПЦР-сшивки с ДНК-фрагментом YlGPD1-Down по праймерам YlGPD1-up-Eco72I-F и YlGPD1-down-Eco72I-R. Полученная генетическая конструкция размером 3376 п.н. названа flYlGPD1-URA3.
1.2. Трансформация штамма Y. lipolytica W29 URA-
1 мкг ДНК-кассеты flYlGPD1-URA3 используют для генетической трансформации штамма Y. lipolytica W29 URA-. Трансформацию осуществляют методом электропорации [14]. Трансформанты отбирают по восстановлению прототрофности к урацилу на минимальной селективной среде SYNBG, полученной при добавлении к среде YNB («Himedia G091») глицерина - 2 масс. %, сорбит - 0,1М, агар - 2 масс. %. Наличие вставки в локус YlGPD1 (фиг. 2) проверяют с помощью ПЦР.
Для ПЦР используют DreamTaq-полимеразу, в качестве ДНК матрицы тотальную геномную ДНК, выделенную из полученных трансформантов, и локус-специфические праймеры
Отобранный трансформант с делецией гена YlGPD1 названный W29(dYlGPD1) используют для дальнейших исследований.
Штамм Y. lipolytica W29(dYlGPD1) не растет на минимальной среде с основным источником углерода, таким как глюкоза, этиловый спирт, алканы (декан, додекан, гексодекан), жирные кислоты (например, олеиновая кислота). Однако, при добавлении в среду небольшого количества глицерина (0.01 масс. %) рост возобновляется. Данная фенотипическая особенность указывает на то, что штамм Y. lipolytica W29(dYlGPD1) является ауксотрофом по глицерину и не способен синтезировать глицерин, входящий в состав структурных компонентов клетки (фосфолипидов и липидов мембран).
Пример 2. Конструирование штамма Y. lipolytica W29(dYlGPD1 URA-) ауксотрофного по урацилу
2.1. Конструирование вспомогательной плазмиды pARS-Cre
Для проведения дальнейших генетических манипуляций на базе сконструированного штамма Y. lipolytica W29(dYlGPD1) получают его клон ауксотрофный по урацилу, для чего конструируют вспомогательную плазмиду pARS-Cre (фиг. 3), которая содержит
- нуклеотидную последовательность рекомбиназы Cre [15];
- прмотор гена глицерол-3-фосфатдегидрогеназы PGPD1 [16];
- терминатор гена щелочной протеазы TXPR2;
- автономно-реплицирующуюся последовательность ARS18 [17];
- селективный маркер hph [18].
Нуклеотидную последовательность гена устойчивости к антибиотику гигромицину (hph) получают из вектора pFA-6a-Mx-hph [18] путем обработки эндонуклеазами рестрикции BamHI и SacI. Высвобожденный фрагмент размером 1690 п.н. очищают после электрофореза в 1% агарозном геле методом экстракции и обрабатывают Pfu-полимеразой для получения тупых концов фрагмента. 0,3 мкг ДНК фрагмента hph лигируют с 0,2 мкг ДНК вектора pUC19, обработанного эндонуклеазой рестрикции HindIII, и Pfu-полимеразой и трансформируют в Е. coli XL1 (Blue) (Stratagene, каталожный номер #200228) как описано в Sambrook et al. [19]. Клоны, содержащие необходимую вставку ДНК отбирают на чашках по устойчивости к ампициллину и стандартному тесту на отсутствие активности β-галактозидазы [19]. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом. Полученная плазмида размером 4376 п.н. названа pUC 19-hph.
ДНК последовательности промотора PGPD1, терминатора TXPR2 и автономно-реплицирующейся последовательности (ARS18) амплифицируют методом ПЦР с использованием Pfu-полимеразы и праймеров
соответственно.
В качестве матрицы для ПЦР промотора и терминатора используют тотальную геномную ДНК штамма Y. lipolytica W29. В качестве матрицы для амплификации ARS18 - тотальную геномную ДНК штамма Y. lipolytica CLIB122.
Полученные нуклеотидные последовательности PGPD1, TXPR2 и ARS18 размером 939 п.н., 166 п.н. и 1332 п.н., соответственно, очищают после электрофореза в 1% агарозном геле методом экстракции ДНК. Очищенные ДНК фрагменты PGPD1 и TXPR2 соединяют методом ПЦР сшивки по праймерам pGPD-F и ARS-PT-R, получая единую нуклеотидную последовательность PGPD1-ТXPR2, размером 1082 п.н., которую далее также очищают после электрофореза в 1% агарозном геле. К нуклеотидной последовательности PGPD1-TXPR2 добавляют последовательность ARS18 методом ПЦР сшивки по праймерам pGPD-F и ARS-R, получая единую нуклеотидную последовательность PGPD1-TXPR2-ARS18, размером 2390 п.н., содержащую слитые генетические элементы - промотор, терминатор и автономно-реплицирующуюся последовательность.
ДНК-фрагмент PGPD1-TXPR2-ARS18 очищают из геля, обрабатывают эндонуклеазами рестрикции MluI и PstI и лигируют с вектором pUC19-hph, обработанным рестриктазами XbaI и PstI и дополнительно дефосфорилированным щелочной фосфотазой CIAP. Лигазную смесь трансформируют в Е. coli XL1 (Blue), клоны отбирают на чашках по устойчивости к ампициллину. Наличие вставки PGPD1-TXPR2-ARS18 и ее ориентацию подтверждают рестрикционным анализом. Полученный вектор размером 6362 п.н. назван pARS-PT-hph.
ДНК последовательности промотора гена глицерол-3-фосфатдегидрогеназы (PGPD1), терминатора гена щелочной протеазы (TXPR2) и автономно-реплицирующейся последовательности секвенируют с использованием стандартного праймера M13/pUC-F, а также
Нуклеотидную последовательность гена, кодирующего фермент рекомбиназу Cre, амплифицируют методом ПЦР с тотальной геномной ДНК фага Р1 с использованием праймеров
Полученный ДНК-фрагмент размером 1048 п.н. очищают из геля и лигируют на вектор pUC19, обработанный эндонуклеазой рестрикции SacI. Клоны, содержащие необходимую вставку ДНК отбирают на чашках по устойчивости к ампициллину и стандартному тесту на отсутствие активности β-галактозидазы. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом, ген рекомбиназы секвенируют с помощью стандартных праймеров M13/pUC-F, M13/pUC-R. Полученную плазмиду pUC-Cre обрабатывают эндонуклеазами рестрикции Есо31I и NheI, высвобожденный ген Cre очищают из геля и лигируют с вектором pARS-PT-hph, предварительно обработанным эндонуклеазами рестрикции Есо31I и XmaJI и дефосфорилированным щелочной фосфотазой CIAP. Лигазную смесь трансформируют в Е. coli XL1 (Blue), клоны отбирают на чашках по устойчивости к ампициллину. Наличие вставки Cre подтверждают рестрикционным анализом. Полученная плазмида размером 7381 п.н. названа pARS-Cre (фиг. 3).
2.2. Трансформация штамма Y. lipolytica W29(dYlGPD1)
500 нг вспомогательной плазмиды pARS-Cre используют для генетической трансформации штамма Y. lipolytica W29(dYlGPD1). Трансформацию осуществляют методом электропорации. Трансформанты отбирают по устойчивости к антибиотику гигромицину на богатой селективной среде YPGhph следующего состава (масс. %): пептон - 1, дрожжевой экстракт - 1, глицерин - 2, сорбит 0,1 М, гигромицин - 0,025, агар - 2, вода - остальное.
Полученные трансформанты рассевают до отдельной колонии на агаризованной среде YNB, содержащей дополнительно (масс. %) глицерин - 2, гигромицин - 0,025, агар - 2 и осуществляют индукцию рекомбиназы Cre путем культивирования выбранных клонов в жидкой среде YPGhph на протяжении 24 ч при 30°C и постоянном перемешивании (250 об/мин).
Полученную клеточную суспензию рассевают до отдельных колоний на полной агаризованной среде YPG следующего состава (масс. %): пептон - 1, дрожжевой экстракт - 1, глицерин - 2, агар - 2, вода - остальное и отбирают клоны, неспособные расти на минимальной среде без урацила.
Полученные ауксотрофные по урацилу клоны инкубируют в жидкой среде YPG (масс. %; пептон - 1, дрожжевой экстракт - 1, глицерин - 2, вода - остальное) на протяжении 24 ч при 30°C и постоянном перемешивании (250 об/мин). Рассевают клеточную суспензию до отдельных колоний на агаризованной среде YPG, печатают отдельные клоны на среды YPG и YPGhph и по отсутствию роста на среде с гигромицином отбирают клоны, в которых вспомогательная плазмида pARS-Cre потеряна.
Штамм ауксотрофный по урацилу и не содержащий плазмиду pARS-Cre назван Y. lipolytica W29(dYlGPD1 URA-).
Пример 3. Экспрессия гена неспецифичной СоА-зависимой диацилглицерид ацилтрансферазы WS/DGAT из грамотрицательных бактерий Acinetobacter baylyi
3.1. Конструирование экспрессионного вектора php4d-WS/DGAT-TXPR2-URA3
Терминатор гена щелочной протеазы XPR2 амплифицируют с тотальной геномной ДНК штамма Y. lipolytica W29 с использованием праймеров
Полученный ПЦР-продукт обрабатывают эндонуклеазами рестрикции XbaI и XmaJI и лигируют с плазмидой pUC19-hp4d (RU 2355754), обработанной эндонуклеазой рестрикции XmaJI и дефосфорилированной щелочной фосфатазой CIAP. Клоны, содержащие необходимую вставку ДНК, отбирают на чашках по устойчивости к ампициллину, а выделенную из них плазмиду проверяют рестрикционным анализом. Полученная плазмида размером 3383 п.н. названа php4d-TXPR2.
Ген URA3 амплифицируют с тотальной геномной ДНК штамма Y. lipolytica W29 с использованием праймеров Lox66-URA3-F и Lox71-URA3-R. ПЦР-продукт URA3 сначала клонируют на вектор pUC19. Полученную плазмиду, названную pUC19-URA3, обрабатывают эндонуклеазами рестрикции EheI и XbaI, а также pfu-полимеразой для образования тупых концов ДНК, и лигируют с плазмидой php4d-TXPR2, обработанной эндонуклеазой рестрикции EheI и дефосфорилированной щелочной фосфатазой CIAP. Клоны, содержащие необходимую вставку ДНК, отбирают на чашках по устойчивости к ампициллину, а выделенную из них плазмиду проверяют рестрикционным анализом. Полученная плазмида размером 5049 названа php4d-TXPR2-URA3.
Ген, кодирующий СоА-зависимую диацилглицерид ацилтрансферазу из грамотрицательных бактерий Acinetobacter baylyi WS/DGAT, амплифицируют с тотальной геномной ДНК A. baylyi методом ПЦР с использованием Pfu-полимеразы и праймеров
Наработанный ПЦР-фрагмент размером 1402 п.н. лигируют с ДНК вектора pUC19, обработанного эндонуклеазой рестрикции Ecl136II и трансформируют в Е. coli XL1 (Blue). Клоны, содержащие необходимую вставку ДНК, отбирают на чашках по устойчивости к ампициллину и стандартному тесту на отсутствие активности В-галактозидазы. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом. Нуклеотидную последовательность гена WS/DGAT секвенируют с помощью стандартных праймеров M13/pUC-F, M13/pUC-R. Полученная плазмида размером 4088 п.н. названа pUC19-WS/DGAT.
Полученную плазмиду pUC 19-WS/DGAT обрабатывают эндонуклеазами рестрикции BpiI и XmaJI, ДНК фрагмент WS/DGAT размером 1379 п.н. очищают после электрофореза в 1% агарозном геле методом экстракции ДНК и лигируют с ДНК вектора php4d-TXPR2-URA3, обработанного эндонуклеазами рестрикции BpiI и XmaJI и дефосфорилированного щелочной фосфатазой CIAP. Лигазную смесь трансформируют в Е. coli XL1 (Blue). Клоны, содержащие необходимую вставку ДНК, отбирают на чашках по устойчивости к ампициллину, а выделенную из них плазмиду проверяют рестрикционным анализом. Полученная плазмида размером 6420 п.н. названа php4d-WS/DGAT-TXPR2-URA3 (фиг.4).
3.2. Конструирование штамма Y. lipolytica W29(dYlGPD1×WS/DGAT)
Экспрессионный вектор php4d-WS/DGAT-TXPR2-URA3 обрабатывают эндонуклеазами рестрикции NdeI и CaiI и используют полученную экспрессионную кассету (1 мкг) для трансформации штамма Y. lipolytica W29(dYlGPD1 URA-). Трансформацию осуществляют методом электропорации. Трансформанты отбирают на минимальной селективной среде SYNBG по восстановлению прототрофности к урацилу.
Культивирование отобранных трансформантов проводят в пробирках (50 мл) с рабочим объемом 5 мл при 30°C и постоянном перемешивании (250 об/мин) в течение 4 суток в среде YNBEtOHsco следующего состава (масс. %): KH2PO4 - 0.085, K2HPO4 - 0.015, MgSO4 - 0.05, NaCl - 0.01, CaCl2 - 0.01, (NH4)2SO4 - 0.2, дрожжевой экстракт - 0.1, глюкоза - 5, глицерин - 0.1, этиловый спирт - 1, 100 мМ калий фосфатный буфер pH=6.8, вода - остальное. Пробы отбирают на 4 сутки культивирования, биомассу осаждают и лиофилизируют.
Анализ этиловых эфиров жирных кислот в биомассе проводят методом газовой хроматографии. Расчет массовой концентрации этиловых эфиров жирных кислот осуществляется на основе соотношений площадей пиков соответствующих этиловых эфиров жирных кислот и площади пика внутреннего стандарта (этиловый эфир маргариновой кислоты).
По результатам культивирования, исходя из количества синтезированных этиловых эфиров жирных кислот полученных трансформантов, был отобран трансформант №1, который накапливает 0.5 мг/г сухого веса этиловых эфиров жирных кислот.
Полученная смесь состоит из этиловых эфиров олеиновой кислоты (20% от общего содержания жирных кислот), линолевой кислоты (40% от общего содержания жирных кислот), цис-13-докозеновой кислоты (20% от общего содержания жирных кислот) и трикозановой кислоты С22:0 (20% от общего содержания жирных кислот).
Сконструированный штамм Yarrowia lipolytica W29(dYlGPD1×WS/DGAT), депонирован во Всероссийской Коллекции Промышленных Микроорганизмов ФГУП ГосНИИгенетика (117545 Москва, 1-ый Дорожный пр-д, д.1), и имеет регистрационный номер ВКПМ Y-4042.
Пример 4. Культивирование штамма Y. lipolytica ВКПМ Y-4042
Подготовку посевной культуры штамма Y. lipolytica ВКПМ Y-4042 проводят в три этапа:
- пересев штамма ВКПМ Y-4042 на агаризованную среду YPG;
- посев в жидкую среду YPG и инкубация в течение 24 ч при 30°C и постоянном перемешивании (250 об/мин);
- пересев из жидкой среды YPG в жидкую среду YNB, содержащую глицерин 2% масс, и инкубация в течение 48 ч при 30°C и постоянном перемешивании (250 об/мин).
Посев осуществляют титром 1-3×106 клеток/мл.
4.1. Культивирование в среде, содержащей дополнительно к основному источнику углерода этиловый спирт
Культивирование штамма осуществляют в среде YNBEtOHsco в пробирках (50 мл) с рабочим объемом 5 мл при 30°C и постоянном перемешивании (250 об/мин).
В качестве контроля используют природный изолят штамма Y. lipolytica W29. Культивирование осуществляют в течение 4-х суток, биомассу осаждают и лиофилизируют.
В результате культивирования штамм Y. lipolytica ВКПМ Y-4042 синтезирует до 0.5 мг/г сух веса этиловых эфиров жирных кислот, штамм Y. lipolytica W29 не накапливает этиловых эфиров жирных кислот.
4.2. Культивирование в среде, содержащей дополнительно к основному источнику углерода метиловый спирт
Культивирование штамма осуществляют в среде YNBMetOHsco следующего состава (масс. %): KH2PO4 - 0.085, K2HPO4 - 0.015, MgSO4 - 0.05, NaCl - 0.01, CaCl2 - 0.01, (NH4)2SO4 - 0.2, дрожжевой экстракт - 0.1, глюкоза - 5, глицерин - 0.1, метиловый спирт - 0.5, 100 мМ калий фосфатный буфер pH=6.8, вода - остальное, содержащей дополнительно к основному источнику углерода метиловый спирт. Культивирование осуществляют по примеру 5.1, но с использованием метилового спирта.
В результате культивирования штамм Y. lipolytica ВКПМ Y-4042 накапливает 0.4 мг/г сух веса смеси метиловых эфиров жирных кислот следующего состава: олеиновая кислота (10% от общего содержания жирных кислот), линолевая кислота (40% от общего содержания жирных кислот), цис-13-докозеновая кислота (30% от общего содержания жирных кислот) и трикозановая кислота (20% от общего содержания жирных кислот). Контрольный штамм W29 не накапливает метиловых эфиров жирных кислот.
Источники информации
[1] М. Khot, S. Kamat, S. Zinjarde, A. Pant, B. Chopade, A. Ravikumar, Single cell oil of oleaginous fungi from the tropical mangrove wetlands as a potential feedstock for biodiesel. Microb Cell Fact 11 (2012) 71.
[2] G. Katre, С. Joshi, М. Khot, S. Zinjarde, A. Ravikumar, Evaluation of single cell oil (SCO) from a tropical marine yeast Yarrowia lipolytica NCIM 3589 as a potential feedstock for biodiesel. AMB Express 2 (2012) 36.
[3] С. Ratledge, J.P. Wynn, The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms. Adv Appl Microbiol 51 (2002) 1-51.
[4] S. Papanikolaou, М. Galiotou-Panayotou, S. Fakasa, М. Komaitis, G. Aggelis, Lipid production by oleaginous mucorales cultivated on renewable carbon sources. Eur J Lipid Sci Technol 109 (11) (2007) 1060-1070.
[5] R. Kalscheuer, T. Stolting, A. Steinbuchel, Microdiesel: Escherichia coli engineered for fuel production. Microbiology 152 (2006) 2529-2536.
[6] Y. Elbahloul, A. Steinbuchel, Pilot-scale production of fatty acid ethyl esters by an engineered Escherichia coli strain harboring the p(Microdiesel) plasmid. Appl Environ Microbiol 76 (2010) 4560-4565.
[7] K.O. Yu, J. Jung, S.W. Kim, C.H. Park, S.O. Han, Synthesis of FAEEs from glycerol in engineered Saccharomyces cerevisiae using endogenously produced ethanol by heterologous expression of an unspecific bacterial acyltransferase. Biotechnol Bioeng 109 (2012) 110-115.
[8] A. Beopoulos, J.M. Nicaud, C. Gaillardin, An overview of lipid metabolism in yeasts and its impact on biotechnological processes. Appl Microbiol Biotechnol 90 (2011) 1193-1206.
[9] R. Kalscheuer, A. Steinbuchel, A novel bifunctional wax ester synthase/acyl-CoA:diacylglycerol acyltransferase mediates wax ester and triacylglycerol biosynthesis in Acinetobacter calcoaceticus ADP1. J Biol Chem 278 (2003) 8075-8082.
[10] T. Stoveken, R. Kalscheuer, U. Malkus, R. Reichelt, A. Steinbuchel, The wax ester synthase/acyl coenzyme A:diacylglycerol acyltransferase from Acinetobacter sp. strain ADP1: characterization of a novel type of acyltransferase. J Bacteriol 187 (2005) 1369-1376.
[11] P. Fickers, M.T. Le Dall, C. Gaillardin, P. Thonart, J.M. Nicaud, New disruption cassettes for rapid gene disruption and marker rescue in the yeast Yarrowia lipolytica. J Microbiol Methods 55 (2003) 727-737.
[12] J. Bahler, J.Q. Wu, M.S. Longtine, N.G. Shah, A. McKenzie, 3rd, A.B. Steever, A. Wach, P. Philippsen, J.R. Pringle, Heterologous modules for efficient and versatile PCR-based gene targeting in Schizosaccharomyces pombe. Yeast 14 (1998) 943-951.
[13] A. Urban, S. Neukirchen, K.E. Jaeger, A rapid and efficient method for site-directed mutagenesis using one-step overlap extension PCR. Nucleic Acids Res 25 (1997) 2227-2228.
[14] E.Y. Yuzbasheva, T.V. Yuzbashev, I.A. Laptev, Т.К. Konstantinova, S.P. Sineoky, Efficient cell surface display of Lip2 lipase using C-domains of glycosylphosphatidylinositol-anchored cell wall proteins of Yarrowia lipolytica. Appl Microbiol Biotechnol 91 (2011) 645-654.
[15] P. Oberdoerffer, K.L. Otipoby, M. Maruyama, K. Rajewsky, Unidirectional Cre-mediated genetic inversion in mice using the mutant loxP pair lox66/lox71. Nucleic Acids Res 31 (2003) e140.
[16] Т. Juretzek, H.J. Wang, J.M. Nicaud, S. Mauersberger, G. Barth, Comparison of Promoters Suitable for Regulated Overexpression of β-Galactosidase in the Alkane-Utilizing Yeast Yarrowia lipolytica. Biotechnology and Bioprocess Engineering 5 (2000) 320-326.
[17] P. Fournier, A. Abbas, M. Chasles, B. Kudla, D.M. Ogrydziak, D. Yaver, J.W. Xuan, A. Peito, A.M. Ribet, C. Feynerol, et al., Colocalization of centromeric and replicative functions on autonomously replicating sequences isolated from the yeast Yarrowia lipolytica. Proc Natl Acad Sci USA 90 (1993) 4912-4916.
[18] С. Janke, M.M. Magiera, N. Rathfelder, С. Taxis, S. Reber, H. Maekawa, A. Moreno-Borchart, G. Doenges, E. Schwob, E. Schiebel, M. Knop, A versatile toolbox for PCR-based tagging of yeast genes: new fluorescent proteins, more markers and promoter substitution cassettes. Yeast 21 (2004) 947-962.
[19] J. Sambrook, T. Maniatis, E. Fritsch, Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory, Cold Spring Harbor, N Y (1989).
1. Дрожжи, принадлежащие к роду Yarrowia, обладающие способностью внутриклеточно накапливать сложные эфиры жирных кислот в условиях лимита по азоту или фосфору при добавлении в среду культивирования спирта дополнительно к основному источнику углерода, характеризующиеся отсутствием активности или сниженной активностью фермента глицерол-3-фосфат дегидрогеназы и экспрессией гена, кодирующего фермент неспецифичную СоА-зависимую ацилтрансферазу.
2. Дрожжи по п.1, отличающиеся тем, что активность фермента глицерол-3-фосфат дегидрогеназы отсутствует за счет инактивации гена YlGPD1 (YALI0B02948g).
3. Дрожжи по п.1, отличающиеся тем, что активность фермента глицерол-3-фосфат дегидрогеназы снижена за счет ослабления экспрессии гена YlGPD1 (YALI0B02948g).
4. Дрожжи по п.1, отличающиеся тем, что активность фермента глицерол-3-фосфат дегидрогеназы снижена за счет внесения изменений в нуклеотидную последовательность гена YlGPD1 (YALI0B02948g).
5. Дрожжи по п.1, отличающиеся тем, что в качестве неспецифичной СоА-зависимой ацилтрансферазы выбрана неспецифичная СоА-зависимая диацилглицерид ацилтрансфераза из грамотрицательных бактерий Acinetobacter baylyi WS/DGAT.
6. Дрожжи по п.1, отличающиеся тем, что указанными дрожжами являются дрожжи Yarrowia lipolytica.
7. Штамм дрожжей Yarrowia lipolytica ВКПМ Y-4042, способный внутриклеточно накапливать сложные эфиры жирных кислот.
8. Способ микробиологического синтеза сложных эфиров жирных кислот, включающий культивирование дрожжей по п.1 или 7 в жидкой питательной среде в условиях лимита по азоту или фосфору при добавлении в среду культивирования спирта дополнительно к основному источнику углерода.