Способ оценки иммуносупрессивных свойств мезенхимальных стромальных клеток человека
Иллюстрации
Показать всеИзобретение относится к области медицины, молекулярной биологии и биофармакологии. Предложен способ определения иммуносупрессивных свойств мезенхимальных стромальных клеток человека путем измерения уровня экспрессии молекулы HLA-DR на поверхности мембран клеток и измерение в клетках уровня экспрессии молекул IDO, iNOS и СОХ-2. Критерием оценки служит двухкратное увеличение уровня экспрессии HLA-DR на поверхности мембран МСК и/или мРНК генов IDO, iNOS и СОХ-2 в клетках. Изобретение может быть использовано для оценки иммуносупрессивных свойств клеток в диагностических целях. 6 ил, 5 пр.
Реферат
Область техники
Изобретение относится к области медицины, в частности к биофармакологии и медицине, и касается способа оценки иммуносупрессивного потенциала мезенхимальных стромальных клеток.
Уровень техники
В последнее время обнаружено, что мезенхимальные стромальные (стволовые) клетки (МСК) обладают антивоспалительными и иммуносупрессивными свойствами, выражающимися в подавлении пролиферации активированных Т-лимфоцитов, в подавлении созревания дендритных клеток и снижении способности В-клеток секретировать иммуноглобулины.
Иммуносупрессивные свойства МСК проявляются не постоянно, а вследствие воздействия провоспалительного микроокружения: (активированных лимфоцитов) и провоспалительных цитокинов (IL-1, TNF-alpha, IFN-gamma) [Rubtsov YP, Suzdaltseva YG, Goryunov KV, Kalinina N1, Sysoeva VY, Tkachuk VA. Acta Naturae. 2012 Jan; 4(1):23-31. Regulation of Immunity via Multipotent Mesenchymal Stromal Cells].
Под действием этих факторов МСК изменяют свой фенотип. На поверхности мембраны клеток в этом случае появляются молекулы HLA-DR (HLA II класса, МНС II класса - главный комплекс гистосовместимости 2 класса), не свойственные им в нормальном микроокружении [Devine S.M., Cobbs С, Jennings М., Bartholomew А., Hoffman R. // Blood. 2003. V.101, P.2999-3001; Krampera M., Glennie S., Dyson J., et al // Blood. 2003. V.101, P.3722-3729; Liu H., Kemeny D.M., Heng B.C., et al // J Immunol. 2006. V.176, P.2864-2871; Romieu-Mourez R., Francois M., Boivin M.N., Stagg J., Galipeau J. // J Immunol. 2007. V.179, Р1549-1558].
Под действием провоспалительных цитокинов МСК секретируют молекулы, также не свойственные им в обычном/нормальном состоянии. Секретируемые МСК молекулы, в свою очередь, оказывают выраженный иммуносупрессивный эффект на активированные лимфоциты. Предполагаемые молекулы, участвующие в процессах иммуносупрессии и являющиеся маркерами этого явления - IDO (индоламин-2,3-диоксигеназа, indoleamine-2,3- deoxygenase), iNOS (индуцируемая NO-синтаза, inducible nitric oxide synthase).
Существующие методы оценки иммуносупрессивных свойств МСК основаны на следующем принципе - контрольные МСК, а также МСК, подверженные воздействию тех или иных факторов, помещают в культуру с активированными Т-клетками или другими видами иммунных клеток (В-клетки, макрофаги, дендритные клетки). После совместной инкубации иммуносупрессивные свойства МСК характеризует их способность подавлять (угнетать) функции иммунных клеток, в частности, секретировать факторы воспаления (например, цитокины), экспонировать на поверхности характеристические молекулы (т.н. маркеры активации), замедлять деление активированных клеток. То есть, способность МСК к иммуносупрессии определяют опосредованно, путем измерения характеристик, присущих иммунным клеткам. К недостаткам данного метода можно отнести сложность измерения, поскольку для сокультивирования МСК и активированных иммунных клеток требуется источник этих клеток, надежный способ их активации, способ измерения одного или более параметров (скорость деления, уровень продукции провоспалительных молекул и т.п.). Дополнительную проблему создает то, что о свойствах МСК судят по свойствам других клеток, что может приводить к дополнительным неточностям и необходимости стандартизации, поскольку в сложной системе невозможно исключить взаимное воздействие одних компонентов на другие.
Наиболее близким аналогом заявляемого изобретения является способ определения фенотипа мезенхимальных стволовых клеток, включающий контактирование мезенхимальных стволовых клеток с антиген-специфическими активированными иммунными клетками, и измерения антиген-специфической активности антиген-специфических иммунных клеток, активированных до и после контакта с мезенхимальными стволовыми клетками, в которых сокращение антиген-специфической активности в результате контакта с мезенхимальными стволовыми клетками определяет иммуносупрессорный потенциал мезенхимальных стволовых клеток (WO 2009134429). Однако, существенным недостатком данного способа является его низкая прогностическая ценность, что приводит к его низкой клинической ценности.
Настоящее изобретение предлагает способ оценки иммуносупрессивных свойств мезенхимальных стромальных клеток жировой ткани, включающий измерение уровня экспрессии HLA-DR на поверхности МСК, и измерение уровня экспрессии молекул IDO и iNOS и COX-2 внутри клеток. Наличие супрессивных свойств, таким образом, оценивают, в частности, путем сравнения с уровнями экспрессии вышеуказанных молекул у активированных провоспалительными факторами МСК и МСК, которые культивировали в нормальных условиях.
Основное преимущество предлагаемого способа заключается в том, что установление корреляции между уровнем отдельных молекул, характерных для МСК в иммуносупрессорном состоянии, позволяет в дальнейшем судить о свойствах МСК, сравнивая эти уровни у контрольных МСК и МСК, предварительно инкубированных с теми или иными факторами или клетками. Таким образом, предложенный способ позволяет напрямую определять параметр, который присущ самим МСК, но не клеткам, вместе с которыми их инкубируют. Предложенный способ является прямым, не требует дополнительных усилий по предварительной активации иммунных клеток, прост с экпериментальной точки зрения и более быстр и надежен по сравнению с аналогами.
Раскрытие изобретения
Задачей настоящего изобретения является разработка прямого способа определения иммуносупрессорных свойств МСК, позволяющего быстро и достоверно определить наличие иммуносупрессорных свойств МСК, в частности у МСК, которые были подвержены различным типам стимуляции (например, со-культивированием в присутствие антиген-активированных лимфоцитов или инкубацией в среде, содержащей провоспалительные белковые факторы-цитокины).
Авторами настоящего изобретения было обнаружено, что иммуносупрессорный потенциал МСК коррелирует с уровнем экспрессии характеристических маркерных молекул, таких как IDO, iNOS, СОХ-2 внутри клеток, а также HLA-DR на поверхности. Необходимость измерения уровня различных маркеров связана с тем, что в различных условиях при появлении у МСК иммуносупрессорного фенотипа изменяется уровень одного или двух маркеров. В то же время уровень остальных может не изменяться. Поэтому, для того чтобы данный способ был более универсальным, предлагается использовать более широкий набор маркеров (сразу четыре), что позволяет оценивать иммуносупрессорные свойства в самых разных условиях.
Техническим результатом настоящего изобретения является разработка способа, с помощью которого можно быстро и точно определить иммуносупрессорный потенциал МСК. Предложенный способ определения иммуносупрессорных свойств имеет существенные преимущества по сравнению с известными методами. В частности, измерению подлежит уровень молекул самих МСК, который прямо коррелирует с их иммуносупрессорной активностью. Уровень этих молекул определяет способность МСК подавлять функции иммунных клеток, например, их деление при активации. Заявленный способ является прямым и более быстрым по сравнению с существующими, так как не требует наличия в культуре предварительно активированных иммунных клеток. Предложенный способ основан на простых экспериментальных подходах, которые доступны в любой современной лаборатории. Кроме того, заявленный способ достаточно легко поддается количественной оценке и нормализации по отношению к контрольному образцу клеток, что позволяет проводить рутинные измерения.
Поставленная техническая задача решается тем, что способ определения иммуносупрессивных свойств мезенхимальных стромальных клеток человека, включает измерение уровня экспрессии молекулы HLA-DR на поверхности мембран клеток методом иммунофлуоресцентного окрашивания, с последующим измерением в клетках уровня экспрессии молекул IDO, iNOS и СОХ-2, при этом вывод о наличии иммуносупрессивных свойств делают, если уровень экспрессии хотя бы одной из вышеуказанных молекул (IDO, iNOS, СОХ-2) или уровень HLA-DR в исследуемых МСК, по крайней мере, вдвое выше по сравнению с контрольным образцом мезенхимальных стромальных клеток.
Частным вариантом настоящего изобретения является упомянутый выше способ, характеризующийся тем, что измерение уровня экспрессии в клетках осуществляют методом полуколичественной ОТ-ПЦР или ОТ-ПЦР в реальном времени.
Краткое описание Фигур
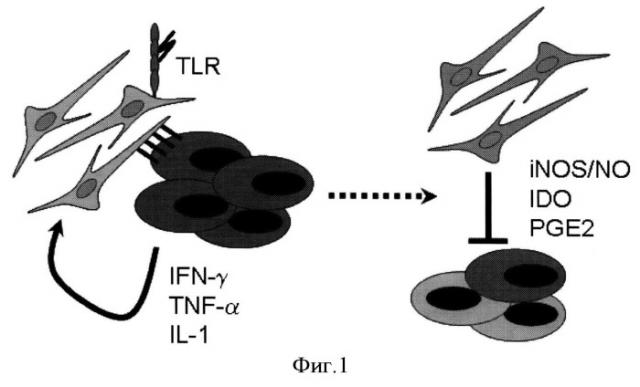
На Фигуре 1 показано схематическое изображение влияния провоспалительных факторов, секретируемых активированными Т-клетками на мезенхимальные стромальные клетки (МСК). Факторы, выделяемые в культуральную среду активированными Т-клетками (IFN, TNF, IL-1)? влияют на МСК таким образом, что МСК приобретают способность угнетать активацию Т-клеток (проявляют иммуносупрессорные свойства) за счет синтеза антивоспалительных молекул, таких как iNOS, IDO, СОХ-2.
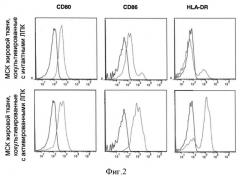
На Фигуре 2 показано изменение уровня поверхностных молекул, участвующих в презентации антигена МСК на поверхности МСК после инкубации с активированными лейкоцитами периферической крови человека (ЛПК). На рисунке приведены гистограммы, показывающие уровень факторов CD80, CD86 и HLA-DR на поверхности МСК после вышеописанной инкубации. Окрашивание соответствующих белков проводили с помощью антител, конъюгированных с флуорофорами, после чего смесь клеток анализировали методом проточной цитометрии, данные анализировали с помощью программного пакета FlowJo. Показано окрашивание контрольными изотипическими антителами и специфическими антителами. В верхнем ряду представлены результаты анализа культур наивных лейкоцитов с МСК, а в нижнем - активированных.
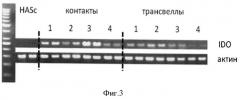
На Фигуре 3 показан пример анализа в агарозном геле, окрашенном бромистым этидием, продуктов амплификации кДНК IDO. кДНК IDO была получена с помощью обратной транскрипции тотальной РНК из образцов МСК, инкубированных с активированными лейкоцитами в различных пропорциях. В качестве контроля использованы образцы, полученные из МСК, которые не контактировали с лейкоцитами. Цифрами обозначены образцы, отличающиеся соотношением МСК:лейкоциты. 1 соответствует соотношению 1:100, 2 - 1:50, 3 - 1:25, а 4 - 1:12.5 соответственно. Видно изменение количества продукта амплификации кДНК в зависимости от соотношения МСК:лейкоциты, которое коррелирует с проявлением МСК иммуносупрессорных свойств, выражающимся в их способности замедлять деление лейкоцитов после активации и увеличивать уровень маркеров активации на поверхности клеток. Для нормировки на количество матрицы для амплификации проводили Полимеразную Цепную Реакцию (ПЦР) с праймерами, специфичными к кДНК актина.
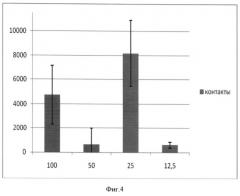
На Фигуре 4 показаны результаты эксперимента, представленного на рис.2, представленные в виде гистограмм. Внизу показаны соотношения МСК:лейкоциты. По оси ординат показаны относительные единицы, отражающие количество продукта амплификации.
На Фигуре 5 показан пример анализа в агарозном геле, окрашенном бромистым этидием, продуктов амплификации кДНК iNOS. кДНК iNOS была получена с помощью обратной транскрипции тотальной РНК из образцов МСК, инкубированных с активированными лейкоцитами в различных пропорциях. В качестве контроля использованы образцы, полученные из МСК, которые не контактировали с лейкоцитами. Цифрами обозначены образцы, отличающиеся соотношением МСК: лейкоциты. 1 соответствует соотношению 1:100. 2 - 1:50, 3 - 1:25, а 4 - 1:12.5 соответственно. Видно изменение количества продукта амплификации кДНК в зависимости от соотношения МСК:лейкоциты, которое коррелирует с проявлением МСК иммуносупрессорных свойств, которое выражается в их способности замедлять деление лейкоцитов после активации и увеличивать уровень маркеров активации на поверхности клеток. Для нормировки на количество матрицы для амплификации проводили Полимеразную Цепную Реакцию (ПЦР) с праймерами, специфичными к кДНК актина.
На Фигуре 6 показан пример анализа в агарозном геле, окрашенном бромистым этидием, продуктов амплификации кДНК СОХ-2. кДНК СОХ-2 была получена с помощью обратной транскрипции тотальной РНК из образцов МСК, инкубированных с активированными лейкоцитами в различных пропорциях. В качестве контроля использованы образцы, полученные из МСК, которые не контактировали с лейкоцитами. Цифрами обозначены образцы, отличающиеся соотношением МСК:лейкоциты. 1 соответствует соотношению 1:100, 2 - 1:50, 3 - 1:25, а 4 - 1:12.5 соответственно. Видно изменение количества продукта амплификации кДНК в зависимости от соотношения МСК:лейкоциты, которое коррелирует с проявлением МСК иммуносупрессорных свойств, которое выражается в их способности замедлять деление лейкоцитов после активации и увеличивать уровень маркеров активации на поверхности клеток. Для нормировки на количество матрицы для амплификации проводили Полимеразную Цепную Реакцию (ПЦР) с праймерами, специфичными к кДНК актина.
Осуществление изобретения
В общем виде предложенное изобретение может быть реализовано следующим образом.
Настоящее изобретение может быть использовано для определения иммуносупрессивных свойств любых культур мезенхимальных стромальных клеток человека. Получение или выделение мезенхимальных стромальных клеток может быть осуществлено стандартными способами [например, как описано Luria Е.А., Panasyuk A.F., Friedenstein A.Y. // Transfusion. 1971. V.11, P.345-349], хорошо известными специалисту в области техники, к которой относится настоящее изобретение, и не ограничивается приведенными примерами. В частности, для исследования могут быть использованы МСК костного мозга или жировой ткани.
Для культивирования МСК человека in vitro может быть использована любая среда, содержащая компоненты, необходимые для роста мезенхимальных стромальных клеток жировой ткани, например, коммерчески доступная среда DMEM/F12 [Resources/media_formulation.55.html].
Для специалиста очевидно, что предлагаемый способ может быть использован для оценки иммуносупрессивных свойств подвергнутых различным типам воздействия. Согласно настоящему изобретению в качестве исследуемых клеток могут быть использованы МСК, предварительно культивированные в присутствии про-воспалительных белковых факторов и цитокинов. При этом в качестве контрольных клеток могут быть использованы интактные клетки МСК, которые культивировались в старндартной среде без добавления соответствующих провоспалительных белковых факторов и цитокинов. Кроме того, в качестве исследуемых могу быть использованы генетически модифицированные с целью повышения иммуносупрессивных свойств МСК, а в качестве контрольных - родительские клетки, не содержащие генетических модификаций.
Согласно настоящему изобретению способ определения иммуносупрессорных свойств МСК включает окрашивание поверхности МСК антителами, специфичными к молекулам HLA-DR, и анализ пропорции и яркости окрашенных клеток методом проточной цитофлюориметрии, а также выделение из МСК смеси тотальной РНК и определение уровня мРНК генов, кодирующих белки IDO, iNOS и СОХ-2.
Согласно настоящему изобретению, для иммунофлуоресцентного окрашивания молекул HLA-DR на поверхности МСК могут быть использованы любые коммерчески доступные антитела, узнающие HLA-DR, напрямую конъюгированные с флуорофорами, либо неконъюгированные первичные антитела, которые узнаются конъюгированными с флуорофором вторичными антителами. Иммунофлуоресцентное окрашивание (в случае напрямую конъюгированных с флуорофором антител) заключается в непродолжительной инкубации клеток с раствором необходимых антител в фосфатном буфере, содержащем 0.1% бычьего сывороточного альбумина (БСА). Содержание антител 0.5-1 мкг на 100 мкл образца. После 30-минутной инкубации клетки осаждают центрифугированием и промывают раствором БСА в фосфатном буфере, после чего клетки повторно осаждают, ресуспендируют в вышеупомянутом растворе и анализируют с помощь проточного цитометра.
Для выделения тотальной РНК из МСК могут быть использованы любые методы, приемлемые для выделения недеградированной тотальной РНК из клеток человека. Уровень мРНК анализируемых генов (уровень экспрессии) может быть определен любым хорошо известным специалисту в данной области техники методом. Частными примерами, не ограничивающими настоящее изобретение, являются методы полуколичественной Обратной Транскрипции - Полимеразной Цепной Реакции (полуколичественная ОТ-ПЦР) и Обратной Транскрипции - Полимеразной Цепной Реакции в режиме реального времени (т.н. Real-time PCR (ОТ-ПЦР в режиме реального времени)). В основе этих методов лежит синтез на матрице тотальной мРНК изучаемых клеток ДНК-копии (кДНК). Полученную кДНК используют в качестве матрицы для амплификации специфического короткого фрагмента ДНК с помощью пары специфических праймеров. Относительное количество изучаемой мРНК определяют путем измерения количества продукта полимеразной цепной реакции либо после проведения реакции (полуколичественная ОТ-ПЦР), либо непосредственно в ходе реакции амплификации (ОТ-ПЦР режиме реального времени). Кинетика накопления продукта зависит от исходного количества копий мРНК в препарате. Для определения относительного изменения уровня конкретной мРНК проводят нормализацию значений, полученных в экспериментальных образцах, на значение, полученное в контрольном образце. Таким образом, удается определить относительное изменение уровня исследуемой мРНК в данном образце клеток.
Согласно настоящему изобретению вывод о наличии иммуносупрессивных свойств у исследуемых МСК может быть сделан, если уровень экспрессии хотя бы одной из анализируемых молекул в исследуемых мезенхимальных стромальных клетках, по крайней мере, вдвое выше по сравнению с контрольными клетками.
Состав реакционной смеси, а также перечень праймеров и зондов, которые могут использоваться для анализа уровня экспрессии генов, кодирующих белки IDO, iNOS, СОХ-2 описанными выше методами ОТ-ПЦР, не ограничены каким-либо специальным образом. Соответствующие нуклеотидные последовательности могут быть подобраны с использованием стандартных программ, хорошо известных специалисту, например, с использованием пакета Primer 3.
Рассматриваемые авторами настоящего изобретения молекулы можно условно разделить на две группы: поверхностные и внутриклеточные. К поверхностным относится молекула HLA-DR, которая представляет собой молекулу главного комплекса гистосовместимости второго класса. Клетки используют эти молекулы для презентации на своей поверхности коротких пептидов-антигенов. Такая молекула со связавшимся пептидом участвует во взаимодействии с Т-клеточным рецептором на поверхности CD4 Т-клеток-хелперов. Это взаимодействие необходимо для эффективной активации иммунного ответа против бактерий и других патогенов. Молекулы HLA-DR на поверхности клеток, таким образом, характеризуют способность клеток презентировать антиген и инициировать иммунный ответ. Известно, что появление HLA-DR на поверхности МСК свидетельствует об их способности активировать Т-клетки.
Среди внутриклеточных молекул, в первую очередь, следует выделить IDO. Этот фермент, индолил-2,3-дезоксигеназа, который катализирует разложение незаменимой аминокислоты триптофана до кинуренина. Известно, что триптофан в больших количествах поглощается активированными Т-клетками, которые в ответ на стимуляцию претерпевают массивные изменения и многократно увеличивают синтез белка. С одной стороны, истощение пула свободного триптофана замедляет деление Т-клеток, а с другой стороны, продукт расщепления триптофана - кинуренин является токсичной молекулой для Т-клеток и согласно литературным данным может вызывать у них апоптоз. Таким образом, IDO является фактором, который негативно влияет на функцию Т-клеток.
iNOS (индуцируемая NO-синтаза) представляет собой фермент, количество которого в клетках сильно возрастает в ответ на присутствие провоспалительных цитокинов. В соответствии с названием, этот белок синтезирует выбрасываемый из клеток NO, который является важным фактором на ранних стадиях иммунного ответа, напрямую участвуя в уничтожении патогенов. Кроме того, установлено, что NO является индуктором митохондриального апоптоза, который зависит от активации каспазы-9 и каспазы-3.
СОХ-2 (циклооксигеназа-2) представляет собой фермент, который участвует в синтезе простогландина Е2 (PGE2), - важной малой молекулы, подавляющей функцию иммунных клеток путем связывания со специфическим рецептором на поверхности иммунных клеток.
Изобретение реализуется в частном случае следующим образом.
Примеры
1. Выделение и культивирование мезенхимальных стромальных клеток жировой ткани in vitro
Подкожный жир человека (от 0,5 до 10 мл) собран в ходе хирургической операции в операционных помещениях с соблюдением правил асептики и антисептики. Выделение клеток из полученного в результате операции материала проведено в стерильных условиях ламинарного бокса.
Основные этапы включают:
Измельчение ткани в тканевом дисинтеграторе gentleMACSdissiciator (Myltenyi Biotec) до консистенции суспензии мелких (размером не более 2 кубических миллиметров) кусочков.
Смешивание измельченной жировой ткани с растворами ферментов коллагеназы I типа (200 ед/мл, Worthington Biochemical, США) и диспазы (40 ед/мл, Sigma, Германия) при соотношении объема ткани (в мл) к объему ферментативного раствора (в мл) 1:2.
Инкубирование образца в CO2-инкубаторе (5% СO2; 95% воздуха) при 37°C в течение 30-45 мин при постоянном встряхивании.
Добавление по окончании инкубации равного объема среды DMEM/F12, содержащей 100 ед./мл пенициллина, 100 ед/мл стрептомицина, 2 мМ глютамина, 1 мМ пирувата натрия (HyClone), 10% фетальной бычьей сыворотки (HyClone).
Центрифугирование полученного образца при 200g в течение 5 мин.
Удаление с помощью вакуумного насоса белесого поверхностного слоя, состоящего из зрелых адипоцитов и кусочков ферментативно необработанной ткани.
Суспендирование осадка, состоящего из клеток стромы жировой ткани и клеток сосудистой стенки и крови, в стерильной деионизованной воде для лизирования эритроцитов.
Добавление для восстановления осмотического давления в образце 10-кратного объема среды DMEM/F12.
Фильтрование полученной суспензии клеток через нейлоновые фильтры с размером пор 100 мкм (BD Falcon Cell Strainer, США).
Центрифугирование фильтрата при 200 g 5 мин.
Удаление супернатанта.
Определение концентрации выделенных из подкожной жировой ткани первичных клеток с помощью камеры Гаряева под микроскопом или с помощью автоматического счетчика клеток (Countess, Invitrogen) при температуре воздуха +20-+25°C и относительной влажности 40-70%.
Ресуспендирование осадка в среде роста DMEM/F12, содержащей 100 ед/мл пенициллина, 100 ед/мл стрептомицина, 2 мМ глютамина, 1 мМ пирувата натрия (HyClone), 10% фетальной бычьей сыворотки (HyClone) до концентрации 5×104 фрагментов/см3.
Высаживание полученной суспензии на чашки Петри (Corning Costar) и инкубирование при 37°C, 5% CO2 в CO2-инкубаторе в течение 2 суток.
Смена среды в чашках Петри для удаления не прикрепившихся клеток. Выход клеток должен составлять 4-7x104 прикрепившихся клеток на 1 мл ткани. Смена ростовой среды проводится каждые 2-3 дня до достижения 70-80% плотности монослоя.
Удаление ростовой среды из чашек Петри.
Двукратная промывка монослоя раствором DPBS (HyClone).
Обработка монослоя смесью 0,25% раствора трипсина и 0,02% ЭДТА (1:1) (HyClone).
Инкубирование в течение 15 мин при 37°C, 5% СО2 в СО2-инкубаторе.
Суспендирование прикрепившихся клеток с помощью пипетирования.
Определение концентрации суспензии культивируемых мезенхимальных стромальных клеток жировой ткани человека с помощью камеры Гаряева под микроскопом или с помощью автоматического счетчика клеток (Countess, Invitrogen) при температуре воздуха +20-+25°C и относительной влажности 40-70%.
Добавление в полученную суспензию клеток 3-кратного от первоначального объема ростовой среды.
Высаживание суспензии на чашки Петри в соотношении 1:3.
2. Выделение, культивирование и активация иммунных клеток in vitro
С согласия здоровых доноров в стерильные флаконы (Corning Costar), содержащие стерильный раствор ЭДТА в количестве 1,2-2 мг/мл крови, pH 7,2 забирали 10-25 мл периферической крови из локтевой вены.
Основные этапы:
Разведение нативной венозной крови 0,01 М стерильным раствором PBS (pH 7,2) в соотношении 1:1.
Внесение в 50-мл конические пробирки (Corning Costar) 20 мл Ficoll Paque® (Pharmacia Biotech) плотностью 1,077.
Наслоение разведенной суспензии клеток крови на Ficoll Paque® в соотношении 1,5:1.
Центрифугирование суспензии клеток крови в градиенте плотности Ficoll Paque® при 400 g 30 мин.
Перенесение клеток, располагающихся в интерфазе, в новую 50-мл пробирку, добавление 50 мл раствора HBSS (HyClone).
Осаждение клеток центрифугированием при 200 g в течение 5 мин.
Удаление супернатанта.
Ресуспендирование осадка в 50 мл раствора HBSS и центрифугирование при 200g в течение 5 мин.
Ресуспендирование осадка в DPBS (HyClone).
Определение концентрации суспензии культивируемых мезенхимальных стромальных клеток жировой ткани человека с помощью камеры Гаряева под микроскопом или с помощью автоматического счетчика клеток (Countess, Invitrogen) при температуре воздуха +20-+25°C и относительной влажности 40-70%.
Разведение суспензии клеток крови до концентрации 1×107 клеток средой DMEM/F12, содержащей 100 ед/мл пенициллина, 100 ед/мл стрептомицина, 2 мМ глютамина, 1 мМ пирувата натрия (HyClone), 10% фетальной бычьей сыворотки (HyClone).
Добавление для активации полученной суспензии клеток фитогемагглютинина (PHA, Sigma) до конечной концентрации 10 мкг/мл.
Инкубирование образца в СО2-инкубаторе (5% СО2; 95% воздуха) при 37°C в течение 2 ч.
Осаждение суспензии активированных клеток крови центрифугированием при 200 g в течение 5 мин.
Ресуспендирование осадка в 50 мл раствора HBSS, центрифугирование при 200g в течение 5 мин.
Ресуспендирование осадка в ростовой среде DMEM/F12, содержащей 100 ед./мл пенициллина, 100 ед./мл стрептомицина, 2 мМ глютамина, 1 мМ пирувата натрия (HyClone), 10% фетальной бычьей сыворотки (HyClone) до концентрации 1×107 клеток и высаживание на чашки Петри с прекокультивированными МСК.
Инкубирование в CO2-инкубаторе (5% CO2; 95% воздуха) при 37°C в течение 48 часов
3. Активация МСК in vitro с помощью провоспалительных цитокинов TNF-alpha, IFN-gamma
Добавление к монослою выделенных и кокультивированных МСК (методика 1) TNF-alpha в концентрации 20 нг/мл и IFN-gamma в концентрации 30 нг/мл.
Инкубирование в СO2-инкубаторе (5% СO2; 95% воздуха) при 37°C в течение 48 часов
4. Оценка уровня экспрессии HLA-DR на поверхности мембран МСК при кокультивировании с активированными лимфоцитами
Основные этапы:
Кокультивирование мезенхимальных стромальных клеток жировой ткани с активированными лимфоцитами периферической крови или провоспалительными цитокинами TNF-alpha, IFN-gamma в CO2-инкубаторе (5% СO2; 95% воздуха) при 37°C, влажности воздуха 95% в течение 48 часов.
Удаление супернатанта.
Двукратная промывка монослоя раствором DPBS (HyClone).
Обработка монослоя смесью 0,25% раствора трипсина и 0,02% ЭДТА (1:1) (HyClone), инкубирование в течение 15 мин при 37°C, 5% СO2 в СO2-инкубаторе.
Суспендирование прикрепившихся клеток с помощью пипетирования.
Центрифугирование полученной суспензии при 200 g 4°C в течение 5 мин.
Ресуспендирование осадка в 100 мкл фосфатно-солевого раствора, содержащего 1% фетальной сыворотки телят.
Подготовка рабочего раствора антител к HLA-DR из расчета 100 мкл на пробу.
Добавление рабочего раствора антител к пробам, инкубирование 20 мин в темноте при +4°C.
Осаждение клеток центрифугированием 200 g 4°C 5 мин.
Двукратная промывка клеток фосфатно-солевым раствором, содержащим 1% фетальной сыворотки телят.
Осаждение центрифугированием 200 g 4°C 5 мин
Ресуспендирование клеток в 500 мкл фосфатно-солевого раствора, содержащего 1% фетальной сыворотки телят, перенесение в FACS-пробирки.
Проведение измерений на приборе FACS CANTO II (BD biosciences).
После проведения цитометрических измерений необходимо провести анализ уровня молекулы HLA-DR на поверхности нормальных МСК и МСК, активированных провоспалительными цитокинами. Для этого могут быть построены соответствующие гистограммы с использованием пакета программ FlowJo. Увеличение пропорции клеток, несущих на поверхности повышенный уровень HLA-DR свидетельствует о приобретении клетками иммуносупрессорного фенотипа. В качестве образца для сравнения каждый раз необходимо использовать интактные МСК.
5. Измерение уровня экспрессии IDO или iNOS в МСК, некультивированных с активированными лимфоцитами или провоспалительными цитокинами.
Проведение кокультивирования мезенхимальных стромальных клеток жировой ткани с провоспалительными цитокинами TNF-alpha, IFN-gamma или с активированными лимфоцитами периферической крови в присутствии межклеточных контактов для определения IDO или в бесктонтактной системе с использованием полупроницаемых мембран (transwell) для определения iNOS.
Удаление супернатанта
Двукратная промывка клеток раствором DPBS (HyClone). Выделение из образцов РНК:
a. К монослою клеток добавляли Trisol (Invitrogen) в расчете 750 мкл на 100 тыс. МСК;
b. Полученный лизат переносили в 1,5-мл пробирки типа «эппендорф», добавляли 0,2 мл Хлороформа (Химмед), перемешивали на вортексе 15 с;
c. Фазы разделяли центрифугированием на микроцентрифуге при 13000 об/мин, Т 20°C;
d. Водную фазу отбирали в новые 1,5-мл пробирки, добавить 0,5 мл изопропанола (Химмед), перемешивали на вортексе 15 с, инкубировали 10 мин, Т 20°С;
e. Центрифугировали на микроцентрифуге 10 мин 13000 об/мин, Т 20°C;
f. Осадки промывали 500 мкл 70% раствором этанола, перемешать на вортексе 15 с, центрифугировать на микроцентрифуге 5 мин 13000 об/мин, Т 10°C;
g. Супернатант удаляли, высушивали промытые осадки на столе при комнатной температуре, но не до полного высыхания;
h. Растворяли осадки очищенной от РНКаз водой (Invitrogen);
i. Концентрацию измеряли на спектрофотометре Nanodrop, чистоту полученной тотальной РНК определяли по соотношению пиков 260/280. Соотношение должно быть больше 1,5, оптимальное значение 1,8-1,9;
Осуществление обратной транскрипции выделенной РНК
a. Приготовляли смесь компонентов: 1 мкл неспецифические праймеры Oligo(dT)20 (Invitrogen) в качестве, 25 мМ смесь динуклеотидтрифосфатов dNTP (Fermentas), 7 мкл воды RNAfree (Invitrogen), 500 нг выделенной тотальной РНК концентрацией 100 нг/мкл;
b. Помещали в термостат, инкубировали 5 мин при 65°C, затем охлаждали на льду при 4°C;
c. Приготовляли смесь компонентов: 4 мкл 5-кратного буфера FSbuffer (Invitrogen), 1 мкл 0,1 М дитиотриэтола (DTT, Invitrogen), 1 мкл ингибитора рибонуклеаз RNAse out (Invitrogen), 1 мкл обратной транскриптазы superscript III (Invitrogen);
d. Добавляли к пробам, перемешивали, инкубировали при 50°C 50 мин, затем инактивировали 15 мин при 70°C. Распределяли на аликвоты;
e. Проводили полимеразную цепную реакцию (ПЦР);
f. B пробирках для ПЦР объемом 0,2 мл с плоской крышкой приготовляли смесь, содержащую 5 мкл ПЦР-буфера фирмы «Fermentas», 5 мкл 25 мМ раствора MgCb, 0,5 мкл 25 мМ раствора смеси динуклеотидтрифосфатов dNTP (Fermentas), 39 мкл воды RNAse free (Invitrogen), 0,25 мкл 100 мкМ раствора праймеров для IDO:
IDOp2 Forward 5-AGCCCCTGACTTATGAGAACATGGA-3
IDOp2 Reverse 5-CCAGCCAGACAAATATATGCGAAGAA-3,
или 0,25 мкл 100 мкМ раствора праймеров для iNOS:
iNOS IDOp1 Forward 5-ATGGCACACGCTATGGAAAACTC-3
iNOS IDOp1 Reverse 5-CTAGACGTGCAAGGCGCTGTGACT-3
или 0,25 мкл 100 мкМ раствора праймеров к гену СОХ-2
COX2p1 Forward 5-TCACGCATCAGTTTTTCAAGACAGAT-3
COX2pl Reverse 5-TACATCATCAGACCAGGCACCAGA-3
100 нг полученной кДНК из расчета на 100 нг исходной тотальной РНК. 1 мкл Taq полимеразы (ДНК технология).
g. Помещали пробирки в амплификатор;
h. Осуществляли амплификацию со следующими параметрами:
i. 1 цикл - начальная денатурация (95°C, 5 мин);
ii. 35 циклов, включающие: денатурация (95°C, 30 сек), отжиг 54°C 30 сек, элонгация 72°C 1 мин;
iii. 1 цикл - заключительная элонгация (72°C, 5 мин);
i. Приготовляли 2% агарозный гель, приготовленный на буфере ТВЕ с бромистым этидием;
k. Вносили в одну из лунок геля стандарт массы ДНК GeneRuler™ 50 bp DNA Ladder, 50-1000 bp (Fermentas), в другие лунки 20 мкл ПЦР-продукта;
l. Во все лунки добавляли 4 мкл 6-кратного красителя loading dye buffer (Fermentas);
m. Проводили электрофорез при напряжении 150 В в течение 40 мин;
n. Помещали гель в гель-документирующую систему Versadoc (Biorad) и фотографировали при ультрафиолетовом облучении;
о. После окончания процедуры гель-электрофореза и фотографирования геля проводили оценку длины продуктов.
Сравнение уровня экспрессии генов IDO, iNOS, СОХ-2 в интактных МСК и МСК, обработанных провоспалительными цитокинами, позволяет оценить уровень иммуносупрессорной активности, которая прямо коррелирует с уровнем синтеза данных эффекторных молекул. Согласно полученным авторами настоящего изобретения данным увеличение уровня данных молекул как минимум в два раза свидетельствует о проявлении клетками иммуносупрессорного фенотипа.
1. Способ определения иммуносупрессивных свойств мезенхимальных стромальных клеток человека, включающий измерение уровня экспрессии молекулы HLA-DR на поверхности мембран клеток методом иммунофлуоресцентного окрашивания и измерение в клетках уровня экспрессии молекул IDO, iNOS и СОХ-2, при этом вывод о наличии иммуносупрессивных свойств делают, если уровень экспрессии по крайней мере одной из вышеуказанных молекул в два раза выше по сравнению с контрольным образцом мезенхимальных стромальных клеток.
2. Способ по п.1, характеризующийся тем, что измерение уровня экспрессии в клетках осуществляют методом полуколичественной ОТ-ПЦР или ОТ-ПЦР в режиме реального времени.