Универсальные раковоспецифичные промоторы и их использование в противоопухолевой терапии
Иллюстрации
Показать всеИзобретение относится к биотехнологии, в частности к опухолеспецифичным промоторам, и может быть использовано в противоопухолевой терапии. Сконструированы опухолеспецифичные промоторы широкого спектра действия, обеспечивающие экспрессию терапевтического гена внутри раковой клетки. Изобретение включает также экспрессионные кассеты, экспрессионные векторы, фармацевтические композиции, способы лечения раковых заболеваний и применения экспрессионных кассет и векторов. Промоторы настоящего изобретения обеспечивают высокий уровень экспрессии функционально связанного с ними терапевтического гена в раковых клетках различного генеза, при этом экспрессия в нормальных клетках отсутствует или находится на низком уровне. 5 н. и 24 з.п.ф-лы, 19 ил., 4 табл., 20 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к биотехнологии, в частности генной инженерии, к искусственным ДНК-конструкциям, демонстрирующим высокую активность транскрипционного промотора, с которого осуществляется экспрессия расположенной ниже произвольной нуклеотидной последовательности, транскрибируемой РНК-полимеразой II. Активность промоторов ограничена только раковыми клетками.
Промоторы могут быть использованы для генной терапии новообразований различной природы.
Уровень техники
Рак представляет собой в настоящее время наиболее серьезную проблему медицины. Становится все более очевидным, что господствовавшая до последнего времени концепция молекулярного нацеливания (таргетинга) противораковых препаратов на предположительные ключевые молекулы раковой клетки, которые вовлечены в развитие опухоли, находится в кризисном состоянии (Salk JJ and Fox EJ et al. (2010) Annu Rev Pathol Mech Dis 5:51-75). Подавляющее большинство агентов этой категории, которые проходили доклинические и клинические испытания, оказались малоэффективными (Hambley TW and Hait WN (2009) Cancer Res 69:1259-62). Это вполне ожидаемый кризис: рак как заболевание сочетает в себе сложность клеточной организации, присущую и другим болезням, со сложностью растущей системы, способной адаптироваться к воздействиям лекарствами путем существования микрогетерогенности внутри опухоли (Merlo LM and Pepper JW et al. (2006) Nat Rev Cancer 6:924-35). Это приводит к тому, что большинство раковых генов принимают только незначительное участие в развитии рака. Вследствие этого их трудно идентифицировать для использования в качестве мишеней действия противораковых агентов (Salk JJ and Fox EJ et al. (2010) Annu Rev Pathol Mech Dis 5:51-75). В результате в терапии рака сложилась критическая ситуация: с одной стороны, медицина располагает достаточно эффективными, но высокотоксичными средствами химиотерапии, с другой - малотоксичными, но малоэффективными средствами молекулярной таргетной терапии (МТТ).
В последнее десятилетие активно начала развиваться генная терапия рака (ГТ). Общий принцип ГТ заключается в доставке регулируемого генетического материала в раковые клетки, где в результате продуцируются продукты, способные к уничтожению раковых клеток. Подходы ГТ могут быть разделены на две широкие категории (Sverdlov ED (2009) Mol Gen Mikrobiol Virusol 24:93-113) / (http://link.springer.com/article/10.3103%2FS089141680903001X). В первой используют стратегию таргетной терапии. При этом в роли таргетного агента выступает продукт гена, вводимого каким-либо способом в клетку опухоли, который является ингибитором того или иного продукта, концентрация которого в раковой клетке повышена, и это является одной из причин ракового процесса. К этой же категории можно отнести обратную технологию -доставка в опухоль гена, продукт которого компенсирует недостаток определенного белка в раковых клетках. В обоих вариантах мишенью воздействия является определенное звено в сигнальных системах клетки, которое меняется при раковом перерождении и способствует ему. Варианты ГТ, основанные на таргетном принципе, страдают от тех же недостатков, что иМТТ.
Первый генно-терапевтический вирус для терапии рака головы и шеи был одобрен для клинического применения в Китае в 2003 г. под названием Гендицин (Gendicine). Вирус содержит в качестве терапевтического гена р53 (Peng Z (2005) Hum Gene Ther 16:1016-27, Wilson JM (2005) Hum Gene Ther 16:1014-5). В сочетании с радиотерапией Гендицин вызывал полную регрессию опухоли у 64% пациентов и частичную - у 29%, тогда как одна радиотерапия давала полную регрессию у 19% и частичную у 60%, что, по-видимому, показывает заметное улучшение результата при комбинированной терапии (Peng Z (2005) Hum Gene Ther 16:1016-27). Но эти результаты показывают также, что только 64% откликаются на обработку, и дальнейшее поведение их болезни неизвестно. Есть основания ожидать появления вторичного роста опухоли, поскольку было показано, что при введении р53 в опухоли, в которых он исходно поврежден, вызывает появление устойчивых к р53 вариантов (Martins CP and Brown-Swigart L et al. (2006) Cell 127:1323-34). Полученные данные с использованием ГТ в качестве молекулярной таргетной терапии предполагают, что также как и классическая МТТ и вследствие тех же причин, она едва ли будет высокоэффективной или универсальной.
Вторая стратегия генной терапии, направленная на уничтожение опухолевых клеток, как таковых, путем использования их свойств, которые характерны для всех раковых клеток, например, повышенная скорость митотических делений, в этом отношении подобна химиотерапии. Однако, в отличие от последней, токсин, убивающий раковые клетки путем ингибирования систем репликации, образуется внутри них, так что свойственная химиотерапии токсичность в данном случае резко снижается. Этот подход известен как ген-направленная энзиматическая пролекарственная терапия, ГНЭПТ (Gene-directed enzyme prodrug therapy, GDEPT) или генная терапия с использованием генов самоубийства опухоли (suicide gene therapy) (Altaner С (2008) Cancer Lett 270:191-201, Fillat С and Carrio M et al. (2003) Curr Gene Ther 3:13-26, Portsmouth D and Hlavaty J et al. (2007) Mol Aspects Med 28:4-41, Seth P (2005) Cancer Biol Ther 4:512-7). Подход не является молекулярно таргетированным и потому лишен всех недостатков МТТ.
Одним из важных элементов успеха генной терапии рака является адекватная система экспрессии терапевтических генов, поскольку данные гены должны работать в раковых клетках и не работать в нормальных клетках организма. В идеальном случае система контроля терапевтических генов в организме должна обеспечивать (i) строго тканеспецифическую и (ii) достаточно сильную экспрессию трансгена, чтобы с одной стороны обеспечить безопасность, а с другой - эффективность системы. Для этого при конструировании векторов используют промоторы и энхансеры, специфично работающие в опухолях данной ткани (Robson Т and Hirst DG (2003) J Biomed Biotechnol 2003:110-137, Saukkonen К and Hemminki A (2004) Expert Opin Biol Ther 4:683-96). Однако все природные опухолеспецифичные промоторы обладают двумя существенными недостатками: с одной стороны, являются слабыми, а с другой - имеют высокий уровень активности только в определенных раковых клеточных линиях, то есть не являются универсальными. Так, AFP промотор наиболее активен в клетках карциномы печени, PSA промотор - в опухолевых клетках простаты, промотор Сох-2 - в раковых клетках желудка и двенадцатиперстной кишки, МК промотор - в клетках нейробластомы (Adachi Y and Reynolds PN et al. (2001) Cancer Res 61:7882-8).
Большинство опухолеспецифичных промоторов обладает низкой активностью по сравнению с конститутивными сильными промоторами, такими как промоторы вирусов SV40 и CMV (Van Houdt WJ and Haviv YS et al. (2006) J Neurosurg 104:583-92, Lu В and Makhija SK et al. (2005) Gene Ther 12:330-8, Rein DT and Breidenbach M et al. (2004) J Gene Med 6:1281-9).
Есть и другая проблема. Даже сравнительно сильные опухолеспецифические промоторы, такие как промотор гена BIRC5 (hSurv), кодирующий ингибитор апоптоза сурвивин, и промотор гена обратной транскриптазы теломеразы человека (hTERT) с достаточно широким спектром активности, проявляют ее не во всех раковых клетках. Так, например, промотор hSurv активен в опухолях только примерно 60- 80% пациентов с немелкоклеточным раком легких (NSLC), а промотор TERT - в 60% пациентов с NSLC (Hsu СР and Miaw J et al. (2003) Eur J Surg Oncol 29:594-9). При этом наблюдается значительная вариабельность относительной активности данных промоторов в различных опухолевых клеточных линиях. Так, активность промотора сурвивина варьирует в пределах от 0,3 до 16% от активности промотора CMV (Chen JS and Liu JC et al. (2004) Cancer Gene Ther 11:740-7, Konopka К and Spain С et al. (2009) Cell Mol Biol Lett 14:70-89, Zhu ZB and Makhija SK et al. (2004) Cancer Gene Ther 11:256-62), а эффективность работы промотора hTERT может различаться до 20 раз в зависимости от раковой клеточной линии (Gu J and Fang В (2003) Cancer Biol Ther 2:S64-70).
Вариабельность природных опухолеспецифичных промоторов в разных опухолях затрудняет подбор доз пролекарства для получения терапевтического эффекта и меняет терапевтический индекс препарата от опухоли к опухоли.
Для увеличения эффективности опухолеспецифической экспрессии терапевтических генов используют комбинированные и двойные (химерные) промоторы. Химерные промоторы могут включать в себя комбинации известных промоторов друг с другом или с отдельными гетерологичными регуляторными элементами с целью увеличить силу и специфичность экспрессии в раковых клетках (Wu С and Lin J et al. (2009) Mol Ther 17:2058-66). Примером химерного промотора может служить комбинация PhTERT с минимальным промотором цитомегаловируса (PhTERT-CMV) (Davis JJ and Wang L et al. (2006) Cancer Gene Ther 13:720-3); или с ТАТА боксом, который отсутствует в нативном PhTERT. Как правило, авторы различных исследований, направленных на эффективное использование гибридных промоторов, идут по пути максимального увеличения эффективности и специфичности экспрессии в определенном виде рака. Примером такого подхода служит работа Poulsen et al. (Poulsen TT and Pedersen N et al. (2008) Cancer Gene Ther 15:563-75). В этой работе было идентифицировано два гена, высокоэкспрессируемых в мелкоклеточном раке легких (SCLC). Один из них кодирует фактор транскрипции hASH1, а другой, EZH2 относится к члену семейства Поликомб. Когда промоторы этих генов были соединены в одну конструкцию, то полученный химерный промотор был способен вызывать сильную экспрессию трансгена специфично в клетках SCLC. Такой промотор способен инициировать экспрессию генов-убийц в SCLC, но не в других видах рака.
Такая идеология максимальной специфичности активности промотора в определенном типе рака является распространенной (см., например, Farokhimanesh S and Rahbarizadeh F et al. (2010) Biotechnol Prog 26:505-11). Использование строго специфичных к данной опухоли промоторов и других регуляторных элементов имеет в качестве преимущества максимальное снижение побочных эффектов за счет снижения экспрессии трансгенов в нормальных тканях. Однако недостатком таких подходов является их неуниверсальный характер и связанное с этим неизбежное увеличение стоимости препаратов, основанных на таких промоторах. Компромиссным вариантом является использование более универсальных раковоспецифических промоторов, способных работать в широком спектре опухолей, но не в нормальных клетках. Несколько увеличивая риск поражения нормальных тканей, такой подход является более экономически оправданным: одни и те же конструкции могут использоваться в лечении широкого спектра опухолей. Существует и еще одно важное соображение в пользу использования промоторов более широкого спектра действия. Оно связано с плохо изученной специфичностью экспрессии генов в метастазах данной опухоли. Нет строгой гарантии, что узкоспецифический промотор, хорошо работающий в первичной опухоли, сохранит эту способность во всех ее метастазах. Использование универсальных промоторов снижает вероятность инактивации промотора в метастазах.
Раскрытие изобретения
Настоящее изобретение направлено на устранение недостатков, свойственных промоторам из уровня техники, строго специфичным в отношении того или иного типа рака, и на создание универсальных промоторов, обладающих широким спектром действия в отношении различных типов рака и их метастазов, и при этом все еще сохраняющих способность функционировать по существу только в опухолевых, но не в нормальных клетках.
Настоящее изобретение обеспечивает искусственные универсальные опухолеспецифичные двойные промоторы, обладающие высокой активностью в широком спектре раковых клеток вне зависимости от их типа.
Опухолеспецифичные двойные промоторы созданы на основе модифицированных промоторов генов обратной транскриптазы теломеразы человека (hTERT) и сурвивина человека и мыши (Surv). Ген сурвивина человека (BIRC5) кодирует белок сурвивин, который относится к семейству белков-ингибиторов апоптоза и является одним из ключевых участников опухолеобразования. Промотор сурвивина обладает высокой опухолеспецифичностью и активен в подавляющем большинстве (85-90%) опухолей (Takakura M and Kyo S et al. (1999) Cancer Res 59:551-7, Ambrosini G and Adida С et al. (1997) Nat Med 3:917-21, Fukuda S and Pelus M (2006) Mol Cancer Ther 5:1087-98). Ген hTERT кодирует каталитическую субъединицу теломеразы человека. Транскрипционная активность данного гена наблюдается во время эмбрионального развития и часто примерно в 85% случаев присутствует в опухолевых клетках, тогда как в подавляющем большинстве нормальных клеток организма экспрессия hTERT подавлена (Cong YS and Wright WE et al. (2002) Microbiol Mol Biol Rev 66:407-25).
Показано, что созданные промоторы по количественным и качественным критериям отличаются от составляющих их промоторов hTERT и Surv.
В экспериментах по транзиентной трансфекции раковых клеточных линий плазмидными векторами, содержащими репортерный ген люциферазы светлячка под контролем созданных промоторов, продемонстрирована высокая активность созданных промоторов, превышающая активность как сильного конститутивного промотора вируса SV40, так и одиночных промоторов генов hTERT и Surv. При этом в экспериментах с использованием нормальных клеток (фибробластов легкого) доказана опухолеспецифичность созданных двойных промоторов.
Также на основе созданных двойных промоторов получены терапевтические конструкции, содержащие ген-убийцу или ген-убийцу в сочетании с геном цитокина.
На панели раковых и нормальных клеточных линий продемонстрирован терапевтический опухолеспецифический эффект полученных конструкций.
На основе созданных двойных промоторов могут быть получены плазмидные, вирусные или иные векторные конструкции для опухолеспецифичной экспрессии любого гена или различных генов в раковых клетках. При этом размер промотора может быть увеличен, а к нуклеотидной последовательности промотора могут быть добавлены другие регуляторные и генетические элементы, обеспечивающие повышение активности промотора.
Таким образом, настоящее изобретение в своем первом аспекте относится к опухолеспецифичному промотору, состоящему из:
А) нуклеотидной последовательности SEQ ID NO:2 или ее функционального производного, и
Б) нуклеотидной последовательности, выбранной из группы, включающей:
(i) нуклеотидную последовательность SEQ ID NO:1 или ее функциональное производное;
(ii) нуклеотидную последовательность SEQ ID NO:3 или ее функциональное производное.
В промоторе настоящего изобретения последовательность SEQ ID NO:2 может быть расположена выше (в 5′-направлении) относительно последовательности SEQ ID NO:1 или SEQ ID NO:3, или последовательность SEQ ID NO:2 может быть расположена ниже (в 3′-направлении) относительно последовательности SEQ IDNO:1 или SEQ ID NO:3. Промотор настоящего изобретения может содержать другие нуклеотидные последовательности, не влияющие на его активность, например линкерную последовательность.
Наиболее предпочтительные последовательности промоторов настоящего изобретения выбраны из группы, включающей SEQ ID NO:4- 7.
В своем втором аспекте настоящее изобретение относится к экспрессионной кассете, содержащей в направлении от 5′ к 3′ промотор настоящего изобретения, кодирующую последовательность, функционально связанную с промотором, и сигнал полиаденилирования, причем экспрессия кодирующей последовательности находится под контролем указанного промотора.
В экспрессионной кассете настоящего изобретения кодирующая последовательность может кодировать различные терапевтические белки или пептиды, антигены, антисмысловую РНК или рибозимы. В частности, экспрессионная кассета может содержать кодирующую последовательность, которая включает гены терапевтического вмешательства, выбранные из группы, включающей: негативные доминантные мутанты (НДМ) генов, участвующих в онкогенезе; гены-убийцы, гены - ингибиторы ангиогенеза, гены-онкосупрессоры, гены-иммуностимуляторы, гены siRNA.
Негативные доминантные мутанты (НДМ) генов могут быть выбраны из группы, включающей НДМ гена сурвивина, НДМ гена c-Jun, НДМ онкогена RAS. Гены-убийцы могут быть выбраны из группы, включающей гены токсинов и гены ферментов, способных превращать нетоксичный агент (пролекарство) в токсин. Последние могут быть выбраны из группы, включающей ген тимидинкиназы вируса простого герпеса и ген цитозиндезаминазы дрожжей или Е. coli. Гены-ингибиторы ангиогенеза могут быть выбраны из группы, включающей гены белков ангиостатина и эндостатина. Геном-онкосупрессором может быть, например, ген белка р53. Гены-иммуностимуляторы могут быть выбраны из группы, включающей гены IL-1, IL-2, IL-4, IL-6, TNF, GM-CSF, или гамма-интерферона. Гены siRNA могут быть выбраны из группы, включающей siRNA к гену сурвивина.
В третьем аспекте настоящее изобретение относится к экспрессионному вектору, содержащему экспрессионную кассету настоящего изобретения. При этом экспрессионный вектор настоящего изобретения может быть вирусным или невирусным. В том случае, когда вектор настоящего изобретения является вирусным вектором, он может быть выбран из группы, включающей ретровирусный, аденовирусный, аденоассоциированный или герпесвирусный вектор. Невирусный вектор может быть представлен, например, плазмидой.
В четвертом аспекте настоящее изобретением относится к фармацевтической композиции, содержащей терапевтически эффективное количество экспрессионной кассеты или вектора настоящего изобретения и фармацевтически приемлемое вспомогательное вещество, которое без ограничения может быть представлено носителем, растворителем, эксципиентом, наполнителем, буферным агентом, стабилизатором, консервантом и т.д.
Фармацевтическая композиция настоящего изобретения может быть использована для лечения широкого спектра онкологических заболеваний, причем заболевание без ограничения может быть выбрано из группы, включающей рак легкого, рак поджелудочной железы, меланому, фибросаркому, саркому, рак шеи и головы.
В пятом аспекте настоящее изобретение относится к способу лечения онкологического заболевания, включающему введение пациенту фармацевтической композиции настоящего изобретения.
Способ лечения настоящего изобретения может предусматривать без ограничения внутривенное, внутриопухолевое внутримышечное, внутрибрюшинное, подкожное, пероральное введение фармацевтической композиции настоящего изобретения. Способ лечения может быть использован для лечения онкологического заболевания, без ограничения выбранного из группы, включающей рак легкого, рак поджелудочной железы, меланому, фибросаркому, саркому, рак головы и шеи.
Наконец, в шестом аспекте настоящее изобретение относится к применению экспрессионной кассеты или вектора настоящего изобретения для изготовления лекарственного средства для лечения онкологического заболевания. Онкологическое заболевание без ограничения может быть выбрано из группы, включающей рак легкого, рак поджелудочной железы, меланому, фибросаркому, саркому, рак головы и шеи.
Краткое описание чертежей
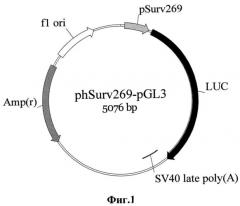
Фиг.1. Схематическое изображение экспрессионной конструкции PhSurv269-pGL3. PhSurv 269 - фрагмент промоторной области гена сурвивина человека; LUC - ген люциферазы светлячка, polyA - сайт полиаденилирования вируса SV40.
Фиг.2. Схематическое изображение экспрессионных конструкций. Слева приведено название конструкций. PhSurv269 - фрагмент промотора гена сурвивина человека; PhTERT -фрагмент промотора гена обратной транскриптазы теломеразы человека; LUC - ген люциферазы светлячка.
Фиг.3. Схематическое изображение экспрессионной конструкции PhTSurv269-HSVtk-pGL3. PhTERT - фрагмент промоторного региона гена обратной транскриптазы теломеразы человека (hTERT); PhSurv269 - фрагмент промоторного региона гена сурвивина человека; HSVtk - ген тимидинкиназы вируса простого герпеса типа 1; SV40 late poly(A) -сигнал полиаденилирования вируса SV40; Amp(r) - ген р-лактамазы.
Фиг.4. Схематическое изображение экспрессионной конструкции PhTSurv269-HSVtk-mGM-CSF-pGL3. PhTERT - фрагмент промоторного региона гена обратной транскриптазы теломеразы человека (hTERT); PhSurv269 - фрагмент промоторного региона гена сурвивина человека; HSVtk - ген тимидинкиназы вируса простого герпеса типа 1; IRES - участок посадки рибосомы вируса энцефаломиокардита человека; mGMCSF - ген гранулоцитарно-макрофагального колониестимулирующего фактора мыши; SV40 late poly(А) - сигнал полиаденилирования вируса SV40; Amp(r) - ген β-лактамазы.
Фиг.5. Схематическое изображение экспрессионной конструкции PhTSurv269-FCU1-mGM-CSF-pGL3. PhTERT - фрагмент промоторного региона гена обратной транскриптазы теломеразы человека (hTERT); PhSurv269 - фрагмент промоторного региона гена сурвивина человека; FCU1 - гибридный ген цитозиндезаминазы/урацилфосфорибозилтрансферазы; IRES - участок посадки рибосомы вируса энцефаломиокардита человека; mGMCSF - ген гранулоцитарно-макрофагального колониестимулирующего фактора мыши; SV40 late poly(А) - сигнал полиаденилирования вируса SV40; Amp(r) - ген р-лактамазы.
Фиг.6. Схема модифицированной системы PhTSurv269-Cre-LoxP//pCMV-Stop-FCU1. При одновременном попадании в опухолевую клетку киллерного и активационного векторов будет инициироваться следующий каскад событий:1) активация промотора гена PhTSurv269, которая будет приводить к экспрессии гена Cre рекомбиназы; 2) наработанная Cre рекомбиназа будет узнавать loxP-сайты в составе киллерного вектора, а затем вырезать фрагмент, фланкированный этими сайтами; 3) в результате удаления ″Stop″-сигнала, промотор CMV будет ″запускать″ наработку киллерного белка CD-UPRT (продукт экспрессии FCU1). Stop - последовательность длиной 705 п.о., состоящая из тройного повтора (235 п.о. ×3) сигнала полиаденилирования вируса SV40. NLS (Nuclear Localization Signal) - сигнал ядерной локализации. Черными стрелками обозначены LoxP-сайты, пустыми стрелками - промоторы, пустыми прямоугольниками - структурные части генов, пустой окружностью обозначена Stop-последовательность.
Фиг.7. Диаграмма относительной активности исследованных промоторов в различных клеточных линиях. Названия промоторов приведены внизу рисунка. По оси ординат приведена относительная люциферазная активность, нормализованная на люциферазную активность в клетках, трансфицированных конструкцией PV-pGL3. Названия клеточных линий приведены по оси абсцисс. Calu-1 - эпидермоидная карцинома легкого человека, A375 - меланома человека, А549 - карцинома легкого человека, PANC1 - карцинома экзокринной части поджелудочной железы, НТ1080 - фибросаркома.
Фиг.8. Активность универсальных опухолеспецифичных промоторов в различных клеточных линиях. По оси ординат приведена активность люциферазы относительно люциферазной активности в клетках, трансфицированных вектором PV-pGL3. По оси абсцисс обозначены типы клеточных линий, в которых проводилось измерение промоторной активности. В правом верхнем углу приведены названия промоторов, используемых в работе. Высота столбцов отражает среднее значение люциферазной активности в трех независимых экспериментах, приведены стандартные ошибки среднего значения (SEM). PV - промотор вируса SV40, mSurv - фрагмент промоторной области гена сурвивина мыши, hTERT - фрагмент промоторной области гена обратной транскриптазы теломеразы человека.
Фиг.9. Активность созданных опухолеспецифичных промоторов в различных клеточных линиях. По оси ординат приведена активность люциферазы относительно люциферазной активности в клетках, трансфицированных вектором PV-pGL3. По оси абсцисс обозначены типы клеточных линий, в которых проводилось измерение промоторной активности. В правом верхнем углу приведены названия промоторов, используемых в работе. Высота столбцов отражает среднее значение люциферазной активности в трех независимых экспериментах, приведены стандартные ошибки среднего значения (SEM).
Фиг.10. Вестерн-блот анализ содержания белка FCU1 в клетках линии S37, трансфицированных конструкциями, экспрессирующих ген FCU1. 1 - pCMV-FCU1; 2-3 - различные соотношения векторов PhTSurv269-Cre и pCMV-STOP-FCU1 (котрансфекция): 2:2, 1:3. В качестве первичных антител использовали овечьи IgG (″Santa-Cruz″) (1:5000). Вторичные антитела к овечьим IgG были конъюгированы с пероксидазой хрена (″Santa-Cruz″). Клеточные лизаты предварительно нормализовали по суммарному белку.
Фиг.11. Выживаемость раковых клеток линии S37 (саркома мыши) в присутствии 5-фторцитозина, трансфицированных следующими векторами: вектором pCMV-FCU1 (положительный контроль), системой векторов PhTSurv269-Cre (активатор)/pCMV-STOP-FCU1 (эффектор) при соотношении активатор/эффектор 2:2 и 1:3 по количеству мкг.
Фиг.12. Выживаемость раковых клеток линии S37 (саркома мыши) в присутствии 5-фторцитозина, трансфицированных следующими векторами: вектором pCMV-FCU1 (положительный контроль), системой векторов PhTSurv269-Cre/pCMV-STOP-FCU1 и PhSurv-Cre/pCMV-STOP-FCU1.
Фиг.13. Схемы двойных промоторов и соответствующих вариантов транскриптов. Прямоугольниками обозначены промоторы PhTERT, PhSurv, PhSurv269, PmSurv и ген люциферазы светлячка - Luc. Слева указаны названия двойных промоторов. Под схемой каждого двойного промотора линиями обозначены транскрипты, инициируемые с данных промоторов. Утолщенная часть линии обозначает последовательность транскрипта, комплементарную последовательностям промоторов или гена люциферазы, тонкая - линкерным участкам. Изломанной стрелкой обозначены точки инициации транскрипции. Стрелками обозначены праймеры. Над стрелками указаны названия праймеров.
При использовании пар праймеров TSL-F/hSurv_150R, TSL-F/hS269_122R and TSL-F/mS_122R амплифицируются только транскрипты, инициированные с дистальных промоторов. Пара праймеров UPF/Luc_202R позволяет амплифицировать суммарные транскрипты.
Фиг.14. Электрофореграммы продуктов, полученных в результате ОТ-ПЦР и инициированных с дистального и проксимального промоторов. Названия двойных промоторов указаны сверху. Положение по отношению к контролируемому гену отдельных промоторных элементов, составляющих двойной промотор, и количество циклов ПЦР указаны слева и внизу, соответственно. Дистальный - продукты амплификации транскриптов, инициированных с промотора PhTERT с использованием праймеров TSL-F/hSurv_150R, TSL-F/hS269_122R для промотора PhTS и праймеров TSL-F/mS_122R для промоторов, PhTSurv269 и PhTmS. Проксимальный - продукты амплификации с использованием праймеров UPF и Luc_202R суммарных транскриптов и/или транскриптов, инициированных с дистального промотора.
Фиг.15. Выживаемость в присутствии ганцикловира раковых клеток линии НТ1080 (фибросаркома человека), трансфицированных векторами: PhSurv-HSVtk, PhTSurv269-HSVtk, контроль.
Фиг.16. Выживаемость в присутствии 5-фторцитозина раковых клеток линии Calu-1, трансфицированных векторами: PhSurv-FCU1-mGM-CSF, PhTSurv269-FCU1-mGM-CSF, CMV-FCU1-mGM-CSF, контроль.
Фиг.17. Вестерн-блот анализ содержания белка HSVtk в клетках линии НТ1080, трансфицированных конструкциями, экспрессирующими ген HSVtk. 1 - pCMV-HSVtk; PhSurv-HSVtk, PhTSurv269-HSVtk. В качестве первичных антител использовали овечьи IgG (″Santa-Cruz″) (1:5000). Вторичные антитела к овечьим IgG были конъюгированы с пероксидазой хрена (″Santa-Cruz″), Клеточные лизаты предварительно нормализовали по суммарному белку.
Фиг.18. Влияние трансформации клеток карциномы легкого Льюис мыши (LLC) генно-инженерньми конструкциями на скорость роста опухолей, вызванных трансплантацией данных клеток мышам С57В1/6. Нетрансформированные (Control), трансформированные конструкцией CMV-HSVtk-mGM-CSF-pGL3 (CMV), трансформированные конструкцией PhSurv-HSVtk-mGM-CSF-pGL3 (PhSurv) и трансформированные конструкцией PhTSurv269-HSVtk-mGM-CSF-pGL3 (PhTSurv269) клетки трансплантировали мышам. Внутрибрюшинные инъекции ганцикловира (GCV) в количестве 75 мг/кг дважды в день проводили 10 дней начиная с третьего дня после трансплантации клеток. Размеры опухоли измеряли с 6 дня после трансплантации клеток. Данные представляют собой средние значения для группы из 10 животных. По оси абсцисс указано время, прошедшее с момента трансплантации клеток.
Фиг.19. Влияние трансформации клеток карциномы легкого Льюис мыши (LLC) генно-инженерными конструкциями на скорость роста опухолей, вызванных трансплантацией данных клеток мышам С57В1/6. Трансформированные конструкцией CMV-HSVtk-mGM-CSF-pGL3 (CMV), трансформированные конструкцией PhSurv-HSVtk-mGM-CSF-pGL3 (PhSurv) и трансформированные конструкцией PhTSurv269-HSVtk-mGM-CSF-pGL3 (PhTSurv269) клетки трансплантировали мышам. Внутрибрюшинные инъекции ганцикловира (GCV) в количестве 75 мг/кг дважды в день проводили 10 дней начиная с третьего дня после трансплантации клеток. Размеры опухоли измеряли с 6 дня после трансплантации клеток. Данные представляют собой средние значения для группы из 10 животных. По оси абсцисс указано время, прошедшее с момента трансплантации клеток.
Осуществление изобретения
Созданные двойные промоторы являются химерными двойными промоторами, в которых промоторы генов hSurv и hTERT находятся в двух положениях относительно друг друга. В первом случае промотор гена hSurv расположен выше промотора hTERT относительно старт-кодона подконтрольного гена, во втором случае промотор гена hTERT расположен выше промотора hSurv относительно старт-кодона подконтрольного гена. Созданные промоторы обладают высокой активностью в раковых клетках человека, причем активность промоторов превышает активность промотора вируса SV40. Промоторы могут иметь функциональные производные, то есть модификации промоторов как результат делеции, замены, инсерции или иной мутации в исходном промоторе, не изменяющие или сохраняющие достаточно высокий уровень активности по сравнению с исходным промотором (примеры 2 и 3, таблица 2).
Полученные промоторы могут быть использованы для преимущественной транскрипции различных генов в раковых клетках в составе экспрессионной кассеты. Экспрессионная кассета (ЭК), предназначенная для экспрессии терапевтических генов в клетках млекопитающих, представляет собой фрагмент ДНК, содержащий все необходимые генетические элементы для экспрессии внедренной в него генетической информации. Экспрессионная кассета, в направлении от 5′ к 3′-концу, состоит из 1) промотора (промоторов); 2) одного или нескольких генов, экспрессию которых предполагается обеспечить; 3) сигнала полиаденилирования, необходимого для окончания транскрипции и посттранскрипционного процессинга РНК. В состав ЭК могут входить также дополнительные элементы, обеспечивающие регулировку условий экспрессии интересующего гена. Так, для усиления экспрессии терапевтического гена иногда используется химерный интрон, расположенный между последовательностями промотора и терапевтического гена (Gross MK and Kainz MS et al. (1987) Mol Cell Biol 7:4576-81, Buchman AR and Berg P (1988) Mol Cell Biol 8:4395-405). Используемый сигнал полиаденилирования также может оказывать эффект на уровень экспрессии гена путем влияния на устойчивость синтезируемого транскрипта (Azzoni AR and Ribeiro SC (2007) J Gene Med 9:392-402).
В качестве генов, подконтрольных опухолеспецифичным промоторам в составе экспрессионных кассет, обычно используют гены терапевтического вмешательства следующих групп:
1. Негативные доминантные мутанты (НДМ) генов, участвующих в онкогенезе
2. Гены-убийцы
3. Гены - ингибиторы ангиогенеза
4. Гены-онкосупрессоры
5. Гены-иммуностимуляторы
6. Гены siRNA
1. Негативные доминантные мутанты (НДМ) генов используются для подавления действия белков генов, участвующих в онкогенезе, таких как онкогены или ингибиторы апоптоза. Так, например, введение НДМ гена сурвивина мыши в раковые клетки простаты ингибирует их рост (Pan L and Peng XC et al. (2011) J Cancer Res Clin Oncol 137:19-28). Введение НДМ гена с-Jun в опухоль толстой кишки приводит к ее частичной регрессии (Suto R and Tominaga К et al. (2004) Gene Ther 11:187-93). НДМ онкогена RAS подавляет развитие ряда линий раковых клеток человека, такие как рак поджелудочной железы, толстой кишки, языка.
2. Генами-убийцами являются гены токсинов (I тип), а также гены ферментов, способных превращать нетоксичный агент (пролекарство) в токсин, убивающий раковые клетки (II тип). Наиболее эффективными генами II типа являются гены тимидинкиназы вируса простого герпеса (HSVtk) и цитозиндезаминазы дрожжей или Е.coli. Цитозиндезаминаза - фермент, катализирующий гидролитическое дезаминирование 5-фторцитозина с образованием 5-фторурацила (5-ФУ), убивающего раковые клетки. Противоопухолевая активность комбинации цитозиндезаминаза/5-фторурацил была показана на животных с таким опухолями, как: фибросаркома (Mullen CA and Coale MM et al. (1994) Cancer Res 54:1503-6), карцинома (Huber BE and Austin EA et al. (1994) Proc Natl Acad Sci US A 91:8302-6, Bentires-Alj M and Hellin AC et al. (2000) Cancer Gene Ther 7:20-6, Huber BE and Austin EA et al. (1993) Cancer Res 53:4619-26, Ohwada A and Hirschowitz EA et al. (1996) Hum Gene Ther 7:1567-76, Kanai F and Lan KH et al. (1997) Cancer Res 57:461-5), глиома (Ichikawa Т and Tamiya Т et al. (2000) Cancer Gene Ther 7:74-82, Ge К and Xu L et al. (1997) Int J Cancer 71:675-9) и другие.
Тимидинкиназа вируса простого герпеса способна превращать нетоксичный противогрибковый агент - Ганцикловир (GCV) в токсичные метаболиты, которые встраиваясь в растущую цепь ДНК раковых клеток во время деления, ингибируют ее синтез, тем самым обеспечивая гибель раковой клетки. HSVtk/GCV - единственная генно-терапевтическая комбинация, достигшая третьей фазы клинических испытаний (Immonen A and Vapalahti M et al. (2004) Mol Ther 10:967-72, Evrard A and Cuq P et al. (1999) Int J Cancer 80:465-70). В фазе I клинических испытаний восьми пациентам с местными рецидивами рака простаты, предварительно прошедшим гормональную терапию, вводили аденовирус, несущий экспрессионную кассету с геном HSVtk. Последующее введение GCV приводило к значительной частичной регрессии опухоли (Nasu Y and Saika Т et al. (2007) Mol Ther 15:834-40).
Исследования фазы II клинических испытаний, в которой в качестве вектора для HSVtk был использован репликативно дефектный аденовирус, показали, что совместное применение стандартной и генотерапии приводит к статистически значимому увеличению средней выживаемости: с 38 до 62 недель (Immonen A and Vapalahti M et al. (2004) Mol Ther 10:967-72).
3. Экспрессия генов - ингибиторов ангиогенеза в клетках опухоли приводит к подавлению образования в ней новых кровеносных сосудов в опухоли ведет к замедлению ее роста и деградации из-за недостаточного поступления питательных веществ и кислорода. Ингибиторами ангиогенеза являются гены белков ангиостатина (подавляет развитие лимфомы EL-4) и эндостатина (рост карциномы почки, меланомы, колоректальной карциномы) (Sun X and Kanwar JR et al. (2001) Gene Ther 8:638-45, Shi W and Teschendorf C et al. (2002) Cancer Gene Ther 9:513-21, Cichon Т and Jamrozy L et al. (2002) Cancer Gene Ther 9:771-7).
4. Гены-онкосупрессоры играют ключевую роль в поддержании стабильности клеточного генома и в регуляции клеточного деления и апоптоза (запрограммированная клеточная гибель). Клетки опухоли подавляют работу генов-онкосупрессоров и т.о. избегают апоптоза. Введение генов-онкосупрессоров в раковые клетки приводит к подавлению их роста и гибели. Белок р53 является самым известным опухолевым супрессором. Первый в мире генно-терапевтический препарат ″Gendicine ™″ (Chinese Shenzhen SiBiono Genetechnologies), созданный на основе нереплицирующегося аденовируса, который несет ген р53, был введен в клиническую практику в 2003 году в Китае и используется для лечения плоскоклеточного рака головы и шеи.
5. Гены-иммуностимуляторы способны активировать клетки иммунной системы. Предполагается, что введение данных генов в раковые клетки обеспечивает стимулирование иммунной системы к узнаванию опухолевых клеток. Примерами генов-иммуностимуляторов являются IL-1, IL-2, IL-4, IL-6, TNF, GM-CSF, гамма-интерферон.
Так, например, использование GM-CSF в комплексе с суицидальными генами приводит к увеличению эффективности терапии онкологических заболеваний. В ряде работ показано, что регрессия опухоли значительно возрастает при совместном использовании гена-убийцы и GM-CSF (Hamilton JA (2002) Trends Immunol 23:403-8, Hamilton JA and Anderson GP (2004) Growth Factors 22:225-31). Более того, в некоторых исследованиях продемонстрировано развитие специфического противоопухолевого иммунитета после совместной экспрессии HSVtk и GM-CSF в клетках опухоли (Guo SY and Gu QL et al. (2003) World J Gastroenterol 9:233-7).
6. Введение в раковые клетки генов siRNA позволяет подавлять экспрессию онкогенов и как следствие индуцирует клеточную смерть. Например, введение в раковые клетки siRNA к гену сурвивина человека в составе рекомбинантной плазмиды подавляет экспрессию гена сурвивина, стимулирует апоптоз раковых клеток и подавляет их пролиферацию.
Для транспортировки терапевтического гена в составе экспрессионной кассеты внутрь раковой клетки используют экспрессионные векторы.
Экспрессионный вектор представляет собой молекулу нуклеиновой кислоты, способную транспортировать экспрессионную кассету внутрь клетки. Обычно, экспрессионный вектор - это плазмида или другая форма ДНК или РНК, обладающая способностью к автономной репликации в определенных клетках. Векторная молекула должна обладать некоторыми свойствами: 1) вектор должен длительное время существовать в популяции клеток-хозяев, т.е. реплицироваться автономно или вместе с хромосомами клеток; 2) в любом векторе должны быть биохимические или генетические маркеры, которые позволяли бы обнаруживать его присутствие в клетках; 3) структура векторной молекулы должна допускать встраивание в нее чужеродной последовательности нуклеотидов без нарушения ее функциональной целостности.
В ц