Способ пренатальной и постнатальной днк-диагностики синдрома дауна, эдвардса, патау, мутации delf508 в гене муковисцидоза и резус-фактора плода
Иллюстрации
Показать всеИзобретение относится к биотехнологии, а именно к способу пренатальной и постнатальной ДНК-диагностики синдрома Дауна, Эдвардса и Патау, мутации delF508 в гене муковисцидоза и резус-фактора плода методом количественной флюоресцентной полимеразной цепной реакции. Способ включает выделение ДНК из анализируемого материала сорбентом Nucleos набора DIAtom DNA Prep 100. Проводят элюацию ДНК дистиллированной стерильной водой. Осуществляют две мультиплексные амплификации с использованием набора флюоресцентно-меченых праймеров - первая на 4 локуса 21-й хромосомы, а именно D21S1435, D21S1411, D21S11 и IFNAR, на мутацию delF508 в гене муковисцидоза и на участок 10 экзона гена RhD, вторая - на 4 локуса 13 хромосомы, а именно D13S628, D13S634, D13S742, D13S305, и 4 локуса 18 хромосомы, а именно D18S386, D18S391, D18S535, D18S978. Смешивают полученные ПЦР-продукты в одной лунке. Проводят детекцию методом капиллярного электрофореза в полиакриламидном геле. Изобретение позволяет с высокой точностью диагностировать наличие синдромов Патау, Эдвардса и Дауна, мутации delF508 в гене муковисцидоза и резус принадлежности плода. 1 з.п. ф-лы, 4 ил., 1 табл., 4 пр.
Реферат
Изобретение относится к области медицины, а именно к молекулярной биологии, и найдет применение для ранней диагностики синдрома Дауна, Эдвардса, Патау, мутации в гене муковисцидоза delF508 и резус принадлежности плода.
На долю анеуплоидий (нарушения числа хромосом) приходится свыше 95% всей хромосомной патологии у плода. Самой распространенной является трисомия по 21 хромосоме (синдром Дауна). Характерными признаками этого синдрома являются умственная отсталость, монголоидный тип лица и поражение многих органов и систем (сердечно-сосудистой, нервной, эндокринной и др.). Частота рождения детей с данной патологией составляет около 1:700 новорожденных.
Возникает такой дефект случайно, вследствие нарушения расхождения хромосом при созревании половых клеток матери или отца. Такие патологические клетки накапливаются со временем, поэтому встречаемость синдрома Дауна имеет прямую зависимость от возраста родителей.
Так, если возраст будущей матери 21 год, то риск рождения больного ребенка составляет 1:1507, в 29 лет - риск 1:1018, в 36 лет - риск 1:307, в 40 лет - 1:112, 43 года - 1:49, в 49 лет риск родить больного ребенка составляет 1:8.
Трисомия по 13 хромосоме (синдром Патау) встречается с частотой 1:7000-1:14000. При данном синдроме наблюдаются тяжелые врожденные пороки: микроцефалия, нарушение развития различных отделов ЦНС, расщелина верхней губы и неба, полидактилия. У 80% новорожденных встречаются пороки развития сердца: дефекты межжелудочковой и межпредсердной перегородок, транспозиции сосудов и др. Для синдрома Патау характерна задержка умственного развития. В связи с тяжелыми врожденными пороками развития большинство детей с синдромом Патау умирают в первые недели или месяцы жизни (95% - до 1 года).
Средняя частота трисомии по 18 хромосоме (синдром Эдвардса) составляет 1:7000 новорожденных. Фенотипические проявления синдрома Эдвардса многообразны. Чаще всего возникают аномалии мозгового и лицевого черепа. Нижняя челюсть и ротовое отверстие маленькие. Из дефектов внутренних органов наиболее часто отмечаются пороки сердца и крупных сосудов. У всех больных наблюдаются выраженная умственная отсталость, снижение мышечного тонуса, переходящее в повышение со спастикой. Продолжительность жизни детей с синдромом Эдвардса невелика: 60% детей умирают в возрасте до 3 мес, до года доживает лишь 5-10%. Основной причиной смерти служат остановка дыхания и нарушения работы сердца. Оставшиеся в живых - глубокие олигофрены.
Пренатальная (дородовая) диагностика анеуплоидий состоит из двух этапов. На первом этапе проводятся скрининговые исследования с помощью различных маркеров (биохимических и ультразвуковых), которые позволяют сформировать группу риска по рождению больного ребенка.
Второй этап заключается в проведении инвазивной процедуры, которая направлена на выяснение кариотипа ребенка для точной постановки диагноза. Кариотипирование является «золотым стандартом» выявления хромосомных нарушений во всем мире. Клетки плода для картирования хромосом получают путем кордоцентеза (забора крови плода из пуповины) или пункции хориона. Обе эти процедуры повышают риск спонтанного аборта - на 1-2% в случае кордоцентеза и до 1% в случае биопсии хориона.
Известен способ обнаружения анеуплоидий X, Y, 13, 18 и 21 хромосом методом количественной флюоресцентной полимеразной цепной реакции (КФ-ПЦР) по ДНК, выделенной из амниоцитов плода (Schmidt W., Jendermy J., Hecher K. et al. Detection of aneuploidy in chomosomes X, Y, 13, 18 and 21 by QF-PCR in 662 selected pregnancies at risk. // Mol Hum Reprod 2000; 6: 9: 855-860).
Сущность способа состоит в том, что геномную ДНК выделяли из 1-2 мл амниотической жидкости используя QIAamp blood kit (Qiagen, Germany). Метод КФ-ПЦР основан на амплификации высокополиморфных STR маркеров, специфичных для каждой хромосомы с флюоресцентно-мечеными праймерами красками FAM, JOE и TAMRA. Для каждой хромосомы для исследования выбирались по 3 локуса. ПЦР ставилась в конечном объеме 50 мкл. Полученные ПЦР продукты разгонялись на капиллярном ДНК-анализаторе 377 DNA Sequencer в 4,25% полиакриламидном геле, и по интенсивности флюоресценции определяется размер и количество аллелей.
Недостатком данного способа является то, что выделение ДНК происходит с помощью мембраны, что приводит к увеличению стоимости анализа. А использование для каждой хромосомы только по 3 маркера, в случае присутствия неинформативных гомозигот, требует исследования дополнительных локусов, что в свою очередь приводит к увеличению трудоемкости метода.
Муковисцидоз (MB) (cystic fibrosis) - одно из наиболее часто встречающихся наследственных заболеваний. Его причиной является мутации в гене трансмембранного регуляторного белка муковисцидоза - CFTR (cystic fibrosis transmembrane conductance regulator). Белок, который кодируется геном CFTR, является хлорным каналом и обеспечивает активный транспорт ионов хлора. В настоящее время в гене CFTR обнаружено более 1500 мутаций. Одни мутации в гене CFTR ведут к снижению синтеза белка CFTR из-за незавершенности процессинга РНК, другие - к качественным изменениям мембранных хлорных каналов. Нарушение транспорта хлоридов обусловливает возникновение мультиорганного патологического процесса (прогрессирующее поражение дыхательных путей, хронические синуситы, недостаточность экзокринной секреторной функции поджелудочной железы).
Ранняя диагностика и своевременная профилактика муковисцидоза - актуальная задача, стоящая перед медицинскими работниками. Мутации в гене муковисцидоза имеют различия по частоте встречаемости и по распределению в различных популяциях. В России наиболее часто (около 56% от всех поврежденных хромосом) встречается мутация delF508, при которой происходит нарушение формирования вторичной и третичной структуры синтезированного белка и такой белок не достигает мембраны клетки, а распадается по пути к ней, в цитоплазме. Наличие мутации delF508 в генотипе в гомозиготном или компаудном положении приводит к тяжелым поражениям поджелудочной железы, более ранним и тяжелым проявлениям нарушений легочной функции и имеет тяжелое течение и плохой прогноз особенно при позднем выявлении. Раннее, а желательно пренатальное обнаружение предрасположенности к муковисцидозу поможет предотвратить рождение в семье больного ребенка, а в случае рождения соответствующая терапия позволит резко повысить качество жизни больных детей.
Известен способ обнаружения мутаций deltaF508 в гене CFTR с помощью мультиплексной амплификации в предимплантационной диагностике (Moutou С, Gardes N, Viville S. Multiplex PCR combining deltaF508 mutation and intragenic microsatellites of the CFTR gene for pre-implantation genetic diagnosis (PGD) of cystic fibrosis. Eur J Hum Genet. 2002 Apr; 10(4): 231-8). Вместе с мутацией DeltaF508 исследовались два внутригенных полиморфных маркера (IVS8CA и IVS17bCA).
Сущность способа состоит в том, что исследуемая геномная ДНК, полученная из бластомера, подвергается мультиплексной флюоресцентной ПГДР-амплификации, с помощью которой удается скопировать нужный участок ДНК, в пределах которого находятся мутации. В этих целях используют пары праймеров, участки ДНК, определяющие начало и конец амплифицированного участка ДНК, один из которых флюоресцентно мечен. Для определения мутации DeltaF508 использовали прямой флюоресцентно-меченый праймер: 6-fam-GTTTTCCTGGATTATGCCTGGCA и обратный праймер: GTTGGCATGCTTTGATGACGCTTC. Для проведения анализа также нужны свободные нуклеотиды и фермент полимераза, катализирующий образование исследуемых и копируемых сегментов ДНК. Для проведения самой ПЦР используют прибор, обеспечивающий нужный температурный режим - термоциклер. Проводят капиллярный электрофорез для разделения полученных фрагментов на ДНК-анализаторе ABI 310. В норме при отсутствии мутации должен присутствовать фрагмент 99 п.н. При гетерозиготном носительстве мутации delF508, наряду с фрагментом размером 99 п.н., соответствующим норме, присутствует фрагмент 96 п.н. При наличии мутации в гомозиготном состоянии наблюдается только фрагмент 96 п.н.
Недостаток данного способа в том, что определяется только одна мутация delF508.
Гемолитическая болезнь новорожденных до сих пор является одним из самых тревожных состояний в акушерстве и в 98% случаев обусловлена несовместимостью плода и матери по D-резус-антигенам. Система резус (Rh) - вторая по значимости для подбора крови (после системы АВО). Антигены системы Rh представляют собой мембранные белки эритроцитов. Rh-принадлежность определяется наличием или отсутствием антигена D, так как он является наиболее иммуногенным и поэтому имеет наибольшее клиническое значение.
Ген RhD располагается на 1-й хромосоме (р36.13-р34.3), имеет размер около 75000 н.п. и включает по 10 экзонов. Резус-положительный тип определяется наличием гена RhD в гомозиготном или гетерозиготном состоянии. Резус-отрицательный тип для белой расы в большинстве случаев обусловлен делецией гена RhD на обеих хромосомах. Соответствующий белковый продукт - эритроцитарный антиген D - при этом не синтезируется, и проявляется резус-отрицательный фенотип.
Антигена D лишено примерно 15% населения Российской Федерации. Даже небольшое количество Rh-положительных эритроцитов, попав в кровь во время беременности у резус-отрицательной матери и резус-положительного плода, может вызвать образование антител в организме матери к эритроцитам плода, развитие резус-конфликта. Такой конфликт может приводить к выкидышу или гемолитической анемии плода. Поэтому важно определение резус принадлежности плода у резус-отрицательной женщины еще на раннем сроке беременности для профилактики резус-конфликта.
Известен способ пренатальног определения резус-принадлежности плода с помощью амплификации участков 7 и 10 экзонов гена RhD (Phillip R. Bennett, Caroline Le Van Kim, Yves Colin, Ruth M. Warwick, Baya Cherif-Zahar, Nicholas M. Fisk, and Jean-Pierre Cartron N. Prenatal Determination of Fetal RhD Type by DNA Amplification. // Engl J Med. 1993 Aug 26; 329(9): 607-10).
Сущность способа состоит в том, что при молекулярно-генетическом исследовании для выявления наличия или делеции гена RhD с помощью ПЦР использовались две пары праймеров. Одна пара фланкировала 7 экзон гена RhD и 7 экзон гена RhCcEe, который использовался как контроль прохождения реакции. Вторая пара праймеров фланкировала только участок 10 экзона гена RhD. Продукты амплификации разгонялись в 3% агарозном геле. При положительном резусе амплифицировались участки 136 п.н. (соответствующие 7 экзонам) и 186 п.н., который соответствовал 10 экзону гена RhD. При отрицательной резус-принадлежности присутствовал только участок 136 п.н., который соответствовал 7 экзону гена RhCcEe. Недостатком способа является его трудоемкость, так как для детекции продуктов амплификации использовался 3% агарозный гель, кроме того, некачественное разделение продуктов реакции в геле может приводить к ошибкам при генотипировании.
Прототипом заявляемого изобретения нами выбран способ обнаружения основных анеуплоидий, таких как синдромы Дауна, Эдвардса и Патау по ДНК, методом КФ-ПЦР (Mann K., Fox S.P., Abbs S.J., Yau S.C., Scriven P.N., Docherty Z., Ogilvie C.M. Development and implementation of a new rapid aneuploidy diagnostic service within the UK National Health Service and implications for the future of prenatal diagnosis. // Lancet. - 2001. - Vol.358. - P.1057-1061).
Выделение ДНК осуществляли из ворсин хориона, амниотических вод или крови плода с использованием InstaGene Matrix kit (Bio-Rad, USA). Сущность способа состоит в том, что в одной мультиплексной КФ-ПЦР для выявления дополнительных хромосом использовали по 4 маркера на 18 и 21 хромосомы и по 3 маркера на 13 хромосому. Также был включен в реакцию праймер на AMXY.
После проведения амплификации полученные ПЦР продукты разгоняются на капиллярном ДНК-анализаторе 3100 (Applied Biosystems, USA) и по интенсивности флюоресценции определяется размер и количество аллелей.
Недостатком данного способа является то, что, во-первых, выделение ДНК осуществляется с помощью InstaGene Matrix kit, при котором невозможно оценить количество ДНК, вносимое в реакционную смесь, что в свою очередь снижает точность анализа из-за возможного перегруза или недостаточности амплификации. Во-вторых, осуществляется диагностика только трисомий по 13, 18 и 21 хромосомам. В-третьих, смесь для амплификации готовится непосредственно перед проведением КФ-ПЦР, что усложняет и замедляет процедуру анализа. Указанные недостатки устраняются в заявляемом изобретении.
Задачей настоящего изобретения является разработка быстрого способа пренатальной и постнатальной ДНК-диагностики синдромов Дауна, Эдвардса, Патау, мутации delF508 в гене муковисцидоза и резус-фактора за счет одновременного анализа сразу нескольких мутаций.
Поставленная задача решается тем, что осуществляют одновременную ДНК-диагностику трисомий по 13, 18, 21 хромосомам, мутации delF508 в гене муковисцидоза CFTR и резус-фактора плода методом количественной флюоресцентной полимеразной цепной реакции (КФ-ПЦР). Способ заключается в проведении двух мультиплексных полимеразных цепных реакций с использованием подобранного набора флюоресцентно-меченых праймеров по 4 маркера на 13, 18 и 21 хромосомы, на мутацию delF508 в гене муковисцидоза и на участок 10 экзона гена RhD.
Затем два полученных ПЦР-продукта смешивают в одной лунке и проводят детекцию с применением метода капиллярного электрофореза в полиакриламидном геле. По наличию тройных или двойных пиков с соотношением высот 1:2 делают вывод о наличии тройной дозы 13, 18 или 21-й хромосом (наличие синдромов Патау, Эдвардса и Дауна соответственно). По наличию пиков размером 96-99 п.н. и 186 п.н. по флюоресцентному каналу R6G делают вывод о наличии мутации delF508 в гене муковисцидоза и о резус-принадлежности соответственно.
Техническим результатом заявленного изобретения является более высокая точность диагностики резус-принадлежности плода, упрощение и удешевление способа пренатальной диагностики синдрома Дауна, Эдвардса и Патау для целей массового скриннинга в условиях лечебных учреждений и формирование группы риска новорожденных по муковисцидозу.
Подробное описание способа и примеры его клинического выполнения.
Предлагаемый способ заключается в следующем. Геномную ДНК выделяют из амниоцитов плода, полученных после центрифугирования 6 мл амниотической жидкости с использованием сорбента Nucleos набора DIAtom DNA Prep100 («Центр Молекулярной генетики», Россия), и растворяют в 50 мкл дистиллированной стерильной воды.
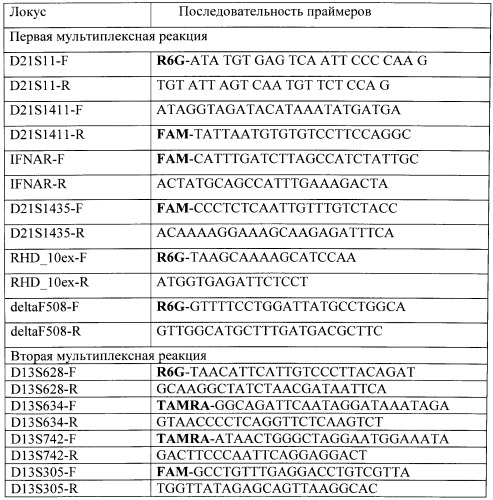
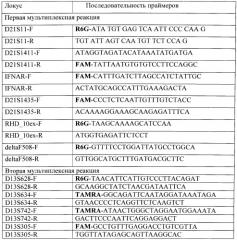
При проведении двух мультиплексных количественных флюоресцентных полимеразных цепных реакций (КФ-ПЦР) для каждой используют 10 мкл двухкратного мастер-микс для мультиплексной амплификации Multiplex PCR Kit (QIAGEN) и следующие пары флюоресцентно-меченых праймеров производства фирмы Синтол (Россия) каждый в концентрации 10 ОЕ/мл. Последовательность прямых (F) и обратных (R) праймеров приведена в табл.
Последовательность прямых и обратных праймеров, используемых в мультиплексных реакциях
В первую КФ-ПЦР вошли праймеры: на 21 хромосому - D21S1435, D21S1411, D21S11 и IFNAR, на мутацию delF508 в гене муковисцидоза и на участок 10 экзона гена RhD. Во вторую КФ-ПЦР вошли праймеры на 13 хромосому - D13S628, D13S634, D13S742, D13S305; на 18 хромосому - D18S386, D18S391, D18S535, D18S978. Праймеры вносят в концентрациях 2-22 пМ на реакцию. Смесь для КФ-ПЦР готовится заранее в стерильных условиях, раскапывается в пробирки для проведения ПЦР по 15 мкл и хранится при минус 20°C до момента добавления 20 нг геномной ДНК и проведения амплификации.
Концентрацию исследуемой ДНК рассчитывают по оптической плотности раствора при 260 нм на спектрофотометре ND-1000 (NanoDrop) и вносят в смесь в конечной концентрации 4 нг/мкл в количестве 5 мкл. Амплификацию проводят на термоциклере с прогреваемой крышкой РТС-220 DNA Engine Dyad (MJ Research, Inc., Waltham, MA) по следующей схеме: денатурация при 95° - 15 мин, затем 28 циклов, каждый из которых состоит из денатурации - 1,5 мин при 94°; отжига - 1,5 мин при 57° и синтеза - 1,5 мин при 72°, и заключительная элонгация 72° в течении 15 мин. Два полученных ПЦР-продукта смешивают в одной лунке по 1 мкл и проводят электрофоретическое разделение ПЦР-продуктов с помощью капиллярного ДНК-анализатора ABI PRISM 3130 (Applied Biosystems), который откалиброван под детекцию флюоресцентных красителей меченых праймеров. Для определения длин полученных фрагментов используют размерный стандарт S450 (СИНТОЛ, Россия), меченный красителем LIZ. В каждую лунку планшета вносят 9 мкл очищенного формамида, 1 мкл размерного стандарта S450 и по 1 мкл первого и второго амплификата. Денатурацию проводят при 95° в течение 5 мин с последующим охлаждением до 4°. Электрофорез проводят в 7% полиакриламидном геле, используя капилляры на 36 см. Фрагментный анализ осуществляется с помощью программы «GeneMapper» v4.0.
При анализе электрофореграмм на наличие трисомий по 13, 18 и 21 хромосомам в образцах без патологии наблюдаются двойные флюоресцентные пики с отношением высот около 1:1 (отношение более высокого аллеля к более низкому не должно быть более чем 1,5) по каждому локусу или один пик в случае неинформативной гомозиготы. При наличии трисомий в электрофореграмме наблюдаются трехаллельные пики с отношением высот, близким к 1:1:1, или диаллельные пики с отношением высот, близким к 1:2.
При амплификации участка 186 п.н. по флюоресцентному каналу R6G (соответствует 10 экзону гена RhD) определяли положительный резус. При отрицательной резус-принадлежности данный участок не амплифицируется и пика на электрофореграмме не наблюдается.
При определении у плода наличия мутации deltaF508 в гене CFTR в норме при отсутствии мутации должен присутствовать фрагмент 99 п.н. по флюоресцентному каналу R6G. При гетерозиготном носительстве мутации delF508 - наряду с фрагментом размером 99 п.н., соответствующим норме, присутствует фрагмент 96 п.н. При наличии мутации в гомозиготном состоянии наблюдается только фрагмент 96 п.н.
При клинических испытаниях предлагаемого способа выявления данных патологий обследовано 93 образца амниотической жидкости (параллельно с проведением кордоцентеза) и 57 образцов хориона, полученных в результате инвазивных пренатальных диагностик. В 143 образцах не было выявлено трисомий по 21, 13 и 18 хромосомам. В 5 образцах диагностировался синдромом Дауна, в одном образце определялся синдром Патау и в одном синдром Эдвардса - наблюдались трехаллельные пики с отношением высот, близким к 1:1:1, или диаллельные пики с отношением высот, близким к 1:2. В 2 образцах было обнаружено гетерозиготное носительство мутации delF508. В 27 случаях определялся отрицательный резус-фактор. Для верификации поставленных диагнозов во всех 150 образцах были проведены: стандартное кариотипирование, молекулярно-генетическое исследование на носительство мутации delF508 в гене CFTR, резус-фактор определялся при рождении ребенка серологическим методом. В 100% случаях диагноз, поставленный с помощью КФ-ПЦР, был подтвержден стандартными методами.
Определяющим существенным отличием заявляемого способа по сравнению с прототипом является следующее.
1. На стадии выделения ДНК из анализируемого материала в прототипе используют InstaGene Matrix kit, который не позволяет промерить и точно дозировать количество ДНК, при проведении амплификации. В предлагаемом способе в качестве сорбента используют Nucleos набора DIAtom DNA Prep100 и элюацию ДНК проводят дистиллированной стерильной водой, что позволяет промерить точную концентрацию ДНК и вносить ее в смесь для ПЦР в определенном количестве, что в свою очередь позволяет избежать перегруза или недостаточности ДНК и избежать повторного проведения КФ-ПЦР.
2. На стадии амплификации в прототипе проводят амплификацию с использованием пар праймеров, фланкирующих только участки 21, 13 и 18 хромосом. В заявляемом способе используется две мультиплексных реакции. В первую вносят праймеры на определение нарушений в 21 хромосоме, добавляют пару праймеров на мутацию delF508 в гене CFTR - прямой флюоресцентно-меченый праймер 6-fam и обратный праймер. В эту же ПЦР вносят пару праймеров, которая фланкирует участок 10 экзона гена RhD (см. таблицу). Во второй мультиплекс вносят праймеры на определение нарушений в 13 и 18 хромосомах. Продукты амплификации смешиваются в одной лунке ДНК-анализатора и проводится детекция флюоресцентного сигнала по 14 локусам, что в отличие от прототипа позволяет проводить одновременную быструю диагностику синдрома Дауна, Эдвардса, Патау, частой мутации delF508 в гене муковисцидоза и резус-фактора при проведении инвазивной пренатальной диагностики.
3. В отличие от прототипа готовая смесь для КФ-ПЦР в предложенном способе готовится заранее в стерильных условиях, раскапывается в пробирки для ПЦР по 15 мкл и хранится при минус 20°С до момента добавления 20 нг геномной ДНК и амплификации, что дополнительно упрощает и ускоряет процедуру анализа.
Изобретение иллюстрируется следующими фигурами.
Фиг.1 - электрофореграмма плода с синдромом Дауна из клинического примера №1.
Фиг.2 - электрофореграмма плода с синдром Эдвардса и отрицательным резус-фактором из клинического примера №2.
Фиг.3 - электрофореграмма плода с наличием мутации deltaF508 в гене CFTR в гетерозиготном положении из клинического примера №3.
Фиг.4 - электрофореграмма плода с синдромом Патау из клинического примера №4.
Работоспособность заявляемого изобретения подтверждается следующими примерами конкретного выполнения.
Пример 1.
Геномную ДНК плода №1 выделяли из осажденных центрифугированием при 8000 об/мин в течение 8 мин амниоцитов, полученных в результате амниоцентеза, с использованием сорбента Nucleos с экстракцией в 50 мкл стерильной дистиллированной водой. Концентрацию исследуемой ДНК определяли на спектрофотометре ND-1000 (NanoDrop). В две пробирки с готовыми смесями для амплификации, которые содержали по 10 мкл 2-кратного Multiplex PCR Master Mix, смеси флюоресцентно-меченых праймеров (от 2 до 22 пМ прямого и обратного в первой пробирке - на 21 хромосому, мутацию delF508 и участок 10 экзона гена RhD; во второй пробирке - на 13 и 18 хромосомы), вносили ДНК в конечной концентрации 4 нг/мкл в количестве 5 мкл. Амплификацию проводили на термоциклере с прогреваемой крышкой РТС-220 DNA Engine Dyad (MJ Research, Inc., Waltham, MA) по следующей схеме: денатурация при 95° - 15 мин, затем 28 циклов, каждый из которых состоит из денатурации - 1,5 мин при 94°; отжига - 1,5 мин при 57° и синтеза - 1,5 мин при 72°, и заключительная элонгация 72° в течение 15 мин.
Электрофоретическое разделение ПЦР-продуктов проводили с помощью капилярного ДНК-анализатора ABI PRISM 3130 (Applied Biosystems) в 7% полиакриламидном геле, используя капилляры на 36 см. Для определения длин полученных фрагментов используют размерный стандарт S450 (СИНТОЛ, Россия), меченный красителем LIZ. В каждую лунку планшета вносили 9 мкл очищенного формамида, 1 мкл размерного стандарта S450 и по 1 мкл первого и второго амплификата. Денатурацию проводили при 95° в течение 5 мин с последующим охлаждением до 4°. Фрагментный анализ осуществляется с помощью программы «GeneMapper» v4.0. Электрофореграмма плода №1 приведена на фиг.1.
По локусам D21S1435 и D21S1411 наблюдались трехаллельные пики с соотношением высот 1:1:1; по локусам D21S11 и IFNAR наблюдаются двухаллельные пики с соотношением высот, близким к 1:2. Это свидетельствует о наличии трех 21-х хромосом и о наличии у плода синдрома Дауна. По всем остальным локусам (на 13 и 18 хромосомы) наблюдаются двухаллельные пики с соотношением высот, близким к 1:1, что свидетельствует о наличии двух копий этих хромосом. В зеленой части спектра (флюоресцентный краситель R6G) присутствует пик размером 186 п.н., что свидетельствует о положительном резус-факторе, а наличие пика размером 99 п.н. в этой же части спектра свидетельствует об отсутствии мутации deltaF508 в гене CFTR. Таким образом, у плода в результате пренатальной диагностики установлен диагноз - синдром Дауна.
Пример 2.
Геномную ДНК плода №2 у резус-отрицательной матери выделяли из осажденных центрифугированием при 8000 об/мин в течение 8 мин амниоцитов, полученных в результате амниоцентеза, с использованием сорбента Nucleos с экстракцией в 50 мкл стерильной дистиллированной водой.
В две пары пробирок с готовыми смесями для амплификации в объеме по 15 мкл каждая вносили по 5 мкл геномной ДНК с концентрацией 4 нг/мкл. Амплификацию проводили по схеме: денатурация при 95° - 15 мин, затем 28 циклов, каждый из которых состоит из денатурации - 1,5 мин при 94°; отжига - 1,5 мин при 57° и синтеза - 1,5 мин при 72°, и заключительная элонгация 72° в течение 15 мин. Электрофоретическое разделение ПЦР-продуктов проводили с помощью капиллярного ДНК-анализатора ABI PRISM 3130 (Applied Biosystems) в 7% полиакриламидном геле, используя капилляры на 36 см. В каждую лунку планшета вносили: 9 мкл очищенного формамида, 1 мкл размерного стандарта S450 и по 1 мкл первого и второго амплификата. Денатурацию проводили при 95° в течение 5 мин с последующим охлаждением до 4°. Фрагментами анализ осуществляли с помощью программы «GeneMapper» v4.0. Электрофореграмма плода №2 приведена на фиг.2. На данной электрофореграмме по локусам D18S386 и D18S535 наблюдались трехаллельные пики с соотношением высот 1:1:1; по локусам D18S978 и D18S391 наблюдаются двухаллельные пики с соотношением высот, близким к 1:2. Это свидетельствует о наличии трех 18-х хромосом и о наличие у плода синдрома Эдвардса. По всем остальным локусам (на 13 и 21 хромосомы) наблюдаются двухаллельные пики с соотношением высот, близким к 1:1, что свидетельствует о наличии двух копий этих хромосом. В зеленой части спектра (флюоресцентный краситель R6G) отсутствует пик размером 186 п.н., что свидетельствует об отрицательном резус-факторе плода, а наличие пика размером 99 п.н. в этой же части спектра свидетельствует об отсутствии мутации deltaF508 в гене CFTR. Таким образом, у плода в результате пренатальной диагностики установлен диагноз - синдром Эдвардса и отрицательный резус-фактор.
Пример 3.
Геномную ДНК плода №3 у резус-отрицательной матери выделяли из осажденных центрифугированием при 8000 об/мин в течение 8 мин амниоцитов, полученных в результате амниоцентеза, с использованием сорбента Nucleos с экстракцией в 50 мкл стерильной дистиллированной водой.
В две пары пробирок с готовыми смесями для амплификации в объеме по 15 мкл каждая вносили по 5 мкл геномной ДНК с концентрацией 4 нг/мкл. Амплификацию проводили по схеме: денатурация при 95° - 15 мин, затем 28 циклов, каждый из которых состоит из денатурации - 1,5 мин при 94°; отжига - 1,5 мин при 57° и синтеза - 1,5 мин при 72°, и заключительная элонгация 72° в течение 15 мин. Электрофоретическое разделение ПЦР-продуктов проводили с помощью капиллярного ДНК-анализатора ABI PRISM 3130 (Applied Biosystems) в 7% полиакриламидном геле, используя капилляры на 36 см. В каждую лунку планшета вносили: 9 мкл очищенного формамида, 1 мкл размерного стандарта S450 и по 1 мкл первого и второго амплификата. Денатурацию проводили при 95° в течение 5 мин с последующим охлаждением до 4°. Фрагментный анализ осуществляли с помощью программы «GeneMapper» v4.0. Электрофореграмма плода №3 приведена на фиг.3.
На данной электрофореграмме по локусам D21S1435, D13S628, D18S978, D13S634 и D18S391 наблюдались по одному пику, что интерпретировалось как неинформативные гомозиготы по данным локусам. По всем остальным локусам (на 13, 18 и 21 хромосомы) наблюдаются двухаллельные пики с соотношением высот, близким к 1:1, что свидетельствует о наличии двух копий этих хромосом. В зеленой части спектра (флюоресцентный краситель R6G) присутствует пик размером 186 п.н., что свидетельствует о положительном резус-факторе плода, а наличие пиков размером 97 п.н. и 100 п.н. в этой же части спектра свидетельствует о наличии мутации deltaF508 в гене CFTR в гетерозиготном положении. Таким образом, у плода в результате пренатальной диагностики установлено: отсутствие синдромов Дауна, Эдвардса и Патау, положительный резус-фактор и наличие мутации deltaF508 в гене CFTR в гетерозиготном положении, что относит его к группе риска по развитию резус-конфликта и муковисцидоза.
Пример 4.
Геномную ДНК плода №4 у резус-положительной матери выделяли из осажденных центрифугированием при 8000 об/мин в течение 8 мин амниоцитов, полученных в результате амниоцентеза, с использованием сорбента Nucleos с экстракцией в 50 мкл стерильной дистиллированной водой.
В две пары пробирок с готовыми смесями для амплификации в объеме по 15 мкл каждая вносили по 5 мкл геномной ДНК с концентрацией 4 нг/мкл. Амплификацию проводили по схеме: денатурация при 95° - 15 мин, затем 28 циклов, каждый из которых состоит из денатурации - 1,5 мин при 94°; отжига - 1,5 мин при 57° и синтеза - 1,5 мин при 72°, и заключительная элонгация 72° в течение 15 мин. Электрофоретическое разделение ПЦР-продуктов проводили с помощью капиллярного ДНК-анализатора ABI PRISM 3130 (Applied Biosystems) в 7% полиакриламидном геле, используя капилляры на 36 см. В каждую лунку планшета вносили: 9 мкл очищенного формамида, 1 мкл размерного стандарта S450 и по 1 мкл первого и второго амплификата. Денатурацию проводили при 95° в течение 5 мин с последующим охлаждением до 4°. Фрагментный анализ осуществляли с помощью программы «GeneMapper» v4.0. Электрофореграмма плода №4 приведена на фиг.4. На данной электрофореграмме по локусам D21S1435 и D13S305 наблюдались по одному пику, что интерпретировалось как неинформативные гомозиготы по данным локусам. По двум локусам 13-й хромосомы (D13S628 и D13S742) наблюдались двухаллельные пики с соотношением высот, близким к 1:2. В локусе D13S634 присутствуют три пика с соотношением высот 1:1:1. Это свидетельствует о наличии трех 13-х хромосом и о наличии у плода синдрома Патау. По всем остальным локусам (на 18 и 21 хромосомы) наблюдаются двухаллельные пики с соотношением высот, близким к 1:1, что свидетельствует о наличии двух копий этих хромосом. В зеленой части спектра (флюоресцентный краситель R6G) присутствует пик размером 186 п.н., что свидетельствует о положительном резус-факторе плода, а наличие пика размером 99 п.н. в этой же части спектра свидетельствует об отсутствии мутации deltaF508 в гене CFTR. Таким образом, у плода в результате пренатальной диагностики установлено: наличие синдрома Патау, положительный резус-фактор и отсутствие мутации deltaF508 в гене CFTR.
Преимущества заявленного способа состоят:
- позволяет проводить одновременную быструю диагностику синдромов Дауна, Эдвардса и Патау, частой мутации delF508 в гене муковисцидоза и резус-фактора при проведении инвазивной пренатальной диагностики, что позволит в ряде случаев своевременно проводить профилактические мероприятия, направленные на снижение частоты этих социально-значимых заболеваний;
- позволяет повысить точность и надежность диагностики данных заболеваний за счет использования флюоресцентно-меченых праймеров, количественной флюоресцентной полимеразной цепной реакции и капиллярного электрофореза;
- позволяет упростить известный способ за счет использования заранее приготовленной смеси для КФ-ПЦР и возможности внесения в ПЦР оптимального количества ДНК;
- позволяет снизить риск прерывания беременности при проведении инвазивной пренатальной диагностики за счет использования амниотических вод для получения ДНК плода.
Способ апробирован на достаточном клиническом материале и может быть рекомендован к использованию для целей медицинской диагностики как уже родившихся детей, так и при проведении пренатальной диагностики.
1. Способ пренатальной и постнатальной ДНК-диагностики синдрома Дауна, Эдвардса и Патау, мутации delF508 в гене муковисцидоза и резус-фактора плода методом количественной флюоресцентной полимеразной цепной реакции (КФ-ПЦР), отличающийся тем, что на стадии выделения ДНК из анализируемого материала в качестве сорбента используют Nucleos набора DIAtom DNA Prep 100 и элюацию ДНК проводят дистиллированной стерильной водой, осуществляют две мультиплексные амплификации с использованием подобранного набора флюоресцентно-меченых праймеров - первая на 4 локуса 21-й хромосомы, а именно D21S1435, D21S1411, D21S11 и IFNAR, на мутацию delF508 в гене муковисцидоза и на участок 10 экзона гена RhD, вторая - на 4 локуса 13 хромосомы, а именно D13S628, D13S634, D13S742, D13S305, и 4 локуса 18 хромосомы, а именно D18S386, D18S391, D18S535, D18S978, затем полученные ПЦР-продукты, смешивают в одной лунке и проводят детекцию с применением метода капиллярного электрофореза в полиакриламидном геле, в случае наблюдения по маркерным локусам 21 хромосомы трехаллельных пиков с соотношением высот 1:1:1 или диаллельных пиков с соотношением 1:2 делается вывод о наличии синдрома Дауна, в случае наличия двух пиков с соотношением высот 1:1 по исследуемым маркерам делается вывод об отсутствии трисомии, аналогично по маркерам 18 и 13 хромосом делают вывод о наличии или отсутствии синдромов Эдвардса и Патау соответственно, в случае наличия в зеленой части спектра, флюоресцентный краситель R6G, пика размером 186 п.н. делают вывод о положительном резус-факторе, в случае отсутствия данного пика об отрицательном резус-факторе плода, наличие пика размером 99 п.н. в зеленой части спектра, флюоресцентный краситель R6G, свидетельствует об отсутствии мутации deltaF508 в гене CFTR, в свою очередь наличие пиков размером 96 п.н. и 99 п.н. в зеленой части спектра, флюоресцентный краситель R6G, свидетельствует о наличии мутации deltaF508 в гене CFTR в гетерозиготном положении, при наличии мутации в гомозиготном состоянии наблюдается только фрагмент 96 п.н.
2. Способ по п.1, отличающийся тем, что смесь для КФ-ПЦР готовится заранее в стерильных условиях, раскапывается в пробирки для ПЦР по 15 мкл и хранится при минус 20°C до момента добавления 20 нг геномной ДНК и амплификации.