Производное гормона роста человека с повышенной стабильностью к протеолитическому разрушению, способ получения такого производного, его применение, способ лечения и фармацевтическая композиция
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, медицины, биохимии и генетической инженерии. Предложено производное гормона роста человека, содержащее дополнительную дисульфидную связь по сравнению с hGh, определенному посредством SEQ ID No. 1, где производное содержит по меньшей мере одну пару мутаций, соответствующих Н21С/М170С, D26/V102C, D26/Y103C, F54C/Y143C, F54C/S144C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, S71C/S132C, L81C/Y143C, Q84C/Y143C, S85C/Y143C, S85C/S144C, F92C/T148C и/или R94C/D107C в SEQ ID No. 1, и обладает активностью гормона роста человека, а также способ получения такого производного, его применение, способ лечения и фармацевтическая композиция. Изобретение обладает повышенной стабильностью и устойчивостью к протеолитическому расщеплению в результате введения остатков цистеина. 5 н. и 13 з.п. ф-лы, 3 ил., 6 табл., 5 пр.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к стабильным соединениям гормона роста (GH), устойчивым к протеолитическому разрушению.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Гормон роста (GH) представляет собой полипептидный гормон, секретируемый аденогипофизом у млекопитающих. В зависимости от вида GH представляет собой белок, состоящий приблизительно из 190 аминокислотных остатков, что соответствует молекулярной массе приблизительно 22 кДа. GH связывается с рецепторами клеточной поверхности, GH-рецепторами (GHR), и передает через них сигналы. GH играет ключевую роль в стимуляции роста, поддержании нормального состава тела, анаболизме и метаболизме липидов. Он также оказывает непосредственное влияние на промежуточный метаболизм, как, например, уменьшает поглощение глюкозы, усиливает липолиз, стимулирует поглощение аминокислот и синтез белка. Этот гормон также оказывает влияние на другие ткани, в том числе жировую ткань, ткань печени, кишечника, почек, скелета, соединительную ткань и мышечную ткань. Получен рекомбинантный hGH, и он имеется в продаже в виде, например: Genotropin™ (Pharmacia Upjohn), Nutropin™ и Protropin™ (Genentech), Humatrope™ (Eli Lilly), Serostim™ (Serono), нордитропина (Novo Nordisk), омнитропа (Sandoz), нутропин-депо (Genentech и Alkermes). Помимо этого на рынке также имеется аналог с дополнительным остатком метионина на N-конце, например: Somatonorm™ (Pharmacia Upjohn/Pfizer).
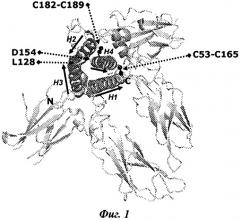
GH имеет общую топологию с другими членами GH-семейства белков, пролактином (PRL) и плацентарным лактогеном (PL). GH классифицируют как белок, имеющий структуру четырехспирального пучка (Фиг.1), демонстрирующий топологию "вверх-вверх-вниз-вниз", с двумя консервативными дисульфидными связями. Конкретно, человеческий GH (hGH) дикого типа состоит из 191 аминокислотного остатка и имеет четыре остатка цистеина в положениях 53, 165, 182 и 189, что стабилизирует пространственную структуру данного белка путем образования двух внутримолекулярных дисульфидных связей, соединяющих С53 с С165 и С182 с С189, соответственно (Фиг.1). Структура hGH была экспериментально определена рентгеновской кристаллографией в свободной форме (Chantalet L. et al. (1995) Protein and Peptide Letters 3, 333-340) и в комплексе со связывающимся с ним белком (внеклеточным доменом человеческого GHR (hGHR)) (Devos, A. M. et al. (1992) Science 255, 306-312). Эти структуры депонированы в Банк белковых структур (PDB) и находятся в открытом доступе (коды доступа в PDB 1HGU и 1HWG, соответственно). Так, среди опубликованных структур hGH можно определить остатки, существенно важные для связывания hGH с hGHR. Кроме того, динамические свойства hGH исследованы посредством спектроскопии ядерного магнитного резонанса (ЯМР) (Kasimova M.R. et al. J. Mol. Biol. (2002) 318, 679-695). В сочетании данные рентгеноструктурного анализа и ЯМР позволяют выделить участки hGH, которые хорошо структурированы и хорошо определены, от участков, которые менее структурированы и динамичны. Ожидается, что менее структурированные и динамичные участки hGH будут особо чувствительны к протеолитическому расщеплению, и надлежащая стабилизация таких участков приведет к улучшенной протеолитической стабильности.
hGH был подвергнут обширному мутагенезу в попытках получить аналоги hGH с желаемыми химическими или биологическими свойствами. В частности, описаны цистеиновые мутанты, полученные для различных целей.
В US 2003/0162949 описаны цистеиновые варианты членов супергенного семейства GH. Приводится общий способ создания сайт-специфических, биологически активных конъюгатов этих белков. Данный способ включает добавление остатков цистеина в несущественные участки белков или замену несущественных аминокислот в белках на остатки цистеина с использованием сайт-специфического мутагенеза и затем осуществление ковалентного связывания между реакционноспособным по цистеину полимером или другой реакционноспособной по цистеину группировкой и белками через добавленный остаток цистеина.
В WO 02/055532 описываются генно-инженерные мутанты hGH, содержащие по меньшей мере одну присоединенную посредством ковалентной связи не являющуюся полипептидом группировку, в частности мутанты hGH, в которых введенный остаток цистеина был использован для пэгилирования.
В US 5951972 описываются физиологически активные производные природных и рекомбинантных белков и полипептидов млекопитающих и человека, где получено производное белка с различными заместителями по меньшей мере по одному природному или введенному в данный белок остатку цистеина.
Протеолитическое расщепление hGH подробно изучено. Длинная петля, в состав которой входят остатки 128-154, содержит предполагаемые сайты расщепления для различных протеаз, таких как тромбин, плазмин, коллагеназа, субтилизин и химотрипсиноподобные сериновые протеазы. Соответственно, показано, что эта часть hGH особенно чувствительна к протеолитическому расщеплению (Lewis, U.J. Ann. Rev. Physiol. (1984) 46, 33-42). Ферменты, известные в качестве отвечающих за разрушение hGH, включают тромбин, плазмин, субтилизин, химотрипсиноподобные сериновые протеиназы и калликреины.
Исследовано разрушение hGH в ткани крысы (Garcia-Barros et al. J. Endocrinol. Invest. (2000) 23, 748-754).
Обнаружено, что в щитовидной железе крыс химотрипсиноподобные протеазы, предпочтительно осуществляющие расщепление по объемным и липофильным аминокислотным остаткам, сначала расщепляли пептидную связь между Y143 и S144 с получением двухцепочечной молекулы, после чего расщепляли связь между Y42 и S43 с высвобождением N-концевого пептида F1-Y42. Последующая обработка расщепленной петли в такой двухцепочечной молекуле выполняется путем расщепления связи между F146 и D147 под действием химотрипсиноподобных протеаз и далее под действием карбоксипептидаз.
Описаны несколько методов получения аналогов hGH, стабилизированных против протеолитического разрушения.
Используя специфические точечные мутации, Alam и соавт. (J. Biotech. 65, 183-190 (1998)) сконструировали мутанты hGH, устойчивые к тромбину и плазмину. Тромбин специфически расщепляет hGH между R134 и Т135, и двойная мутация R134D, Т135Р приводила к получению варианта hGH, устойчивого к расщеплению тромбином, а тройная мутация R134D, Т135Р, K140A приводила к устойчивости к плазмину. Кроме того, последний мутант hGH был устойчив к протеолизу под действием плазмы крови человека в течение 7 суток.
В ЕР534568 описываются мутанты hGH, стабилизированные против протеолитического разрушения посредством изменения R134 на аланин, лейцин, треонин, фенилаланин, пролин или гистидин.
В WO2004022593/Nautilus описываются общие высокопроизводительные способы получения модифицированных цитокинов с применением направленной эволюции, в том числе вариантов GH, с повышенной протеолитической стабильностью.
В WO2006048777/Nautilus конкретно описываются модифицированные аналоги hGH с улучшенной протеолитической стабильностью. Эти аналоги содержат от одной до пяти мутаций в положениях 1-55, 57, 58, 60-63, 67-87, 89-91, 93, 95-100, 102-128, 131-132, 135-139, 141, 142, 144, 148-182, 184, 185 и 187-191. Введение остатков цистеина теоретически может приводить к образованию нежелательных связанных дисульфидными связями димеров, и в WO2006048777 замена аминокислотных остатков на цистеин особо исключена из объема изобретения; в WO2006048777 (стр.65) сформулировано: "Замена аминокислот на остатки цистеина однозначно не допускается, поскольку такая замена теоретически будет приводить к образованию межмолекулярных дисульфидных связей".
Существует очевидная необходимость в разработке соединений hGH, которые устойчивы к протеолитическому разрушению. Такие стабилизированные соединения будут демонстрировать повышенную стабильность к протеолитическому расщеплению при сохранении желаемых биологических свойств hGH. Такие молекулы GH будут иметь повышенную стабильность, замедленный клиренс и/или продолжительный полупериод существования in vivo.
Кроме того, обычно необходимо, чтобы белковые терапевтические средства были введены внутривенно или подкожно, поскольку обычно они не обладают достаточной пероральной доступностью. Низкая пероральная биодоступность белков частично обусловлена протеолитическим разрушением в желудочно-кишечном тракте. Поэтому также существует необходимость в разработке соединений hGH, которые можно вводить перорально для лечения hGH-ассоциированных расстройств.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям hGH, содержащим дополнительные дисульфидные связи. В соединения hGH по настоящему изобретению введен по меньшей мере один дополнительный остаток цистеина посредством изменения по меньшей мере одной из аминокислот в последовательности hGH дикого типа на цистеин. В соединениях hGH по настоящему изобретению сайты мутации выбраны таким образом, что (1) введенный(ые) остаток(ки) цистеина подходящим образом размещается(ются) в пространственной структуре свернутого белка, чтобы давать возможность образовываться дополнительным дисульфидным связям, не присутствующим в белке дикого типа, (2) нативная структура hGH не искажается, (3) соединение hGH демонстрирует повышенную стабильность к протеолитическому расщеплению по сравнению с hGH дикого типа или другие улучшенные функциональные характеристики и (4) соединение hGH сохраняет желаемые биологические активности, ассоциированные с hGH дикого типа. Такие дисульфидные варианты соединений hGH, устойчивые к протеолитическому разрушению в желудочно-кишечном тракте, могут быть разработаны в виде перорально вводимых лекарственных средств для лечения hGH-ассоциированных расстройств.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг.1
Структура hGH в связанном состоянии с двумя копиями hGH-связывающего белка (1HWG в PDB). Четыре основные спирали в hGH показаны темно-серым цветом и отмечены как Н1-Н4. Направления (N→С-конец) указаны стрелками. N- и С-концы hGH отмечены как N и С, соответственно. Две дисульфидные связи, соединяющие С53 с С165 и С182 с С189, соответственно, представлены черными палочками и шариками. Также отмечены остатки L128 и D154, представляющие собой первый и последний остатки, соответственно, в длинной гибкой петле, соединяющей Н3 и Н4.
Фиг.2
Аминокислотная последовательность hGH дикого типа с четырьмя основными спиралями (Н1-Н4), выделенными другим цветом и отмеченными. Также отмечены три петли (L1-L3), соединяющие основные спирали. Определения спиралей относятся к hGH в комплексе со своим связывающим белком (1HWG в PDB).
Фиг.3
Зависимость протеолитического расщепления hGH дикого типа и соединений hGH с дополнительными дисульфидными связями от времени. Используют следующие протеазы: химотрипсин (панель А) и эластазу (панель В). Анализ выполняют, как описано в Примере 5. Количество интактного белка (в % относительно t=0) отложено в зависимости от времени инкубации. Величины T½ (часы), полученные аппроксимацией данных к одноэкспоненциальным зависимостям, приведены в таблицах.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к стабильным соединениям hGH, имеющим дополнительные дисульфидные связи. Дисульфидные связи образуются между парами цистеинов, из которых один или оба введены посредством точечных мутаций в последовательность hGH дикого типа. Сайты мутации выбирают таким образом, чтобы введенные остатки цистеина подходящим образом размещались в пространственной структуре свернутого белка для возможного образования дисульфидной связи. Если введен только один цистеин, то его партнер при образовании дисульфидной связи будет включать один из четырех остатков цистеина, имеющихся в hGH дикого типа. Свернутый белок с дополнительной дисульфидной связью может быть получен в результате экспрессии соответствующего цистеинового мутанта hGH в растворимой форме подходящим организмом хозяина или извлечен из телец включения с использованием стандартных условий для рефолдинга соединений гормона роста, которые хорошо известны специалисту в данной области (Cabrita and Bottomley, Biotechnology Annual Review 10, 31-50 (2004)). Идентификации положений, являющихся кандидатами для введения дополнительных дисульфидных связей, могут способствовать вычислительные методы, например с использованием экспериментально установленной пространственной структуры hGH (код доступа 1HWG в PDB) в комплексе с двумя копиями связывающегося с ним белка. Выбор соответствующих положений для введения дисульфидной связи может быть основан на критериях расстояния и геометрии для дисульфидных связей, описанных в Dombkowski А., А., Bioinformatics 19, 1852-1853 (2003) и Petersen et al., Protein Eng. 12, 535-548 (1999).
Цистеиновые мутанты выбирают таким образом, чтобы введенные дисульфидные связи не искажали нативную структуру данного белка и оказывали минимальное негативное воздействие на желаемую биологическую активность, ассоциированную с hGH. Так, соединения конструируют таким образом, чтобы введенные дисульфидные связи не ослабляли взаимодействие с hGHR. Участки в hGH, важные для взаимодействия с рецептором, идентифицированы на основании 1HWG. Таким образом, при выборе соответствующих положений для введения дисульфидных связей, нейтральных в отношении биологической активности, можно руководствоваться анализом структуры 1HWG.
Можно выбрать такие цистеиновые мутанты, чтобы введенные дисульфидные связи обеспечивали повышенную стабильность к протеолитическому расщеплению. Предрасположенность белка к расщеплению протеазами отчасти определяется первичной аминокислотной последовательностью указанного белка. Протеазы могут быть относительно неспецифичны или могут распознавать, с различной степенью селективности, конкретные мотивы в первичной аминокислотной последовательности. Однако пространственная структура и динамические свойства молекулы белка, выступающего в качестве субстрата, сильно влияют на протеолитическую стабильность. Обладающие большой гибкостью и динамичностью петлевые структуры особенно уязвимы к катализируемому протеазами расщеплению, в то время как хорошо структурированные участки, как правило, в меньшей степени. Таким образом, защита против протеолитического расщепления может быть получена в результате стабилизации динамичных участков белка путем введения дисульфидных связей.
Один из аспектов изобретения относится к соединению гормона роста, содержащему дополнительные дисульфидные связи в SEQ ID No. 1. Как изложено в данном описании ниже, полипептид соединения гормона роста по изобретению предпочтительно имеет высокий уровень идентичности с человеческим гормоном роста, идентифицированным посредством SEQ ID No. 1 и, соответственно, соединение гормона роста содержит одну или более чем одну дополнительную дисульфидную связь(и) по сравнению с человеческим гормоном роста, который определен в SEQ ID No. 1.
В соответствии с этим согласно одному из воплощений настоящего изобретения предложены стабильные соединения GH, соответствующие SEQ ID No.1, сделанные устойчивыми к протеолитическому разрушению путем введения дополнительных дисульфидных связей.
В одном из воплощений, соответствующих изобретению, соединение гормона роста содержит дополнительные дисульфидные связи между по меньшей мере одной из пар аминокислот в положениях, соответствующих R16C/L117C, А17С/Е174С, Н21С/М170С, D26/V102C, D26/Y103C, N47C/T50C, Q49C/G161C, F54C/Y143C, F54C/S144C, F54C/F146C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, Р61С/Е66С, Р61С/T67C, S71C/S132C, L73C/S132C, L73C/F139C, R77C/I138C, R77C/F139C, L81C/Q141C, L81C/Y143C, Q84C/Y143C, Q84C/S144C, S85C/Y143C, S85C/S144C, P89C/F146C, F92C/F146C, F92C/T148C, R94C/D107C, V102C/A105C, L156C/F146C, L156C/T148C и/или V185C/S188C в SEQ ID No. 1.
В одном из воплощений настоящего изобретения соединение гормона роста содержит дополнительные дисульфидные связи между по меньшей мере одной из пар аминокислот в положениях, соответствующих R16C/L117C, А17С/Е174С, Н21С/М170С, N47C/T50C, Q49C/G161C, F54C/S144C, F54C/F146C, I58C/Q141C, I58C/S144C, P59C/Q137C, Р61С/Е66С, Р61С/T67C, S71C/S132C, L73C/S132C, L73C/F139C, R77C/I138C, R77C/F139C, L81C/Q141C, L81C/Y143C, Q84C/Y143C, S85C/Y143C, P89C/F146C, F92C/F146C, F92C/T148C, R94C/D107C, V102C/A105C, L156C/F146C, L156C/T148C и/или V185C/S188C в SEQ ID No. 1, но ими не ограничивается.
В одном из воплощений настоящего изобретения соединение гормона роста содержит дополнительные дисульфидные связи между по меньшей мере одной из пар аминокислот в положениях, соответствующих А17С/Е174С, Н21С/М170С, S71C/S132C, Q84C/Y143C и R94C/D107C в SEQ ID No. 1, но ими не ограничивается.
В одном из воплощений настоящего изобретения соединение гормона роста содержит дополнительную дисульфидную связь между парой аминокислот в положениях, соответствующих Q84C/Y143C в SEQ ID No. 1.
В одном из воплощений, соответствующих изобретению, соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих R16C/L117C, А17С/Е174С, Н21С/М170С, D26/V102C, D26/Y103C, N47C/T50C, Q49C/G161C, F54C/Y143C, F54C/S144C, F54C/F146C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, Р61С/Е66С, Р61С/Т67С, S71C/S132C, L73C/S132C, L73C/F139C, R77C/I138C, R77C/F139C, L81C/Q141C, L81C/Y143C, Q84C/Y143C, Q84C/S144C, S85C/Y143C, S85C/S144C, P89C/F146C, F92C/F146C, F92C/T148C, R94C/D107C, V102C/A105C, L156C/F146C, L156C/T148C и/или V185C/S188C в SEQ ID No. 1.
В одном из воплощений настоящего изобретения соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих R16C/L117C, А17С/Е174С, Н21С/М170С, N47C/T50C, Q49C/G161C, F54C/S144C, F54C/F146C, I58C/Q141C, I58C/S144C, P59C/Q137C, Р61С/Е66С, Р61С/Т67С, S71C/S132C, L73C/S132C, L73C/F139C, R77C/I138C, R77C/F139C, L81C/Q141C, L81C/Y143C, Q84C/Y143C, S85C/Y143C, P89C/F146C, F92C/F146C, F92C/T148C, R94C/D107C, V102C/A105C, L156C/F146C, L156C/T148C и/или V185C/S188C в SEQ ID No. 1, но ими не ограничивается.
В одном из воплощений настоящего изобретения соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих А17С/Е174С, Н21С/М170С, S71C/S132C, Q84C/Y143C и R94C/D107C в SEQ ID No. 1, но ими не ограничивается.
В одном из воплощений настоящего изобретения соединение гормона роста настоящего изобретения содержит одну пару мутаций, соответствующих положению Q84C/Y143C в SEQ ID No. 1.
В одном из воплощений настоящего изобретения протеолитической стабильности соединения гормона роста достигают путем введения дисульфидной связи между петлевым сегментом и спиральной структурой.
В одном из воплощений настоящего изобретения протеолитической стабильности соединения гормона роста достигают путем введения дисульфидной связи в пределах петлевого сегмента.
В одном из воплощений настоящего изобретения протеолитической стабильности соединения гормона роста достигают путем введения дисульфидной связи между петлевыми сегментами.
В одном из воплощений настоящего изобретения протеолитической стабильности соединения гормона роста достигают путем введения дисульфидной связи между спиралями.
В одном из воплощений настоящего изобретения по меньшей мере одна из введенных дисульфидных связей связывает два остатка цистеина в соединении гормона роста, при этом по меньшей мере один из указанных остатков цистеина не присутствует в hGH дикого типа.
В одном из воплощений настоящего изобретения введенные дисульфидные связи соединения гормона роста расположены между остатками цистеина, которые выбраны с учетом критериев расстояния и геометрии, описанных в Dombkowski A., A., Bioinformatics 19, 1852-1853 (2003) и Petersen et al., Protein Eng. 12(7), 535-548 (1999).
В одном из воплощений настоящего изобретения введенная дисульфидная связь(и) соединения гормона роста стабилизирует(ют) петлю, соединяющую НЗ и Н4 (L3, остатки 128-154), то есть по меньшей мере один из цистеинов во введенной дисульфидной связи располагается в сегменте, содержащем остатки 128-154 (Фиг.1 и 2).
| Таблица 1 | |||
| Первая аминокислота, определенная путем выравнивания последовательности с SEQ ID No. 1 | Вторая аминокислота, определенная путем выравнивания последовательности с SEQ ID No. 1 | Соединенные сегменты вторичной структуры а | |
| 1. | 16 | 117 | Н1-Н3 |
| 2. | 17 | 174 | Н1-Н4 |
| 3. | 21 | 170 | Н1-Н4 |
| 4. | 26 | 102 | H1-L2 |
| 5. | 26 | 103 | H1-L2 |
| 6. | 47 | 50 | L1-L1 |
| 7. | 49 | 161 | L1-L1 |
| 8. | 54 | 143 | L1-L3 |
| 9. | 54 | 144 | L1-L3 |
| 10. | 54 | 146 | L1-L3 |
| 11. | 55 | 143 | L1-L3 |
| Первая аминокислота, определенная путем выравнивания последовательности с SEQ ID No. 1 | Вторая аминокислота, определенная путем выравнивания последовательности с SEQ ID No. 1 | Соединенные сегменты вторичной структуры а | |
| 12. | 57 | 143 | L1-L3 |
| 13. | 58 | 141 | L1-L3 |
| 14. | 58 | 143 | L1-L3 |
| 15. | 58 | 144 | L1-L3 |
| 16. | 59 | 137 | L1-L3 |
| 17. | 61 | 66 | L1-L1 |
| 18. | 61 | 67 | L1-L1 |
| 19. | 71 | 132 | L1-L3 |
| 20. | 73 | 132 | H2-L3 |
| 21. | 73 | 139 | H2-L3 |
| 22. | 77 | 138 | H2-L3 |
| 23. | 77 | 139 | H2-L3 |
| 24. | 81 | 141 | H2-L3 |
| 25. | 81 | 143 | H2-L3 |
| 26. | 84 | 143 | H2-L3 |
| 27. | 84 | 144 | H2-L3 |
| 28. | 85 | 143 | H2-L3 |
| 29. | 85 | 144 | H2-L3 |
| 30. | 89 | 146 | H2-L3 |
| 31. | 92 | 146 | H2-L3 |
| 32. | 92 | 148 | H2-L3 |
| 33. | 94 | 107 | Н2-Н3 |
| 34. | 102 | 105 | L2-H3 |
| 35. | 156 | 146 | H4-L3 |
| 36. | 156 | 148 | H4-L3 |
| 37. | 185 | 188 | Ct-Ct |
| а) Н1-H4 относится к спирали 1-4, L1-L3 относится к петлям 1-3, a Ct относится к C-концевому сегменту. |
Как описано выше, изобретение относится к соединению гормона роста, содержащему дополнительную дисульфидную связь между петлевым сегментом и спиральным сегментом, или в пределах петлевого сегмента, или между петлевыми сегментами, или между спиральными сегментами полипептида. Расположение любой такой дополнительной дисульфидной связи описано, с учетом задачи данной заявки, со ссылкой на полипептид hGH, который определен в SEQ ID No. 1.
В одном из воплощений соединение гормона роста по изобретению содержит по меньшей мере одну пару мутаций, соответствующих R16C/L117C, А17С/Е174С, Н21С/М170С, D26/V102C, D26/Y103C, N47C/T50C, Q49C/G161C, F54C/Y143C, F54C/S144C, F54C/F146C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, Р61С/Е66С, Р61С/Т67С, S71C/S132C, L73C/S132C, L73C/F139C, R77C/I138C, R77C/F139C, L81C/Q141C, L81C/Y143C, Q84C/Y143C, Q84C/S144C, S85C/Y143C, S85C/S144C, P89C/F146C, F92C/F146C, F92C/T148C, R94C/D107C, V102C/A105C, L156C/F146C, L156C/T148C и/или V185C/S188C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих А17С/Е174С, Н21С/М170С, D26/V102C, D26/Y103C, F54C/Y143C, F54C/S144C, F54C/F146C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, S71C/S132C, L81C/Y143C, Q84C/Y143C, S85C/Y143C, S85C/S144C, F92C/T148C и/или R94C/D107C в SEQ ID No.1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих А17С/Е174С, Н21С/М170С, F54C/S144C, F54C/F146C, I58C/Q141C, I58C/S144C, P59C/Q137C, S71C/S132C, L81C/Y143C, Q84C/Y143C, S85C/Y143C, F92C/T148C и/или R94C/D107C в SEQ ID No. 1.
Одно из воплощений, соответствующих изобретению, относится к соединению гормона роста, содержащему дополнительную дисульфидную связь, при этом по меньшей мере один из цистеинов присутствует в L3 (АА (аминокислоты) 128-154 в SEQ ID No. 1) или, например, в средней части этой петли, определенной посредством АА 135-148, или в соответствующих аминокислотных остатках.
В одном из воплощений соединения гормона роста по меньшей мере один из цистеинов дополнительной дисульфидной связи присутствует в L3 в положении, соответствующем АА141, АА142, АА143, АА144, АА145 или АА146, предпочтительно AA143 или AA144 в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих F54C/Y143C, F54C/S144C, F54C/F146C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, S71C/S132C, L73C/S132C, L73C/F139C, R77C/I138C, R77C/F139C, L81C/Q141C, L81C/Y143C, Q84C/Y143C, Q84C/S144C, S85C/Y143C, S85C/S144C, P89C/F146C, F92C/F146C и/или F92C/T148C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих F54C/Y143C, F54C/S144C, F54C/F146C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, S71C/S132C, L81C/Y143C, Q84C/Y143C, S85C/Y143C, S85C/S144C и/или F92C/T148C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих F54C/S144C, F54C/F146C, I58C/Q141C, I58C/S144C, P59C/Q137C, S71C/S132C, L81C/Y143C, Q84C/Y143C, S85C/Y143C и/или F92C/T148C в SEQ ID No. 1.
Одно из воплощений, соответствующих изобретению, относится к соединению гормона роста, содержащему дополнительную дисульфидную связь, соединяющую L3 с L1.
В одном из воплощений соединение гормона роста содержит дополнительную дисульфидную связь, соединяющую аминокислотный остаток, соответствующий АА54, АА55, АА56, АА57, АА58 или АА59 в L3, с аминокислотой, соответствующей АА143 или АА144 в L1 в SEQ ID No. 1.
В одном из воплощений соединение гормона роста по изобретению содержит по меньшей мере одну пару мутаций, соответствующих F54C/Y143C, F54C/S144C, F54C/F146C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C и/или S71C/S132C в SEQ ID No. 1.
В одном из воплощений гормон роста содержит по меньшей мере одну пару мутаций, соответствующих F54C/S144C, F54C/F146C, I58C/Q141C, I58C/S144C, P59C/Q137C и/или S71C/S132C в SEQ ID No. 1.
Одно из воплощений, соответствующих изобретению, относится к соединению гормона роста, содержащему дополнительную дисульфидную связь, соединяющую L3 со спиральным сегментом, таким как спираль 2 (Н2).
В одном из воплощений соединение гормона роста содержит дополнительную дисульфидную связь, соединяющую аминокислотный остаток, соответствующий АА84 или АА85 в Н2, с аминокислотой, соответствующей АА143 или АА144 в L3 в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих L73C/S132C, L73C/F139C, R77C/I138C, R77C/F139C, L81C/Q141C, L81C/Y143C, Q84C/Y143C, Q84C/S144C, S85C/Y143C, S85C/S144C, P89C/F146C, F92C/F146C и F92C/T148C в SEQ ID No 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих L81C/Y143C, Q84C/Y143C, S85C/Y143C, S85C/S144C и/или F92C/T148C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих L81C/Y143C, Q84C/Y143C, S85C/Y143C и/или F92C/T148C в SEQ ID No. 1.
Одно из воплощений, соответствующих изобретению, относится к соединению гормона роста, содержащему дополнительную дисульфидную связь, соединяющую L2 со спиралью 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих D26C/V102C или D26C/Y103C.
Что касается дисульфидных мостиков между двумя остатками цистеина, то остатки цистеина можно ввести в любой из участков или в любое из положений, которые описаны ранее, или провести по ним замены на остатки цистеина с тем, чтобы способствовать образованию одной или более введенных дисульфидных связей, как будет необходимо. Замены и вставки аминокислотных остатков могут быть выполнены стандартными методами, известными специалисту в данной области.
В соответствии с данным изобретением одну или более чем одну дополнительную дисульфидную связь(и) вводят путем осуществления аминокислотной замены по меньшей мере двух аминокислот по сравнению с SEQ ID No. 1. В следующем воплощении соединение содержит точно одну дополнительную дисульфидную связь по сравнению с SEQ ID No. 1. В одном из воплощений соединение по изобретению содержит по меньшей мере 2 аминокислотные замены по сравнению с SEQ ID No. 1. В одном из следующих воплощений соединение содержит точно 2 аминокислотные замены по сравнению с SEQ ID No. 1. В одном из воплощений полипептид соединения гормона роста по изобретению содержит по меньшей мере два дополнительных цистеина по сравнению с человеческим гормоном роста, который определен в SEQ ID No. 1. В следующем воплощении полипептид содержит точно два дополнительных цистеина по сравнению с человеческим гормоном роста, который определен в SEQ ID No. 1.
В одном из воплощений настоящего изобретения соединение гормона роста, в дополнение к образованию дополнительных дисульфидных связей, химически модифицировано посредством присоединения таких группировок, как ПЭГ, углеводы, альбумин-связывающие вещества, жирные кислоты, алкильные цепи, липофильные группы, витамины, желчные кислоты, но ими не ограничиваясь; или спейсеров к боковой цепи или основной цепи соединения гормона роста.
В одном из воплощений настоящего изобретения соединение гормона роста химически модифицировано по сравнению с hGH с целью облегчения транспорта сквозь эпителий.
В одном из воплощений настоящего изобретения соединение гормона роста по настоящему изобретению химически модифицировано с целью получения пролонгированной продолжительности действия in vivo.
В одном из воплощений настоящего изобретения соединение гормона роста химически модифицировано с целью получения пролонгированной продолжительности полупериода функционального существования in vivo.
В одном из воплощений настоящего изобретения химические модификации соединения гормона роста также могут носить временный характер, то есть они легко могут быть удалены in vivo.
В одном из воплощений настоящего изобретения модификации соединения гормона роста могут быть осуществлены по любому аминокислотному остатку без влияния на связывание соединения гормона роста с hGHR.
В одном из воплощений настоящего изобретения соединение гормона роста обладает повышенной стабильностью к протеолитическому расщеплению.
В одном из воплощений настоящего изобретения соединение гормона роста обладает повышенной стабильностью к протеолитическому разрушению под действием панкреатической протеазы.
В одном из воплощений настоящего изобретения соединение гормона роста обладает повышенной стабильностью к протеолитическому разрушению под действием протеаз, присутствующих в желудочно-кишечном тракте.
В одном из воплощений настоящего изобретения соединение гормона роста обладает повышенной стабильностью к протеолитическому разрушению под действием протеаз, присутствующих в плазме млекопитающих.
Одно из воплощений настоящего изобретения относится к соединению гормона роста, содержащему одну или более чем одну дополнительную дисульфидную связь(и), которое стабилизировано против разрушения под действием протеаз(ы), таких как пищеварительные протеазы, как, например, пепсин, трипсин, химотрипсин, карбоксипептидаза и/или эластазы.
В одном из воплощений настоящего изобретения соединение гормона роста обладает повышенной стабильностью к протеолитическому разрушению под действием трипсина, химотрипсина и/или эластазы.
В одном из воплощений соединение гормона роста стабилизировано против разрушения под действием химотрипсина и/или эластазы.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих Н21/М170, D26/V102C, D26/Y103C, F54C/Y143C, F54C/S144C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/Y143C, I58C/S144C, P59C/Q137C, S71C/S132C, L81C/Y143C, Q84C/Y143C, S85C/Y143C и/или S85C/S144C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих Н21/М170, F54C/S144C, S55C/Y143C, S57C/Y143C, I58C/Q141C, I58C/S144C, P59C/Q137C, S71C/S132C, L81C/Y143C, Q84C/Y143C и/или S85C/Y143C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих D26/V102C, D26/Y103C, S57C/Y143C, I58C/S144C, P59C/Q137C, S71C/S132C, Q84C/Y143C, S85C/Y143C, S85C/S144C, F92C/T148C и/или R94C/D107C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих I58C/S144C, P59C/Q137C, S71C/S132C, Q84C/Y143C, S85C/Y143C, F92C/T148C и/или R94C/D107C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих S57C/Y143C, Q84C/Y143C, S85C/Y143C и/или S85C/S144C в SEQ ID No. 1.
В одном из воплощений соединение гормона роста содержит по меньшей мере одну пару мутаций, соответствующих Q84C/Y143C и/или S85C/Y143CB SEQ ID No. 1.
В одном из воплощений настоящего изобретения соединение гормона роста имеет увеличенный полупериод существования in vivo.
В одном из воплощений настоящего изобретения соединение гормона роста имеет увеличенный срок хранения.
В одном из воплощений настоящего изобретения соединение гормона роста может представлять собой слитый белок.
Одно из воплощений настоящего изобретения относится к соединению гормона роста, полипептидная последовательность которого по меньшей мере на 80%, как например на 90%, или как например на 95% идентична hGH, определенному посредством SEQ ID No. 1. В следующих воплощениях полипептид на 96%, 97%, 98% или 99% идентичен hGH, определенному посредством SEQ ID No.1.
В одном из воплощений настоящего изобретения соединение гормона роста представляет собой полипептид, содержащий аминокислотную последовательность, идентичную по меньшей мере на 20%, как например по меньшей мере на 30%, например по меньшей мере на 40%, как например по меньшей мере на 50%, например по меньшей мере на 60%, как например по меньшей мере на 70%, например по меньшей мере на 80%, как например по меньшей мере на 90%, идентичную, например по меньшей мере на 95%, как например по меньшей мере на 96%, например по меньшей мере на 97%, как например по меньшей мере на 98%, например по меньшей мере на 99% с SEQ ID No. 1, и при этом данный полипептид обладает активностью, измеренной в анализе, описанном в Примере 3 и Примере 3А (гипофизэктомированные крысы), составляющей по меньшей мере 1%, как например по меньшей мере 5%, например по меньшей мере 10%, как например по меньшей мере 25% от активности hGH. Во избежание неясности следует отметить, что соединение гормона роста по изобретению также может обладать более высокой активностью в этих анализах, чем hGH. Если соединение гормона роста некоторым образом модифицировано, то активность гормона роста по отношению к hGH следует измерять на немодифицированном соединении гормона роста, поскольку такая модификация может существенно менять активность. Например, в случае соединения гормона роста, модифицированного с использованием модифицирующей его свойства группы, которая пролонгирует полупериод функционального существования in vivo соединения гормона роста, активность такого модифицированного соединения гормона роста может быть много ниже активности hGH, причем это уменьшение компенсируется пролонгированным временем удержания в организме. В одном из воплощений соединение гормона роста представляет собой фрагмент такого полипептида, и в этом фрагменте сохранено значительное количество активности гормона роста, как описано выше.
В одном из воплощений настоящего изобретения соединение гормона роста представляет собой укороченный вариант hGH, то есть один или более аминокислотных остатков с N- и/или С-концов соответствующей SEQ No. 1 делегированы при сохранении указанным соединением желаемых биологических свойств hGH дикого типа.
Одно из воплощений настоящего изобретения относится к соединению гормона роста, содержащему дополнительные дисульфидные связи в SEQ ID No. 1 или содержащему одну или более чем одну дополнительную дисульфидную связь(и) по сравнению с человеческим гормоном роста, который определен в SEQ ID No. 1, при этом указанное соединение обладает активностью in vitro, сравнимой с активность in vitro hGH, определенного посредством SEQ ID No. 1. Активность in vitro соединений гормона роста предпочтительно измеряют в BAF-анализе, который изложен в данном описании в Примере 3. В одном из воплощений соединение по изобретению может иметь активность in vitro, отличающуюся от активности in vitro hGH. Как описано выше, более низкая активность in vitro может быть скомпенсирована другими функциональными свойствами in vivo. В одном из воплощений активность in vitro может составлять, например, по меньшей мере 1%, как например по меньшей мере 5%, например по меньшей мере 10%, как например по меньшей мере 25% от активности hGH. В следующем воплощении отношение ЕС50 для соединения к EC50 для hGH дикого типа, определенного посредством SEQ ID No. 1, составляет не более 10, не более 8, не более 6, не более 4, не более 2. В одном из воплощений отношение EC50 для указанного соединения к ЕС50 для hGH дикого типа, определенного посредством SEQ ID No. 1, составляет 5-0,01 или, например, 3-0,01, или составляет, например, 2-0,01. В альтернативном случае EC50 в соответствии с данным изобретением может быть измерена в анализе с использованием поверхностного плазменного резонанса (Biacore), как описано в Примере 4. В соответствующих воплощениях активность in vitro, определенная с помощью Biacore, может составлять, например, по меньшей мере 1%, как например по меньшей мере 5%, например по меньшей мере 10%, как например по меньшей мере 25% от активности hGH. В следующих воплощениях отношение EC50 для соединения к ЕС50 для hGH дикого типа, определенного посредством SEQ ID No. 1, определенное с помощью Biacore, составляет не более 10, не более 8, не более 6, не более 4, не более 2. В одном из воплощений отношение EC50 для указанного соединения к ЕС50 для hGH дикого типа, определенного посредством SEQ ID No. 1, составляет 5-0,01, или, например, 3-0,01, или, например, 2-0,01.
Другие примеры соединений GH, в которые могут быть введены дополнительные дисульфидные мостики, включают соединения, опсианные в WO 92/09690 (Genentech), US 6004931 (Genentech), US 6143523 (Genentech), US 613636 (Genentech), US 6057292 (Genentech), US 5849535 (Genentech), WO 97/11178 (Genentech), WO 90/04788 (Genentech), WO 02/055532 (Maxygen APS и Maxygen Holdings), US 5951972 (American Cynanamid Corporation), US 2003/0162949 (Bolder Biotechnologies, Inc.), которые в