Улучшенные аминокислотные последовательности против il-6r и содержащие их полипептиды для лечения связанных с il-6r заболеваний и нарушений
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к одиночному вариабельному домену, направленному против IL-6R, к полипептиду и конструкции, направленным против IL-6R, содержащим указанный одиночный вариабельный домен, а также к способам их получения. Раскрыты нуклеиновые кислоты, кодирующие вышеуказанный одиночный вариабельный домен, полипептид и конструкцию, а также генетические конструкции, содержащие вышеуказанные нуклеиновые кислоты. Описаны клетки-хозяева и организмы хозяева, содержащие вышеуказанные нуклеиновые кислоты. Изобретение также охватывает композицию для блокирования взаимодействия IL-6/IL-6R, содержащую эффективное количество описанного одиночного вариабельного домена, полипептида, конструкции, нуклеиновой кислоты или генетической конструкции. Также раскрыт способ профилактики и/или лечения по меньшей мере одного из заболеваний или расстройств, связанных с IL-6, IL-6R, комплексом IL-6/IL-6R и/или сигнальными путями, в которые вовлечен IL-6, IL-6R или комплекс IL-6/IL-6R и/или биологическими функциями и реакциями, в которых участвует IL-6, IL-6R или комплекс IL-6/IL-6R с использованием описанного одиночного вариабельного домена, полипептида, конструкции или композиции. Изобретение позволяет эффективно с увеличенной афинностью и биологической активностью блокировать взаимодействие IL-6/IL-6R. 14 н. и 11 з.п. ф-лы, 70 ил., 56 табл., 61 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к аминокислотным последовательностям, направленным против и/или способным специфически связываться (как определено здесь) с рецептором интерлейкина-6 (IL-6R), а также к соединениям или конструкциям, в частности белкам и полипептидам, содержащим или в основном состоящим из одной или нескольких таких аминокислотных последовательностей (которые также именуются как "аминокислотные последовательности изобретения", "соединения изобретения", "конструкции изобретения" и "полипептиды изобретения", соответственно).
Изобретение также имеет отношение к нуклеиновым кислотам, кодирующим такие аминокислотные последовательности и полипептиды (которые также именуются как "нуклеиновые кислоты изобретения" или "нуклеотидные последовательности изобретения"); способам получения таких аминокислотных последовательностей и полипептидов; клеткам-хозяевам, экспрессирующим или способным экспрессировать такие аминокислотные последовательности или полипептиды; композициям, в частности фармацевтическим композициям, содержащим такие аминокислотные последовательности, полипептиды, нуклеиновые кислоты и/или клетки-хозяева; а также к применению таких аминокислотных последовательностей или полипептидов, нуклеиновых кислот, клеток-хозяев и/или композиций, в частности, для профилактики, терапевтических или диагностических целей, как-то профилактики, терапевтических или диагностических целей, указанных в настоящем изобретении.
Другие аспекты, воплощения, преимущества и применения изобретения станут ясными из дальнейшего описания.
Уровень техники
Взаимодействие IL-6-белка, первоначально идентифицированного как фактор дифференцировки В-клеток (Hirano et al., 1985, Proc. Natl. Acad. Sci. USA, 82: 5490-4; EP 0257406), с рецептором IL-6R (Yamasaki et al., 1988, Science, 241: 825-8; EP 0325474) приводит к образованию комплекса IL-6/IL-6R. Этот комплекс связывается с gp130 (Taga et al., 1989, Cell, 58; 573-81; EP 0411946), мембранным белком на клетке мишени, который передает различные физиологические действия IL-6. В настоящее время известно, что IL-6 участвует, среди прочего, в регуляции иммунного ответа, гемопоэза, острой фазы ответа, метаболизма костей, ангиогенеза и воспаления. Дерегулирование продукции IL-6 влечет за собой патологические процессы некоторых аутоиммунных и хронических воспалительных пролиферативных заболеваний (Ishihara and Hirano, 2002, Biochim. Biophys. Acta, 1592: 281-96). Вследствие этого ингибиторы индуцируемого IL-6 сигнализирования в прошлом привлекали большое внимание (Hirano et al., 1990, Immunol. Today, 11: 443-9). Полипептиды, специфически связывающиеся с IL-6 (Klein et al., 1991, Blood, 78: 1198-204; EP 0312996), IL-6R (EP 0409607) или gp130 (Saito et al., 1993, J. Immunol. Methods, 163: 217-223; EP 0572118), как оказалось, проявляют существенный ингибиторный эффект на функционирование IL-6.
Суперпродукция IL-6 и сигнализирование (в частности, так называемое транссигнализирование) вовлечены в различные заболевания и нарушения, такие как сепсис (Stames et al., 1999, J. Immunol., 148: 1968), различные формы рака, как-то множественная миелома (ММ), почечно-клеточная карцинома (RCC), плазмоцитарная лейкемия (Klein et al., 1991), лимфома, В-лимфопролиферативные нарушения (BLPD) и рак простаты. Неограничительные примеры других заболеваний, вызванных избыточной продукцией IL-6 или сигнализированием, включают резорбцию костей (остеопороз) (Roodman et al., 1992, J. Bone Miner. Res., 7: 475-8; Jilka et al„ 1992, Science, 257: 88-91), кахексию (Strassman et al., 1992, J. Clin. Invest. 89: 1681-1684), псориаз, мезангиальный пролиферативный гломерулонефрит, саркому Капоши, связанную со СПИДом лимфому (Emilie et al., 1994, Int. J. Immunopharmacol. 16: 391-6), воспалительные заболевания и нарушения, такие как ревматоидный артрит, системный юношеский идиопатический артрит, гипергаммаглобулинемия (Grau et al., 1990, J. Exp. Med. 172: 1505-8); болезнь Крона, язвенный колит, системная красная волчанка (SLE), рассеянный склероз, болезнь Кэстлмана, IgM-гаммопатия, миксома сердца, астма (в частности аллергическая астма) и аутоиммунный инсулинозависимый сахарный диабет (Campbell et al., 1991, J. Clin. Invest. 87: 739-742). Другие связанные с IL-6 заболевания должны быть известны специалистам в этой области.
Как можно видеть, к примеру, из вышеприведенных работ, на предшествующем уровне техники описаны антитела и фрагменты антител против IL-6 человека, против IL-6R человека и против белка gp130 человека для профилактики и лечения связанных с IL-6 заболеваний. Их примерами являются Tocilizumab (см. Woo et al., 2005, Arthritis Res. Ther. 7: 1281-8; Nishimoto et al., 2005, Blood 106: 2627-32; Ito et al., 2004, Gastroenterology, 126: 989-96; Choy et al., 2002, Arthritis Rheum. 46: 3143-50), BE8 (см. Bataille et al., 1995, Blood 86: 685-91; Emilie et al., 1994, Blood 84: 2472-9; Beck et al., 1994, N. Engl. J. Med. 330: 602-5; Wendling et al., 1993, J. Rheumatol. 20: 259-62) и CNTO-328 фирмы Centocor (см. Journal of Clinical Oncology, 2004, 22/14S: 2560; Journal of Clinical Oncology, 2004, 22/14S: 2608; Int. J. Cancer, 2004, 111:592-5). Другим активным элементом, известным в этой области для профилактики и лечения связанных с IL-6 заболеваний, является продукт слияния Fc и растворимого gp130 (см. Becker et al. 2004, Immunity, 21: 491-501; Doganci et al., 2005, J. Clin. Invest. 115: 313-25; Nowell et al., 2003, J. Immunol. 171: 3202-9; Atreya et al., 2000, Nat. Med. 6: 583-8). Аминокислотные последовательности и нанотела, направленные против IL-6R, и содержащие их полипептиды описаны в WO 08/020079.
Сущность изобретения
Конкретной, но не ограничительной целью настоящего изобретения является обеспечение аминокислотных последовательностей, полипептидов и терапевтических соединений и композиций, обладающих улучшенными терапевтическими и/или фармакологическими свойствами, наряду с другими полезными свойствами (такими, к примеру, как большая легкость получения и/или снижение стоимости товаров), по сравнению с аминокислотными последовательностями, антителами и нанотелами предшествующего уровня техники. Эти улучшенные и полезные свойства станут понятными из дальнейшего описания. Не налагая каких-либо ограничений, аминокислотные последовательности, полипептиды и терапевтические соединения и композиции, предусмотренные изобретением, могут обладать лучшим связыванием и/или сродством, лучшей авидностью, лучшей эффективностью и/или активностью, большей избирательностью и/или они могут быть способны частично или предпочтительно полностью блокировать взаимодействие IL-6/IL-6R и/или ингибировать сигнализирование через IL-6, IL-6R и/или комплекс IL-6/IL-6R.
В общем, целью изобретения является обеспечение фармакологически активных средств, а также содержащих их композиций, которые могут применяться при диагностике, профилактике и/или лечении одного или нескольких связанных с IL-6 заболеваний (как определено здесь); и обеспечение способов диагностики, профилактики и/или лечения таких заболеваний и/или нарушений, которые включают введение и/или применение таких средств и композиций.
Настоящее изобретение касается аминокислотных последовательностей (также именуемых "аминокислотные последовательности изобретения"), направленных против и/или способных специфически связываться (как определено здесь) с рецептором интерлейкина-6 (IL-6R) с лучшим сродством и/или авидностью и/или обладающих лучшей эффективностью и/или активностью и способных (частично или предпочтительно полностью) блокировать взаимодействие IL-6/IL-6R и/или ингибировать проведение сигнала через IL-6, IL-6R и/или комплекс IL-6/IL-6R. Более конкретно, настоящим изобретением предусмотрены аминокислотные последовательности, которые содержат один или несколько участков аминокислотных остатков, выбранных из следующего:
a) SEQ ID NO's:80-82; или
b) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:80-82, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса;
и/или
c) SEQ ID NO's:84-91; или
d) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:84-91, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазмонного резонанса;
и/или
e) SEQ ID NO's:93-95; или
f) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:93-95, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса.
Для связывания со своим эпитопом на IL-6R аминокислотная последовательность обычно должна содержать в пределах своей аминокислотной последовательности один или несколько аминокислотных остатков либо один или несколько участков аминокислотных остатков (определенных в нем далее; при этом каждый "участок" содержит один или несколько аминокислотных остатков, расположенных рядом друг с другом или в близком соседстве друг с другом, т.е. в первичной или третичной структуре аминокислотной последовательности), через которые аминокислотная последовательность изобретения может связываться с эпитопом на IL-6R. Эти аминокислотные остатки или участки аминокислотных остатков тем самым образуют "сайт" для связывания с эпитопом на IL-6R (который также именуется здесь как "антигенсвязывающий сайт", как определено далее).
Настоящим изобретением предусмотрен целый ряд участков аминокислотных остатков (определенных в нем), которые особенно подходят для связывания с определенньм эпитопом на IL-6R. Эти участки аминокислотных остатков могут находиться в и/или могут быть включены в аминокислотную последовательность изобретения, в частности таким образом, что они образуют (входят в состав) антигенсвязывающий сайт аминокислотной последовательности изобретения. Полученные при этом аминокислотные последовательности связываются с определенным эпитопом на IL-6R, который лежит в, образует часть или совпадает с (т.е. в первичной или третичной структуре) или находится в близком соседстве с (т.е. в первичной или третичной структуре) сайтом связывания IL-6 на IL-6R (к примеру, конкурентно с IL-6); и при этом полученные аминокислотные последовательности способны частично или предпочтительно полностью блокировать взаимодействие IL-6/IL-6R и/или ингибировать прохождение сигнала через IL-6, IL-6R и/или комплекс IL-6/IL-6R. В этом плане аминокислотные последовательности и полипептиды изобретения предпочтительно таковы, что они могут конкурировать с IL-6 за связывание с рецептором IL-6. Аминокислотные последовательности и полипептиды изобретения предпочтительно таковы, что они могут конкурировать за связывание с рецептором IL-6 с коммерчески доступным перестроенным химерным моноклональным антителом человека-мыши против IL-6R Tocilizumab (MRA) (Chugai/Roche) или его антиген-связывающим фрагментом (к примеру, см. WO 92/19759 и соответствующий Европейский патент ЕР 0628639, а также Shinkura et al., 1998, Anticancer Research 18, 1217-1222), например, в методе, описанном в Примере 11; и/или таковы, что они могут связываться с тем же самым эпитопом или сайтом связывания на IL-6R, что и Tocilizumab, либо с эпитопом, находящимся рядом с данным сайтом связывания и/или перекрывающимся с данным сайтом связывания.
Также аминокислотные последовательности изобретения предпочтительно таковы, что они могут конкурировать за связывание с рецептором IL-6 с контрольным IgG, приведенным в SEQ ID NO's:1 и 2, и/или с контрольным Fab, приведенным в SEQ ID NO's:3 и 4 (см. Пример 1); и/или таковы, что они могут связываться с тем же эпитопом или сайтом связывания на IL-6R, что и контрольный IgG или контрольный Fab, либо с эпитопом, расположенным рядом с данным сайтом связывания и/или перекрывающимся с данным сайтом связывания. Насчет получения и последовательности контрольного IgG и контрольного Fab следует обратиться к нижеприведенному Примеру 1, а также к SEQ ID NO's:1-4.
Следует отметить, что изобретение в самом широком смысле не ограничивается специфической структурной ролью или функцией, которые эти участки аминокислотных остатков могут иметь в аминокислотной последовательности изобретения, если только эти участки аминокислотных остатков позволяют аминокислотной последовательности изобретения связываться со специфическим эпитопом на IL-6R с определенным сродством и/или силой (как определено далее). Таким образом, в целом изобретение в самом широком смысле включает любые аминокислотные последовательности, которые способны связываться со специфическим эпитопом на IL-6R и которые содержат один или несколько участков аминокислотных остатков, описанных в нем (в частности, и подходящие комбинации из двух или нескольких участков аминокислотных остатков), которые соответствующим образом соединяются друг с другом через одну или несколько дополнительных аминокислотных последовательностей таким образом, что вся аминокислотная последовательность образует домен связывания и/или единицу связывания, способную связываться со специфическим эпитопом на IL-6R. Однако следует также отметить, что присутствие только одного из таких участков аминокислотных остатков в аминокислотной последовательности изобретения само по себе уже может быть достаточным для получения аминокислотной последовательности изобретения, способной связываться со специфическим эпитопом на IL-6R (к примеру, опять же можно обратиться к так называемым "expedite-фрагментам", описанным в WO 03/050531).
Аминокислотные последовательности, содержащие один или несколько из этих специфических участков аминокислотных остатков, проявляют улучшенные свойства, такие, к примеру, как лучшее связывание и/или сродство, лучшую авидность, лучшую эффективность и силу и/или большую избирательность вдобавок к их способности частично или полностью блокировать взаимодействие IL-6/IL-6R и/или ингибировать прохождение сигнала через IL-6, IL-6R и/или комплекс IL-6/IL-6R.
Более конкретно, аминокислотные последовательности изобретения, содержащие один или несколько из этих специфических участков аминокислотных остатков, могут связываться с IL-6R со сродством (соответствующим образом измеренным и/или выраженным в виде значения Ко (действительного или кажущегося), значения Кд (действительного или кажущегося), константы скорости kon и/или koff или же в виде значения IC50, как описано далее), предпочтительно таким, что они:
- связываются с hIL-6 с константой диссоциации (KD) от 1 нМ до 1 пМ или меньше, предпочтительно от 500 пМ до 1 пМ или меньше, более предпочтительно от 100 пМ до 1 пМ или меньше и еще более предпочтительно от 50 пМ до 1 пМ или меньше;
и/или таким, что они:
- связываются с cynoIL-6R с константой диссоциации (KD) от 1 нМ до 1 пМ или меньше, предпочтительно от 500 пМ до 1 пМ или меньше, более предпочтительно от 100 пМ до 1 пМ или меньше и еще более предпочтительно от 50 пМ до 1 пМ или меньше;
и/или таким, что они:
- связываются с hIL-6 с константой скорости kon от 104 М-1s-1 до 107 M-1s-1, предпочтительно от 105 М-1s-1 до 107 М-1s-1, более предпочтительно около 106 M-1s-1 или больше;
и/или таким, что они:
- связываются с cynoIL-6R с константой скорости kon от 104 M-1s-1 до 107 М-1s-1, предпочтительно от 105 M-1s-1 до 107 M-1s-1, более предпочтительно около 106 M-1s-1 или больше;
и/или таким, что они:
- связываются с hIL-6 с константой скорости koff от 10-3 (t½=0,69 сек) до 10-6 s-1 (давая почти необратимый комплекс с t½ в несколько дней), предпочтительно от 10-4 s-1 до 10-6 s-1, более предпочтительно от 10-5 s-1 до 10-6 s-1, как-то около 10-5 s-1 или меньше;
и/или таким, что они:
- связываются с cynoIL-6R с константой скорости koff от 10-3 (t½=0,69 сек) до 10-6 s-1 (давая почти необратимый комплекс с t½ в несколько дней), предпочтительно от 10-4 s-1 до 10-6 s-1, более предпочтительно от 10-5 s-1 до 10-6 s-1, как-то около 10-5 s-1 или меньше.
Некоторые предпочтительные значения IC50 для связывания аминокислотных последовательностей изобретения с IL-6R станут ясными из дальнейшего описания и приведенных в нем примеров.
Например, при определении методом TF-1, описанным Kitamura et al. (1989, J. Cell PhysioL, 140: 323), аминокислотные последовательности изобретения могут иметь значения IC50 (при 100 ME IL-6/мл) между 10 нМ и 50 пМ, предпочтительно между 5 нМ и 50 пМ, более предпочтительно между 1 нМ и 50 пМ или меньше, как-то около 750 или 500 пМ или меньше. При определении этим методом TF-1 аминокислотные последовательности изобретения могут иметь значения IC50 (при 5000 ME IL-6/мл) между 50 нМ и 1 нМ, предпочтительно между 25 нМ и 1 нМ, более предпочтительно между 10 нМ и 1 нМ или меньше, как-то около 8 нМ или меньше. При определении этим методом TF-1 аминокислотные последовательности изобретения могут иметь значения IC50, которые по крайней мере такие же или предпочтительно лучше по меньшей мере в два раза, предпочтительно в три раза, более предпочтительно в четыре раза, еще более предпочтительно в 5 раз, в 7 раз или больше чем 7 раз по сравнению со значением IC50, полученным для контрольного IgG, приведенного в SEQ ID NO:1 и 2, или контрольного Fab, приведенного в SEQ ID NO:3 и 4 (см. Пример 1). При определении этим методом TF-1 аминокислотные последовательности изобретения могут иметь значения IC50, которые по крайней мере такие же или предпочтительно лучше по меньшей мере в два раза, предпочтительно в три раза, более предпочтительно в четыре раза, еще более предпочтительно в 5 раз, в 7 раз или больше чем 7 раз по сравнению со значением IC50, полученным для Tocilizumab (MRA).
При определении методом активности в плазме при значениях ЕСзо для IL-6 (напр., в присутствии 27,29 нг IL-6/мл, как описано в Примере 45) аминокислотные последовательности изобретения могут иметь значения IC50 между 500 пМ и 50 пМ, предпочтительно между 250 пМ и 50 пМ, более предпочтительно между 200 пМ и 50 пМ или меньше, как-то 150 пМ или меньше. При определении методом активности в плазме при значениях ЕС95 для IL-6 (напр., в присутствии 885 нг IL-6/мл, как описано в Примере 45) аминокислотные последовательности изобретения могут иметь значения IC50 между 1000 пМ и 100 пМ, предпочтительно между 750 пМ и ЮОпМ, более предпочтительно между 500 пМ и 100 пМ или меньше, как-то 400 пМ или меньше. При определении этим методом активности в плазме аминокислотные последовательности изобретения могут иметь значения IC50, которые по крайней мере такие же или предпочтительно лучше по меньшей мере в два раза, предпочтительно в три раза, более предпочтительно в четыре раза, еще более предпочтительно в 5 раз, в 7 раз или больше чем 7 раз по сравнению со значением IC50, полученным для контрольного IgG, приведенного в SEQ ID NO:1 и 2, или контрольного Fab, приведенного в SEQ ID NO:3 и 4 (см. Пример 1). При определении этим методом активности в плазме аминокислотные последовательности изобретения могут иметь значения IC50, которые по крайней мере такие же или предпочтительно лучше по меньшей мере в два раза, предпочтительно в три раза, более предпочтительно в четыре раза, еще более предпочтительно в 5 раз, в 7 раз или больше чем 7 раз по сравнению со значением IC50, полученным для Tocilizumab (MRA).
При определении методом связывания с мембранным IL-6R на клетках СНО аминокислотные последовательности изобретения могут иметь значения IC50 между 10 нМ и 100 пМ, предпочтительно между 5 нМ и 100 пМ, более предпочтительно между 2 нМ и 10 пМ или меньше, как-то 2 нМ или меньше.
В предпочтительном аспекте аминокислотные последовательности изобретения могут содержать два или больше участков аминокислотных остатков, выбранных из следующего:
a) SEQ ID NO's:80-82; или
b) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:80-82, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса; и/или
c) SEQ ID NO's:84-91; или
d) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:84-91, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса; и/или
e) SEQ ID NO's:93-95; или
f) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:93-95, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса;
с тем, что (i) когда первый участок аминокислотных остатков соответствует одной из аминокислотных последовательностей согласно а) или b), то второй участок аминокислотных остатков соответствует одной из аминокислотных последовательностей согласно с), d), е) или f); (И) когда первый участок аминокислотных остатков соответствует одной из аминокислотных последовательностей согласно с) или d), то второй участок аминокислотных остатков соответствует одной из аминокислотных последовательностей согласно а), b), е) или f); либо (iii) когда первый участок аминокислотных остатков соответствует одной из аминокислотных последовательностей согласно е) или f), то второй участок аминокислотных остатков соответствует одной из аминокислотных последовательностей согласно а), b), с) или d);
Еще более предпочтительно аминокислотные последовательности изобретения содержат три или больше участков аминокислотных остатков, при этом первый участок аминокислотных остатков выбран из группы, состоящей из:
a) SEQ ID NO's:80-82; или
b) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:80-82, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса;
второй участок аминокислотных остатков выбран из группы, состоящей из:
c) SEQ ID NO's:84-91; или
d) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:84-91, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазмонного резонанса; и
третий участок аминокислотных остатков выбран из группы, состоящей из:
e) SEQ ID NO's:93-95; или
f) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:93-95, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазмонного резонанса.
Следует отметить, что изобретение не ограничивается ни происхождением аминокислотной последовательности изобретения (или нуклеотидной последовательности изобретения, используемой для ее экспрессии), ни тем, как (была) создана или получена аминокислотная последовательность или нуклеотидная последовательность изобретения. Таким образом, аминокислотные последовательности изобретения могут представлять собой природные аминокислотные последовательности (из любого подходящего вида) либо синтетические или полусинтетические аминокислотные последовательности.
В одном специфическом, но не ограничительном аспекте аминокислотная последовательность изобретения может представлять собой такую аминокислотную последовательность, которая содержит иммуноглобулиновую складку, или такую аминокислотную последовательность, которая при определенных условиях (как-то физиологических условиях) способна образовывать иммуноглобулиновую складку (напр., путем укладки). Можно обратиться, среди прочего, к обзору Halaby et al. (1999, J. Protein Eng. 12: 563-71). Предпочтительно при правильной укладке с образованием иммуноглобулиновой складки участки аминокислотных остатков могут надлежащим образом сформировать антиген-связывающий сайт для связывания специфического эпитопа на IL-6R или же более предпочтительно способны связываться со своим эпитопом на IL-6R со сродством (соответствующим образом измеренным и/или выраженным в виде значения Ко (действительного или кажущегося), значения KA (действительного или кажущегося), константы скорости kon и/или koff или же в виде значения IC50, как описано далее), которое определено в настоящем изобретении.
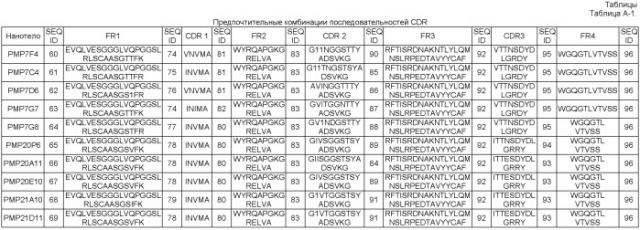
В другом специфическом, но не ограничительном аспекте аминокислотные последовательности изобретения представляют собой имммуноглобулиновые последовательности. В частности, но без ограничения, аминокислотные последовательности изобретения могут представлять собой аминокислотные последовательности, которые в основном состоят из 4 каркасных участков (от FR1 до FR4, соответственно) и 3 определяющих комплементарность участков (от CDR1 до CDR3, соответственно); или любые подходящие фрагменты таких аминокислотных последовательностей, которые все еще связывают специфический эпитоп на IL-6R.
В такой аминокислотной последовательности изобретения каркасные последовательности могут представлять собой любые каркасные последовательности, а примеры подходящих каркасных последовательностей должны быть известны специалистам, к примеру, из стандартных справочников и дальнейшего изложения и приведенных в нем работ предшествующего уровня техники.
Каркасные последовательности предпочтительно представляют собой каркасные последовательности (подходящие их комбинации) иммуноглобулинов или каркасные последовательности, полученные из каркасных последовательностей иммуноглобулинов (к примеру, путем оптимизации последовательности типа гуманизации или камелизации). Например, каркасные последовательности могут представлять собой каркасные последовательности, происходящие из вариабельного домена легкой цепи (напр., последовательности VL) и/или из вариабельного домена тяжелой цепи (напр., последовательности VH). В том случае, когда аминокислотная последовательность изобретения является последовательностью вариабельного домена тяжелой цепи, она может представлять собой последовательность вариабельного домена тяжелой цепи, происходящую из обычного четырехцепочечного антитела (типа последовательности VH, происходящей из антител человека), или так называемую последовательность vHH (как определено далее), происходящую из так называемых "антител из тяжелой цепи" (как определено далее). В одном особенно предпочтительном аспекте каркасные последовательности представляют собой либо каркасные последовательности, которые были получены из последовательности vhh (в которой данные каркасные последовательности необязательно могли быть частично или полностью гуманизированы), либо обычные последовательности VH, которые были подвергнуты камелизации (как определено далее).
За общим описанием антител из тяжелой цепи и их вариабельных доменов следует обратиться, среди прочего, к приведенным здесь работам предшествующего уровня техники, а также к работам предшествующего уровня техники, приведенным на стр. 59 WO 08/020079, и к библиографии, приведенной на стр. 41-43 Международной заявки WO 06/040153, причем работы и ссылки предшествующего уровня техники включены в настоящее изобретение путем ссылки.
Аминокислотная последовательность изобретения, в частности, может представлять собой доменное антитела (или аминокислотную последовательность, подходящую для использования в качестве доменного антитела), однодоменные антитела (или аминокислотную последовательность, подходящую для использования в качестве однодоменного антитела), "dAb" (или аминокислотную последовательность, подходящую для использования в качестве "dAb") или нанотело (как определено здесь, в том числе, но не ограничиваясь этим последовательность VHH); Другие одиночные вариабельные домены или любые подходящие фрагменты любых из них.
В частности, аминокислотная последовательность изобретения может представлять собой нанотело (Nanobody®) (как определено здесь) или любой подходящий его фрагмент. [Примечание: Nanobody® (напотело), Nanobodies® (напотела) и Nanoclone® (наноклон) -это зарегистрированные торговые марки Ablynx N.V.] Такие нанотела, направленные против IL-6R, также будут именоваться здесь как "нанотела изобретения".
В общем, нанотело может быть определено как аминокислотная последовательность (общей) структуры:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,
где FR1-FR4 означают каркасные участки от 1 до 4, соответственно, а CDR1-CDR3 означают участки комплементарности от 1 до 3, соответственно, причем один или несколько остатков Hallmark определены в WO 08/020079 (таблицы от А-3 до А-8).
В общем, нанотела (в частности последовательности VHH и частично гуманизированные нанотела), в частности, могут характеризоваться присутствием одного или нескольких "остатков Hallmark' в одной или нескольких каркасных последовательностях (напр., как это описано в WO 08/020079, от с.61, строка 24, до с.98, строка 3).
В этом отношении аминокислотные последовательности изобретения могут в основном состоять из 4 каркасных участков (FR1-FR4, соответственно), и 3 участков, определяющих комплементарность (CDR1-CDR3, соответственно), причем:
- CDR1 выбран из группы, состоящей из:
a) SEQ ID NO's:80-82; или
b) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:80-82, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса; и/или
- CDR2 выбран из группы, состоящей из:
c) SEQ ID NO's:84-91; или
d) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:84-91, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса; и/или
- CDR3 выбран из группы, состоящей из:
e) SEQ ID NO's:93-95; или
f) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:93-95, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса.
Эти предпочтительные участки комплементарности (CDR1-CDR3, соответственно) также обозначаются как "CDR(s) изобретения".
Предпочтительно, аминокислотные последовательности изобретения в основном состоят из 4 каркасных участков (FR1-FR4, соответственно) и 3 определяющих комплементарность участков (участки (CDR1-CDR3, соответственно), причем:
- CDR1 выбран из группы, состоящей из:
a) SEQ ID NO's:80-82; или
b) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:80-82, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса; и
- CDR2 выбран из группы, состоящей из:
c) SEQ ID NO's:84-91; или
d) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:84-91, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса; и
- CDR3 выбран из группы, состоящей из:
e) SEQ ID NO's:93-95; или
f) участков аминокислотных остатков, имеющих не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:93-95, при условии, что аминокислотная последовательность, содержащая такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью, содержащей данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазмонного резонанса.
Такие нанотела могут быть получены любым подходящим способом и из любого подходящего источника и могут представлять собой, к примеру, природные последовательности VHH (то есть из любого подходящего вида Camelid) либо синтетические или полусинтетические аминокислотные последовательности.
В одном специфическом аспекте аминокислотная последовательность или нанотело изобретения содержит по меньшей мере SEQ ID NO:80 либо участок аминокислотных остатков, имеющий не более 2, предпочтительно не более 1 аминокислотного отличия от SEQ ID NO:80, при условии, что аминокислотная последовательность или нанотело, содержащее такой участок аминокислотных остатков, связывается с IL-6R с таким же, примерно таким же или большим сродством по сравнению с аминокислотной последовательностью или нанотелом, содержащим данный участок аминокислотных остатков без 2 или 1 аминокислотного отличия, причем сродство измеряется методом поверхностного плазменного резонанса.
В другом специфическом аспекте аминокислотная последовательность или нанотело изобретения содержит по меньшей мере участок аминокислотных остатков, выбранный из SEQ ID NO's:84, 89 или 91, либо участок аминокислотных остатков, имеющий не более 2, предпочтительно не более 1 аминокислотного отличия от одной из SEQ ID NO's:80, 89 или 91, при условии, что аминокислотная последовательность или нанотело,