Пептид glp-1 с присоединенной олигосахаридной цепью
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к пептиду GLP-1 с присоединенной олигосахаридной цепью, и может быть использовано в медицине. Указанный пептид GLP-1, обладающий активностью GLP-1, имеет (а1) одну аминокислоту, дополнительно присоединенную к С-концу (позиция 37), в котором указанная присоединенная аминокислота заменена аминокислотой с присоединенной олигосахаридной цепью; или (а2) одну или две аминокислоты, замененные аминокислотой с присоединенной олигосахаридной цепью, где сайт замены выбирают из позиций 18, 20, 22, 30 и 36, а также может дополнительно включать от 1 до 5 делеций, замен или вставок аминокислот, где указанная олигосахаридная цепь содержит пять или более сахаров и представлена Формулой 1. Изобретение также относится к фармацевтической композиции и способу лечения или предупреждения заболевания, поддающегося лечению или предупреждаемого введением GLP-1, например диабета, предусматривающим использование вышеуказанного пептида GLP-1 с присоединенной олигосахаридной цепью. Изобретение позволяет получить пептид GLP-1 с присоединенной олигосахаридной цепью, обладающий улучшенной стабильностью и более высокой активностью в контролировании уровня сахара в крови по сравнению с GLP-1. 3 н. и 11 з.п. ф-лы, 22 ил., 10 табл., 49 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение имеет отношение к пептиду GLP-1 с присоединенной олигосахаридной цепью.
Уровень техники
GLP-1 (глюкагон-подобный пептид-1) представляет собой пептид кишечника, который глубоко вовлечен в регуляцию гомеостаза глюкозы. GLP-1 синтезируют кишечные L-клетки путем тканеспецифического посттрансляционного процессинга препроглюкагона, который представляет собой предшественник глюкагона и выходит в кровоток в ответ на прием пищи. Эти пептиды служат в качестве основных медиаторов оси, ведущей от кишечника к панкреатическим островкам, и действуют через связывание с определенными рецепторами.
Известно, что GLP-1 влияет в основном на поджелудочную железу и стимулирует выход инсулина из β-клеток зависимым от концентрации глюкозы способом. Также считается, что вероятно GLP-1 подавляет секрецию глюкагона, задерживает опорожнение желудка и усиливает удаление периферической глюкозы.
Введение GLP-1 пациентам с инсулиннезависимым сахарным диабетом может нормализовать уровень глюкозы, возникающий после приема пищи, следовательно, можно предположить, что GLP-1 может быть использован в качестве терапевтического лекарственного средства. GLP-1 также улучшает гликемический контроль у пациентов с инсулинозависимым сахарным диабетом. Поскольку влияние GLP-1 на стимуляцию высвобождения инсулина зависит от концентрации глюкозы в плазме, GLP-1 опосредует снижение высвобождения инсулина при низкой концентрации глюкозы в плазме и, следовательно, преимущественно не вызывает серьезной гипогликемии. Таким образом, при необходимости высокобезопасное лечение диабета может быть достигнуто с помощью контроля количества GLP-1 в крови. Однако время полужизни GLP-1 в крови чрезвычайно коротко, от 2 до 6 минут, что ограничивает его возможности и создает проблемы при его применении в качестве терапевтического средства.
Для решения этой проблемы были предприняты попытки модифицировать GLP-1. Например, патентный документ 1 раскрывает пегилированное соединение GLP-1, включающее соединение GLP-1, конъюгированное по меньшей мере с 1-й молекулой полиэтиленгликоля (ПЭГ), в котором каждый ПЭГ связан с соединением GLP-1 через аминокислоты Cys или Lys или через С-концевую аминокислоту, и пегилированное соединение GLP-1 имеет период полувыведения, равный по меньшей мере 1-му часу.
Согласно патентному документу 1 полученный биологически активный пептид имеет более продолжительное время полужизни и сильно замедленный клиренс по сравнению с непегилированными пептидами. Было также показано, что пегилированное соединение и композиция, включающие GLP-1, полезны при лечении таких состояний здоровья, как диабет, ожирение и синдром раздраженной кишки, а также для снижения уровня сахара в крови, подавления перистальтики желудка и/или кишечника, подавления опорожнения желудка и/или кишечника, и контролирования приема пищи (например, непатентный документ 1).
Однако ПЭГ представляет собой соединение, которое не метаболизируется in vivo. Следовательно, при непрерывном введении пегилированного соединения GLP-1 ПЭГ будет накапливаться in vivo и может вызвать побочную реакцию в живых организмах (непатентный документ 1).
В США в продаже появился эксендин-4, обнаруженный в слюне ящериц (Heloderma), который представляет собой соединение, структурно похожее на GLP-1 и имеющее похожую активность и высокую стабильность в крови (непатентный документ 2). Однако эксендин-4 имеет последовательность, отличную от последовательности человека, и может индуцировать образование нейтрализующих антител вследствие долговременного введения, что приведет к ослаблению эффективности (непатентные документы 3-5).
С другой стороны, стало очевидно, что цепи олигосахаридов имеют разнообразные функции in vivo. Они менее хорошо изучены из-за их сложных и разнотипных структур, хотя важность таких исследований была осознана. Была предпринята попытка разработать способ получения гликопептида, имеющего постоянный состав (патентный документ 2). Однако этот способ получения по-прежнему малоудовлетворителен с точки зрения удобства или широкомасштабного производства и не представляет собой практический способ, в особенности, для длинноцепочечных олигосахаридов, существующих in vivo.
[Патентный документ 1] Национальная публикация Международной патентной заявки No. 2006-520818
[Патентный документ 2] WO 2005-095331
[Непатентный документ 1] Toxicological Science, 42, 152-157 (1998)
[Непатентный документ 2] J Biol Chem. 267, 402-5 (1992)
[Непатентный документ 3] Vascular Health and Risk Management 2, 69-77 (2006)
[Непатентный документ 4] JAMA. 298, 194-206 (2007)
[Непатентный документ 5] Endocrine Reviews 28, 187-218 (2007)
Раскрытие изобретения
Проблема, которая будет решена с помощью изобретения
Цель настоящего изобретения заключается в обеспечении пептида GLP-1 с присоединенной олигосахаридной цепью, который имеет более высокую стабильность в крови по сравнению с GLP-1 и, более предпочтительно, проявляет более высокую активность в контролировании уровня сахара в крови по сравнению с GLP-1.
Средства решения проблемы
Настоящее изобретение может иметь следующие характеристики для решения проблемы.
В особенности, настоящее изобретение обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором по меньшей мере одна аминокислота заменена аминокислотой с присоединенной олигосахаридной цепью, в
(a) GLP-1;
(b) пептиде, который имеет аминокислотную последовательность GLP-1 с делецией, заменой или вставкой одной или более аминокислот; или
(c) аналоге GLP-1.
Настоящее изобретение также обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором по меньшей мере одна аминокислота заменена аминокислотой с присоединенной олигосахаридной цепью в
(a) GLP-1; или
(b) пептиде, который имеет аминокислотную последовательность GLP-1 с делецией, заменой или вставкой одной или более аминокислот и, который имеет активность GLP-1.
Настоящее изобретение также обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором пептид GLP-1 с присоединенной олигосахаридной цепью представляет собой
(a) пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий одну или более аминокислот, дополнительно присоединенных к С-концу (позиция 37) GLP-1, в котором по меньшей мере одна из присоединенных аминокислот заменена аминокислотой с присоединенной олигосахаридной цепью; или
(b) пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий аминокислотную последовательность пептид GLP-1 с присоединенной олигосахаридной цепью по пункту (а), с делецией, заменой или вставкой одной или более аминокислот, за исключением аминокислоты (аминокислот) с присоединенной олигосахаридной цепью.
Настоящее изобретение также обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором пептид GLP-1 с присоединенной олигосахаридной цепью представляет собой
(a) пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий одну или более аминокислот, дополнительно присоединенных к N-концу (позиция 7) GLP-1, в котором по меньшей мере одна из присоединенных аминокислот заменена аминокислотой с присоединенной олигосахаридной цепью; или
(b) пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий аминокислотную последовательность пептида GLP-1 с присоединенной олигосахаридной цепью по пункту (а) с делецией, заменой или вставкой одной или более аминокислот за исключением аминокислоты (аминокислот) с присоединенной олигосахаридной цепью.
Настоящее изобретение также обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором пептид GLP-1 с присоединенной олигосахаридной цепью представляет собой
(a) пептид GLP-1 с присоединенной олигосахаридной цепью, в котором аминокислота по меньшей мере в одном сайте, который выбирают из позиций 18, 20, 22, 26, 30, 34 и 36 GLP-1, заменена аминокислотой с присоединенной олигосахаридной цепью; или
(b) пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий аминокислотную последовательность пептида GLP-1 с присоединенной олигосахаридной цепью по пункту (а) с делецией, заменой или вставкой одной или более аминокислот за исключением аминокислоты (аминокислот) с присоединенной олигосахаридной цепью.
Кроме того, настоящее изобретение обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором по меньшей мере две аминокислоты замещены аминокислотами с присоединенной олигосахаридной цепью в
(a) GLP-1;
(b) пептиде, который имеет аминокислотную последовательность GLP-1 с делецией, заменой или вставкой одной или более аминокислот; или
(c) аналоге GLP-1.
Настоящее изобретение также обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором по меньшей мере две аминокислоты замещены аминокислотами с присоединенной олигосахаридной цепью в
(а) GLP-1; или
(b) пептиде, который имеет аминокислотную последовательность GLP-1 с делецией, заменой или вставкой одной или более аминокислот.
Настоящее изобретение также обеспечивает пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий активность GLP-1, в котором по меньшей мере две аминокислоты замещены аминокислотами с присоединенной олигосахаридной цепью в
(a) GLP-1; или
(b) пептиде, который имеет аминокислотную последовательность GLP-1 с делецией, заменой или вставкой одной или более аминокислот и который имеет активность GLP-1.
В настоящем изобретении аминокислота с присоединенной олигосахаридной цепью может быть предпочтительно, но, не ограничиваясь, Asn с присоединенной олигосахаридной цепью или Cys с присоединенной олигосахаридной цепью, в зависимости от воплощений.
В настоящем изобретении в аминокислоте с присоединенной олигосахаридной цепью, олигосахаридная цепь может быть присоединена к аминокислоте с помощью линкера или без помощи линкера. Предпочтительно, олигосахаридная цепь присоединена к аминокислоте без помощи линкера (т.е., непосредственно), в зависимости от воплощений.
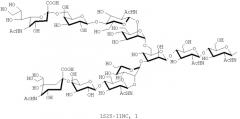
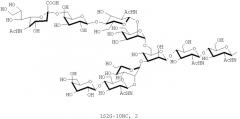
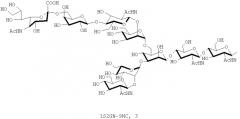
В настоящем изобретении олигосахаридная цепь обычно, предпочтительно, представляет собой олигосахаридную цепь, состоящую из четырех или более сахаров. Однако олигосахаридная цепь, состоящая из от пяти до одиннадцати сахаров, может быть предпочтительна, в зависимости от воплощений.
В настоящем изобретении олигосахаридная цепь может быть предпочтительно, но, не ограничиваясь, олигосахаридной цепью, которую выбирают из группы, состоящей из дисиало-, моносиало-, асиало-, диGlcNAc- и диманнозных цепей олигосахаридов, в зависимости от воплощений.
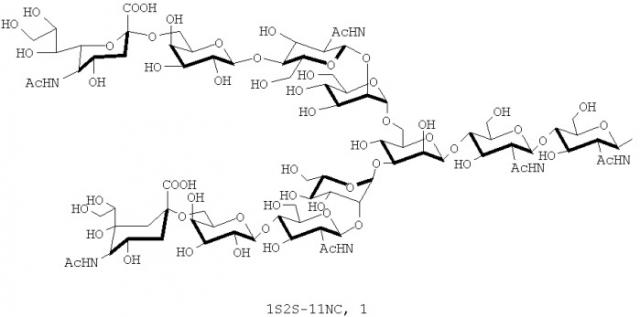
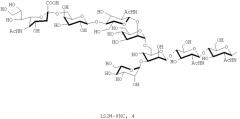
В настоящем изобретении олигосахаридная цепь может представлять собой предпочтительно, но, не ограничиваясь, олигосахаридную цепь, представленную следующей формулой, в зависимости от воплощений:
[Формула 1]
в которой
R1 и R2 одинаковые или различные группы и каждая представляет собой следующее
[Формула 2]
, ,
, или
и
Ас представляет собой ацетильную группу.
В настоящем изобретении олигосахаридная цепь, предпочтительно, представляет собой существенным образом однородную цепь. В настоящем изобретении цепи олигосахаридов могут быть подобраны так, чтобы иметь такую структуру. Согласно раскрытию настоящего изобретения может быть достигнуто, например по меньшей мере 90% или по меньшей мере 99% однородности.
Пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения, предпочтительно, имеет более высокую стабильность в крови по сравнению с GLP-1.
Пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения может иметь активность в контролировании уровня сахара в крови предпочтительно по меньшей мере в 5 раз, более предпочтительно по меньшей мере в 10 раз, еще более предпочтительно по меньшей мере в 20 раз больше таковой в GLP-1 в OGTT (пероральный тест на толерантность к глюкозе).
Пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения может иметь предпочтительно по меньшей мере в 30 раз, более предпочтительно по меньшей мере в 50 раз более высокую устойчивость к DPP-IV по сравнению с GLP-1.
Пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения может быть применен в качестве нового активного ингредиента в медицинских применениях. Такие медицинские применения охватывают лечение или предупреждение заболеваний, связанных с GLP-1. Например, диабет представляет собой такое типичное заболевания.
Конечно, одно или более сочетаний описанных выше характеристик настоящего изобретения также включены в пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения.
Результат изобретения
Пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения имеет более высокую стабильность в крови по сравнению с GLP-1. В одном из аспектов настоящего изобретения пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения имеет более высокую активность в контролировании уровня сахара в крови по сравнению с GLP-1. Соответственно, пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения может быть введен в сниженной дозе и в меньшем числе доз по сравнению с GLP-1.
Олигосахаридная цепь, присоединенная к пептиду GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения, легко деградирует in vivo и, следовательно, не вызывает побочную реакцию, связанную с его накоплением в живых организмах.
Некоторые или все цепи олигосахаридов, присоединенные к пептиду GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения, существуют in vivo в млекопитающих, включая человека, в птицах и т.п. При введении живым организмам они не проявляют ни побочных эффектов, ни антигенности. Следовательно, они не вызывают проблем, связанных с аллергическими реакциями или с потерей эффективности вследствие образования антител.
До настоящего времени цепи олигосахаридов, в особенности, длинноцепочечные олигосахариды, пептиды с присоединенными олигосахаридными цепями (или белки), имеющие однородную структуру олигосахаридной цепи, трудно было получить в больших количествах с неизменным качеством. Однако в соответствии со способом получения настоящего изобретения соединение настоящего изобретения, которое представляет собой пептид с присоединенной олигосахаридной цепью, может быть обеспечен стабильным и легким способом в больших количествах и также представляется очень полезным с точки зрения фармацевтического производства.
Краткое описание чертежей
Фиг.1 представляет собой один из примеров ВЭЖХ-хроматограммы по примеру 43 и демонстрирует пики 18Asn-асиало-GLP-1 и 18Asn-дисиало-GLP-1;
фиг.2 представляет собой один из примеров ВЭЖХ-хроматограммы по примеру 44 и демонстрирует пики 22Asn-асиало-GLP-1 и 22Asn-дисиало-GLP-1;
фиг.3 представляет собой один из примеров ВЭЖХ-хроматограммы по примеру 45 и демонстрирует пики 30Asn-асиало-GLP-1 и 30Asn-дисиало-GLP-1;
фиг.4 представляет собой один из примеров ВЭЖХ-хроматограммы по примеру 47 и демонстрирует пики 36Asn-асиало-GLP-1 и 36Asn-дисиало-GLP-1;
фиг.5 представляет собой график, на котором приведены результаты ВЭЖХ-анализа пептида GLP-1 с присоединенной олигосахаридной цепью по примеру 7 в тестовом примере 1 (Тест на стабильность в плазме);
фиг.6 представляет собой график, на котором приведены результаты ВЭЖХ-анализа GLP-1 по сравнительному примеру 1 в тестовом примере 1 (Тест на стабильность в плазме);
фиг.7 представляет собой график, демонстрирующий изменение уровня сахара в крови после введения пептида GLP-1 с присоединенными олигосахаридными цепями по примерам 1-5 и GLP-1 соединения по сравнительному примеру 1 в тестовом примере 2 (Тест на влияние на снижение уровня сахара в крови у db/db мышей);
фиг.8 представляет собой график, демонстрирующий изменение уровня сахара в крови после введения пептида GLP-1 с присоединенными олигосахаридными цепями по примеру 5 и GLP-1 по сравнительному примеру 1 в тестовом примере 3 (Тест на влияние на снижение уровня сахара в крови у db/db мышей);
фиг.9 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-1, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.10 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-1, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.11 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-1, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.12 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-2, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния структуры олигосахаридных цепей пептидов на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.13 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-2, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния структуры олигосахаридных цепей пептидов на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.14 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-2, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния структуры олигосахаридных цепей пептидов на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.15 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-3, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния структуры олигосахаридных цепей пептидов на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.16 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-3, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния структуры олигосахаридных цепей пептидов на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.17 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-3, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния доз пептидов на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.18 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-3, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния доз пептидов на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.19 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-4, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными Asn олигосахаридными цепями;
фиг.20 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 7-5, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния числа цепей олигосахаридов, присоединенных к пептидам, на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями;
фиг.21 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенной олигосахаридной цепью по примеру и GLP-1 по сравнительному примеру 1 в тестовом примере 7-5, который представляет собой пероральный тест на толерантность к глюкозе (OGTT), проводимый для исследования влияния числа цепей олигосахаридов, присоединенных к пептидам, на подавление роста уровня сахара в крови с помощью пептида GLP-1 с присоединенными олигосахаридными цепями; и
фиг.22 представляет собой график, демонстрирующий изменение уровня сахара в крови после добавления пептида GLP-1 с присоединенными олигосахаридными цепями по примерам и GLP-1 по сравнительному примеру 1 в тестовом примере 8, проводимый для исследования влияния на подавление роста уровня сахара в крови у мышей с моделью диабета с помощью пептида GLP-1 с присоединенными олигосахаридными цепями.
Осуществление изобретения
Термин «GLP-1», примененный в этом документе, означает глюкагон-подобный пептид-1 и имеет отношение к GLP-1 (7-37).
GLP-1 (7-37) имеет следующую аминокислотную последовательность
His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Trp-Leu-Val-Lys-Gly-Arg-Gly (SEQ ID NO: 2).
В настоящем изобретении «аналог GLP-1» представляет собой пептид, структурно похожий на GLP-1, и/или пептид, структурно перекрывающийся с GLP-1. Примеры таких пептидов включают: пептид, который имеет аминокислотную последовательность GLP-1 с делецией, заменой или вставкой одной или более аминокислот; пептид, который имеет аминокислотную последовательность GLP-1 с консервативной заменой одной или более аминокислот; модифицированный GLP-1; фрагмент GLP-1, имеющий активность GLP-1; удлиненный GLP-1, имеющий активность GLP-1; и эксендин-4 и его аналог (Curr. Opin. Investig. Drugs 8, 842-8 (2007), J. Pharmacol. Exp. Ther. 307, 490-496 (2003), Diabetes 50, 2530-9 (2001), и т.п.).
Термин «аминокислота», примененный в этом документе, применяют в широком смысле, и он охватывает не только природные аминокислоты, но также неприродные аминокислоты, такие как варианты и производные аминокислот. Принимая во внимание это широкое определение, специалисты в этой области техники могут понять, что примеры аминокислоты, примененные в этом документе, включают: природные протеогенные L-аминокислоты; D-аминокислоты; химически модифицированные аминокислоты, такие как варианты и производные аминокислот; природные непротеогенные аминокислоты, такие как норлейцин, β-аланин и орнитин; и химически синтезированные соединения, имеющие свойства, характерные для аминокислот, известных в этой области техники. Примеры неприродных аминокислот включают α-метиламинокислоты (α-метилаланин и т.п.), D-аминокислоты, гистидин-подобные аминокислоты (2-амино-гистидин, β-гидрокси-гистидин, гомогистидин, α-фторметил-гистидин и α-метил-гистидин, и т.п.), аминокислоты, имеющего дополнительный метилен в боковой цепи («гомо»аминокислоты) и аминокислоты, имеющие карбоксильную функциональную группу в боковой цепи, замещенную группой сульфоновой кислоты (цистеиновой кислоты и т.п.). Известно, что некоторые аналоги GLP-1, имеющие активность GLP-1, содержат неприродные аминокислоты. В предпочтительном аспекте аминокислоты, которые содержатся в соединении настоящего изобретения, состоят только из природных аминокислот.
Во фразе «делеция, замена или вставка одной или более аминокислот», примененной в этом документе, число аминокислот, замененных и т.п., в особенности, не ограничено, до тех пор, пока сохраняется активность GLP-1. Число аминокислот, замененных и т.п., равно от 1 до примерно 9, предпочтительно от 1 до примерно 5, более предпочтительно от 1 до примерно 3 или соответствует не более 20%, предпочтительно, не более 10% от общей длины. Аминокислоты, замененные или вставленные, могут быть природными аминокислотами, неприродными аминокислотами или аналогами аминокислот и, предпочтительно, представляют собой природные аминокислоты.
Термин «консервативная замена одной или более аминокислот», примененный в этом документе, имеет отношение к замене аминокислоты, которая заменяет исходную аминокислоту аминокислотой, имеющей показатели гидрофильности и/или гидрофобности, похожие на показатели исходной кислоты и не вызывает явного снижения или потери активности GLP-1 после замены.
Термин «модифицированный GLP-1», примененный в этом документе, представляет собой соединение, в котором GLP-1 представляет собой природный или искусственно модифицированный GLP-1. Примеры таких модификаций включают алкилирование, ацилирование (например, ацетилирование), амидирование, карбоксилирование, этерификацию, образование дисульфидной связи, гликозилирование, липидирование, фосфорилирование, гидроксилирование и мечение одного или более аминокислотных остатков GLP-1.
Термин «фрагмент GLP-1, имеющий активность GLP-1», примененный в этом документе, представляет собой пептид, который имеет делецию по одной или более аминокислотам с N-конца и/или С-конца GLP-1 и сохраняет активность GLP-1.
Термин «удлиненный GLP-1, имеющий активность GLP-1», примененный в этом документе, представляет собой пептид, который имеет вставку одной или более аминокислот на N-конце и/или С-конце в GLP-1 и сохраняет активность GLP-1 (смотри, например, Endocrinology, 125, 3109-14 (1989)).
Во фразе «пептид, имеющий одну или более аминокислот, дополнительно присоединенных к С-концу (позиция 37) GLP-1», примененной в этом документе, аминокислоты, присоединенные к С-концу GLP-1, последовательно означают аминокислоту в позиции 38, аминокислоту в позиции 39,… и т.п. Во фразе «пептид, имеющий одну или более аминокислот, дополнительно присоединенных к N-концу (позиция 7) GLP-1», аминокислоты, присоединенные к N-концу GLP-1 последовательно, означают аминокислоту в позиции 6, аминокислоту в позиции 5,… и т.п. Примеры «пептида, имеющего одну аминокислоту, дополнительно присоединенную к С-концу (позиция 37) GLP-1» включают пептид, в котором Asn или Cys добавлены к 37Gly в GLP-1.
Термин «пептид GLP-1 с присоединенной олигосахаридной цепью (гликозилированный пептид GLP-1, пептид GLP-1 с присоединенной цепью сахаров)» настоящего изобретения характеризуется тем, что по меньшей мере одна аминокислота заменена аминокислотой с присоединенной олигосахаридной цепью.
Термин «пептид GLP-1 с присоединенной олигосахаридной цепью», примененный в этом документе, охватывает пептид, в котором по меньшей мере одна аминокислота GLP-1 заменена аминокислотой с присоединенной олигосахаридной цепью, и пептид, в котором по меньшей мере одна аминокислота аналога GLP-1 заменена аминокислотой с присоединенной олигосахаридной цепью. Эти пептиды включены в пептид GLP-1 с присоединенной олигосахаридной цепью, даже если они дополнительно имеют делецию, замену или вставку одной или более аминокислот, помимо аминокислот с присоединенными олигосахаридными цепями. Пептид, в котором С-конец любого из этих пептидов амидирован (например, GLP-1(7-36)NH2, имеющий следующую аминокислотную последовательность His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys-Glu-Phe-Ile-Ala-Tip-Leu-Val-Lys-Gly-Arg-NH2 (SEQ ID NO: 3), в которой по меньшей мере одна аминокислота заменена аминокислотой с присоединенной олигосахаридной цепью) также включен в пептид GLP-1 с присоединенной олигосахаридной цепью. Соли этих пептидов также включены в пептид GLP-1 с присоединенной олигосахаридной цепью.
Термин «соли», примененный в этом документе, означает соли, известные специалистам в этой области техники и которые могут быть любыми кислотно-аддитивными или основно-аддитивными солями. Кислоты, обычно применяемые для образования кислотно-аддитивных солей, представляют собой неорганические кислоты, такие как соляная кислота, бромоводородная кислота, йодистоводородная кислота, серная кислота и фосфорная кислота, и органические кислоты, такие как п-толуолсульфоновая кислота, метансульфоновая кислота, щавелевая кислота, п-бромфенилсульфоновая кислота, карбоновая кислота, янтарная кислота, лимонная кислота, бензойная кислота и уксусная кислота. Примеры основно-аддитивных солей включают соли, полученные в результате добавления гидроксида аммония или гидроксидов щелочных или щелочноземельных металлов, и соли, производные от неорганических оснований, таких как карбонаты и бикарбонаты. В особенности предпочтительны фармацевтически приемлемые соли.
Термин «аминокислота с присоединенной олигосахаридной цепью», примененный в этом документе, представляет собой аминокислоту, присоединенную к олигосахаридной цепи. В этом контексте, олигосахаридная цепь может быть присоединена к аминокислоте через линкер. Место олигосахаридной цепи, к которой присоединена аминокислота, в особенности, не ограничено. Предпочтительно, аминокислота присоединена к редуцирующему концу олигосахаридной цепи.
Тип аминокислоты, присоединенной к олигосахаридной цепи, в особенности, не ограничен, и могут быть применены как природные, так и неприродные аминокислоты. С той точки зрения, что аминокислота с присоединенной олигосахаридной цепью представляет собой структурно то же самое или сходна с таковой для существующей в форме гликопептида (гликопротеина) in vivo, аминокислота с присоединенной олигосахаридной цепью представляет собой предпочтительно Asn с присоединенной олигосахаридной цепью, такой как N-связанная олигосахаридная цепь, или Ser с присоединенной олигосахаридной цепью, и Thr с присоединенной олигосахаридной цепью, такие как O-связанная олигосахаридная цепь, в особенности, предпочтительно Asn с присоединенной олигосахаридной цепью.
Если олигосахаридная цепь присоединена к аминокислоте через линкер, то аминокислота в аминокислоте с присоединенной олигосахаридной цепью предпочтительно представляет собой: аминокислоту, имеющую две или более карбоксильных групп в молекуле, такую как аспарагиновая кислота или глутаминовая кислота; аминокислоту, имеющую две или более аминогрупп в молекуле, такую как лизин, аргинин, гистидин или триптофан; аминокислоту, имеющую гидроксильную группу в молекуле, такую как серии, треонин или тирозин; аминокислоту, имеющую тиоловую группу в молекуле, такую как цистеин; или аминокислоту, имеющую амидную группу в молекуле, такую как аспарагин или глутамин, с точки зрения легкости связывания с линкером. В особенности, с точки зрения реакционноспособности предпочтительны аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, серин, треонин, цистеин, аспарагин или глутамин.
В приведенном ниже тестовом примере 7-4 пептид GLP-1 с присоединенными олигосахаридными цепями настоящего изобретения не демонстрирует существенной разницы в подавлении роста уровня сахара в крови между случаями Asn с присоединенной олигосахаридной цепью (без помощи линкера) и Cys с присоединенной олигосахаридной цепью (через линкер) в качестве аминокислоты с присоединенной олигосахаридной цепью, если они имеют одинаковую структуру олигосахаридных цепей, одну и ту же структуру, за исключением структуры олигосахаридных цепей, одни и те же места присоединения олигосахаридной цепи и одно и то же число присоединенных цепей олигосахаридов.
Если олигосахаридная цепь присоединена к аминокислоте через линкер, то может быть применено множество разных линкеров, применяемых в этой области техники. Примеры линкеров могут включать группировку -NH-(CO)-(CH2)a-CH2-, в которой:
«а» представляет собой целое число, предпочтительно целое число, равное от 0 до 4, но не ограничиваясь этими числами, пока представляющие интерес функции линкера не будут ингибироваться; и
C1-10-полиметилен и -CH2-R-, в котором R представляет собой группу, сформированную путем удаления одного атома водорода из заместителя, который выбирают из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, карбоциклической группы, замещенной карбоциклической группы, гетероциклической группы и замещенной гетероциклической группы.
Пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий аминокислоту с присоединенной олигосахаридной цепью, в которой олигосахаридная цепь присоединена к аминокислоте без помощи линкера, может иметь сниженную антигенность по сравнению с пептидом GLP-1 с присоединенной олигосахаридной цепью, в котором олигосахаридная цепь присоединена к аминокислоте через линкер. Пептид GLP-1 с присоединенной олигосахаридной цепью, имеющий аминокислоту с присоединенной олигосахаридной цепью, в которой олигосахаридная цепь присоединена к аминокислоте через линкер, может иметь повышенную стабильность в крови по сравнению с пептидом GLP-1 с присоединенной олигосахаридной цепью, в которой олигосахаридная цепь присоединена к аминокислоте без помощи линкера.
Способ получения пептида GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения не ограничен никаким образом описанием (например, описанием, которое начинается словами «пептид GLP-1 с присоединенной олигосахаридной цепью, в котором аминокислота заменена аминокислотой с присоединенной олигосахаридной цепью»). Пептид GLP-1 с присоединенной олигосахаридной цепью, который получают с помощью любого из способов А и В, включен в «пептид GLP-1 с присоединенной олигосахаридной цепью, в котором аминокислота заменена аминокислотой с присоединенной олигосахаридной цепью». Кроме того, например: пептид GLP-1 с присоединенной олигосахаридной цепью, в котором несвязанная с аминокислотой олигосахаридная цепь присоединена непосредственно или через линкер к аминокислоте в пептиде; пептид GLP-1 с присоединенной олигосахаридной цепью, в котором олигосахаридную цепь уже добавлена, дополнительно удлинен путем присоединения сахара или олигосахаридной цепи к нему; и пептид GLP-1 с присоединенной олигосахаридной цепью, в котором одну или более аминокислот, связанных с амино- и/или карбоксильными группами аминокислоты с присоединенной олигосахаридной цепью дополнительно присоединяют к одному или более фрагментам GLP-1, также включены в пептид GLP-1 с присоединенной олигосахаридной цепью настоящего изобретения до тех пор пока их конечные структуры находятся в соответствии с вышеизложенным.
Число замен, при которых аминокислоту GLP-1 замен