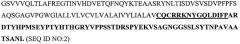Пептиды цитоплазматического домена белка muc-1 в качестве ингибиторов раковых заболеваний
Иллюстрации
Показать всеИзобретение относится к области биотехнологии, конкретно к пептидам из цитоплазматического домена MUC1, и может быть использовано в противоопухолевой терапии. Способ ингибирования MUC1-положительной опухолевой клетки у индивидуума включает введение указанному индивидууму MUC1-пептида длиной по меньшей мере 6 последовательных остатков MUC1 и не более 20 последовательных остатков MUC1, и, содержащего последовательность CQCRRK, в которой аминоконцевой цистеин из CQCRRK закрыт на своем NH2-конце по меньшей мере одним аминокислотным остатком, который не должен соответствовать нативной трансмембранной последовательности MUC-1. Альтернативно может быть использован MUC1-пептид длиной по меньшей мере 6 последовательных остатков MUC1 и не более 20 последовательных остатков MUC1, который содержит последовательность CQCRRK, причем все аминокислотные остатки указанного пептида являются D-аминокислотами. Изобретение позволяет эффективно ингибировать олигомеризацию MUC1 и индуцировать апоптоз опухолевых клеток и некроз опухолевых тканей in vivo. 11 н. и 69 з.п. ф-лы, 16 ил., 1 табл., 3 пр.
Реферат
Предпосылки изобретения
По данной заявке испрашивается приоритет согласно предварительной заявке США № 61/106380, поданной 17 октября 2008, и предварительной заявке США № 61/177109, поданной 11 мая, 2009, полное содержание которых включено в настоящее описание посредством ссылки.
1. Область техники, к которой относится изобретение
Изобретение относится к регуляции роста клеток и, более конкретно, к регуляции роста раковых клеток. В частности, было показано, что MUC1-пептиды, полученные на основе последовательности из определенной области цитоплазматического домена белка MUC1, ингибируют олигомеризацию и ядерную транслокацию MUC1, вызывая остановку роста и даже гибель опухолевых клеток, экспрессирующих MUC1.
2. Уровень техники
Муцины представляют собой интенсивно О-гликозилированные белки, которые экспрессируются преимущественно эпителиальными клетками. Секретируемые и мембраносвязанные муцины образуют физический барьер, который защищает апикальные границы эпителиальных клеток от повреждений, вызываемых токсинами, микроорганизмами и другими видами стрессовых воздействий, возникающих на границе с внешней окружающей средой. Трансмембранный муцин 1 (MUC1) также может осуществлять передачу сигнала внутрь клетки через свой цитоплазматический домен. MUC1 не имеет гомологии по последовательности с другими мембраносвязанными муцинами, за исключением домена белка спермы морского ежа/энтерокиназы/агрина (SEA-домена) (Duraisamy et al., 2006). Вследствие наличия этого домена, MUC1 транслируется в виде одиночного полипептида, а затем претерпевает ауторасщепление по SEA-домену (Macao, 2006).
N-концевая субъединица MUC1 (MUC1-N) содержит различное количество тандемных повторов с высоким содержанием остатков серина и треонина, модифицированных О-гликозилированием (Siddiqui, 1988). MUC1-N отвечает за гликокаликс клетки и соединен с ее поверхностью с помощью нековалентного связывания с трансмембранной С-концевой субъединицей MUC1 (MUC1-C) (Merlo, 1989). MUC1-C состоит из 58-аминокислотного внеклеточного домена, 28-аминокислотного трансмембранного домена и 72-аминокислотного цитоплазматического домена, который взаимодействует с различными сигнальными молекулами (Kufe, 2008). Сбрасывание MUC1-N в защитный физический барьер оставляет MUC1-C на клеточной поверхности в качестве потенциального рецептора для передачи внутриклеточных сигналов, которые обуславливают рост и выживание клеток (Ramasamy et al., 2007; Ahmad et al., 2007).
Доступные на сегодняшний момент данные указывают на то, что карциномы человека используют функцию MUC1 для усиления онкогенных свойств. В этом случае при трансформации и потере полярности высокий уровень экспрессии MUC1 наблюдается на всей поверхности клеток эпителия молочных желез и других органов (Kufe, 1984). В другой работе было показано, что сверхэкспрессия MUC1 обуславливает независимый от прикрепления рост и онкогенные свойства (Li et al., 2003a; Raina et al., 2004; Ren et al., 2004; Wei et al., 2005) по меньшей мере частично за счет стабилизации β-катенина (Huang et al., 2005). Более того, в соответствии с функцией, обеспечивающей выживание нормальных эпителиальных клеток, сверхэкспрессия MUC1 придает устойчивость клеткам карциномы к индуцируемому стрессом апоптозу (Ren et al., 2004; Yin and Kufe, 2003; Yin et al., 2004; Yin et al., 2007).
Утрата ограничения на апикальной мембране дает возможность формирования комплексов с рецептором фактора роста эпидермиса (EGFR) и коактивации опосредованных EGFR сигнальных путей (Li et al., 2001; Ramasamy et al., 2007). Сверхэкспрессия MUC1 клетками карциномы также ассоциирована с накоплением MUC1-C в цитозоле и транслокацией этой субъединицы в ядро клетки (Li et al., 2003b; Li et al., 2003c) и митохондрию (Ren et al., 2004; Ren et al., 2006). Важно отметить, что олигомеризация MUC1-C необходима для его переноса в ядро клетки и взаимодействия с различными эффекторами (Leng et al., 2007). Например, цитоплазматический домен MUC1-C (MUC1-CD) функционирует в качестве субстрата для c-Src (Li et al., 2001), c-Abl (Raina et al., 2006), протеин-киназы Cδ (Ren et al., 2002) и гликоген-синтаза-киназы 3β (Li et al., 1998), и напрямую взаимодействует с эффектором Wnt-сигнального пути, β-катенином (Yamamoto et al., 1997; Huang et al., 2005) и опухолевым супрессором, p53 (Wei et al., 2005). Таким образом, хотя олигомеризация, по-видимому, является важной, не существует непосредственных свидетельств о том, что нарушение формирования олигомеров MUC1 имело бы отрицательный эффект на опухолевые клетки, еще меньше известно о способах выполнения этой задачи.
Краткое изложение сущности изобретения
Таким образом, настоящее изобретение относится к способу ингибирования опухолевых клеток, экспрессирующих MUC1 (MUC1-положительных опухолевых клеток), у субъекта, включающему введение указанному субъекту MUC1-пептида длиной по меньшей мере 4 последовательных остатка MUC1 и не более 20 последовательных остатков MUC1, и содержащего последовательность CQC, в которой аминоконцевой цистеин из CQC закрыт на своем NH2-конце по меньшей мере одним аминокислотным остатком, который не должен соответствовать нативной трансмембранной последовательности MUC-1. Пептид может содержать по меньшей мере 5 последовательных остатков MUC1, по меньшей мере 6 последовательных остатков MUC1, по меньшей мере 7 последовательных остатков MUC1, по меньшей мере 8 последовательных остатков MUC1 и, более конкретно, последовательность может включать CQCR (SEQ ID NO:54), CQCRR (SEQ ID NO:50), CQCRRR (SEQ ID NO:51), CQCRRRR (SEQ ID NO:52), CQCRRK (SEQ ID NO:4) или CQCRRKN (SEQ ID NO:53). Пептид может содержать не более 10 последовательных остатков, 11 последовательных остатков, 12 последовательных остатков, 13 последовательных остатков, 14 последовательных остатков, 15 последовательных остатков, 16 последовательных остатков, 17 последовательных остатков, 18 последовательных остатков или 19 последовательных остатков MUC1. Пептид может быть слит с доменом для переноса в клетки, таким как поли-D-R, поли-D-P или поли-D-K. Пептид может содержать все L-аминокислоты, все D-аминокислоты или смесь L- и D-аминокислот.
MUC1-положительной опухолевой клеткой может быть клетка карциномы, клетка лейкемии или клетка миеломы, такая как клетка карциномы простаты или молочной железы. Введение может включать внутривенное, внутриартериальное, внутриопухолевое, подкожное, поверхностное или внутрибрюшинное введение, или местное, зональное, системное или непрерывное введение. Ингибирование может включать остановку роста указанной опухолевой клетки, апоптоз указанной опухолевой клетки и/или некроз опухолевой ткани, включающей указанную опухолевую клетку. Субъектом может быть человек.
Способ может дополнительно включать проведение для указанного субъекта второй противораковой терапии. Второй противораковой терапией может быть хирургическое вмешательство, химиотерапия, радиационная терапия, гормональная терапия, терапия токсинами, иммунотерапия и криотерапия. Вторую противораковую терапию можно осуществлять перед введением указанного пептида, после введения указанного пептида или одновременно с введением указанного пептида. Способ может дополнительно включать стадию оценки экспрессии MUC1 в опухолевой клетке указанного субъекта перед введением указанного пептида, и/или способ может дополнительно включать стадию оценки эффекта указанного пептида на экспрессию MUC1 в опухоли указанного субъекта.
Пептид можно вводить в количестве 0,1-500 мг/кг/день или 10-100 мг/кг/день. Пептид можно вводить ежедневно, например, в течение 7 дней, 2 недель, 3 недель, 4 недель, одного месяца, 6 недель, 8 недель, двух месяцев, 12 недель или 3 месяцев. Пептид можно вводить еженедельно, например, в течение 2 недель, 3 недель, 4 недель, 6 недель, 8 недель, 10 недель или 12 недель.
В другом варианте осуществления изобретение относится к фармацевтической композиции, содержащей: (а) MUC1-пептид длиной по меньшей мере 4 последовательных остатка MUC1 и не более 20 последовательных остатков MUC1, и содержащий последовательность CQC, в которой аминоконцевой цистеин из CQC закрыт на своем NH2-конце по меньшей мере одним аминокислотным остатком, который не должен соответствовать нативной трансмембранной последовательности MUC-1; и (b) фармацевтически приемлемый носитель, буфер или разбавитель. Длина пептида может составлять по меньшей мере 5, 6, 7 или 8 последовательных остатков MUC1. Длина пептида может составлять не более 10 последовательных остатков, 11 последовательных остатков, 12 последовательных остатков, 13 последовательных остатков, 14 последовательных остатков, 15 последовательных остатков, 16 последовательных остатков, 17 последовательных остатков, 18 последовательных остатков или 19 последовательных остатков MUC1. Пептид может быть слит с доменом для переноса в клетку, таким как поли-D-R, поли-D-P или поли-D-K, или с доменом для трансдукции клеток, таким как домен для трансдукции клеток белка HIV tat. Длина пептида может составлять по меньшей мере 8 аминокислотных остатков, и по меньшей мере два, не примыкающих друг к другу остатка, образуют мостик через свои боковые цепи. Мостик может включать линкер, химически модифицированные боковые цепи или углеводородную сшивку. Линкеры могут содержать модификации, которые стабилизируют альфа-спиральную структуру указанного пептида. Буфер может содержать β-меркаптоэтанол, глутатион или аскорбиновую кислоту, или другой восстанавливающий агент, который поддерживает пептид в мономерном состоянии.
В еще одном варианте осуществления изобретение относится к способу ингибирования олигомеризации и ядерного транспорта MUC1 в клетке, включающему контактирование клетки, экспрессирующей MUC1, с MUC1-пептидом длиной по меньшей мере 4 последовательных остатка MUC1 и не более 20 последовательных остатков MUC1, и содержащим последовательность CQC, в которой аминоконцевой цистеин из CQC закрыт на своем NH2-конце по меньшей мере одним аминокислотным остатком, который не должен соответствовать нативной трансмембранной последовательности MUC-1. Пептид может содержать по меньшей мере 5 последовательных остатков MUC1, по меньшей мере 6 последовательных остатков MUC1, по меньшей мере 7 последовательных остатков MUC1, по меньшей мере 8 последовательных остатков MUC1, и, более конкретно, последовательность может содержать CQCR, CQCRR, CQCRRR, CQCRRRR, CQCRRK или CQCRRKN. Пептид может содержать не более 10 последовательных остатков, 11 последовательных остатков, 12 последовательных остатков, 13 последовательных остатков, 14 последовательных остатков, 15 последовательных остатков, 16 последовательных остатков, 17 последовательных остатков, 18 последовательных остатков или 19 последовательных остатков MUC1. Пептид может быть слит с доменом для переноса в клеток, таким как поли-D-R, поли-D-P или поли-D-K. Пептид может содержать все L-аминокислоты, все D-аминокислоты или смесь L- и D-аминокислот.
Клеткой, экспрессирующей MUC1, может быть опухолевая клетка, такая как клетка карциномы, клетка лейкемии или клетка миеломы, такая как клетка карциномы простаты или молочной железы. Опухолевая клетка может находиться в живом субъекте. Субъектом может быть человек.
В еще одном варианте осуществления изобретение относится к пептидомиметику, который имитируют структуру и способность к связыванию MUC1 MUC1-пептида длиной по меньшей мере 4 последовательных остатка MUC1 и не более 20 последовательных остатков MUC1, и содержащего последовательность CQC, в которой аминоконцевой цистеин из CQC закрыт на своем NH2-конце по меньшей мере одним аминокислотным остатком, который не должен соответствовать нативной трансмембранной последовательности MUC-1. Дополнительный вариант осуществления изобретения относится к MUC1-пептиду длиной по меньшей мере от 3 последовательных остатков MUC1 и не более 20 последовательных остатков MUC1, и содержащему последовательность CQC, причем все аминокислотные остатки указанного пептида являются D-аминокислотами. Пептид может дополнительно содержать последовательность KRRCQC (SEQ ID NO:49).
Раковой клеткой может быть, например, клетка рака молочной железы, рака легких, рака толстой кишки, рака поджелудочной железы, рака почек, рака желудка, рака печени, рака костей, гематологического рака, рака нейрональной ткани, меланомы, рака яичников, рака яичек, рака простаты, рака шейки матки, вагинального рака или рака мочевого пузыря.
Также изобретение охватывает способы уничтожения раковой клетки. Способы могут включать получение субъектом одного или нескольких дополнительных методов лечения перед, после или одновременно с проведением описанных выше способов. Методы лечения могут представлять собой, например, одну или несколько форм ионизирующей радиации и/или один или несколько химиотерапевтических агентов. Одним или несколькими химиотерапевтическими агентами могут быть, например, цисплатин, карбоплатин, прокарбазин, мехлоретамин, циклофосфамид, камптотецин, ифосфамид, мелфалан, хлорамбуцил, бисульфан, нитрозомочевина, дактиномицин, даунорубицин, доксорубицин, блеомицин, пликомицин, митомицин, этопозид, верампил, подофиллотоксин, тамоксифен, таксол, трансплатин, 5-фторурацил, винкристин, винбластин, метотрексат или аналог любого из указанных выше соединений. Также, в качестве комбинированных методов лечения предусмотрены гормональная терапия, иммунотерапия, терапия токсинами, криотерапия и хирургическое вмешательство.
Предусмотрено, что любой способ или композицию, описанную в настоящем описании, можно осуществлять применительно к любому другому способу или композиции, описанной в настоящем описании.
Использование единственного числа в связи с термином «содержащий» («включающий») в формуле изобретения и/или описании изобретения может означать «один», но также соответствует значению «один или несколько», «по меньшей мере один» и «один или более одного». Слово «примерно» означает плюс или минус 5% от указанного числа.
Другие цели, признаки и преимущества настоящего изобретения будут очевидны из приведенного ниже следующего подробного описания. Однако следует понимать, что подробное описание и конкретные примеры, которые указывают на определенные варианты осуществления изобретения, приведены только для иллюстративных целей, поскольку из подробного описания для специалистов в данной области будут очевидны различные изменения и модификации, входящие в сущность и объем изобретения.
Краткое описание фигур
Приведенные ниже фигуры представляют собой часть настоящего описания и включены для дополнительной демонстрации некоторых аспектов настоящего изобретения. Изобретение можно лучше понять с помощью одной или нескольких таких фигур вместе с подробным описанием.
Фиг.1A-D. MUC1/CQC-пептид блокирует олигомеризацию MUC1. (Фиг.1A) Схематично представлена субъединица MUC1-C и показана 72-аминокислотная последовательность MUC1-CD. N-концевой пептид MUC1/CQC (затемненная последовательность) и мутированный N-концевой пептид MUC1/AQA длиной 15 аминокислот были синтезированы с доменом для трансдукции поли-dArg. (Фиг.1B) Пептиды His-MUC1-CD (1,4 мг/мл) иммобилизовали на сенсорном чипе для системы BIAcore. Пептид MUC1/CQC пропускали через чип в концентрации 10 мкМ. Исходные данные по связыванию анализировали с помощью программного обеспечения BIAevaluation software version 3.0 и приводили к модели связывания Лангуира 1:1. (Фиг.1С) Очищенный пептид His-MUC1-CD (1,5 мг/мл) инкубировали с PBS, MUC1/CQC, 200 мкМ, или MUC1/AQA, 200 мкМ, в течение 1 часа при комнатной температуре. Белки разделяли электрофорезом ДСН-полиакриламидном геле в невосстанавливающих условиях и анализировали иммуноблоттингом с антителами к MUC1-C. (Фиг.1D) Клетки 293 транзиентно трансфицировали для экспрессии «пустого» вектора или GFP-MUC1-CD и Flag-MUC1-CD. Через 48 часов после трансфекции клетки обрабатывали MUC1/CQC или MUC1/AQA, 5 мкМ, в течение 3 дней. Затем клетки собирали для иммуноблоттинга с антителами к MUC1-C (левая панель). Также проводили иммуноосаждение общих клеточных лизатов анти-Flag антителами и проводили иммуноблоттинг полученных осадков с указанными антителами (правые панели).
Фиг.2А-С. Пептид MUC1/CQC блокирует ядерную локализацию MUC1-C. (Фиг.2А) Клетки инкубировали с меченным FITC пептидом MUC1/CQC (5 мкМ) в течение указанных периодов времени и затем анализировали с помощью проточной цитометрии. В каждую из панелей включен средний показатель флуоресценции (MFI). (Фиг.2В-С) Клетки ZR-75-1 (фиг.2B) и MCF-7 (фиг.2C) инкубировали в присутствии 5 мкМ пептидов MUC1/CQC или MUC1/AQA в течение 3 дней. Проводили иммуноблоттинг общих клеточных лизатов (ОКЛ) (левые панели) и ядерных лизатов (правые панели) с указанными антителами.
Фиг.3A-D. Пептид MUC1/CQC вызывает торможение в S-фазе и некроз. Клетки ZR-75-1 (фиг.2A-B) и MCF-7 (фиг.2C-D) обрабатывали пептидами MUC1/CQC или MUC1/AQA (5 мкМ) в течение 3 и 4 дней. Клетки фиксировали и анализировали распределение по фазам клеточного цикла с помощью проточной цитометрии (фиг.2А и 2С). Процент клеток в G1-, S- и G2/M-фазах включен в панели. Клетки также окрашивали пропидиййодидом и анализировали с помощью проточной цитометрии на некроз (фиг.2B и 2D). Процент некротических клеток включен в панели.
Фиг.4А-Е. Селективность пептида MUC1/COC в отношении клеток рака молочной железы, экспрессирующих MUC1. (Фиг.4A) Клетки ZR-75-1 стабильно инфицировали «пустым» лентивирусом (вектором) или лентивирусом, экспрессирующим киРНК к MUC1. Иммуноблоттинг лизатов инфицированных клеток проводили с указанными антителами. (Фиг.4В) Клетки ZR-75-1, несущие вектор, оставляли необработанными (ромбы), а клетки ZR-75-1, несущие вектор (квадраты) и клетки ZR-75-1, несущие киРНК к MUC1 (треугольники), обрабатывали пептидом MUC1/CQC в течение указанных периодов времени. Число живых клеток определяли по исключению красителя трипанового синего. (Фиг.4С) Клетки 293 оставляли необработанными (ромбы) и обрабатывали 5 мкМ пептидов MUC1/CQC (квадраты) или MUC1/AQA (треугольники) в течение указанных периодов времени. Число живых клеток определяли по исключению красителя трипанового синего. (Фиг.4D) Клетки MCF-10A оставляли необработанными (левая панель) и обрабатывали 5 мкМ пептидов MUC1/CQC (средняя панель) или MUC1/AQA (правая панель). Через 3 дня анализировали распределение по фазам клеточного цикла. (Фиг.4Е) Клетки MCF-10A оставляли необработанными (ромбы) и обрабатывали 5 мкМ пептидов MUC1/CQC (квадраты) или MUC1/AQA (треугольники) в течение указанных периодов времени. Число живых клеток определяли по исключению красителя трипанового синего.
Фиг.5А-С. Пептид MUC1/CQC блокирует рост ксенографтов опухоли молочной железы, ZR-75-1. (Фиг.5A) 4-6-недельным самкам мышей Balb-c nu/nu имплантировали капсулы с 17-β-эстрадиолом. Через 24 часа в подвздошную область вводили подкожно клетки рака молочной железы, ZR-75-1, заключенные в матригель. Когда объем опухоли достигал ~150 мм3, мышей распределяли соответствующими парами по группам и вводили с помощью внутрибрюшинных инъекций PBS (контроль носителя; закрашенные квадраты), 50 мг/кг пептида MUC1/AQA (контрольный пептид; незакрашенные квадраты) или 10 мг/кг MUC1/CQC-пептида (закрашенные треугольники) ежедневно в течение 21 дня. Другая группа получала 50 мг/кг пептида MUC1/CQC ежедневно в течение 6 дней (незакрашенные треугольники). Мышей взвешивали дважды в неделю, и измерение опухоли проводили каждые 4 дня. (Фиг.5В и 5С). На 24-й день (стрелка) опухоли, собранные у контрольной группы и группы, получавшей 50 мг/кг/день в течение 6 дней, окрашивали H&E (гематоксилином/эозином) (фиг.5B) и антителами к MUC1 (фиг.5C).
Фиг.6А-В. Пролонгированные эффекты MUC1/CQC-пептида на опухоли ZR-75-1. (Фиг.6А) Мышам вводили с помощью инъекций клетки ZR-75-1, как описано в подписях к фиг.5А. Когда объем опухоли достигал ~275 мм3, мышей распределяли соответствующими парами по группам и вводили с помощью внутрибрюшинных инъекций PBS (контроль носителя; сплошные квадраты), 50 мг/кг пептида MUC1/AQA (контрольный пептид; незакрашеные квадраты) или 30 мг/кг пептида MUC1/CQC (закрашенные квадраты) ежедневно в течение 21 дня. Контрольных мышей забивали на 32-й день, когда объем опухоли достигал ~1200 мм3. За получавшими воздействие мышами вели наблюдение до 52-го дня, когда опухоли собирали для окрашивания H&E (Фиг.6B).
Фиг.7. 7-членный пептид MUC1 ингибирует карциному простаты. Клетки DU145 карциномы простаты обрабатывали 5 мкМ короткого CQC-пептида (7-членного) или 5 мкМ длинного CQC-пептида (15-членного) в течение 4 дней. Рост клеток измеряли с помощью МТТ-анализа. Данные представлены как процент ингибирования роста относительно необработанных клеток (контроль).
Фиг.8. Последовательности соединенных углеводородной сшивкой MUC1-CD-пептидов.
Фиг.9А. Эффекты соединенных углеводородной сшивкой MUC1-CD-пептидов на рост клеток немелкоклеточной легочной карциномы H1650. Для оценки чувствительности к ингибированию функции MUC1 клетки немелкоклеточной легочной карциномы, H1650, обрабатывали 1 и 5 мкМ соединенных углеводородной сшивкой MUC1/CQC-пептидов (GO-200-1B) в течение 7 дней. Обработка клеток Н1650 5 мкМ GO-200-1B сопровождалась значительным ингибированием роста и затем снижением числа клеток.
Фиг.9В. Эффект GO-200-2B на пролиферацию клеток. Клеточную линию H-1975 немелкоклеточной легочной карциномы выращивали в среде DMEM с 10% температурно-инактивированной фетальной телячьей сыворотки, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 2 ммоль/л L-глутамина. Клетки пересевали через один день после обработки. Клетки обрабатывали 5 мкМ GO-200-2B в течение 3 дней, и жизнеспособность клеток определяли по исключению трипанового синего.
Фиг.10. Эффект различных MUC1-CD-пептидов (содержащих CQC-область) на рост гормонозависимых клеток карциномы молочной железы. Для определения влияния воздействия различных содержащих CQC-область MUC1-CD-пептидов, клетки карциномы молочной железы ZR-75-1 обрабатывали различными пептидами в концентрации 5 мкМ в течение 4 дней и контролировали пролиферацию клеток. Несомненно наблюдалось значительное ингибирование роста клеток по сравнению с необработанными клетками.
Фиг.11. Эффект различных MUC1-CD-пептидов (содержащих CQC-область) на рост клеток немелкоклеточной легочной карциномы. Клетки немелкоклеточной легочной карциномы А549 обрабатывали 5 мкМ GO-203, GO-203-2 или GO-203cyc в течение 7 дней. Число живых клеток определяли на 7-й день по исключению трипанового синего, а процент ингибирования роста вычисляли, сравнивая клеточный рост с необработанными клетками.
Фиг.12. Эффект различных MUC1-CD-пептидов (содержащих CQC-область) на рост клеток немелкоклеточной легочной карциномы Н1975. Клетки немелкоклеточной легочной карциномы Н1975 обрабатывали 5 мкМ различных содержащих CQC-область MUC1-CD-пептидов в течение 6 дней. Число живых клеток определяли на 6-й день по исключению трипанового синего. Результаты демонстрируют, что обработка клеток Н1975 5 мкМ различных пептидов сопровождалась значительным ингибированием роста.
Фиг.13. Эффект различных MUC1-CD-пептидов (содержащих CQC-область) на рост клеток «тройной негативной» карциномы молочной железы. Клетки «тройной негативной» карциномы молочной железы MDA-MB-231 обрабатывали 5 мкМ различных содержащих CQC-область MUC1-CD-пептидов в течение 6 дней. Число живых клеток определяли на 6-й день по исключению трипанового синего. Результаты демонстрируют, что обработка клеток MDA-MB-231 различными пептидами сопровождалась значительным ингибированием роста.
Фиг.14. Эффект более коротких пептидов GO-203 на пролиферацию клеток карциномы молочной железы ZR-75-1. Клетки рака молочной железы человека ZR-75-1 выращивали в среде RPMI1640 с 10% температурно-инактивированной фетальной телячьей сыворотки, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина. Клетки обрабатывали различными пептидами с концентрацией 5 мкМ ежедневно в течение 4 дней, и жизнеспособность клеток определяли по исключению трипанового синего. В отличие от GO-210 обработка клеток карциномы молочной железы ZR-75-1 5 мкМ пептидов GO-203 (SEQ ID NO:53), GO-207 (SEQ ID NO:4), GO-208 (SEQ ID NO:50) и GO-209 (SEQ ID NO:54) ежедневно в течение 4 дней сопровождалось значительным ингибированием роста.
Фиг.15A-D. Эффекты GO-203 в комбинации с различными противораковыми лекарственными средствами. Клетки ZR-75-1 обрабатывали указанными концентрациями цисплатина (фиг.15А), доксорубицина (фиг.15В), rh-TNF-α (фиг.15C) и таксола (фиг.15D) отдельно и в комбинации с GO-203. Для цисплатина, доксорубицина и таксола обработка была последовательной, когда клетки обрабатывали этими агентами в течение 72 часов, с последующим воздействием 5 мкМ GO-203 в течение 72 часов. В случае исследований с rh-TNF на клетки воздействовали различными концентрациями rh-TNF отдельно и в комбинации с 5 мкМ GO-203 в течение 72 часов. Для определения выживаемости клеток использовали MTS-анализ.
Фиг.16. GO-203 обладает аддитивным или синергическим действием относительно противораковых агентов. На графиках показаны комбинационные индексы относительно различных уровней воздействия (фракции пораженных клеток). Уровень воздействия получали, обрабатывая клетки указанными комбинациями противораковых лекарственных средств и GO-203.
Описание иллюстративных вариантов осуществления изобретения
I. Настоящее изобретение
Роль белка MUC1 в раковых заболеваниях интенсивно исследуется авторами изобретения и другими учеными. Как обсуждалось выше, белок MUC1 человека представляет собой гетеродимерный гликопротеин, транслируемый в виде единого полипептида и расщепляемый на N- и С-концевые субъединицы в эндоплазматическом ретикулуме (Ligtenberg et al., 1992; Macao et al., 2006; Levitin et al., 2005). Нарушенная сверхэкспрессия MUC1, обнаруживаемая в большинстве карцином человека (Kufe et al., 1984), обуславливает не зависящий от прикрепления рост и онкогенность (Li et al., 2003a; Huang et al., 2003; Schroeder et al., 2004; Huang et al., 2005). В других исследованиях было показано, что сверхэкспрессия MUC1 придает устойчивость к апоптозу, вызываемому окислительным стрессом и генотоксичными противораковыми агентами (Yin and Kufe, 2003; Ren et al., 2004; Raina et al., 2004; Yin et al., 2004; Raina et al., 2006; Yin et al., 2007).
Семейство связанных и секретируемых муцинов функционирует, обеспечивая защитный барьер поверхности эпителиальных клеток. При повреждении эпителиального слоя, плотные связи между соседними клетками разрушаются, и теряется полярность, поскольку клетки начинают индуцируемую герегулином программу восстановления (Vermeer et al., 2003). MUC1-N сбрасывается с поверхности клеток (Abe and Kufe, 1989), оставляя MUC1-C функционировать в качестве передатчика стрессовых сигналов от окружения в клетку. В этом случае MUC1-C образует комплексы на клеточной поверхности с членами семейства ErbB-рецепторов, и MUC1-C транслоцируется в ядро клетки в ответ на стимуляцию герегулином (Li et al., 2001; Li et al., 2003c). MUC1-C также функционирует, соединяя вместе сигнальные пути ErbB-рецептора и Wnt в результате прямого взаимодействия между цитоплазматическим доменом MUC1 (MUC1-CD) и членами катенинового семейства (Huang et al., 2005; Li et al., 2003c; Yamamoto et al., 1997; Li et al., 1998; Li et al., 2001; Li and Kufe, 2001). В других исследованиях было продемонстрировано, что MUC1-CD фосфорилируется гликоген-синтаза-киназой 3β, c-Src, белковой киназой Cδ и c-Abl (Raina et al., 2006; Li et al., 1998; Li et al., 2001; Ren et al., 2002).
Механизмы, отвечающие за ядерную локализацию MUC1-C, не ясны. Содержащие классический сигнал ядерной локализации (NLS) белки импортируются в ядро клетки, сначала связываясь с импортином α, а затем, в свою очередь, с импортином β (Weis, 2003). Транспортный комплекс импортинов α/β прикрепляется к ядерной поре, связываясь с нуклеопоринами, и переносится через нее с помощью механизма, зависимого от ГТФазы Ran. Классические NLS состоят либо из одного сигнального участка с кластером из 4-5 основных аминокислот или из двух участков с двумя кластерами основных аминокислот, разделенных линкером из 10-12 аминокислот. MUC1-CD содержит RRK-мотив, который не соответствует прототипному NLS с одним сигнальным участком (Hodel et al., 2002). Однако некоторые белки, содержащие неклассические NLS, транспортируются через ядерные поры, напрямую связываясь с импортином β (Kau et al., 2004). Импортин β связывается с несколькими нуклеопоринами (Ryan and Wente, 2000), включая Nup62, который выходит как на цитоплазматическую, так и нуклеоплазматическую стороны комплексов ядерных пор (Percipalle et al., 1997). В других исследованиях было показано, что импорт β-катенина в ядро клетки осуществляется по импортин- и нуклеопорин-независимому механизму (Suh and Gumbiner, 2003).
В 2006 году авторы изобретения опубликовали данные о том, что MUC1 импортируется в ядро клетки с помощью механизма, включающего связывание с Nup62. Авторы также продемонстрировали, что MUC1 образует олигомеры через CQC-мотив в цитоплазматическом домене MUC1, и что олигомеризация MUC1 необходима для ядерного импорта. В этом исследовании авторы продолжили данную работу для дальнейшего понимания роли, которую CQC-мотив играет в образовании олигомеров. Авторы изобретения продемонстрировали, что короткие пептиды, соответствующие этой области, способны нарушать образование олигомеров MUC1, ингибируя его транспорт в ядро опухолевых клеток. Эти пептиды способны ингибировать рост опухолевых клеток, а также вызывать апоптоз в таких клетках и даже некроз в опухолевой ткани. Эти и другие аспекты изобретения подробно описаны ниже.
II. MUC1
A. Структура
MUC1 представляет собой гликопротеин муцинового типа, который экспрессируется на апикальных границах нормальных секреторных эпителиальных клеток (Kufe et al., 1984). MUC1 образует гетеродимер после синтеза в виде единого полипептида и расщепления предшественника на две субъединицы в эндоплазматическом ретикулуме (Ligtenberg et al., 1992). Расщепление может опосредоваться автокаталитическим процессом (Levitan et al., 2005). N-концевая субъединица MUC1 с молекулярной массой, превышающей 250 кДа (MUC1 N-ter, MUC1-N), содержит различное число 20-аминокислотных несовершенных тандемных повторов с высоко консервативными вариациями и модифицирована О-связанными гликанами (Gendler et al., 1988; Siddiqui et al., 1988). MUC1-N прикреплена к клеточной поверхности в результате димеризации с С-концевой субъединицей массой примерно 23 кДа (MUC1 C-ter, MUC1-C), которая содержит 58-аминокислотную внеклеточную область, 28-аминокислотный трансмембранный домен и 72-аминокислотный цитоплазматический домен (CD; SEQ ID NO:1) (Merlo et al., 1989). Последовательность MUC1 человека показана ниже:
Полужирным шрифтом выделена последовательность цитоплазматического домена, и подчеркнутая часть последовательности соответствует пептиду, ингибирующему олигомеризацию (SEQ ID NO:3), описанному в примерах.
При трансформации нормального эпителия в карциному MUC1 аномально экспрессируется в цитозоле и по всей клеточной мембране (Kufe et al., 1984; Perey et al., 1992). Ассоциированный с клеточной мембраной MUC1 направляется в эндосомы путем клатрин-опосредованного эндоцитоза (Kinlough et al., 2004). Кроме того, MUC1-С, но не MUC1-N, транспортируется в ядро клетки (Baldus et al., 2004; Huang et al., 2003; Li et al., 2003a; Li et al., 2003b; Li et al., 2003c; Wei et al., 2005; Wen et al., 2003) и митохондрии (Ren et al., 2004).
В. Функция
MUC1 взаимодействует с членами семейства ErbB-рецепторов (Li et al., 2001b; Li et al., 2003c; Schroeder et al., 2001) и с эффектором Wnt-сигнального пути, β-катенином (Yamamoto et al., 1997). Рецептор фактора роста эпидермиса и c-Src фосфорилируют цитоплазматический домен MUC1 (MUC1-CD) по Y-46 и, тем самым, усиливают связывание MUC1 и β-катенина (Li et al., 2001a; Li et al., 2001b). Связывание MUC1 и β-катенина также регулируется гликоген-синтаза-киназой 3β и белковой киназой Cδ (Li et al., 1998; Ren et al., 2002). MUC1 колокализуется с β-катенином в ядре (Baldus et al., 2004; Li et al., 2003a; Li et al., 2003c; Wen et al., 2003) и совместно с ним активирует транскрипцию генов-мишеней Wnt-сигнального пути (Huang et al., 2003). В других исследованиях было показано, что MUC1 также напрямую связывается с р53 и регулирует транскрипцию генов-мишеней р53 (Wei et al., 2005). Следует отметить, что сверхэкспрессия MUC1 является достаточной для индукции независимого от прикрепления роста и онкогенности (Huang et al., 2003; Li et al., 2003b; Ren et al., 2002; Schroeder et al., 2004).
Большинство митохондриальных белков кодируются ядерной ДНК и импортируются в митохондрии с помощью комплексов-переносчиков во внешней и внутренней митохондриальных мембранах. Некоторые митохондриальные белки содержат N-концевые митохондриальные сигнальные последовательности и взаимодействуют с Tom20 во внешней митохондриальной мембране (Truscott et al., 2003). Другие митохондриальные белки содержат внутренние сигнальные последовательности и взаимодействуют с Tom70-рецептором (Truscott et al., 2003). В недавних исследованиях было показано, что митохондриальные белки без внутренних сигнальных последовательностей доставляются к Tom70 с помощью комплекса, состоящего из HSP70 и HSP90 (Young et al., 2003).
III. MUC1-пептиды
A. Структура
Настоящее изобретение предусматривает разработку, продуцирование и использование различных MUC1-пептидов. Структурные признаки таких пептидов следующие. Во-первых, пептиды имеют не более 20 последовательных аминокислотных остатков из MUC1. Поэтому термин «пептид, имеющий не более 20 последовательных остатков», даже включая термин «содержащий» не может истолковываться, как включающий большее число последовательных аминокислотных остатков MUC1. Во-вторых, пептиды должны содержать CQC-мотив, и могут также включать CQCR-мотив, CQCRR-мотив и CQCRRK-мотив. Поэтому, пептиды будут иметь по меньшей мере эти три последовательных остатка из MUC1-C-домена. В-третьих, пептиды будут иметь по меньшей мере один аминокислотный остаток, присоединенный к NH2-концу первого остатка цистеина в CQC-мотиве, так что первый остаток цистеина будет «закрыт» по меньшей мере одной аминокислотой, присоединенной к нему. Этот остаток может принадлежать MUC1 (например, входить в трансмембранный домен), может представлять собой случайно выбранную аминокислоту (любую из 20 природных аминокислот или их аналогов) или может являться частью другой пептидной последовательности (например, последовательности, используемой для очистки, стабилизирующей последовательности или домена, обеспечивающего доставку в клетку).
Как правило, длина пептида будет составлять 50 аминокислотных остатков или меньше, в свою очередь, содержащих не более 20 последовательных остатков из MUC1. Общая длина может составлять 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 остатков. Предусмотрены диапазоны размеров пептидов из 4-50 остатков, 5-50 остатков, 6-50 остатков, 7-50 остатков, 7-25 остатков, 4-20 остатков, 5-20 остатков, 6-20 остатков, 7-20 остатков и 7-15 остатков. Число последовательных аминокислотных остатков из MUC1 может составлять 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20. Предусмотрены диапазоны последовательных аминокислотных остатков из 4-20 остатков, 5-20 остатков, 6-20 остатков, 7-20 остатков и 4-15 остатков, 5-15 остатков, 6-15 остатков или 7-15 остатков.
В настоящем изобретении можно использовать L-конфигурацию аминокислот, D-конфигурацию аминокислот или их смесь. Хотя L-аминокислоты представляют подавляющее большинство аминокислот в белках, D-аминокислоты найдены в некоторых белках, продуцируемых редко встречающимися морскими организмами, такими как улитки-конусы. Они также являются распространенными компонентами пептидогликанов клеточной стенки бактерий. D-серин может действовать в качестве нейротрансмиттера в мозге. L и D-обозначения для конфигурации аминокислот относятся не к оптической активности самих аминокислот, а к оптической активности изомера глицеральдегида, из которого эту аминокислоту теоретически можно синтезировать (D-глицеральдегид является правовращающими; L-глицеральдегид является левовращающим).
Одной формой пептида, состоящего только из D-аминокислот, является ретроинвертированный пептид. Ретроинвертированная модификация природных полипептидов включает синтетическую сборку аминокислот со стереохимией α-углерода, противоположной стереохимии соответствующих L-аминокислот, т.е. D-аминокислот в обратном порядке относительно природной пептидной последовательности. Ретроинвертированный аналог, поэтому, будет иметь инвертированные концы и инвертированное (противоположное) направление пептидных связей (NH-CO, а не CO-NH), при этом приблизительно сохраняя топологию боковых цепей, как в природной пептидной последовательности. См. патент США 6261569, включенный в настоящее описание посредством ссылки.
Как указано выше, настоящее изобретение предполагает слияние или конъюгацию домена для доставки в клетку (также называемого вектором для клеточной доставки, или доменом для трансдукции клеток, CDD/CTD). Такие домены хорошо известны в данной области и обычно представляют собой короткие амфипатические или катионные пептиды