Вакцина для профилактики и лечения ротавирусной инфекции, содержащая гибридный белок в качестве активного агента (варианты)
Иллюстрации
Показать всеИзобретение относится к молекулярной биологии, биотехнологии, медицине и предназначена для профилактики и лечения ротавирусной инфекции. Предложена вакцина против ротавирусной инфекции на основе гибридного белка, охарактеризованного последовательностями SEQ ID NO.: l, SEQ ID NO.: 2, состоящего из иммуногенных эпитопов белков VP6 и VP8, соединенных гибким мостиком (варианты). Также предложена вакцина против ротавирусной инфекции на основе гибридного белка (SEQ ID NO.: 3 - SEQ ID NO.: 6), состоящего из иммуногенных эпитопов белков VP6 и VP8 и адъюванта - фрагментов флагеллина, соединенных гибкими мостиками (варианты). Гибридный белок - активный компонент вариантов вакцины - получают в клетках прокариот и эукариот с использованием технологии рекомбинантной ДНК и разных методик очистки. Показана иммунологическая поливалентность предложенных вариантов вакцины против ротавируса групп А, В и С, показано профилактическое и терапевтическое действие. Использование данных вариантов вакцины позволит обеспечить универсальную защиту человека от ротавирусов. 6 з.п. ф-лы, 6 ил., 1 табл., 9 пр.
Реферат
Группа изобретений относится к молекулярной биологии, биотехнологии, медицине и может быть использована в качестве средств для профилактики и лечения ротавирусной инфекции, вызываемой различными штаммами ротавирусов.
Термин "гибридный (химерный) белок" в данном тексте обозначает белок, полученный в результате экспрессии рекомбинантной молекулы ДНК, в которой соединены друг с другом в одной рамке считывания кодирующие участки нескольких разных генов.
По данным Всемирной организации здравоохранения, ротавирус (род Rotavirus, семейство Rotaviridiae) является одной из ведущих причин возникновения тяжелой диареи, приводящей к дегидратации организма у детей младшего возраста. Большинство детей инфицируется до достижения 5-летнего возраста. Большинство случаев острых ротавирусных гастроэнтеритов наблюдается в странах с низкими доходами населения, при этом поражаются дети в возрасте до 1 года. В большинстве стран с низкими доходами населения в Азии и Африке эпидемиология ротавирусной инфекции характеризуется эпизодами относительно интенсивной циркуляции вируса по сравнению с фоновой передачей на протяжении года. Однако в странах умеренного климата с высокими доходами типичной является четкая зимняя сезонность [1].
Ротавирус повреждает энтероциты, расположенные на микроворсинках тонкого кишечника, что приводит к снижению абсорбции и диарее. Широкий спектр клинических проявлений колеблется от преходящей легкой диареи до тяжелой диареи и рвоты, вызывающих дегидратацию, нарушение электролитного баланса, шок и при отсутствии лечения смерть.
Иммунитет к ротавирусной инфекции в большинстве случаев возникает в раннем детстве после перенесенного заболевания. Иммунитет нестойкий, поэтому у взрослых с низким уровнем антител заболевание может повториться. Невосприимчивость у переболевших обусловлена не только гуморальными, но и секреторными антителами.
Зарегистрированные вакцины для профилактики ротавирусной инфекции содержат живые аттенуированные штаммы ротавируса человека и/или животного, которые размножаются в кишечнике человека. На международном рынке имеются две ротавирусные вакцины: моновалентная (RV1) и пентовалентная (RV5). Вакцина RV1 получена на основе человеческого штамма, тогда как вакцина RV5 содержит 5 рекомбинантных вирусов, полученных на основе человеческого и бычьего штаммов ротавируса.
Использование вакцин на основе рекомбинантных белков позволяет избежать рисков, связанных с введением вируса в организм, пусть и аттенуированного. Так, выбранные участки белков не несут функций природных белков ротавирусов (например, гемагглютинирующая активность) и, соответственно, не вызывают побочных эффектов, характерных для вакцин, полученных с использованием ротавирусов. Вакцинные препараты, получаемые с помощью технологии рекомбинантной ДНК, обладают большей фармацевтической чистотой (не содержат аллергенов в виде яичных белков), чем вирионы, выращенные в куриных эмбрионах, и не содержат консервантов (формальдегид, мертиолят). Технология получения рекомбинантных белков с использованием клеток бактерий позволяет получить в течение 2-3 дней в ферментерах небольшого объема, занимающих меньшую площадь и требующих меньших технических ресурсов по сравнению с культивированием живого вируса, аналогичное или большее количество вакцинных доз (10-литровый ферментер обеспечивает в среднем 1000000 доз).
Белок наружного капсида VP4 ответственен за адаптацию ротавирусов к росту in vitro, контролирует их вирулентность на уровне организма, является вирусным гемагглютинином и, по-видимому, обеспечивает проникновение вируса в клетку. В экспериментах с нейтрализующими моноклональными антителами к VP4 показано, что они сообщают организму протективный иммунитет против гомологичного и некоторых гетерологичных серотипов ротавируса.
Белок VP8 является N-концевым триптическим фрагментом белка VP4. Данный белок (VP8) является высокоиммуногенным полипептидом и индуцирует эффективную гомотипическую защиту против заболевания, причем эффект наблюдали у детенышей, привитых данным полипептидом самок. Белок VP8 содержит пять нейтрализующих эпитопов.
Использование эпитопов белка VP8 для создания вакцины от ротавирусной инфекции позволит обеспечить протективный иммунитет против гомологичного и некоторых гетерологичных серотипов ротавируса.
Полипептид внутреннего капсида VP6 (42 кД) является мажорным белком вириона. Введение данного белка индуцирует выработку нейтрализирующих секреторных антител (IgA). Такие антитела содержатся в большом количестве в молоке кормящей самки, что обеспечивает защиту новорожденных животных [2].
Таким образом, защиту ребенка от заболевания ротавирусной инфекцией возможно обеспечить вакцинацией матери белками VP6, VP8. Антитела IgA секретируются также на эпителиях, что обеспечивает защиту взрослого от инфекции. Удобнее вакцинировать единой конструкцией, содержащей последовательности VP6, VP8. Продукция химерного белка, содержащего не полноразмерные белки, а их иммуногенные эпитопы, более выгодна.
Известен химерный белок, содержащий субъединичный белок ротавируса или его иммуногенную часть, а также другой белок, адъювант используется в совокупности с химерным белком [3]. Другой белок не влияет на экспрессию и иммуногенность белка ротавируса, предотвращает формирование комплексов ротавирусным субъединичным белком и обеспечивает его очистку. Ротавирусный субъединичный белок выбирают из VP1, VP2, VP3, VP4, VP6, VP7, NSP1, NSP2, NSP3, NSP4 или NSP5.
Известно изобретение, по которому в трансформанте экспрессируется эпитоп белка вируса, вызывающего эпизоотическую диарею свиней (PEDV), и белок ротавируса (VP8 или BVP5) [4]. Данные полипептиды функционально связаны в единой векторной конструкции. Заявлена также вакцинная композиция, которая может содержать получаемый в трансформанте рекомбинантный белок. Назначение вакцины - индуцировать формирование нейтрализующих указанные вирусы антител и уменьшать степень заражения ими животных. Создается рекомбинантный вектор, вектор вводят в Agrobacterium с последующей трансформацией клеток растений данными бактериями.
Известна векторная конструкция для экспрессии целевого гена в растениях, целевым геном заявлен ген из группы GFP, ротавирусных белков VP6, VP2, VP4 и VP7 [5]. Предусмотрена трансформация клеток растений бактериями, содержащими описанную векторную конструкцию.
Перспективнее использовать несколько генов, кодирующих иммуногенные эпитопы белков ротавируса в одной конструкции и, соответственно, один гибридный белок, обеспечивающий более широкий спектр активностей, соответственно, обеспечивающий большую степень защиты от патогена.
Известен рекомбинантный белок-носитель (VP6), в последовательность которого введены эпитопы других белков других вирусов с сохранением эпитопов VP6 на поверхности белка [6].
К недостаткам аналогов можно отнести ограниченность их действия за счет использования в качестве компонента гибридного белка только одного белка ротавируса. Также недостатком аналогов является сложность получения активного белка ввиду сложности его правильной пространственной укладки из-за использования полноразмерного белка ротавируса в качестве компонента гибридного белка.
Прототипом изобретения (гибридный белок SEQ ID NO:1, SEQ ID NO:2) является рекомбинантный химерный белок, несущий эпитопы белков VP4 ротавирусов Р[4]223, Р[4]56 и VP7 ротавируса G1[142], G4[208], P[8]296 и G2[87] [7].
К недостаткам прототипа можно отнести ограниченность иммунного ответа на ротавирусную инфекцию: лишь по одному механизму - синтез нейтрализующих антител, предотвращающих попадание вируса в энтероцит. Такой механизм обеспечивает только профилактический эффект вакцины.
Известен рекомбинантный ген, содержащий нукледотидную последовательность, кодирующую первый эпитопН1-d структурного гена флагеллина Salmonella и хотя бы один эпитоп гетерологичного организма, включенного в последовательность флагеллина таким образом, что флагеллин способен связываться с антителом к флагеллину, причем хотя бы один эпитоп гетерологичного организма помещен вместо ДНК, находящейся между естественными EcoRV сайтами гена H1-d Salmonella [8]. В данном изобретении в составе химерного белка заявлен лишь первый эпитоп гена H1(FliC1) Salmonella, а также в примерах указан белок VP7 в качестве второго возможного элемента конструкции. Использование обоих эпитопов - FliC1, FliC2 - в единой конструкции позволит получить более сильный иммунный ответ на вводимый иммуноген, использование исключительно эпитопов гена H1, связанных гибкими мостиками, а также использование нескольких иммуногенных эпитопов белков, индуцирующих формирование иммунного ответа по разным механизмам, VP6 и VP8, позволит обеспечить комплексную защиту от вируса.
Известны рекомбинантные химерные белки, среди которых заявлены белки, включающие фрагменты VP4, VP7, FIjb: VP4 l-336::VP7::FIjb [9]. Данное изобретение является наиболее близким к предлагаемому (SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6) - прототипом. К недостаткам данной конструкции можно отнести сложность получения активного, растворимого белка за счет возникновения сложностей, связанных с приобретением неправильной третичной структуры гибридным белком значительного размера.
Заявленная группа изобретений относится к объектам одного вида одинакового назначения, обеспечивающим получение одного и того же технического результата (варианты).
Технический результат от использования группы изобретений состоит в упрощении получения активного растворимого гибридного белка за счет уменьшения размера белка благодаря использованию лишь фрагментов белков - иммуногенных эпитопов, связанных гибкими мостиками.
Технический результат от использования группы изобретений также состоит в расширении спектра активностей гибридного белка на основе белков ротавируса - в обеспечении наряду с профилактическим терапевтического действия. Нейтрализующие IgA антитела, связываясь с белком клеточной оболочки вируса (VP8), останавливают проникновение вируса в энтероциты и индуцируют его выведение из клеток, а при связывании белка внутреннего капсида VP6 IgA-антителами непосредственно в энтероците останавливается внутриклеточное размножение вируса. Ввиду этого целесообразно использовать в качестве иммуногена, помимо фрагмента белка VP4, также белок именно внутреннего капсида (VP6), поскольку именно он остается на поверхности вирусной частицы после попадания в энтероцит.
Введение в конструкцию гибридного белка эпитопов белка VP6 ротавируса позволит остановить репликацию вируса внутри энтероцитов за счет выработки антител к данному белку, что окажет терапевтический эффект.
Технический результат от использования группы изобретений главным образом состоит увеличении валентности вакцины против ротавируса: после прививания вакцинами, заявленными в изобретении, у человека вырабатывается иммунитет к ротавирусам групп A-С. После вакцинации в организме вырабатываются антитела на эпитопы белков VP6, VP8 разных ротавирусов. Формируется способность вырабатывать антитела в ответ на попадание в организм ротавируса. В дальнейшем при попадании в организм ротавируса A, В или С иммунный ответ будет быстро вырабатываться, что выразится в том, что удастся избежать заражения либо заболевание пройдет в легкой форме. Такой подход к вакцинации позволит элиминировать данное заболевание.
Технический результат от использования вакцины, содержащей гибридный белок, в состав которого дополнительно введены фрагменты флагеллина (SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6), заключается в увеличении ее иммуногенности и более быстром ответе на терапию и вакцинацию гибридным белком.
Технический результат от использования в качестве адъюванта эпитопов FliC1, FliC2 флагеллина, нетоксичного агента, в приведенной конструкции белка состоит в усилении иммунного ответа и более быстром ответе на терапию и вакцинацию гибридным белком. На данный момент флагеллин является одним из наиболее перспективных и хорошо изученных адъювантов нового поколения. Результаты исследований показывают, что рекомбинантные белки, вводимые с флагеллином, имеют повышенные иммуногенные и антигенные характеристики. Ответы на них регистрируются в более короткие сроки и вызывают более сильный клеточный и гуморальный иммунный ответ [10].
Технический результат от производства лишь одного компонента - гибридного белка - взамен производства множества отдельных компонентов вакцинной смеси (аналоги) выражается в удешевлении и сокращении сроков производства вакцины.
Сущность изобретения
Предложена группа изобретений, представляющая собой вакцины на основе высокоочищенных гибридных белков (SEQ ID NO:1, SEQ ID NO:2), включающих иммуногенные эпитопы белка VP6, иммуногенный эпитоп белка VP8 ротавируса А, фрагмент белка VP6 имеет общие и гомологичные участки с фрагментом белка VP6 ротавируса С, а также гомологичные участки с фрагментом белка VP6 ротавируса В, компоненты соединены гибкими мостиками. К группе изобретений также относятся вакцины, активный компонент которых (описанные гибридные белки) дополнительно содержит компоненты флагеллина FliC1 и FliC2 в качестве адъюванта (SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6), компоненты соединены гибкими мостиками. Представленный фрагмент белка VP6 является консенсусной последовательностью, к которой в процессе естественной инфекции образуются специфические антитела, перекрестно реагирующие с гомологичными эпитопами среди различных штаммов ротавируса групп А, В и С. Данный фрагмент содержит два иммуногенных эпитопа. Использование эпитопов нескольких белков позволяет увеличить эффективность вакцины. Используемый фрагмент белка VP8 содержит один высокоиммуногенный эпитоп. Использование гибких мостиков между эпитопами позволяет сохранить правильную пространственную укладку белка и, соответственно, обеспечивает полноценное функционирование каждого эпитопа.
Вакцины получены способом, включающим создание оптимизированной по кодонному составу для экспрессии в прокариотических либо эукариотических клетках рекомбинантной ДНК, кодирующей гибридный белок (SEQ ID NO.:1, SEQ ID NO.:2, SEQ ID NO.:3, SEQ ID NO.:4, SEQ ID NO.:5, SEQ ID NO.:6), введение такой ДНК в векторную конструкцию, обеспечивающую высокий уровень ее экспрессии в клетках прокариот либо эукариот, введение данной векторной конструкции в клетки прокариот либо эукариот, продукцию гибридного белка в указанном организме, его выделение, очистку и смешивание с физиологически приемлемым носителем.
На основании выбранных аминокислотных последовательностей были рассчитаны нуклеотидные последовательности соответствующих генов с учетом частоты встречаемости кодонов в белоккодирующих генах используемых прокариот либо эукариот, при этом кодоны выбирались с учетом уменьшения dG соответствующих мРНК.
Для получения в соответствии с настоящей группой изобретений гибридных белков могут быть использованы стандартные методы молекулярной биологии и микробиологии, известные специалистам в данной области техники. Такие методы полно представлены в научной литературе.
Краткое описание чертежей
Фиг.1. Динамика гибели мышей, иммунизированных кандидатной вакциной (SEQ ID NO.:6), интраназальное введение, после заражения 10LD/50 ротавируса антигенной группы А.
Фиг.2. Динамика массы тела выживших мышей, иммунизированных кандидатной вакциной (SEQ ID NO.:6), интраназальное введение, после заражения 10LD/50 ротавируса антигенной группы А.
Фиг.3. Динамика гибели мышей, иммунизированных кандидатной вакциной (SEQ ID NO.:5), внутримышечное введение, после заражения 10LD/50 ротавируса антигенной группы В.
Фиг.4. Динамика массы тела выживших мышей, иммунизированных кандидатной вакциной (SEQ ID NO.:5), внутримышечное введение, после заражения 10LD/50 ротавируса антигенной группы В.
Фиг. 5. Динамика гибели мышей, иммунизированных кандидатной вакциной (SEQ ID NO.:2), внутримышечное введение, после заражения 10LD/50 ротавируса антигенной группы С.
Фиг. 6. Динамика массы тела выживших мышей, иммунизированных кандидатной вакциной (SEQ ID NO.:2), внутримышечное введение, после заражения 10LD/50 ротавируса антигенной группы С.
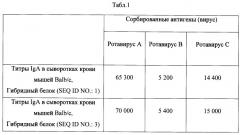
Табл. 1. Титры сывороточных антител (IgA) после двукратной иммунизации мышей гибридным белком (SEQ ID NO.:1, SEQ ID NO.:3).
Список литературы
1. http://www.who.int/immunization/documents/WHO_PP_Rotavirus_2013_summary_R U.pdf-оттиск 10.03.2013.
2. Gil MT, de Souza CO, Asensi M, Buesa J., Homotypic protection against rotavirus-induced diarrhea in infant mice breast-fed by dams immunized with the recombinant VP8* subunit of the VP4 capsid protein. Viral Immunol. 2000; 13(2): 187-200.
3. US 19980106347 P 19981030.
4. KR 20120066559 (A), 20101214.
5. KR 20060013000, 20040805.
6. CN 102643335 (A), 20120417.
7. CN 102643348 (A), 20120417.
8. US 19920837668 19920214-expired.
9. СА 20102698413 20100406.
10. Balaram P, Kien PK, Ismail A. Toll-like receptors and cytokines in immune responses to persistent mycobacterial and Salmonella infections. Int J Med Microbiol. 2009 Mar; 299(3): 177-85. doi: 10.1016 / j.ijmm. 2008.08.004. Epub 2008 Oct 8. Review.
11. Yamada К., Wang J.C., Osawa H. et al. Efficient large-scale transformation of yeast // Biotechniques .- 1998. - V.24. - P.596-598.
12. Bogush V.G. et al., 2009, J. Neuroimmune Pharmacol., v.4, 17-27.
13. Комарова Т.В., Скулачев М.В., Зверева A.C., Шварц A.M., Дорохов Ю.Л., Атабеков И.Г. (2006). Биохимия, 71, 1043-1049.
Осуществление настоящего изобретения
Пример 1. Получение высокоочищенного гибридного белка (SEQ ID NO.:1) для вакцины против ротавирусной инфекции с использованием клеток бактерий E.coli.
1.1. Моделирование гибридного белка.
Спланированный гибридный полипептид имеет 2 домена: VP6, VP8. Для моделирования белка были произведены следующие действия.
1. Поиск иммуногенных эпитопов белков VP6, VP8 с помощью программы CPREDS (http://ailab.cs.iastate.edu/bcpreds/predict.html).
2. Построение модели целого белка для определения ориентации доменов.
3. Построение моделей для каждого домена (с использованием образцов 3D структур и ab initio).
4. Докинг моделей с использованием модели целого белка.
Для получения наиболее реалистичных результатов в автоматическом режиме использовали алгоритм I-Tasser для моделирования белков.
Смоделированный гибридный белок состоит из 175 а.о., представлена его аминокислотная последовательность - SEQ ID NO:1. Анализ аминокислотной последовательности данного белка с помощью программы ProtParam (http://au.expasy.org/tools/protparam.html) показал, что гибридный белок стабилен и имеет молекулярную массу 19,4 кДа, pI 4,41.
1.2. Создание нуклеотидной последовательности, кодирующей гибридный белок.
Перевели аминокислотную последовательность гибридного белка, включающего домены VP6, VP8, в нуклеотидную (525 п.н.), оптимизировав последнюю для экспрессии в клетках E.coli.
Синтез данной нуклеотидной последовательности осуществляли путем удлинения взаимоперекрывающихся олигонуклеотидов согласно описанным методам (Majumder, 1992). Олигонуклеотиды представляли собой фрагменты гибридного гена длиной около 70 нуклеотидов со взаимоперекрывающимися участками длиной около 20 нуклеотидов. Основные требования к праймерам заключались в том, что их длина не должна была превышать 60 нуклеотидов, а участки гибридизации должны были быть не меньше 20 нуклеотидов. Кроме того, на концах олигонуклеотидов не должно было быть длинных участков с повторяющимися G или С. В ряде случаев подбор оптимальных праймеров осуществляли эмпирически путем сдвига праймера по отношению к матрице или изменения длины праймера на 3-6 нуклеотидов. В общей сложности для синтеза гибридного гена длиной 525 п.н. было использовано 20 праймеров. Синтезированные фрагменты по 300 п.н. выделяли с помощью гель-электрофореза и клонировали в плазмидном векторе pGEM-T Easy. Клонирование осуществляли с использованием рестрикционных сайтов Kpnl, SacII, EcoRV, BamHI или посредством "тупых" концов. После секвенирования фрагменты амплифицировали, после чего соединяли в нуклеотидную последовательность гибридного белка путем их сплавления методом полимеразной цепной реакции (ПЦР). После заключительного этапа синтеза гибридного гена путем лигирования фрагментов искусственный ген клонировали в вектор pGEM-T по рестрикционным сайтам KpnI и SacI. Полученный ген был фланкирован дополнительными рестрикционными сайтами EcoRI на 5'-конце и XhoI на 3'-конце. Далее искусственный ген переклонировали в экспрессионный вектор рЕТ24а по рестрикционным сайтам EcoRI и XhoI.
1.3. Создание плазмидной ДНК, кодирующей гибридный белок. Полученный ген клонировали в плазмиде рЕТ24а для последующей экспрессии.
Для этого проводили реакцию лигирования гена и вектора рЕТ24а с использованием соответствующего буфера и лигазы при +20°С в течение 2 часов.
Смесь прогревали при +95°С в течение 10 мин и очищали от солей диализом на нитроцеллюлозных фильтрах с диаметром пор 0,025 мкм (Millipore, США). Диализ проводили против раствора, содержащего 0,5 мМ ЭДТА в 10% глицерине, в течение 10 мин.
1.4. Создание штамма E.coli для амплификации плазмидной ДНК, содержащей гибридный ген.
Полученной плазмидой трансформировали клетки Е. coli штамма DH10B/R (Gibko BRL, США) с генотипом F-mcrA Δ(mrr-hsdRMS-mcrBC) φ80dlacZΔM 15 ΔlасХ74 deoR recA1 endA1 araD139 Δ(ara, leu)769 galU galKλ,- rpsL nupG методом электропорации.
После трансформации клетки инкубировали в SOC-среде (2% бакто-триптон, 0.5% дрожжевой экстракт, 10 мМ NaCl, 2.5 мМ КСl, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкоза) в течение 40 мин при +37°С.
С помощью скрининга клеток E.coli на наличие плазмид на селективной среде, содержащей LB-arap, 100 мкг/мл ампициллина, отбирали колонии клеток E.coli - штамм E.coli для амплификации плазмидной ДНК, содержащей гибридный ген.
Из выросших клонов выделяли плазмидную ДНК с использованием набора Wizard Minipreps DNA Purification System (Promega, США).
Очищенную плазмидную ДНК проверяли с помощью рестрикционного анализа и секвенирования. В ходе работы были отобраны клоны, содержащие фрагменты ДНК требуемого размера в составе плазмиды, из которых такие плазмиды были выделены для дальнейшей индукции экспрессии гена.
1.5. Создание штамма Е. coli - продуцента гибридного белка.
Для экспрессии гена, кодирующего гибридный белок, использовали клетки E.coli штамма BL21 Star (DE3) (Invitrogen, USA), с генотипом F- ompT hsdSB (rB-mB-) gal dcm rne131 (DE3), содержащие в геноме λDe3 лизоген и мутацию rne131. Мутированный ген rne (rne 131) кодирует усеченную форму РНКазы Е, что уменьшает внутриклеточное разрушение мРНК, приводя к увеличению ее ферментативной стабильности. lon- и ompT-мутации по генам протеаз позволяют получать непротеолизированные рекомбинантные белки в больших количествах.
Подготавливали клетки Е. coli штамма BL 21с генотипом F- ompT hsdSB (rB-mB-) gal dcm rne131 (DE3) следующим образом. Инкубировали клетки при +37°С в течение ночи в 5 мл L-бульона, содержащего 1% триптон, 1% дрожжевой экстракт и 1% натрий хлористый. Разводили культуру свежим L-бульоном в 50-100 раз и выращивали на качалке при +37°С до оптической плотности 0,2-0,3 при длине волны 590 нм. При достижении оптической плотности более 0,3 культуру разводили свежим L-бульоном до оптической плотности 0,1 и растили 30 мин. Переносили 100 мл культуры в стерильную центрифужную пробирку и осаждали клетки при +4°С на 5000g в течение 10 мин. Супернатант сливали, клетки ресуспендировали в деионизованной воде в исходном объеме с последующим центрифугированием. Процедуру отмывки повторяли трижды. После отмывки осадок клеток ресуспендировали в малом объеме деионизованной воды и центрифугировали 30 сек при 5000 об/мин, на микроцентрифуге.
Трансформацию компетентных клеток осуществляли методом электропорации. Для этого 1 мкл плазмидной ДНК добавляли к 12 мкл компетентных клеток, перемешивали и проводили электропорацию на генераторе высоковольтных импульсов ГВИ-1 (СПбГТУ, Санкт-Петербург) в стерильных ячейках при электрическом импульсе напряженностью 10 кВ/см длительностью 4 мсек.
После трансформации клетки инкубировали в SOC-среде (2% бакто-триптон, 0,5% дрожжевой экстракт, 10 мМ NaCl, 2,5 мМ КСl, 10 мМ MgCl2, 10 мМ MgSO4, 20 мМ глюкоза) в течение 40 мин при +37°С. 10-100 мкл клеточной суспензии высеивали на селективную LB-среду (Gibko BRL, США), содержащую ампициллин (100 мкг/мл), для отбора клонов, содержащих плазмиды (штаммов-продуцентов).
Полученная после трансформации компетентных клеток штаммов Е. coli плазмида обеспечивала высокий уровень биосинтеза рекомбинантного белка, закодированного в ней.
1.6. Получение гибридного белка в клетках E.coli индукцией синтеза белка 0.2% лактозой по методу Штудиера.
Для культивирования полученных штаммов-продуцентов использовали стандартную агаризованную LB-среду, содержащую ампициллин в концентрации 100 мкг/мл и глюкозу в концентрации 1% для блокирования неспецифической экспрессии.
Индукцию экспрессии проводили при достижении культурой клеток оптической плотности 0.6-0.8 оптических единиц при длине волны 600 нм.
В качестве индуктора использовали 0.2% лактозу (Studier, 2005).
Для автоиндукции экспрессии по методу Штудиера (Studier, 2005) использовали среду PYP-5052, состоящую из 1% пептона (Gibco, США), 0.5% дрожжевого экстракта (Gibco, США), 50 мМ Na2HPO4, 50 мМ К2НРО4, 25 мМ (NH4)2SO4, 2 мМ MgSO4, 0.5% глицерола, 0.05% глюкозы и 0.2% лактозы.
В среду PYP-5052, содержащую ампициллин в концентрации 100 мкг/мл, инокулировали единичную колония штамма-продуцента. Ферментацию проводили при +37°С в термостатированном шейкере роторного типа при 250 об/мин в течение 20 часов до отсутствия существенного изменения ОП600 за 1 час. Отбирали аликвоту клеток на анализ экспрессии гена, кодирующего вакцинный белок, методом электрофореза в ПААГ, а оставшуюся биомассу осаждали центрифугированием при 9000 g.
Белок выделяли из клеток E.coli посредством лизиса клеток. Клетки ресуспендировали в лизирующем буфере, содержащем 20 мМ трис-HCl рН 7,5, 5 мМ ЭДТА и 1 мМ феноксиметилсульфонилфторид, из расчета на 1 г клеток 5-7 мл буфера. Суспензию клеток обрабатывали ультразвуком 7 раз по 30 сек с интервалом в 30 сек (частота ультразвука составляет 22 кГц). Лизат центрифугировали 10 мин при +4°С, 5000 g. Надосадочную жидкость сливали, к осадку добавляли раствор 1 М мочевины из расчета 10 мл на 1 г клеток, интенсивно перемешивали. Повторяли центрифугирование. Супернатант сливали, осадок ресуспендировали в растворе 2 М мочевины того же объема. Повторяли центрифугирование. Супернатант сливали.
Полученный препарат содержал по данным SDS-PAGE (PolyAcrylamide Gel Electrophoresis with Sodium dodecyl sulfate) около 98% гибридного белка в концентрации 1 мг/мл.
Условия выделения и очистки подбирались экспериментальным путем и могут варьировать в известных среднему специалисту в этой области значениях.
1.7. Получение очищенного препарата гибридного белка.
К раствору гибридного белка добавляли MgCl2 до концентрации 6 мМ и проводили очистку гибридного белка с использованием метода иммобилизованной металлоаффинной хроматографии (ИМАХ) с использованием сорбента Ni-НТУ сефарозы. Связывание с данным сорбентом происходит за счет 6 остатков гистидина, имеющихся на N-конце полученного рекомбинантного белка. Белковый раствор фильтровали через ПВДФ фильтр с диаметром пор 0,22 мкн, к полученному фильтрату добавляли сорбент Ni-НТУ сефарозу, уравновешенную буфером для рефолдинга, из расчета, что 1 мл сорбента связывает не более 40 мг белка, и проводили связывание при постоянном перемешивании в течение 2 часов. Сорбент осаждали центрифугированием и в минимальном объеме наносили на гравитационную хроматографическую колонку, содержащую 2 мл сорбента.
Элюцию проводили ступенчатым градиентом имидазола от 20 до 300 с шагом в 50% от предыдущего, при этом на каждую ступеньку приходился объем элюирующего раствора, равный 5-20 объемам колонки. Выход и чистоту белка контролировали методом диск-электрофореза и измерением концентрации белка по методу Бредфорд.
Для определения содержания эндотоксинов приготавливали стандартный стоковый раствор эндотоксина с концентрацией 4000 EU на мл, полученный раствор был стабилен при хранении при +4°С в течение, по крайней мере, 2-х недель. Серию разведений стокового раствора эндотоксина с шагом в 2 раза приготавливали с использованием свободной от эндотоксинов воды в стерильных полистиреновых пробирках, заклеивающихся свободным от эндотоксина парафильмом. Готовили серию разведений образца субстанции с шагом концентрации 5, а после предварительного определения содержания эндотоксина - с шагом концентрации 2.
На дно каждого эппендорфа добавляли образец, воду или эндотоксин в 100 мкл, после чего добавляли 100 мкл лизата ЛАЛ-реактива и инкубировали в течение 1 часа при 37°С на водяной бане. Результаты оценивали по наличию или отсутствию плотного тромба на дне пробирки путем переворачивания пробирки.
Было показано, что в исследуемом образце отсутствуют факторы, ингибирующие образование тромба. Гель-тромб образовался при 1/8 разведении образца, т.е. при чувствительности метода 0,03 EU/мл, в образце с концентрацией 50 мкг/мл содержится менее 100 EU.
Конформацию рекомбинантного гибридного белка при его синтезе в клетках E.coli определяли методом диск-электрофореза в ПААГ клеток E.coli, разрушенных с использованием ультразвука после проведения индукции экспрессии, при этом анализировали осадок и супернатант, образовавшиеся после осаждения клеточных обломков. В результате денситометрического анализа было показано, что рекомбинантный белок, синтезированный в клетках E.coli штаммов-продуцентов при индукции экспрессии 0.2% лактозой, на 100% находится в супернатанте, т.е. растворимой фракции.
Культивирование бактерий при различных температурах: 20°С, 30°С и 37°С не вызывало изменения растворимости белка.
После проведения диск-электрофореза в ПААГ лизатов клеток E.coli после автоиндукции экспрессии 0.2% лактозой осуществляли анализ уровня экспрессии целевого белка в клетках E.coli методом денситометрирования. В результате денситометрического анализа было показано, что в клетках E.coli гибридный белок накапливается в количестве 45% от общего клеточного белка.
Полученный уровень экспрессии не изменялся в штамме-продуценте в течение 6 пассажей, что свидетельствует о стабильном характере экспрессии анализируемого гена.
1.8. Получение рекомбинантного гибридного белка с использованием культивирования клеток E.coli с непрерывным добавлением питательных субстратов, предпочтительно глюкозы и дрожжевого экстракта.
При культивировании штамма Escherichia coli для получения гибридного белка использовали метод периодических культур с подпиткой. Данный метод применяется для предотвращения негативных последствий лимита субстрата, при этом субстрат или другие необходимые компоненты добавляются либо непрерывно, либо по сигналу от какого-либо датчика. Для оптимизации выхода продуктов, выделяемых в среду, важно усилить биосинтетическую способность клеток бактерий, а метод культивирования с подпиткой позволяет продлить вторую фазу роста и повысить выход внеклеточных метаболитов. Данный метод можно использовать в случае потенциально токсичного субстрата (рекомбинантные белки токсичны для клеток E.coli), так как при этом его концентрация в среде будет поддерживаться на низком уровне.
Ограничение скорости поглощения субстрата скоростью его доставки оказывается способом преодоления "катаболитной репрессии" образования продукта.
Культура с подпиткой оказалась наиболее эффективным путём для достижения высокой плотности клеток и высокой продуктивности.
Штамм E.coli стерильно пересевали на скошенные косяки ЭДТА-содержащего агара и выдерживали в термостате 5 суток. Для получения инокулята осуществляли смыв культуры с косяков, засевали в жидкую среду с ЭДТА и культивировали 3-4 суток. После инокулят в количестве 10 мл переносили в стерильные 750-мл колбы с 200 мл стерильной жидкой среды и культивировали в течение 10 суток на качалке при 150-200 об/мин при температуре 28-30°С.
Твердая питательная среда использовалась для получения свежей культуры штамма.
Жидкую питательную среду применяли для получения посевного материала и для периодического культивирования. Приготовление жидкой питательной среды
1) MgSO4*7Н2O 10 мл/л
2) СаСl2*2 Н2O 20 мл/л
3) КН2РО4 + NaH2PO4*12 H2O 10 мл/л
4) EDTA 10 мл/л
5) Микроэлементы 1 мл/л
(доводили до рН 4,2) + 5,6 г/л ЭДТА:
FeCl2*4H2O 1,5 г/л
Н3ВО3 0,06 г/л
MnСl2*6Н2О 0,1 г/л
СаСl2*6 Н2O 0,12 г/л
ZnCl2 0,07 г/л
NiCl2*6 H2O 0,025 г/л
CuCl2*2Н2О 0,015г/л
Na2MoCl4 0,025 г/л
6) Витамины
Пиридоксин 20 мг
Тиамин 10 мг
Рибофлавин 10 мг
Никотиновая кислота 10 мг
Р - аминобензойная кислота 10 мг
Липоевая кислота 10 мг
Никотинамид 10 мг
Витамин В12 10 мг
Биотин 4 мг
Фолиевая кислота 4 мг
Все компоненты растворяли в 200 мл воды, стерилизовали при 0,5 атм 30 минут и добавляли в жидкую питательную среду в количестве 1 мл/л.
Компоненты питательных сред взвешивали на технических и аналитических электронных весах и растворяли в дистиллированной воде. Опыт по приготовлению питательных сред показал, что ее удобно готовить из заранее стерилизованных концентрированных растворов.
Твердую питательную среду готовили как жидкую, с добавлением 3% агара.
Оптическая плотность (ОП600) культур клеток E.coli составила 9 О.Е. Клетки осаждали центрифугированием при 13000 g в течение 6 мин при температуре 10°С. Осадок клеток взвешивали, он составил 1,9 г.
Клетки ресуспендировали в 30 мл буфера (50 мМ ТрисНСl, рН, 50 мМ ЭДТА, 20 мМ L-цистеин, рН 8.6) и разрушали с использованием ультразвука (время озвучивания - 10 мин, время импульса - 30 сек, время паузы между импульсами - 30 сек, амплитуда - 70%). После разрушения клеток тельца включения осаждали с использованием центрифугирования при 30000 g в течение 20 мин при температуре 10°С, вес сырого остатка телец включения из клеток составил 1.5 г. Осажденные тельца включения отмывали с использованием последовательной смены нескольких буферов по следующей схеме.
1. Осадок телец включения ресуспендировали в 10 мл (последняя отмывка 15 мл) буфера для отмывки.
2. Ресуспендированные тельца включения перемешивали на горизонтальном шейкере в течение 1 часа при комнатной температуре.
3. Тельца включения осаждали центрифугированием при 30000 g в течение 20 мин при температуре 10°С.
После пяти отмывок сырой вес телец включения составил 0.9 г.
Для солюбилизации белка из отмытых телец включения использовали 18 мл раствора (9 М мочевина, 2 мМ ЭДТА, 50 мМ ТрисНСl, рН 8.6). Солюбилизированные тельца включения центрифугировали при 30000 g в течение 20 мин при температуре 10°С. Образовавшийся супернатант переносили в новые фальконы и использовали для рефолдинга.
Рефолдинг проводили методом 10-кратного разведения солюбилизированных телец включения в буфере для рефолдинга при температуре +4°С по каплям. К раствору рефолдированного белка добавляли MgCl2 до 6 мМ и использовали для очистки белка метод иммобилизованной металлоаффинной хроматографии (ИМАХ) с использованием сорбента Ni-НТУ сефарозы. Белковый раствор фильтровали через ПВДФ фильтр с диаметром пор 0,22 микрона и к полученному фильтрату добавляли сорбент Ni-НТУ сефарозу, уравновешенный буфером для рефолдинга, из расчета, что 1 мл сорбента связывает не более 40 мг белка, после чего проводили связывание при постоянном перемешивании в течение 2 часов. Сорбент осаждали центрифугированием и в минимальном объеме наносили на гравитационную хроматографическую колонку, содержащую 2 мл сорбента. Элюцию проводили ступенчатым градиентом имидазола (20, 40, 100, 150, 200 и 300 мМ), при этом на каждую ступеньку приходился объем элюирующего раствора, равный 10 объемам колонки.
С использованием данного метода очистки было получено 43 мг гибридного белка с чистотой 98%.
1.9. Получение гибридного белка, очищенного перед растворением удалением растворимых клеточных компонентов, включающих ДНК, РНК, белки, липополисахариды посредством промывания буферным раствором, содержащим детергент гуанидингидрохлорид.
После проведения ферментации и разрушения клеток E.coli, отмывки телец включения (п. 1.8.) проводили солюбилизацию белка 18 мл раствора (8 М GuHCl, 2 мМ ЭДТА, 50 мМ ТрисНСl, рН 8.6), содержащего гуанидингидрохлорид. Солюбилизированные тельца включения центрифугировали при 30000 g в течение 20 мин при температуре 10°С. Образовавшийся супернатант переносили в новые фальконы и использовали для рефолдинга.
Далее проводили рефолдинг рекомбинантного белка и их очистку (см. Пример 8). В результате очистки был получен 41 мг гибридного белка с чистотой 98%.
Пример 2. Получение высокоочищенного гибридного белка (SEQ ID NO.:3) для вакцины против ротавирусной инфекции с использованием клеток E.coli.
2.1. Моделирование гибридного белка.
Спланированный гибридный полипе