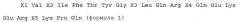Мотилин-подобное пептидное соединение, обладающее приданной ему трансмукозальной абсорбционной способностью
Иллюстрации
Показать всеИзобретение относится к биотехнологии и представляет собой полипептид (варианты) и фармацевтическую композицию, включающую данный полипептид. Полипептид имеет последовательность, представленную нижеследующей формулой 1:
Связи между аминокислотами, кроме X1-Val связи, являются амидными связями. Связь X1-Val представляет собой амидную связь или связь, представленную нижеследующей формулой 2 X1 представляет собой ароматическую аминокислоту или гетероароматическую аминокислоту, Х2 представляет собой пролин или саркозин, Х3 представляет собой глутаминовую кислоту или аспарагиновую кислоту, Х4 представляет собой метионин или лейцин, Х5 представляет собой аспарагин или пролин. Предложенное изобретение может быть использовано в медицине для лечения заболевания, связанного с нарушением функции желудочно-кишечного тракта. Предложенное изобретение позволяет эффективно лечить заболевания, связанные с нарушением функции желудочно-кишечного тракта. 3 н. и 4 з.п. ф-лы, 5 ил., 4 табл., 5 пр.
Реферат
Область техники
Настоящее изобретение относится к мотилин-подобным пептидным соединениям, которые обладают более высокой активностью в отношении стимуляции моторики пищеварительного тракта и более высокой абсорбционной способностью после трансмукозального введения, которые используют для лечения состояний, характеризуемых нарушениями функций желудочно-кишечного тракта, таких как функциональная диспепсия, диабетический гастропарез, рефлюксная гастроэзофагеальная болезнь, синдром раздраженного кишечника, чрезмерное развитие микрофлоры тонкого кишечника, псевдонепроходимость толстой кишки, паралитическая непроходимость кишечника, хроническая идиопатическая псевдообструкция кишечника и послеоперационная непроходимость кишечника.
Известный уровень техники
Мотилин представляет собой физиологически активный пептид из 22 аминокислот, выделенный из абдоминальной гладкой мышцы, и его структура была впервые идентифицирована в 1973 посредством выделения свиного мотилина (непатентные документы 1 и 2). В 1995 был выделен и идентифицирован человеческий мотилин как имеющий такую же структуру, как и свиной мотилин (непатентный документ 3).
Известно, что мотилин обладает физиологической функцией, которая связана с межпищеварительным мигрирующим комплексом (в дальнейшем в сокращенном виде IMC), который возникает на стадии голодания. IMC представляет собой физиологическую функцию, благодаря которой содержимое желудочно-кишечного тракта, такое как эпителий и слизистая оболочка, которые были отшелушены с его внутренней стенки, а также секреторные жидкости, выделение которых непосредственно связано с процессом переваривания пищи, принудительно продвигается к его более нижним отделам, тем самым очищая его внутреннюю часть. У здоровых людей мотилин секретируется из двенадцатиперстной кишки и тощей кишки с интервалами приблизительно 100 минут на стадии голодания, при этом IMC проявляется при увеличении уровня мотилина в плазме (непатентный документ 4); IMC индуцируется, когда мотилин вводят собаке, обезьяне или человеку (непатентные документы 5, 6 и 7); физиологическое проявление IMC подавляется введением антимотилиновой сыворотки; принимая во внимание эти и другие полученные данные, полагают, что функции желудочно-кишечного тракта, такие как переваривание пищи и выделение пищеварительного секрета, поддерживаются в нормальном состоянии в результате секреции мотилина, который индуцирует IMC, заставляя химус перемещаться в дистальном направлении внутри желудочно-кишечного тракта (непатентный документ 8).
Что касается связи между нарушением функции IMC и заболеванием, то имеются сообщения о том, что, когда моторика желудочно-кишечного тракта IMC снижается, химус внутри желудочно-кишечного тракта накапливается внутри кишечника, вызывая анормальный рост кишечных бактерий, которые, в свою очередь, продуцируют эндотоксины, вызывая такие желудочно-кишечные состояния, как чрезмерное выделение газа, вспучивание живота, диарея и боль в животе (непатентный документ 9). В частности, в отношении болезней, связанных с нарушениями функций желудочно-кишечного тракта, таких как функциональная диспепсия, постоперационная непроходимость кишечника и хроническая идиопатическая псевдообструкция кишечника, были сообщения о том, что проявление IMC снижено или не наблюдается вовсе (непатентный документ 13) и что снижение в секреции эндогенного мотилина in vivo или снижение действия мотилина связано с нарушениями или снижением двигательных функций пищеварительного тракта (непатентный документ 14). Синдром раздраженного кишечника представляет собой хроническое кишечное заболевание, которое в отсутствие какого-либо из основных заболеваний, таких как воспаления и новообразования, но вследствие функциональных нарушений в нижней части желудочно-кишечного тракта, обычно в толстой кишке, вызывает хронические неприятные ощущения в животе, иллюстрируемые болью в животе и вспучиванием живота, или нарушения перистальтики кишечника, такие как запор и диарея. Сообщалось, что, по меньшей мере, у нескольких пациентов, у которых развился синдром раздраженного кишечника, произошли изменения в кишечной флоре, заключающиеся как в изменении бактериального типа, так и анормальном росте бактерий и т.д. (непатентный документ 9), и что накопление химуса желудочно-кишечного тракта внутри кишечного тракта вследствие снижения функции IMC может быть причиной изменения в кишечной флоре.
Доступные в настоящее время лекарственные средства первого выбора против заболеваний, связанных с вышеупомянутыми нарушениями функций пищеварительного тракта, представляют собой лекарственные средства для внутреннего применения, действие которых направлено на улучшение двигательной функции желудочно-кишечного тракта, примерами которых являются антагонисты рецептора допамина, селективные агонисты рецептора 5-HT4 серотонина и парасимпатические стимулирующие средства. В самом деле, имеется несколько случаев, когда лечение этими терапевтическими средствами показало временное улучшение симптомов, однако во многих других случаях никакого терапевтического действия не наблюдалось, и врачи и пациенты получают лишь небольшое удовлетворение от использования этих внутренних лекарственных средств для улучшения моторики пищеварительного тракта. Поэтому существует крайне высокая потребность в разработке терапевтических средств, основанных на новом механизме действия, и ожидается, что это могло бы привести к уменьшению интенсивности симптомов или излечению заболевания путем введения извне агонистов рецептора мотилина пациентам с нарушениями функций желудочно-кишечного тракта с тем, чтобы нормализовать функции их пищеварительного тракта.
С того момента, как было сообщено, что эритромицин и родственные ему соединения обладают активностью, свойственной агонистам мотилина, были проведены клинические испытания с низкомолекулярными агонистами мотилина на пациентах с нарушениями функций желудочно-кишечного тракта (непатентные документы 19 и 20), и в настоящее время, кроме того, имеется множество таких низкомолекулярных агонистов мотилина, которые были подвергнуты клиническим испытаниям в качестве пероральных лекарственных средств (непатентные документы 21 и 22). Однако по той или иной причине, такой как проявление побочных действий, которые не имеют ничего общего с действием агонистов мотилина (т.е. ингибирование HERG, сперматогенный дефект и канцерогенное действие), или ослабление эффективности лекарственного средства вследствие повторного введения, разработка лекарственных препаратов, содержащих агонисты мотилина в качестве активного ингредиента, была приостановлена и ни одно из них до настоящего времени не представлено на рынке в качестве лекарственного препарата для улучшения функций желудочно-кишечного тракта.
Кроме того, были проведены клинические испытания на пациентах, страдающих нарушениями функций желудочно-кишечного тракта, используя нативный мотилин или пептидные агонисты мотилина в виде пептидных соединений (непатентные документы 15 и 16). Однако единственным путем введения, о котором когда-либо сообщалось в связи с клиническими испытаниями и экспериментами на животных с использованием этих пептидных соединений, было внутривенное введение, и из-за трудности, возникающей в связи с осуществлением пролонгированного, повторного введения пациентам, терапевтическая эффективность соединений еще не нашла своего подтверждения.
Примерами мотилин-подобных пептидных соединений, которые были разработаны до настоящего времени, являются атилмотин от Baxter (патентный документ 1) и SK-896 от SANWA KAGAKU (патентный документ 2). Первое представляет собой соединение, созданное с целью улучшения периода полураспада in vivo и при помощи опыта по метаболизму, используя супернатант гомогената почки, которая представлена в качестве основного органа для метаболизма мотилина (непатентный документ 17), это соединение, как было подтверждено, обладает более высокой метаболической стабильностью (патентный документ 1), и его период полураспада в плазме составляет около 10 минут, приблизительно в три раза длиннее, чем период полураспада мотилина (непатентный документ 18). Последнее представляет собой соединение, предназначенное для реализации более эффективного продуцирования. Оба соединения поддерживают активность в усилении моторики пищеварительного тракта, сравнимую с активностью мотилина. Однако, как и в случае мотилина, путь введения этих соединений ограничен внутривенным путем, и каждое соединение создает проблему, связанную с тем, что его использование ограничено лечением в медицинских учреждениях с их помещением и оборудованием, где оно не может использоваться на протяжении пролонгированного периода времени. Следовательно, к настоящему времени не было обнаружено лекарственного средства, действие которого было бы основано на присущем мотилину действии, т.е. поддержании функций желудочно-кишечного тракта обычным путем перемещения химуса внутри пищеварительного тракта в направлении толстой кишки, с тем результатом, чтобы к тому же еще была подтверждена его терапевтическая эффективность.
Был разработан пептид, имеющий замещение метионина в положении 13 на лейцин (патентный документ 3). Однако биологическая активность этого пептида оказалась сравнимой с биологической активностью мотилина, и путь его введения также ограничивается внутривенным путем, тем самым оставляя проблему невозможности пролонгированного использования по-прежнему нерешенной.
С учетом вышеизложенного существует потребность в разработке нового терапевтического лекарственного средства, основанного на присущем мотилину действии, при этом пептидный агонист мотилина должен рассматриваться в качестве фармацевтического средства, которое может вводиться на протяжении пролонгированного периода времени неинвазивным путем.
Перечень ссылок
Ссылка на патентные документы
Патентный документ 1: JP Hei 7-70178 A
Патентный документ 2: JP Hei 7-42319 B
Патентный документ 3: JP Sho 52-46068 A
Ссылка на непатентные документы
Непатентный документ 1: Brown J et al., Can J Biochem, 51, 533 (1973)
Непатентный документ 2: Schubert H et al., Can J Biochem, 52, 7 (1974)
Непатентный документ 3: De Clercq et al., Regul Pept, 55, 79 (1995)
Непатентный документ 4: Itoh, Nisshoushi (Journal of the Japanese Society of Gastrogenterology) 93, 517 (1996)
Непатентный документ 5: Nakaya M et al., Peptides, 4, 439 (1983)
Непатентный документ 6: Yogo K et al., Dig Dis Sci, 52, 3112 (2007)
Непатентный документ 7: Haans J et al., Neurogastroenterol Motil, 18, 637 (2006)
Непатентный документ 8: Kusano et al, MB Gastro, 1, 47 (1991)
Непатентный документ 9: Pimentel M et al., Dig Dis Sci, 47, 2639 (2002)
Непатентный документ 10: Pardo A et al., Hepatology 31, 858 (2000)
Непатентный документ 11: Castiglione F et al., Aliment Pharmacol Ther. 18, 1107 (2003)
Непатентный документ 12: Henry C. Lin, JAMA. 292, 852 (2004)
Непатентный документ 13: Labo G et al., Gastroenterology, 90, 20 (1986)
Непатентный документ 14: Kusano M et al., Am J Gastroenterol, 92, 481 (1997)
Непатентный документ 15: Kamerling I et al., Am J Physiol Gastrointest Liver Physiol, 284, G776 (2003)
Непатентный документ 16: Park M-I et al., Neurogastroenterol Motil, 18, 28 (2006)
Непатентный документ 17: Jenssen TG et al., Scand J Gastroenterol, 19, 717 (1984)
Непатентный документ 18: Peeters TL et al., Neurogastroenterol Motil, 18, 1 (2006)
Непатентный документ 19: Janssens J et al., N Engl J Med, 322, 1028 (1990)
Непатентный документ 20: Stacher G et al., Gut, 34, 166 (1993)
Непатентный документ 21: Choi MG et al., J Pharmacol Exp Ther, 285, 37 (1998)
Непатентный документ 22: Netzer P et al., Aliment Pharmacol Ther, 16, 1481 (2002)
Краткое изложение существа изобретения
Техническая задача изобретения
Целью настоящего изобретения является разработка мотилин-подобных пептидных соединений, которые поддерживают присущую нативному мотилину стимулирующую активность моторики пищеварительного тракта и которые были бы адаптированы для проявления более высокой абсорбционной способности после трансмукозального введения.
Решение технической задачи
Для решения этой задачи авторы сначала высказали предположение, что мотилин может разлагаться после неинвазивного трансмукозального введения, и осуществили эксперимент по деградации мотилина, используя супернатант гомогената легкого. В результате этого было обнаружено, что мотилин разлагается, и путем идентифицирования продукта деградации было установлено, что путь деградации мотилина состоит в том, что его С конец подвергается ферментативному расщеплению под действием дикарбоксипептидазы.
Исходя из этих результатов, авторы заместили глицин в положении 21 мотилина пролином, для того чтобы ингибировать опосредованную дикарбоксипептидазой деградацию С конца, с получением мотилин-подобных пептидных соединений, демонстрирующих более высокую абсорбционную способность после трансмукозального введения, что и привело к завершению настоящего изобретения. Кроме того, поскольку N концевая часть фенилаланина, как было обнаружено, подвергается деградации, было показано, что замена амидной связи между первой и второй аминокислотами от N конца непептидной связью, связью -psi[CH2NH], также может способствовать дополнительному улучшению метаболической стабильности.
(i) В частности, настоящее изобретение обнаружило, что вышеизложенная задача может быть достигнута путем получения пептидных соединений, которые сохраняют активность в стимулировании моторики пищеварительного тракта, сравнимую со стимулирующей активностью нативного мотилина, и которые к тому же имеют более высокую абсорбционную способность после трансмукозального введения, причем указанные соединения представляют собой соединения, содержащие последовательность, представленную нижеследующей формулой 1, которая характеризуется замещением аминокислоты в положении 21 пролином:
X1 Val X2 Ile Phe Thr Tyr Gly X3 Leu Gln Arg X4 Gln Glu Lys Glu Arg X5 Lys Pro Gln (формула 1) (SEQ ID NO: 2)
[где все связи между аминокислотами, кроме связи X1-Val, являются амидными связями;
X1 представляет собой ароматическую аминокислоту или гетероароматическую аминокислоту;
связь X1-Val представляет собой амидную связь или связь, представленную нижеследующей формулой 2
(формула 2)
X2 представляет собой пролин или саркозин;
X3 представляет собой глутаминовую кислоту или аспарагиновую кислоту;
X4 представляет собой метионин или лейцин;
X5 представляет собой аспарагин или пролин],
или их фармацевтически приемлемые соли.
Кроме того, настоящее изобретение охватывает нижеследующее:
(ii) Соединение или его фармацевтически приемлемую соль, представленные в (i), где X1 в формуле 1 представляет собой α-аминокислоту, такую как фенилаланин (Phe), тирозин (Tyr), или триптофан (Trp), или β-гомофенилглицин (Phg(C#CH2)), или ацетилнафтилаланин (Ac-Nal).
(iii) Соединение или его фармацевтически приемлемую соль, представленные в (ii), где X1 в формуле 1 представляет собой фенилаланин (Phe) или β-гомофенилглицин.
(iv) Соединение, которое изображено последовательностью, выбранной из группы, состоящей из SEQ ID NO: 3-15, или его фармацевтически приемлемую соль.
(v) Соединение, которое изображено последовательностью SEQ ID NO: 4, или его фармацевтически приемлемую соль.
(vi) Соединение, которое изображено последовательностью SEQ ID NO: 6, или его фармацевтически приемлемую соль.
(vii) Соединение, которое изображено последовательностью SEQ ID NO: 8, или его фармацевтически приемлемую соль.
(viii) Фармацевтическую композицию для лечения заболевания, связанного с нарушением функции пищеварительного тракта, которая содержит пептидное соединение или его фармацевтически приемлемую соль, изложенные в любом из (i)-(vii).
(ix) Фармацевтическую композицию, представленную в (viii), где заболевание, связанное с нарушением функции желудочно-кишечного тракта, включает снижение, относительно базового уровня, моторной активности пищеварительного тракта.
(x) Фармацевтическую композицию, представленную в (viii), где заболевание, связанное с нарушением функции пищеварительного тракта, представляет собой функциональную диспепсию, диабетический гастропарез, рефлюксную гастроэзофагеальную болезнь, синдром раздраженного кишечника, чрезмерное развитие микрофлоры тонкого кишечника, псевдонепроходимость толстой кишки, паралитическую непроходимость кишечника, хроническую идиопатическую псевдообструкцию кишечника или послеоперационную непроходимость кишечника.
(xi) Фармацевтическую композицию, представленную в любом из (viii)-(x), которая предназначена для трансмукозального введения.
(xii) Фармацевтическую композицию, представленную в (xi), где трансмукозальное введение представляет собой легочное или интраназальное введение.
(xiii) Фармацевтическую композицию, представленную в (xii), где трансмукозальное введение представляет собой интраназальное введение.
(xiv) Способ лечения состояний, характеризуемых снижением, относительно базового уровня, моторной активности пищеварительного тракта, таких как функциональная диспепсия, диабетический гастропарез, рефлюксная гастроэзофагеальная болезнь, синдром раздраженного кишечника, чрезмерное развитие микрофлоры тонкого кишечника, псевдонепроходимость толстой кишки, паралитическая непроходимость кишечника, хроническая идиопатическая псевдообструкция кишечника и послеоперационная непроходимость кишечника, причем этот способ включает введение индивидууму фармацевтической композиции, представленной в (viii).
Преимущества настоящего изобретения
Новые мотилин-подобные пептидные соединения по данному изобретению обладают мотилин-подобной активностью в отношении стимулирования моторики пищеварительного тракта и демонстрируют более высокую эффективность всасывания после трансмукозального введения. Поэтому соединения по данному изобретению могут быть использованы для лечения заболеваний, связанных с нарушениями функций пищеварительного тракта (например, состояния, характеризуемые снижением, относительно базового уровня, моторной активности желудочно-кишечного тракта). Заболевания, связанные с нарушениями функций желудочно-кишечного тракта, включают состояния, такие как функциональная диспепсия, диабетический гастропарез, рефлюксная гастроэзофагеальная болезнь, синдром раздраженного кишечника, чрезмерное развитие микрофлоры тонкого кишечника, псевдонепроходимость толстой кишки, паралитическая непроходимость кишечника, хроническая идиопатическая псевдообструкция кишечника и послеоперационная непроходимость кишечника. Кроме того, соединения по данному изобретению обладают более высокой эффективностью всасывания, чем нативный мотилин, после трансмукозального введения, и поэтому в случае лечения пациентов для достижения эффективных плазменных концентраций должны вводиться при более низких дозах.
Краткое описание чертежей
Фиг.1 - график, показывающий активность индуцирования IMC на стадии голодания, демонстрируемую после внутривенного введения нативного мотилина, соединения 4 и соединения 6.
Фиг.2 - график, демонстрирующий профиль плазменных уровней у крыс, которым был внутривенно введен нативный мотилин.
Фиг.3 - график, демонстрирующий профили плазменных уровней после легочного введения нативного мотилина, соединения 2 (MT 114) и соединения 6 (MT 140).
Фиг.4 - график, демонстрирующий профили плазменных уровней у обезьян, которым был внутривенно введен нативный мотилин и соединение 2 (MT 114).
Фиг.5 - график, демонстрирующий профили плазменных уровней у обезьян, которым был интраназально введен нативный мотилин и соединение 2 (MT 114).
Описание вариантов осуществления изобретения
Известно, что нативный мотилин имеет N-концевую часть в качестве существенного сайта для проявления его активности, и, кроме того, известно, что, хотя нативный мотилин образует α-спиральную структуру в растворе в С-концевой области, простирающейся от области треонина в положении 6 [Andersson A. & Maler L., J. Biomol. NMR, 24, 103-112 (2002)], производные, имеющие мутации, введенные в α-спиральную структуру, которая расположена вдали от активного центра, обладают более низкой способностью активировать рецептор [Miller P et al., Peptides, 16, 11-18 (1995)]. Исходя из данных, представленных в этих документах, авторы предположили, что α-спиральная структура может вносить вклад в стабилизацию активного центра на N конце. Другими словами, авторы считали, что присутствие α-спиральной структуры может благоприятствовать защите структуры активного центра на N конце.
Поэтому при осуществлении структурных модификаций, которые могли бы препятствовать пути деградации мотилина, авторы выбрали сайты, которые предположительно независимы от возможного снижения в активности, которое могло быть результатом дестабилизации α-спиральной структуры.
Аминокислота в 1-положении на N конце мотилина (которую в дальнейшем называют Х1) является существенной для активации рецептора, и поэтому желательно ее защитить от деградации. Авторы предположили, что для придания устойчивости к протеолитическому ферменту удлинение расстояния от N-концевой аминогруппы до пептидной связи X1-Val или замена пептидной связи X1-Val неамидной связью могли бы быть полезными для приобретения устойчивости к деградатации.
Кроме того, X2 в нативном мотилине представляет собой пролин и определяет конформационную структуру соединения, поэтому авторы предположили, что путем повышения ее степени свободы можно будет регулировать способность соединения активировать рецептор. В нативном мотилине X3 представляет собой глутаминовую кислоту, и она образует водородную связь вместе с боковой цепью треонина в 6-положении, по-видимому, тем самым способствуя образованию α-спиральной структуры в области, простирающейся от 6-положения в направлении С-концевого конца [Andersson A. & Maler L.,J. Biomol. NMR, 24, 103-112 (2002)]. Поскольку известно, что замещение X3 аланином или D-глутаминовой кислотой вызвало существенное снижение в способности активировать рецептор [Miller P. et al., Peptides, 16, 11-18 (1995), and Peeters T.L., et al., Peptides, 13, 1103-1107 (1992)], то желательно X3 выбирать из L-кислых аминокислот. Что касается X4, то он представляет собой метионин в нативном мотилине и может снижать способность активировать рецептор через окисление боковой цепи. Поэтому метионин желательно заменить на лейцин, который, по существу, сравним с ним с точки зрения размера боковой цепи.
Мотилин расщепляется под действием дикарбоксипептидазы, начиная с С-концевого конца. Авторы предположили, что замещение аминокислот пролином на С-концевой части нативного мотилина может фиксировать двугранный угол около пептидной связи и придать устойчивость к деградации вследствие стерического препятствия, которое будет сопровождать координацию с субстратсвязывающим сайтом, на котором дикарбоксипептидаза связывается с субстратом, или с активным центром.
С другой стороны, поскольку α-спиральная структура мотилина важна для проявления способности активировать рецептор, полагают, что сайты аминокислот для замещения пролином, которые затрудняют образования α-спиральной структуры мотилина, весьма ограничены. С этих точек зрения, авторы предложили замещение X5 и/или аминокислоты в 21-положении пролином.
С учетом вышеизложенных точек зрения авторы сконструировали и синтезировали производные и подвергли их опыту по деградации, используя супернатант гомогената легкого, и эксперименту по сокращению, используя извлеченный кишечный тракт. Ряд мотилин-подобных пептидных соединений по данному изобретению, которые имели замещение глицина в положении 21 мотилина пролином, были подвергнуты эксперименту по трансмукозальному введению in vivo, посредством которого авторы подтвердили, что указанные соединения демонстрируют более высокую абсорбционную способность, чем нативный мотилин, и к тому же поддерживают индуцирующую активность в отношении IMC, сравнимую с индуцирующей активностью нативного мотилина; исходя из этого заключения, настоящее изобретение можно считать завершенным.
Пептидные соединения по данному изобретению представляют собой соединения, содержащие последовательность, представленную нижеследующей общей формулой 1, которая характеризуется замещением аминокислоты в 21-положении пролином:
X1 Val X2 Ile Phe Thr Tyr Gly X3 Leu Gln Arg X4 Gln Glu Lys Glu Arg X5 Lys Pro Gln (формула 1) (SEQ ID NO: 2)
[где все связи между аминокислотами, кроме связи X1-Val, являются амидными связями;
связь X1-Val представляет собой амидную связь или связь, представленную нижеследующей формулой 2
(формула 2)
X1 представляет собой ароматическую аминокислоту или гетероароматическую аминокислоту;
X2 представляет собой пролин или саркозин;
X3 представляет собой глутаминовую кислоту или аспарагиновую кислоту;
X4 представляет собой метионин или лейцин;
X5 представляет собой аспарагин или пролин],
или их фармацевтически приемлемые соли, и они характеризуются поддержанием стимулирующей активности в отношении моторики пищеварительного тракта, сравнимой со стимулирующей активностью нативного мотилина и к тому же наличием более высокой абсорбционной способности после трансмукозального введения.
В вышеупомянутой формуле 1 X1 представляет собой ароматическую аминокислоту или гетероароматическую кислоту. Ароматическая аминокислота или гетероароматическая аминокислота относится к любой аминокислоте, которая содержит в своей химической структуре ароматический цикл, и примеры включают, например, α-аминокислоты, такие как фенилаланин (Phe), тирозин (Tyr) и триптофан (Trp), а также или β-гомофенилглицин (Phg(C#CH2)), ацетилнафтилаланин (Ac-Nal) и т.п. В настоящем изобретении фенилаланин (Phe), β-гомофенилглицин (Phg(C#CH2)) и ацетилнафтилаланин (Ac-Nal) могут быть упомянуты в качестве более предпочтительных примеров аминокислоты X1.
В вышеупомянутой формуле 1 X1 может быть L-аминокислотой или D-аминокислотой. Согласно предшествующему уровню техники до настоящего времени были получены варианты путем замещения L-аминокислот D-аминокислотами в качестве аминокислоты в положении 1 мотилина (Miller P. et al., Peptides, 16, 11-18 (1995)), и эти варианты, как было показано, сохраняют активность мотилина.
В вышеупомянутой формуле 1 X2 представляет собой пролин (Pro) или саркозин (Sar, также называемый N-метилглицин или MeGly); X3 представляет собой глутаминовую кислоту (Glu) или аспарагиновую кислоту (Asp); X4 представляет собой метионин (Met) или лейцин (Leu); и X5 представляет собой аспарагин (Asn) или пролин (Pro). Аминокислоты, обозначенные X1-X5, могут быть использованы в любой комбинации.
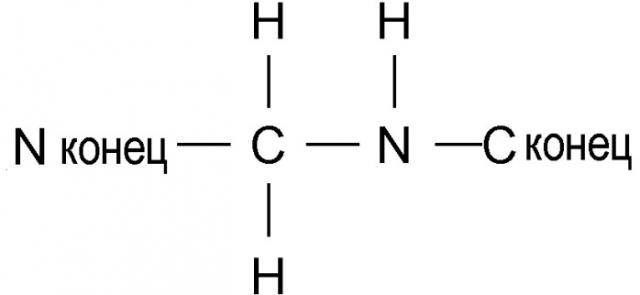
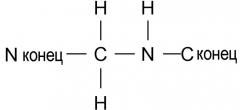
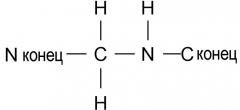
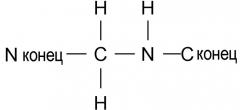
В пептидных соединениях вышеупомянутой формулы 1, связь между первой аминокислотой (X1) и второй аминокислотой (Val) является амидной связью или связью, представленной нижеследующей формулой 2
(формула 2)
Связь формулы 2 также называют связью -psi[CH2NH]-. Связь X1-Val может быть либо амидной связью, либо связью -psi[CH2NH]-, независимо от типа аминокислоты, которая составляет X1.
Соединения вышеупомянутой формулы 1 по данному изобретению включают, например, соединения, изображенные нижеследующими последовательностями или их фармацевтически приемлемые соли.
Phe Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Met Gln Glu Lys Glu Arg Asn Lys Pro Gln (SEQ ID NO: 3);
Phe Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Leu Gln Glu Lys Glu Arg Asn Lys Pro Gln (SEQ ID NO: 4);
Phe Val Pro Ile Phe Thr Tyr Gly Asp Leu Gln Arg Leu Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 5);
Phg(C#CH2) Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Leu Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 6);
Phg(C#CH2) Val Sar Ile Phe Thr Tyr Gly Glu Leu Gln Arg Leu Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 7);
Phe Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Met Gln Glu Lys Glu Arg Asn Lys Pro Gln (SEQ ID NO: 8);
Phe Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Leu Gln Glu Lys Glu Arg Asn Lys Pro Gln (SEQ ID NO: 9);
Phe Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Met Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 10);
Phe Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Leu Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 11);
Phg(C#CH2) Val Sar Ile Phe Thr Tyr Gly Glu Leu Gln Arg Met Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 12);
Ac-Nal Val Pro Ile Phe Thr Tyr Gly Glu Leu Gln Arg Met Gln Glu Lys Glu Arg Asn Lys Pro Gln (SEQ ID NO: 13);
Phe Val Pro Ile Phe Thr Tyr Gly Asp Leu Gln Arg Leu Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 14);
Phe Val Pro Ile Phe Thr Tyr Gly Asp Leu Gln Arg Met Gln Glu Lys Glu Arg Pro Lys Pro Gln (SEQ ID NO: 15).
Соединения по данному изобретению можно получить обычными способами. Например, они могут быть получены с помощью химического синтеза, методом генной инженерии (в случае пептидов, состоящих исключительно из L-аминокислот), или с помощью их комбинаций.
Уже были разработаны различные способы для химического синтеза пептидов, и соединения по данному изобретению могут быть также легко получены известными способами. Например, могут быть использованы классические методы синтеза пептидов и твердофазные методы их получения. В частности, аминокислоты с защитными группами концентрируют жидкофазным методом и/или твердофазным методом, затем пептидную цепь наращивают, и после необязательного отщепления N-концевой защитной группы с помощью основания, такого как пиперазин, все защитные группы и смолу удаляют с помощью кислоты, и полученный неочищенный продукт очищают методом разделение/очистка, таким как гель-фильтрация, ультрафильтрация, диализ, электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), или различными хроматографическими методами, после чего могут быть получены пептиды по данному изобретению. Например, они могут быть получены методами, описанными в книгах, таких как “Seikagaku Jikken Koza 1 Tanpakushitu no Kagaku (Course of Biochemical Experimentation 1, Chemistry of Protein),” Vol. 4, Chapters 2 and 3 (written in Japanese, Tokyo Kagaku Dojin) и “Zoku Iyakuhinn no Kaihatsu 14 Peptide Gosei (Drug Development 14, Sequel Version, Peptide Synthesis)” (written in Japanese, Hirokawa Shoten).
Из числа соединений по данному изобретению соединения, имеющие связь -psi[CH2NH]- формулы 2 в виде связи между аминокислотами, можно также получить химическим синтезом. Например, в случае синтеза соединения, в котором связь X1-Val в формуле 1 представляет собой связь -psi[CH2NH]-, вышеописанный способ используют для наращивания пептидной цепи от C конца до аминокислоты в 2-положении (Val в формуле 1), и затем защитную группу на α-аминогруппе в аминокислоте 2-положения отщепляют химически; после этого альдегид Boc- или Fmoc-аминокислоты вводят согласно реакции гидроалкилирования посредством натрий цианотригидроборат/1% уксусной кислоты, с последующим удалением смолы и снятием защиты с помощью кислоты таким же способом, как описано выше, получая неочищенный продукт, который затем очищают, используя метод разделения/очистки, такой как гель-фильтрация, ультрафильтрация, диализ, электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE), или различные хроматографические методы, после чего могут быть получены пептиды по данному изобретению.
Пептиды, состоящие исключительно из природных аминокислот L-формы, можно получить методом генной инженерии. В частности, может быть культивирована клетка-хозяин, трансформированная экспрессирующим вектором, содержащим ДНК, кодирующую пептидную последовательность согласно данному изобретению, для того, чтобы затем выделить желаемый пептид из полученной культуры.
Примеры вектора, в который должен быть введен ген, включают векторы E. coli (например, pBR322, pUC18 и pUC19), векторы B. subtilis (например, pUB110, pTP5 и pC194), дрожжевые векторы (например, YEp, YRp и типы YIp) и векторы клеток животных (например, ретровирус и вирус коровьей оспы), но могут быть использованы и другие векторы при условии, что они способны стабильно удерживать требуемый ген внутри клетки-хозяина. Вектор, представляющий интерес, вводят в подходящую клетку-хозяина. Различные методы могут быть использованы для включения требуемого гена в плазмиду или для введения в клетку-хозяина, и типичные методы описаны в Molecular Cloning (Sambrook et al., 1989).
Для экспрессии требуемого пептидного гена в плазмиде, упомянутой выше, промотор функционально встраивают в ориентации, противоположной направлению транскрипции этого гена. Любые промоторы могут быть использованы в настоящем изобретении при условии, что они подходят для клетки-хозяина, которую используют для экспрессии требуемого гена. Например, если клетка-хозяин, подлежащая трансформированию, представляет собой род Escherichia, то могут быть использованы промотор lac, промотор trp, промотор lpp, промотор λPL, промотор recA и т.д.; в случае рода Bacillus могут быть использованы промотор SP01, промотор SP02, промотор penP и т.д.; в случае дрожжей могут быть использованы промотор GAP, промотор PH05, промотор ADH и т.д.; в случае клеток животных могут быть использованы промотор SV40, промотор CMV, ретровирус-производный промотор и т.д.
В тех случаях, когда клетка-хозяин должна быть трансформирована полученным таким образом вектором, содержащим представляющий интерес ген, клетка-хозяин, подлежащая использованию, может быть бактериальной (например, Escherichia рода и Bacillus рода), дрожжами (Saccharomyces рода, Pichia рода и Candida рода), клетками животных (клетка CHO, клетка COS и т.д.) и т.п. В качестве культуральной среды подходящими являются жидкие среды, и особенно предпочтительны среды, содержащие источники углерода, источники азота и другие питательные вещества, которые требуются для роста трансформированной клетки, подлежащей культивированию. При желании могут быть добавлены витамины, стимулирующие рост факторы, сыворотки и т.д. Для выделения соединения по данному изобретению из культуральной среды, содержащей пептидное производное по данному изобретению, могут быть использованы такие же методы разделения/очистки, как те, которые были использованы при получении пептидных соединений химическим синтезом.
Соединения по данному изобретению могут быть использованы для лечения заболеваний, которые включают нарушения функций пищеварительного тракта (например, состояния, которые характеризуются снижением, относительно базового уровня, моторной активности желудочно-кишечного тракта). Нарушения функций пищеварительного тракта представляют собой состояния, которые характеризуются проявлением таких симптомов в пищеварительном тракте, которые вызывают дискомфорт, физические неудобства, хотя результаты эндоскопического исследования, анализа крови и т.д. при этом никаких очевидных органических аномалий, таких как воспаления и язвы, не обнаруживают, и эта группа болезней, которые в совокупности называют “функциональные нарушения желудочно-кишечного тракта”, систематизирована и определяется присущими ей симптомами в соответствии с критериями ROME III (Gastroenterology 130: 1377-1556, 2006). Заболевания, которые включают нарушения функций желудочно-кишечного тракта, включают такие состояния, как функциональная диспепсия, диабетический гастропарез, рефлюксная гастроэзофагеальная болезнь, синдром раздраженного кишечника, чрезмерное развитие микрофлоры тонкого кишечника, псевдонепроходимость толстой кишки, паралитическая непроходимость кишечника, хроническая идиопатическая псевдообструкция кишечника и послеоперационная непроходимость кишечника.
Следует указать на то, что нарушения функций желудочно-кишечного тракта диагностируют не только по субъективным симптомам, таким как боль в животе, тошнота, рвота, диарея, запор, изжога, вспучивание живота и плохой аппетит, но с помощью объективных исследований, таких как измерение давления в желудочно-кишечном тракте, исследование желудочного сока, мониторинг рН желудка, анализ опорожнения желудка, рентгенография желудочно-кишечного тракта и эндоскопическое исследование.
Соединения по данному изобретению или их фармацевтически приемлемые соли могут быть использованы для животных, включая человека, в количествах, достаточных для придания требуемой моторной активности пищеварительного тракта, либо одни, либо в смеси с известными, фармацевтически премлемыми носителями, эксципиентами, наполнителями и т.д.
Для целей настоящего изобретения фармацевтически приемлемые соли включают, например, соли с неорганическими основаниями, соли с органическими основаниями, соли с неорганическими кислотами, соли с органическими кислотами и соли с основными или кислыми аминокислотами, но эти перечисленные соли не являются единственными примерами, и могут быть использованы любые обычные соли.
Пептидные соединения по данному изобретению могут вводиться различными инъекционными путями, такими как подкожное введение, внутримышечное введение и внутривенное введение. Кроме того, поскольку пептидные соединения по данному изобретению предполагают высокую абсорбцию по