Выделенный полинуклеотид, кодирующий полипептид, вовлеченный в биосинтез пирипиропена а, вектор и клетка-хозяин содержащие такой полинуклеотид и способ получения предшественника пирипиропена а (варианты)
Иллюстрации
Показать всеПредставленные изобретения касаются выделенного полинуклеотида, кодирующего полипептид, вовлеченный в биосинтез пирипиропена А, вектора и клетки-хозяина, включающих такой полипептид, и способов получения предшественников пирипиропена А, включающих культивирование клетки-хозяина. Представленный полинуклеотид кодирует полипептид, обладающий какой-либо одной или более из активностей - поликетидсинтазы, пренилтрансферазы, гидроксилазы, ацетилтрансферазы или аденилатсинтазы. Представленные изобретения позволяют синтезировать пирипиропен А, являющийся инсектицидным агентом, и могут быть использованы при формировании устойчивости растений к насекомым-вредителям. 5 н. и 11 з.п. ф-лы, 11 ил., 1 табл., 11 пр.
Реферат
Перекрестная ссылка на родственную заявку
По настоящей патентной заявке испрашивается приоритет японской патентной заявки No. 190862/2008, которая зарегистрирована 24 июля 2008 г., японской патентной заявки No. 270294/2008, которая зарегистрирована 20 октября 2008 г., и японской патентной заявки No. 20591/2009, которая зарегистрирована 30 января 2009 г., и полный объем раскрытого содержания всех их включен в настоящее описание в качестве ссылки в виде части раскрытия настоящей заявки.
Известный уровень техники
Область техники, к которой относится изобретение
Настоящее изобретение относится к гену биосинтеза пирипиропена А.
Характеристика известного уровня техники
Как раскрыто в выложенной японской патентной публикации No. 360895/1992 (патентный документ 1) и в Journal of Antibiotics (1993), 46(7), 1168-9 (непатентный документ 1), пирипиропен А обладает ингибиторной активностью в отношении ACAT (ацил-CoA-холестеринацилтрансферазы). Предполагается его применение для лечения заболеваний, вызываемых аккумуляцией холестерина или тому подобного.
Дополнительно в статье в Journal of Synthetic Organic Chemistry, Japan (1998), Vol. 56, No. 6, 478-488 (непатентный документ 2), WO94/09147 (патентный документ 2), выложенной японской патентной публикации No. 184158/1994 (патентный документ 3), выложенной японской патентной публикации No. 239385/1996 (патентный документ 4), выложенной японской патентной публикации No. 259569/1996 (патентный документ 5), выложенной японской патентной публикации No. 269062/1996 (патентный документ 6), выложенной японской патентной публикации No. 269063/1996 (патентный документ 7), выложенной японской патентной публикации No. 269064/1996 (патентный документ 8), выложенной японской патентной публикации No. 269065/1996 (патентный документ 9), выложенной японской патентной публикации No. 269066/1996 (патентный документ 10), выложенной японской патентной публикации No. 291164/1996 (патентный документ 11) и в статье в Journal of Antibiotics (1997), 50(3), 229-36 (непатентный документ 3) раскрыты аналоги и производные пирипиропена, а также их ингибиторная активность в отношении ACAT.
Далее, в статье в Applied and Environmental Microbiology (1995), 61(12), 4429-35 (непатентный документ 4) раскрыто, что пирипиропен А обладает инсектицидной активностью против личинки Helicoverpa armigera. Кроме того, в WO2004/060065 (патентный документ 12) раскрыто, что пирипиропен А обладает инсектицидной активностью против личинки капустной моли и Tenebrio molitor.
Кроме того, в WO2006/129714 (патентный документ 13) и в WO2008/066153 (патентный документ 14) раскрыто, что аналоги пирипиропена обладают инсектицидной активностью против растительной тли.
Более того, в качестве бактерии, продуцирующей пирипиропен А, раскрыты штамм FO-1289 Aspergillus fumigatus в выложенной японской патентной публикации No. 360895/1992 (патентный документ 1); штамм NRRL-3446 Eupenicillium reticulosporum в статье в Applied and Environmental Microbiology (1995), 61(12), 4429-35 (непатентный документ 4); и штамм F1959 Penicillium griseofulvum в патенте WO2004/060065 (патентный документ 12); и штамм PF1169 Penicillium coprobium в Journal of Technical Disclosure 500997/2008 (патентный документ 15).
Также в качестве пути биосинтеза пирипиропена А в статьях в Journal of Organic Chemistry (1996), 61, 882-886 (непатентный документ 5) и в Chemical Review (2005), 105, 4559-4580 (непатентный документ 6) раскрыт предполагаемый путь биосинтеза в штамме FO-1289 Aspergillus fumigatus. В этих документах раскрыто, что в штамме FO-1289 Aspergillus fumigates подструктуры, индивидуально синтезируемые с помощью поликетидсинтазы и пренилтрансферазы, соединяются для синтеза пирипиропена А под действием циклазы.
[Ссылки предшествующего уровня техники]
[Патентные документы]
[Патентный документ 1] выложенная японская патентная публикация No. 360895/1992
[Патентный документ 2] WO94/09147
[Патентный документ 3] выложенная японская патентная публикация No. 184158/1994
[Патентный документ 4] выложенная японская патентная публикация No. 239385/1996
[Патентный документ 5] выложенная японская патентная публикация No. 259569/1996
[Патентный документ 6] выложенная японская патентная публикация No. 269062/1996
[Патентный документ 7] выложенная японская патентная публикация No. 269063/1996
[Патентный документ 8] выложенная японская патентная публикация No. 269064/1996
[Патентный документ 9] выложенная японская патентная публикация No. 269065/1996
[Патентный документ 10] выложенная японская патентная публикация No. 269066/1996
[Патентный документ 11] выложенная японская патентная публикация No. 291164/1996
[Патентный документ 12] WO2004/060065
[Патентный документ 13] WO2006/129714
[Патентный документ 14] WO2008/066153
[Патентный документ 15] Journal of Technical Disclosure 500997/2008
[Непатентные документы]
[Непатентный документ 1] Journal of Antibiotics (1993), 46(7), 1168-9
[Непатентный документ 2] Journal of Synthetic Organic Chemistry, Japan (1998), Vol. 56, No. 6, 478-488
[Непатентный документ 3] Journal of Antibiotics (1997), 50(3), 229-36
[Непатентный документ 4] Applied and Environmental Microbiology (1995), 61(12), 4429-35
[Непатентный документ 5] Journal of Organic Chemistry (1996), 61, 882-886
[Непатентный документ 6] Chemical Review (2005), 105, 4559-4580
[Краткое изложение сущности изобретения]
Изобретатели этого изобретения в настоящий момент выявили нуклеотидную последовательность, кодирующую, по меньшей мере, один полипептид, вовлеченный в биосинтез пирипиропена А. Настоящее изобретение было осуществлено на основе этих данных.
Соответственно, целью настоящего изобретения является обеспечение выделенным новым полинуклеотидом, обладающим нуклеотидной последовательностью, кодирующей, по меньшей мере, один полипептид, вовлеченный в биосинтез пирипиропена А, рекомбинантным вектором, включающим полинуклеотид, и трансформантом, включающим полинуклеотид.
Далее, в соответствии с одним вариантом осуществления настоящего изобретения предлагается выделенный полинуклеотид, который представляет собой
(a) полинуклеотид, обладающий нуклеотидной последовательностью SEQ ID NO:266,
(b) полинуклеотид, обладающий нуклеотидной последовательностью, которая способна гибридизоваться с нуклеотидной последовательностью SEQ ID NO:266 в жестких условиях, или
(c) полинуклеотид, обладающий полинуклеотидной последовательностью, кодирующей, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 267-274, или по существу эквивалентную им аминокислотную последовательность.
Также в соответствии с другим вариантом осуществления настоящего изобретения предлагается выделенный полинуклеотид, который обладает, по меньшей мере, одной нуклеотидной последовательностью, выбранной из нуклеотидной последовательности в любом из пунктов (1) или (2) ниже:
(1) нуклеотидной последовательностью в любом из пунктов от (a) до (h) ниже:
(a) нуклеотидной последовательностью от 3342 до 5158 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(b) нуклеотидной последовательностью от 5382 до 12777 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(c) нуклеотидной последовательностью от 13266 до 15144 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(d) нуклеотидной последовательностью от 16220 до 18018 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(e) нуклеотидной последовательностью от 18506 до 19296 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(f) нуклеотидной последовательностью от 19779 до 21389 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(g) нуклеотидной последовательностью от 21793 до 22877 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(h) нуклеотидной последовательностью от 23205 до 24773 в нуклеотидной последовательности, представленной SEQ ID NO:266;
(2) нуклеотидной последовательностью, которая способна гибридизоваться с нуклеотидной последовательностью из (1) в жестких условиях.
Далее, в соответствии с другим вариантом осуществления настоящего изобретения предлагается полинуклеотид, кодирующий, по меньшей мере, один полипептид, вовлеченный в биосинтез пирипиропена А.
Кроме того, в соответствии с другим вариантом осуществления настоящего изобретения предлагается полинуклеотид, кодирующий полипептид, обладающий какой-либо одной или более из активностей - активностью поликетидсинтазы, активностью пренилтрансферазы, активностью гидроксилазы, активностью ацетилтрансферазы или активностью аденилатсинтетазы.
Более того, в соответствии с другим вариантом осуществления настоящего изобретения предлагается полинуклеотид, который происходит из штамма PF1169 Penicillium coprobium.
Дополнительно в соответствии с другим вариантом осуществления настоящего изобретения предлагается рекомбинантный вектор, включающий указанный выше полинуклеотид.
Кроме того, в соответствии с другим вариантом осуществления настоящего изобретения предлагается трансформант, включающий указанный выше полинуклеотид.
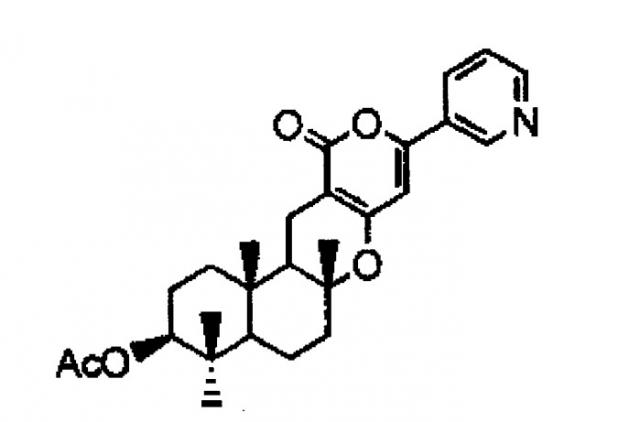
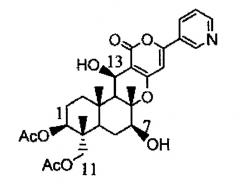
Дополнительно в соответствии с одним вариантом осуществления настоящего изобретения предлагается способ получения предшественника пирипиропена А, отличающийся культивированием трансформанта, в который полинуклеотид, обладающий нуклеотидной последовательностью, указанной выше в (c) или (d), включен одновременно или отдельно, и выделением предшественника пирипиропена А из пирипиропена E, представленного следующей формулой:
[Химическая формула 1]
Пирипиропен E
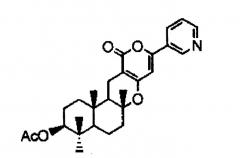
Кроме того, предлагается способ получения, в котором указанный выше предшественник пирипиропена А представляет собой предшественник, представленный следующей формулой (I):
[Химическая формула 2]
Формула (I)
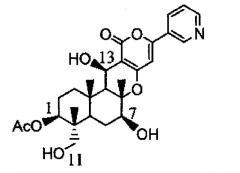
Также предлагается способ получения предшественника пирипиропена А, отличающийся культивированием указанного выше трансформанта, и выделением предшественника пирипиропена А из пирипиропена O, представленного следующей формулой:
[Химическая формула 3]
Пирипиропен O
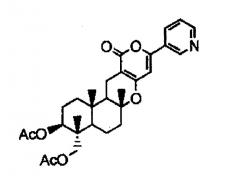
Кроме того, предлагается способ получения, в котором указанный выше предшественник пирипиропена А представляет собой соединение, представленное следующей формулой (II):
[Химическая формула 4]
Формула (II)
В соответствии с одним вариантом осуществления настоящего изобретения предлагается получение нового аналога пирипиропена, улучшение продуктивности бактерии, продуцирующей пирипиропен А, получение нового инсектицидного агента для микроорганизмов, создание новой устойчивости растений к насекомым-вредителям или тому подобное.
[Краткое описание фигур]
[Фигура 1] На фигуре 1 представлен образец электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали амплифицированные продукты ПЦР с применением следующих праймеров: M: маркер молекулярной массы (шаг 100 п.о.), дорожка 1: праймеры SEQ ID NO:1 и 2, дорожка 2: праймеры SEQ ID NO:239 и 240, дорожка 3: праймеры SEQ ID NO:237 и 238, дорожка 4: праймеры SEQ ID NO:241 и 242, дорожка 5: праймеры SEQ ID NO:247 и 248, дорожка 6: праймеры SEQ ID NO:251 и 252, дорожка 7: праймеры SEQ ID NO:245 и 246, дорожка 8: праймеры SEQ ID NO:243 и 244, дорожка 9: праймеры SEQ ID NO:249 и 250, дорожка 10: праймеры SEQ ID NO:235 и 236, дорожка 11: праймеры SEQ ID NO:233 и 234, дорожка 12: праймеры SEQ ID NO:227 и 228, дорожка 13: праймеры SEQ ID NO:229 и 230, дорожка 14: праймеры SEQ ID NO:231 и 232.
[Фигура 2] Сходно с фигурой 1 на фигуре 2 представлен образец электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали амплифицированные продукты ПЦР с применением следующих праймеров: M: маркер молекулярной массы (шаг 100 п.о.), дорожка 1: праймеры SEQ ID NO:253 и 254, дорожка 2: праймеры SEQ ID NO:257 и 258, дорожка 3: праймеры SEQ ID NO:259 и 260, дорожка 4: праймеры SEQ ID NO:255 и 256, дорожка 5: праймеры SEQ ID NO:261 и 262.
[Фигура 3] Сходно с фигурой 1 на фигуре 3 представлен образец электрофореза продуктов ПЦР в агарозном геле. Для электрофореза использовали амплифицированные продукты ПЦР с применением следующих праймеров: дорожка 1: маркер молекулярной массы (шаг 100 п.о.), дорожка 2: праймеры SEQ ID NO:264 и 265 (амплифицированный фрагмент 400 п.о.).
[Фигура 4] На фигуре 4 представлена карта плазмиды pUSA.
[Фигура 5] На фигуре 5 представлена карта плазмиды pPP2.
[Фигура 6] На фигуре 6 представлена схема амплификации кДНК P450-2.
[Фигура 7] На фигуре 7 представлена карта плазмиды pPP3.
[Фигура 8] На фигуре 8 представлен спектр 1H-ЯМР пирипиропена E в дейтерированном ацетонитриле.
[Фигура 9] На фигуре 9 представлен спектр 1H-ЯМР в дейтерированном ацетонитриле продукта культуры Aspergillus oryzae, трансформированного плазмидой pPP2.
[Фигура 10] На фигуре 10 представлен спектр 1H-ЯМР пирипиропена O в дейтерированном ацетонитриле.
[Фигура 11] На фигуре 11 представлен спектр 1H-ЯМР в дейтерированном ацетонитриле продукта культуры Aspergillus oryzae, трансформированного плазмидой pPP3.
[Подробное описание изобретения]
Депонирование микроорганизмов
Escherichia coli (Escherichia coli EPI300™-T1R), трансформированная плазмидой pCC1-PP1, была депонирована в международном депозитарии запатентованных организмов, государственный институт прогрессивной промышленной науки и технологии (адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под No. поступления FERM BP-11133 (переведенного из местного депозитария под No. поступления FERM P-21704) (идентификационная ссылка депозиторов: Escherichia coli EPI300™-T1R/pCC1-PP1) 9 октября 2008 г. (исходная дата депонирования).
Aspergillus oryzae, трансформированный плазмидой pPP2, был депонирован в международном депозитарии запатентованных организмов, государственный институт прогрессивной промышленной науки и технологии (адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под No. поступления FERM BP-11137 (идентификационная ссылка депозиторов: Aspergillus oryzae PP2-1) 23 июня 2009 г.
Aspergillus oryzae, трансформированный плазмидой pPP3, был депонирован в международном депозитарии запатентованных организмов, государственный институт прогрессивной промышленной науки и технологии (адрес: AIST Tsukuba Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki, Japan, 305-8566), под No. поступления FERM BP-11141 (идентификационная ссылка депозиторов: Aspergillus oryzae PP3-2) 3 июля 2009 г.
Выделенный полинуклеотид
В настоящем изобретении представлен выделенный полинуклеотид. Выделенный полинуклеотид по настоящему изобретению представляет собой (a) полинуклеотид, обладающий нуклеотидной последовательностью SEQ ID NO:266; (b) полинуклеотид, обладающий нуклеотидной последовательностью, которая способна гибридизоваться с нуклеотидной последовательностью SEQ ID NO:266 в жестких условиях, или (c) полинуклеотид, обладающий полинуклеотидной последовательностью, кодирующей, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: 267-274, или по существу эквивалентную им аминокислотную последовательность. Указанный выше выделенный полинуклеотид предпочтительно обладает нуклеотидной последовательностью, кодирующей, по меньшей мере, один полипептид, который обладает ферментативной активностью, вовлеченной в биосинтез пирипиропена А.
В настоящем изобретении «по существу эквивалентная аминокислотная последовательность» обозначает аминокислотную последовательность, которая не влияет на активность полипептида, несмотря на тот факт, что одна или более аминокислот изменены в результате замены, делеции, добавки или вставки. Количество измененных аминокислотных остатков составляет предпочтительно от 1 до 40 остатков, более предпочтительно от 1 до нескольких остатков, еще более предпочтительно от 1 до 8 остатков, наиболее предпочтительно от 1 до 4 остатков.
Далее, пример изменения, которое не влияет на активность, включает консервативную замену. Термин «консервативная замена» обозначает замену одного или более аминокислотных остатков другими химически сходными аминокислотными остатками, так что активность полипептида существенно не изменяется. Их примеры включают случаи, когда остаток определенной гидрофобной аминокислоты заменяют остатком другой гидрофобной аминокислоты, и случаи, когда остаток определенной полярной аминокислоты заменяют остатком другой полярной аминокислоты, обладающей теми же зарядами. Функционально сходные аминокислоты, способные на такие замены, известны в данной области техники для каждой аминокислоты. Конкретно, примеры неполярных (гидрофобных) аминокислот включают аланин, валин, изолейцин, лейцин, пролин, триптофан, фенилаланин, метионин и тому подобное. Примеры полярных (нейтральных) аминокислот включают глицин, серин, треонин, тирозин, глутамин, аспарагин, цистеин и тому подобное. Примеры положительно заряженных (основных) аминокислот включают аргинин, гистидин, лизин и тому подобное. Примеры отрицательно заряженных (кислых) аминокислот включают аспарагиновую кислоту, глутаминовую кислоту и тому подобное.
Также выделенный полинуклеотид по настоящему изобретению может представлять собой полинуклеотид, обладающий, по меньшей мере, одной нуклеотидной последовательностью, выбранной из нуклеотидной последовательности в любом из пунктов (1) или (2) ниже:
(1) нуклеотидной последовательностью в любом из пунктов от (a) до (h) ниже:
(a) нуклеотидной последовательностью от 3342 до 5158 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(b) нуклеотидной последовательностью от 5382 до 12777 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(c) нуклеотидной последовательностью от 13266 до 15144 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(d) нуклеотидной последовательностью от 16220 до 18018 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(e) нуклеотидной последовательностью от 18506 до 19296 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(f) нуклеотидной последовательностью от 19779 до 21389 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(g) нуклеотидной последовательностью от 21793 до 22877 в нуклеотидной последовательности, представленной SEQ ID NO:266,
(h) нуклеотидной последовательностью от 23205 до 24773 в нуклеотидной последовательности, представленной SEQ ID NO:266;
(2) нуклеотидной последовательностью, которая способна гибридизоваться с нуклеотидной последовательностью из (1) в жестких условиях.
Полинуклеотид, обладающий, по меньшей мере, одной нуклеотидной последовательностью, выбранной из нуклеотидной последовательности в любом из указанных выше пунктов (1) или (2), предпочтительно кодирует, по меньшей мере, один полипептид, обладающий ферментативной активностью, вовлеченной в биосинтез пирипиропена А.
Термин «жесткие условия» в настоящем изобретении обозначает условия, когда процедура отмывки мембран после гибридизации осуществляется при высоких температурах в растворе с низкими концентрациями соли, например, в условиях отмывки в растворе с концентрацией 2×SSC (1×SSC: 15 мМ цитрата тринатрия, 150 мМ хлорида натрия) и 0,5% SDS при 60°С в течение 20 минут.
Полинуклеотид, обладающий, по меньшей мере, одной нуклеотидной последовательностью, выбранной из нуклеотидной последовательности в любом из указанных выше пунктах (1) или (2) по настоящему изобретению представляет собой полинуклеотид, кодирующий полипептид, обладающий какой-либо одной или более из активностей - активностью поликетидсинтазы, активностью пренилтрансферазы, активностью гидроксилазы, активностью ацетилтрансферазы или активностью аденилатсинтетазы; и, в частности, полинуклеотид, кодирующий полипептид, обладающий активностью гидроксилазы.
Кроме того, в соответствии с одним вариантом осуществления настоящего изобретения указанный выше полинуклеотид представляет собой полинуклеотид, кодирующий полипептид, обладающий активностью в отношении гидроксилирования положения 7 и/или положения 13 указанного выше пирипиропена E или O, или представляет собой полинуклеотид, кодирующий полипептид, обладающий активностью в отношении гидроксилирования положения 11 указанного выше пирипиропена E.
Получение выделенного полинуклеотида
Способ получения выделенного полинуклеотида по настоящему изобретению особенно не ограничен. Например, полинуклеотид может быть выделен из штамма PF1169 Penicillium coprobium или нитчатой бактерии с помощью следующего способа.
Основываясь на гомологии последовательности, полученной методом примера 9 ниже или тому подобного, синтезируют праймеры, способные к специфичной амплификации гена поликетидсинтазы. ПЦР осуществляют для фосмидной геномной библиотеки штамма PF1169 Penicillium coprobium, который получают отдельно с последующей гибридизацией колоний. В результате этого получают рекомбинантный вектор, и определяют последовательность оснований его вставленной ДНК.
Также, основываясь на гомологии последовательности, полученной методом примера 9 ниже или тому подобного, синтезируют праймеры, способные к специфичной амплификации гена пренилтрансферазы. Далее определяют последовательность оснований вставленной ДНК тем же способом, что и описанный выше.
Далее, основываясь на гомологии последовательности, полученной способом примера 9 ниже или тому подобного, синтезируют праймеры, способные к специфичной амплификации любого или обоих гена поликетидсинтазы и гена пренилтрансферазы. Далее определяют последовательность оснований вставленной ДНК тем же способом, что и описанный выше.
Кроме того, основываясь на гомологии последовательности, по меньшей мере, одной нуклеотидной последовательности, выбранной из SEQ ID NO:266, и нуклеотидной последовательности в любом из указанных выше пунктов (1) или (2) по настоящему изобретению, синтезируют праймеры, способные к специфичной амплификации любого одного или более гена поликетидсинтазы, гена пренилтрансферазы, гена гидроксилазы, гена ацетилтрансферазы или гена аденилатсинтетазы, предпочтительно гена гидроксилазы. Далее определяют последовательность оснований вставленной ДНК тем же способом, что и описанный выше.
Кроме того еще, основываясь на аминокислотной последовательности поликетидсинтаз, консервативных среди различных нитчатых бактерий, синтезируют вырожденные праймеры для амплификации и определяют последовательность оснований вставленной ДНК.
Трансформант
В целом примеры способа улучшения продуктивности продукта вторичного метаболизма с помощью рекомбинации генов включают улучшение экспрессии гена, кодирующего белок, катализирующий биосинтетическую реакцию, которая представляет собой реакцию, лимитирующую скорость биосинтеза, улучшение экспрессии гена биосинтеза или разрушение гена, регулирующего экспрессию гена биосинтеза, блокирование необязательной системы вторичного метаболизма и тому подобное. Следовательно, определение гена биосинтеза делает возможным улучшение продуктивности продукта вторичного метаболизма путем лигирования гена в подходящий вектор и введения вектора в бактерию-продуцент.
Между тем, для того чтобы создать новое активное вещество путем рекомбинации генов осуществляют изменение доменов поликетидсинтазы [Ikada and Ohmura, “Protein. Nucleic acid and enzyme” Vol. 43, p. 1265-1277, 1998], [Carreras, C.W. and Santi, D.V., “Current Opinion in Biotechnology”, (UK), 1998, Vol. 9, p. 403-411], [Hutchinson, C.R., “Current Opinion in Microbiology”, (UK), 1998, Vol. 1, p. 319-329], [Katz, L. and McDaniel, R., “Medicinal Research Reviews”, (USA), 1999, Vol. 19, p. 543-558]; разрушение гена биосинтеза; введение модифицированного гена фермента от других организмов [Hutchinson, C.R., “Bio/Technology”, (USA), 1994, Vol. 12, p. 375-380]; и тому подобное. Таким образом, установление гена биосинтеза делает возможным создание нового активного вещества путем лигирования гена с подходящим вектором и введения вектора в бактерию, продуцирующую продукт вторичного метаболизма.
Следовательно, пирипиропен А может быть получен или его продукция может быть улучшена путем лигирования выделенного полинуклеотида по настоящему изобретению с подходящим вектором, введения вектора в хозяина, его экспрессирования, повышения его экспрессии или осуществления разрушения части гена выделенного полинуклеотида с использованием гомологичной рекомбинации и ослабления его функций.
Разрушение гена с использованием гомологичной рекомбинации может быть осуществлено в соответствии с общепринятым способом. Получение вектора, используемого для разрушения гена, и введение вектора в хозяина очевидно для специалистов в данной области техники.
Рекомбинантный вектор по настоящему изобретению предпочтительно включает любой один или более из полинуклеотидов, обладающих нуклеотидной последовательностью SEQ ID NO:266 и указанными выше в (1); полинуклеотид, обладающий нуклеотидной последовательностью, которая способна гибридизоваться с нуклеотидной последовательностью SEQ ID NO:266 и указанными выше в (1) в жестких условиях, или полинуклеотид, обладающий полинуклеотидной последовательностью, кодирующей, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO: с 267 по 274 или по существу эквивалентную им аминокислотную последовательность. Более предпочтительно, рекомбинантный вектор по настоящему изобретению представляет собой вектор, в котором указанный выше полинуклеотид включает полинуклеотид, кодирующий полипептид, гидроксилирующий пирипиропен E или O в положении 7 и/или положении 13, и указанный выше полинуклеотид, включающий полинуклеотид, кодирующий полипептид, гидроксилирующий пирипиропен E в положении 11.
Рекомбинантный вектор для введения гена может быть получен путем модификации полинуклеотида, предлагаемого настоящим изобретением, в подходящую форму в зависимости от объекта и лигирования в вектор в соответствии с общепринятым способом, например, способами рекомбинации генов, описанными в руководстве {Sambrook, J. et al., “Molecular cloning: a laboratory manual”, (USA), 2nd Edition, Cold Spring Harbor Laboratory, 1989].
Рекомбинантный вектор, используемый в настоящем изобретении, может быть подходящим образом выбран из вирусных, плазмидных, фосмидных, космидных векторов или тому подобного. Например, когда клеткой-хозяином является E. coli, их примеры включают бактериофаг на основе фага λ и плазмиды на основе pBR и pUC. В случае Bacillus subtilis примеры включают плазмиды на основе pUB. В случае дрожжей примеры включают плазмиды на основе YEp, YRp, YCp и YIp.
Кроме того, предпочтительно, чтобы, по меньшей мере, одна плазмида из используемых плазмид включала маркер селекции для селекции трансформанта. В качестве маркера селекции может быть использован ген, кодирующий устойчивость к лекарственным средствам, и ген, завершающий ауксотрофию. Их конкретные предпочтительные примеры включают при использовании бактерии в качестве хозяина - гены устойчивости к ампициллину, гены устойчивости к канамицину, ген устойчивости к тетрациклину и тому подобное; в случае дрожжей - ген биосинтеза триптофана (TRP1), ген биосинтеза урацила (URA3), ген биосинтеза лейцина (LEU2) и тому подобное; в случае грибов - гены устойчивости к гигромицину, гены устойчивости к биалафосу, гены устойчивости к блеомицину, гены устойчивости к ауреобасидину и тому подобное; и в случае растения - гены устойчивости к канамицину, гены устойчивости к биалафосу и тому подобное.
Кроме того, используемые в настоящем изобретении молекулы ДНК, служащие в качестве экспрессионного вектора, предпочтительно содержат последовательности ДНК, необходимые для экспрессии каждого гена, регуляторные сигналы транскрипции и регуляторные сигналы трансляции, такие как промоторы, сигналы инициации транскрипции, сайты связывания с рибосомой, стоп-сигналы трансляции, терминаторы. Предпочтительные примеры промоторов включают промоторы оперона лактозы, оперона триптофана и тому подобное в Escherichia coli; промоторы гена алкогольдегидрогеназы, гена кислой фосфатазы, гена метаболизма галактозы, гена глицеральдегид-3-фосфатдегидрогеназы или тому подобное в дрожжах; промоторы гена α-амилазы, гена глюкоамилазы, гена целлобиогидролазы, гена глицеральдегид-3-фосфатдегидрогеназы, гена abp1 или тому подобное в грибах; промотор CaMV 35S RNA, CaMV 19S RNA или промотор гена нопалинсинтетазы в растениях.
Хозяин, которому вводят выделенный полинуклеотид по настоящему изобретению, может быть подходящим образом выбран в зависимости от типа используемого вектора из актиномицетов, Escherichia coli, Bacillus subtilis, дрожжей, нитчатых бактерий, клеток растений и тому подобного.
Метод введения рекомбинантного вектора в хозяина может быть выбран в зависимости от тестируемой клетки-хозяина из конъюгационного переноса, трансдукции фагом, а так же методов трансформации, таких как метод с использованием ионов кальция, метод с использованием ионов лития, метод электропорации, метод с использованием ПЭГ, метод Agrobacterium или метод с использованием инжектора частиц.
В случаях, когда в настоящем изобретении в клетки-хозяева вводят множество генов, гены могут находиться в одной молекуле ДНК или раздельно в разных молекулах ДНК. Кроме того, когда клетка-хозяин представляет собой бактерию, каждый ген может быть сконструирован таким образом, чтобы он экспрессировался в виде полицистронной мРНК и вмещался в одну молекулу ДНК.
Трансформант по настоящему изобретению предпочтительно включает любой один или более из полинуклеотидов, имеющих нуклеотидную последовательность SEQ ID NO:266 и упомянутую выше (1); полинуклеотид, имеющий нуклеотидную последовательность, которая способна гибридизоваться с нуклеотидной последовательностью SEQ ID NO:266 и упомянутой выше (1) в жестких условиях, или полинуклеотид, имеющий полинуклеотидную последовательность, кодирующую, по меньшей мере, одну аминокислотную последовательность, выбранную из SEQ ID NO с 267 по 274 или по существу эквивалентную ей аминокислотную последовательность.
Полученный трансформант можно культивировать традиционным способом, и можно исследовать новоприобретенные свойства. В качестве среды можно использовать обычно применяемые компоненты, например, в качестве источников углерода глюкозу, сахарозу, крахмальный сироп, декстрин, крахмал, глицерин, мелассу, животные и растительные масла или тому подобное. Также в качестве источников азота могут быть использованы соевая мука, проростки пшеницы, жидкость от замоченной кукурузы, мука из семян хлопчатника, мясной экстракт, полипептон, мальтоэкстракт, дрожжевой экстракт, сульфат аммония, нитрат натрия, мочевина и тому подобное. Кроме того, при необходимости эффективна добавка натрия, калия, кальция, магния, кобальта, хлора, фосфорной кислоты (гидрофосфат калия или тому подобного), серной кислоты (сульфата магния или тому подобного) или неорганических солей, которые могут образовывать другие ионы. Также при необходимости могут быть добавлены различные витамины, такие как тиамин (гидрохлорид тиамина или тому подобное), аминокислоты, такие как глутаминовая кислота (глутамат натрия или тому подобное) или аспарагин (DL-аспарагин или тому подобное), следовые питательные вещества, такие как нуклеотиды, или агенты селекции, такие как антибиотики. Более того, могут быть подходящим образом добавлены органические вещества или неорганические вещества, которые способствуют росту бактерии и содействуют продукции пирипиропена A.
pH среды составляет, например, приблизительно от pH 5,5 до pH 8. В качестве метода культивирования может быть использовано культивирование на твердой фазе в аэробных условиях, культивирование со встряхиванием, культивирование с барботированием при перемешивании или аэробное культивирование в глубокой части, и особенно аэробное культивирование в глубокой части является наиболее подходящим. Подходящая температура для культивирования составляет от 15°С до 40°С, и во многих случаях рост происходит при приблизительно от 22°С до 30°С. Продукция пирипиропена A варьирует в зависимости от среды и условий культивирования или используемого хозяина. При любом методе культивирования аккумуляция обычно достигает пика от 2 дней до 10 дней. Культивирование прекращают в момент времени, когда аккумуляция пирипиропена A достигает пика, и желаемое вещество выделяют и очищают из культуры.
Для выделения пирипиропена A из культуры его можно экстрагировать и очищать с помощью обычных средств отделения с использованием его свойств, таких как метод экстракции растворителем, метод с использованием ионообменной смолы, метод распределительной колоночной хроматографии, метод гель-фильтрации, диализ, метод осаждения, метод кристаллизации, которые можно использовать раздельно или в соответствующем сочетании.
Метод получения предшественника пирипиропена A
Для выделения пирипиропена A пирипиропен A может быть выделен из предшественника пирипиропена A с помощью известного метода. Пример известного метода включает метод WO2009/022702. Путем культивирования микроорганизма, содержащего вектор, включающий одно или более из указанного выше, предшественник пирипиропена A может быть выделен из пирипиропена E. Предшественник пирипиропена A может представлять собой, например, соединение, представленной упомянутой выше формулой (I).
Предшественник пирипиропена A может также может быть выделен из пирипиропена O путем культивирования микроорганизма, включающего вектор, содержащий одно или более. Примером может служить соединение, представленной упомянутой выше формулой (II).
ПРИМЕРЫ
Настоящее изобретение будет далее подробно иллюстрировано следующими примерами, которые не предназначены для ограничения настоящего изобретения.
Пример 1: Получение геномной ДНК штамма PF1169 Penicillium coprobium
Стерилизованную среду NB (500 мл) помещали в эрленмейеровский сосуд (1 л). Штамм PF1169 Penicillium coprobium (Journal of Technical Discosure No. 500997/2008 (патентный документ 15)), предварительно культивированный в 1/2 агаровой среде CMMY при 28°С в течение 4 дней, добавляли к упомянутой выше среде и культивировали в жидкости при 28°С в течение 4 дней. Производили фильтрование с помощью Miracloth с получением 5 г бактериальных клеток. Из этих бактериальных клеток было получено 30 мкг геномной ДНК в соответствии с руководством, прилагаемым к набору для очистки геномной ДНК Genomic-tip 100/G (производство Qiagen K.K.).
Пример 2: Вырожденные праймеры для амплификации поликетидсинтазы (PKS) и ее амплифицированного фрагмента
Основываясь на аминокислотной последовательности поликетидсинтаз, консервативной для различных нитчатых бактерий, были сконструированы и синтезированы следующие праймеры в качестве вырожденных праймеров для амплификации:
LC1: GAYCCIMGITTYTTYAAYATG (SEQ ID NO:1)
LC2c: GTICCIGTICCRTGCATYTC (SEQ ID NO:2)
(где R=A/G, Y=C/T, M=A/C, I=инозин)
С помощью этих вырожденных праймеров геномной ДНК, полученной в примере 1, и ExTaq полимеразе (производство Takara Bio Inc.) давали провзаимодействовать в соответствии с прилагаемой инструкцией. Был обнаружен амплифицированный фрагмент приблизительно 700 п.н. (см. фигуру 1). Более того, указанный выше амплифицированный фрагмент был проанализирован для установления последовательности расположенных внутри 500 п.н. (SEQ ID NO:3).
Пример 3: Широкомасштабное секвенирование геномной ДНК и поиск гомологии аминокислотной последовательности
Геномную ДНК штамма PF1169 Penicillium coprobium, полученную в примере 1, подвергали широкомасштабному секвенированию и производили поиск гомологичных аминокислотных последовательностей. Конкретно, часть из 50 мкг геномной ДНК предварительно обрабатывали и затем вводили в ДНК-секвенатор Roche 454FLX с получением 103 тысяч фрагментов последовательностей приблизительно 250 п.н. (суммарно 49 м.н. последовательности).
Для этих последовательностей в качестве известных последовательностей для поликетидсинтаз и пренилтрансфераз были отобраны пять следующих последовательностей (последовательности из поликетидсинтаз: Aspergillus(A.) fumigatus PKS 2146 а.к. и Penicillium(P.) griseofluvum синтазы 6-метилсалициловой кислоты 1744 а.к.; а также пренилтрансфераз: Aspergillus(A.) fumigatus пренилтрансферазы, Aspergillus(A.) fumigatus пренилтрансферазы (4-гидроксибензоатоктапренилтрансферазы) и Penicillium(P.) marneffei пренилтрансферазы) и был произведен поиск с помощью программы blastx поиска гомологичных последовательностей с получением в результате 89, 86, 2, 1 и 3 гомологичных последовательностей, соответственно (см. таблицу 1). Далее из гомологичных последовательностей A. fumigatus PKS 2146 а.к. и P. griseofluvum синтазы 6-метилсалициловой кислоты 1744 а.к. было, соответственно, получено 19 и 23 близких последовательностей (непрерывные последовательности A. fumigatus PKS 2146 а.к.: SEQ ID NO: 179-197; непрерывные последовательности P. griseofluvum синтазы 6-метилсалициловой кислоты 1744 а.к.: SEQ ID NO: с 198 по 220) (см. таблицу 1).
| Таблица 1 | ||
| Наименование фермента | Происхождение | Количествогомологичных последователь-нос |