Олигонуклеотидные праймеры, флуоресцентный зонд и способ для выявления рнк вируса болезни ибараки методом полимеразной цепной реакции в режиме реального времени
Иллюстрации
Показать всеИзобретение относится к ветеринарной вирусологии. Описан способ выявления геномной РНК вируса болезни Ибараки (ВБИ) с помощью ПЦР с детекцией продуктов амплификации в режиме реального времени с использованием олигонуклеотидных праймеров и зонда, комплементарных участку 10 сегмента генома ВБИ, кодирующему неструктурные белки NS3 и NS3a. Способ с помощью ПЦР-РВ проводят при следующем температурном режиме: 1) 5 мин предварительной денатурации кДНК при 94°С; 2) 5 циклов реакции (денатурация при 94°С - 15 сек, отжиг праймеров при 62°С - 15 сек, элонгация при 72°С - 15 сек); 3) 35 циклов реакции с детекцией на стадии отжига праймеров (денатурация при 94°С - 15 сек, отжиг праймеров при 62°С - 15 сек, элонгация при 72°С - 20 сек). Учет результатов реакции проводят, анализируя кривые накопления флуоресцентного сигнала для каждой пробы. Представлен нуклеотидный состав указанных праймеров и зонда: IbarF 5'-GATCAAACCATTTTGCGCTT-3' IbarR5'-CTCATCCTCACCGCCTCATTG-3' IbarZ 5'-[HEX] TCTTGTATGGTCAATCCGCTGGCT [BH2J-3'. Изобретение позволяет сократить время проведения исследования, а также осуществлять не только качественный, но и количественный анализ содержания НК в образцах. 3 н.п. ф-лы, 4 табл., 6 пр.
Реферат
Болезнь Ибараки (БИ) - трансмиссивная неконтагиозная болезнь парнокопытных жвачных вирусной этиологии, характеризующаяся в острой форме лихорадкой, анорексией, язвенным поражением ротовой полости и нарушением глотательного рефлекса. В некоторых случаях возбудитель инфекции - вирус болезни Ибараки (ВБИ) - влияет и на репродуктивную функцию, вызывая абортирование плодов и мертворождение.
Наиболее часто БИ регистрируют среди КРС. Однако доказана слабая патогенность возбудителя инфекции для овец, которые являются скрытыми вирусоносителями.
Инкубационный период при БИ составляет 4-12 дней. Затем наблюдают внезапное повышение температуры тела до 40°С, продолжающееся 2-3, реже 7-10 дней. У животных развиваются такие клинические признаки болезни как: общее угнетение, отсутствие или снижение аппетита, лейкопения, слезотечение, пенистое слюнотечение, гиперемия и отек конъюнктивы, слизистой оболочки носа и ротовой полости. Большинство животных выздоравливают через 2-3 дня, однако у некоторых течение болезни осложняется развитием некрозов, эрозий и язв на коже лицевой части головы, слизистой оболочке рта, носа, желудка и венчике копыт. У 20-30% животных через 7-10 дней после начала болезни появляется характерный симптом - затрудненное глотание, а также наблюдается выпячивание языка. Данные нарушения возникают вследствие паралича мышц языка, гортани, глотки, пищевода и приводят к обезвоживанию и истощению организма при отсутствии дефицита корма. Кроме того, течение болезни может сопровождаться появлением аспирационной пневмонии и нарушением репродуктивной функции.
Летальность у КРС при данном заболевании варьирует в пределах 5-10%, а при развитии такого симптома болезни как затрудненное глотание, 30-40% животных погибают, или подвергаются вынужденному убою.
Возбудитель инфекции - вирус болезни Ибараки - относится к роду Orbivirus семейства Reoviridae и по большинству морфологических и структурных характеристик сходен с другими представителями указанного семейства такими как: вирус эпизоотической геморрагической болезни оленей (ВЭГБО), вирус блютанга (ВБ), вирус африканской чумы лошадей (ВАЧЛ). Геном ВБИ состоит из 10 сегментов двухцепочечной РНК. В результате изучения нуклеотидного состава сегментов генома, а также проведенных серологических исследований был сделан вывод о принадлежности ВБИ к серогруппе ЭГБО и наибольшей его генетической близости со штаммами ВЭГБО, относящимися ко 2 серотипу.
Основными территориями распространения ВБИ являются Япония, Корея, Тайвань. В ходе мониторинговых исследований антитела к ВБИ были обнаружены в крови КРС в Австралии и Индонезии.
ЭГБО является арбовирусной инфекцией и, следовательно, передача вируса между чувствительными животными происходит через укусы насекомых - мокрецов рода Culicoides. Это определяет сезонный характер эпизоотий, регистрируемых, как правило, в конце лета - осенью.
В настоящее время для диагностики ВБИ используют такие методы как: 1) выделение вируса на чувствительной лабораторной модели - культура клеток (первичные культуры клеток почки теленка, овцы, хомячка; перевиваемые клеточные культуры ВНК-21, HmLu-1, L-клетки), куриные эмбрионы, лабораторные животные (мыши); 2) серологические методы исследования (PH, непрямой МФА, различные варианты ИФА); 3) методы молекулярной биологии (различные варианты ПЦР, рестрикционный анализ).
В связи с необходимостью создания быстрых и точных методов диагностики ВБИ был разработан ряд ПЦР, позволяющих выявлять геном указанного вируса. Так, при проведении мониторинговых исследований по выявлению генома ВБИ в пробах мокрецов, собранных на территории Кореи в 2006-2008 гг., использовали стандартную ПЦР с обратной транскрипцией (ОТ-ПЦР) (чувствительность 4,0 lg ТЦД50/см 3) и гнездовой вариант ПЦР (чувствительность 2,0 lg ТЦД50/см 3). Праймеры, применявшиеся в стандартной ОТ-ПЦР, были рассчитаны Y. Uchinuno с сотр. и фланкировали участок 3 сегмента генома ВБИ, кодирующего структурный протеин VP3. Положительный результат был зарегистрирован в 20 пробах из 348 (5,75%), которые представляли собой суспензию, приготовленную из пула мокрецов (30-40 особей) на фосфатно-солевом буфере.
Для идентификации возбудителя эпизоотии болезни КРС, зарегистрированной в 1997 г., использовали стандартную ПЦР с последующим анализом полиморфизма длин рестрицированных фрагментов. Необходимость проведения рестрикционного анализа возникла в связи синтезом специфичного продукта не только в пробах, содержащих РНК ВБИ, но и в образцах ВЭГБО австралийского происхождения (CRISO 439, CRISO 157, CRISO 753, CRISO 775, DPP 59), хотя в пробах североамериканских штаммов ВЭГБО ампликонов соответствующего размера не обнаруживали.
В последние годы для идентификации геномов вирусов стала широко применяться ПЦР с детекцией продуктов амплификации в режиме реального времени (ПЦР-РВ). Данный метод исключает стадию постановки электрофореза для учета результатов реакции и, как следствие, сокращается время проведения исследования. Кроме того, ПЦР-РВ позволяет осуществлять не только качественный, но и количественный анализ содержания НК в вируссодержащих образцах.
Поэтому целью данного изобретения является разработка способа выявления геномной РНК ВБИ с помощью ПЦР с детекцией продуктов амплификации в режиме реального времени. В основе предложенного варианта ПЦР лежит специфичное связывание сконструированных пары праймеров и зонда с участком 10 сегмента генома ВБИ, кодирующим неструктурные белки NS3 и NS3a.
Поставленная цель достигается способом для обнаружения РНК ВБИ в образцах крови, пробах органов от инфицированных животных и вируссодержащем материале, полученном при выделении вируса в различных чувствительных системах (культуры клеток (КК), куриные эмбрионы (КЭ), мыши). При этом вначале проводят выделение НК из исследуемого материала, затем - синтез комплементарной ДНК (кДНК) на матрице выделенной вирусной РНК, а далее - амплификацию специфичного фрагмента генома ВБИ.
Для выделения НК из исследуемого материала используют метод нуклеосорбции, заключающийся в разрушении клеточных и вирусных мембран и последующем связывании НК с поверхностью сорбента.
Реакцию обратной транскрипции осуществляют в 2 этапа: 1) денатурация цепей РНК (10 мин при 88°С); 2) синтез кДНК на матрице РНК ВБИ (30 мин при 42°С). Для синтеза специфичной кДНК используют пару праймеров IbarF и IbarR.
Полученная кДНК необходима в качестве матрицы при проведении предложенного варианта ПЦР-РВ. Для обеспечения амплификации специфичного фрагмента генома ВБИ к ПЦР-смеси помимо матрицы добавляют олигонуклеотидные праймеры (IbarF и IbarR), фланкирующие данный участок, и флуоресцентный зонд IbarZ.
Нуклеотидный состав указанных праймеров и зонда приведен ниже:
IbarF 5′-GATCAAACCATTTTGCGCTT-3′
IbarR 5′-CTCATCCTCACCGCCTCATTG-3′
IbarZ 5′-[НЕХ] TCTTGTATGGTCAATCCGCTGGCT [ВН2]-3′.
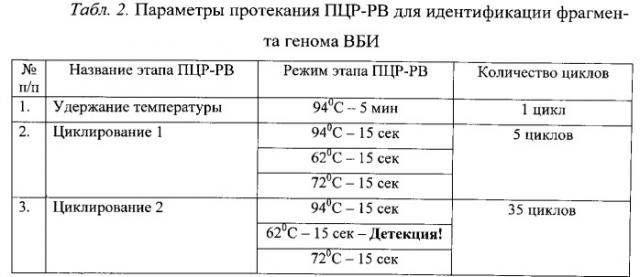
ПЦР-РВ проводят при следующем температурном режиме: 1) 5 мин предварительной денатурации кДНК при 94°С; 2) 5 циклов реакции (денатурация при 94°С - 15 сек, отжиг праймеров при 62°С - 15 сек, элонгация при 72°С - 15 сек); 3) 35 циклов реакции с детекцией на стадии отжига праймеров (денатурация при 94°С - 15 сек, отжиг праймеров при 62°С - 15 сек, элонгация при 72°С - 20 сек). Учет результатов реакции проводят, анализируя кривые накопления флуоресцентного сигнала для каждой пробы с помощью программного обеспечения прибора.
Техническим результатом изобретения является повышение степени специфичности и чувствительности, а также сокращение времени проведения диагностической работы по обнаружению вируса в исследуемых пробах.
Сущность изобретения состоит в том, что при помощи указанных видоспецифичных олигонуклеотидов (IbarF, IbarR, IbarZ) проводят ПЦР-РВ, позволяющую выявить фрагмент генома ВБИ. При наличии в исследуемых образцах РНК вируса болезни Ибараки в ходе ПЦР-РВ синтезируется фрагмент ДНК размером 159 п.н.
Существенным отличием данных праймеров и зонда является то, что они:
1) комплементарны умеренно консервативной области гена, кодирующего неструктурные белки NS3 и NS3a ВБИ, и не комплементарны каким-либо участкам геномов других вирусов;
2) присутствие флуоресцентного зонда увеличивает специфичность реакции и позволяет проводить предварительную идентификацию РНК искомого вируса уже в процессе реакции.
Изобретение иллюстрируется несколькими примерами.
Пример 1. Расчет первичной структуры олигонуклеотидных праймеров и зонда.
С помощью программы «BioEdit 7.0» выравнены доступные в базе данных GenBank нуклеотидные последовательности 10 сегмента генома вируса болезни Ибараки (код доступа GI 118918006) и вируса эпизоотической геморрагической болезни оленей, штамм Alberta (код доступа GI 260590287), являющихся близкородственными вирусами, относящимися ко 2 серогруппе ВЭГБО. В результате анализа указанных последовательностей внутри данного сегмента генома вируса болезни Ибараки выбран участок между 485 и 643 нуклеотидами, отличающийся уникальным нуклеотидным составом. С помощью программы «Oligo 6.0» рассчитаны первичные структуры олигонуклеотидных праймеров, фланкирующих указанный участок генома в нуклеотидных позициях 485-504 (IbarF) и 623-643 (IbarR). Для детекции продуктов амплификации подобран олигонуклеотидный флуоресцентномеченый зонд IbarZ, комплементарный участку, находящемуся внутри нуклеотидной последовательности амплифицируемого фрагмента (нуклеотидные позиции: 573-596).
Основная характеристика рассчитанных олигонуклеотидов представлена в таблице 1.
Пример 2. Экстракция РНК вируса болезни Ибараки из проб крови, органов и вируссодержащего материала, полученного при выделении данного вируса в различных чувствительных системах (КК, КЭ, мыши).
В необходимое количество пробирок объемом 1,5 миллилитра (мл) на N-ное число образцов (включая отрицательный контроль выделения - ОКВ) вносят по 500 микролитров (мкл) лизирующего раствора №1, содержащего гуанидин тиоцианат. Затем в них добавляют по 100 мкл исследуемого материала (кровь, суспензия вируса, 10%-ная суспензия органов), тщательно перемешивают содержимое пробирок и инкубируют при 56°С в течение 5 мин. Далее проводят центрифугирование проб в течение 15 сек при 12000 об/мин для осаждения капель со стенок пробирок, и добавляют к образцам 30-35 мкл предварительно ресуспендированного сорбента «силика». Пробы инкубируют в течение 7-10 мин при комнатной температуре, периодически перемешивая через каждые 2-3 мин. После этого сорбент осаждают центрифугированием при 10000-12000 об/мин в течение 15 сек и удаляют надосадочную жидкость. К осадку добавляют 300 мкл отмывочного раствора №2, ресуспендируют сорбент и центрифугируют пробы в течение 15 сек при 10000-12000 об/мин с последующим удалением надосадка. Затем сорбент ресуспендируют в 300 мкл отмывочного раствора №3, проводят центрифугирование пробирок с целью осаждения сорбента и удаляют надосадочную жидкость. Осадок сорбента подсушивают при 56°С в течение 4-5 мин, после чего добавляют в пробирки по 50 мкл буфера для элюции (деионизированная вода), перемешивают и инкубируют при 56°С в течение 7-10 мин. После центрифугирования в течение 30 сек при 13400 об/мин пробы готовы к постановке реакции обратной транскрипции.
Пример 3. Синтез кДНК вируса болезни Ибараки на матрице выделенной РНК.
Для получения кДНК отбирают и маркируют необходимое количество пробирок объемом 0,6 мл, соответствующее числу исследуемых образцов (N), включая отрицательный контроль обратной транскрипции (ОКТ) и отрицательный контроль выделения. В каждую пробирку вносят по 7 мкл предварительно перемешанного и осажденного на вортексе буфера для ОТ №1, содержащего по 1 мкл 10 пМ праймеров (IbarF и IbarR) и 5 мкл деионизированной воды. На поверхность реакционной смеси наслаивают по капле (30-40 мкл) минерального масла. При необходимости сбрасывают капли масла со стенок пробирок кратковременным (3-5 сек) центрифугированием. В пробирки под масло вносят по 9 мкл РНК-пробы. Пробирки помещают в термоциклер и продолжают предварительно активизированную программу №1 (денатурация РНК): 1) 88°С - пауза; 2) 88°С - 10 мин, 1 цикл. По окончании программы №1 пробирки переносят в охлажденный до температуры минус 70°С хладагент.
За 5 мин до окончания денатурации РНК в отдельной пробирке готовят общую реакционную смесь для ОТ на необходимое количество образцов, состоящую из 9,3 мкл буфера для ОТ №2 (4 мкл буфера для обратной транскрипции, 0,3 мкл 25 мМ дезоксирибонуклеозидтрифосфатов, 5 мкл деионизированной воды) и 0,2 мкл MMLV-ревертазы. Смесь перемешивают, избегая образования пены, и вносят по 9,5 мкл в пробирки, находящиеся в хладагенте. Пробы помещают в термоциклер и продолжают предварительно активизированную программу №2 (обратная транскрипция): 42°С - пауза; 2) 42°С - 30 мин, 1 цикл. После инкубации реакционную смесь, содержащуюся в пробирках, используют при постановке ПЦР-РВ как препарат кДНК.
Пример 4. Амплификация специфичного участка кДНК ВБИ в процессе ПЦР-РВ.
Для проведения ПЦР-РВ в отдельной пробирке готовят реакционную смесь на необходимое количество образцов (N), в число которых входит отрицательный контроль выделения (ОКВ), отрицательный контроль обратной транскрипции (ОКТ), отрицательный контроль ПЦР (ОК) и положительный контроль ПЦР (ПК). Объем смеси для одной пробы составляет 16 мкл, содержащих: 5 мкл буфера для Taq-полимеразы 5-кратной концентрации, 0,5 мкл 25 мМ MgCl2, 8 мкл воды (составляют буфер №1), 0,2 мкл 25 мМ дезоксирибонуклеозидтрифосфатов, по 10 пМ каждого праймера, 3 пМ флуоресцентного зонда (составляют буфер №2) и 0,2 мкл Taq-полимеразы (20 ед/мкл). Приготовленную смесь перемешивают, избегая образования пены, и раскапывают по 16 мкл в предварительно промаркированные пробирки вместимостью 0,2 мл. Затем в каждую пробирку на поверхность смеси наслаивают по 1 капле (15 мкл) предварительно расплавленного воска, служащего барьером между компонентами смеси и матрицей, что предотвращает неспецифичный отжиг праймеров при комнатной температуре до начала ПЦР-РВ.
В подготовленные для ПЦР пробирки со смесью вносят по 9 мкл синтезированной кДНК.
Пробирки помещают в амплификатор «Rotor-Gene 6000» (Corbett Research, Австралия) с программой протекания реакции, приведенной в табл.2.
Флуоресценцию измеряют при 62°С на канале Yellow.
Пример 5. Учет и интерпретация результатов амплификации.
В основе учета результатов реакции лежит анализ кривых накопления флуоресцентного сигнала для каждой пробы с помощью программного обеспечения «Rotor-Gene 6000», версия программного обеспечения 1.8.17.5.
Результаты интерпретируют на основании наличия/отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией (threshold line), что соответствует наличию/отсутствию значения порогового цикла «Ct» в соответствующей графе таблицы результатов.
Результат считается достоверным только в случае прохождения положительного контроля амплификации (ПК) и отсутствия пересечения пороговой линии кривыми флуоресценции для отрицательного контроля амплификации (ОК) и отрицательного контроля выделения РНК (ОКВ).
Образец считают положительным на наличие РНК вируса болезни Ибараки, если значение Ct на канале Yellow составляет менее 33.
Образец считают отрицательным, если по каналу Yellow значение Ct для него отсутствует.
Результаты не подлежат учету, если:
- отсутствует положительный сигнал в пробе с положительным контролем ПЦР. Это может свидетельствовать о неправильно выбранной программе амплификации и о других ошибках, допущенных на этапе постановки ПЦР. В таком случае необходимо провести ПЦР еще раз.
- значение Ct по каналу Yellow превышает 33. В данном случае требуется повторить ПЦР и считать образец положительным в случае повторения результата.
- появляется любое значение Ct в таблице результатов для отрицательного контроля выделения и для отрицательного контроля ПЦР на канале Yellow. Это свидетельствует о наличии контаминации реактивов или образцов. Поэтому результаты анализа по всем пробам считаются недействительными. Требуется повторить анализ всех проб, а также предпринять меры по выявлению и ликвидации источника контаминации.
Пример 6. Определение чувствительности и специфичности ПЦР-РВ на основе синтетических олигонуклеотидных праймеров и зонда, комплементарных участку 10 сегмента генома ВБИ.
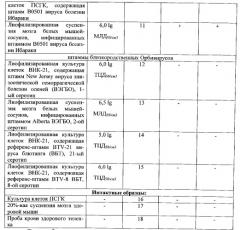
Специфичность метода определили, используя пробы, содержащие РНК вируса болезни Ибараки, близкородственных Орбивирусов (вирус блютанга и вирус эпизоотической геморрагической болезни оленей), а также интактные образцы.
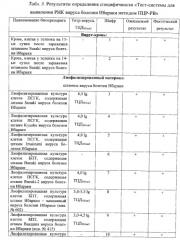
Результаты оценки специфичности ПЦР-РВ с праймерами, комплементарными гену, кодирующему белки NS3/3a вируса болезни Ибараки, представлены в таблице 3.
Таким образом, положительный результат зарегистрировали только в пробах, содержащих РНК ВБИ, что является подтверждением специфичности разработанного метода.
Чувствительность метода определили, используя панель 10-кратных разведений культурального материала, содержащего штамм Susaki ВБИ с титром инфекционной активности 6,5 lg ТЦД50/см3. В результате РНК вируса болезни Ибараки обнаружили в разведении 1:100000, что соответствует 1,5 lg ТЦД50/см3 (таблица 4).
Так как численным выражением концентрации вируса могут являться не только единицы инфекционной дозы, но и количество копий гена-мишени, то для определения чувствительности предложенного метода также использовали количественную ПЦР-РВ на матрице последовательных десятикратных разведений сконструированной рекомбинантной плазмиды.
В результате проведенной ПЦР-РВ установили, что предельным разведением, позволяющим обнаруживать рекомбинантный вектор, являлось 10-ое разведение материала с содержанием плазмиды 4,7214 молекулы/мкл (или 4721,4 молекулы/мл). Учитывая, что в реакцию брали 5 мкл плазмиды, с помощью предложенного метода можно выявлять 24 копии ДНК на реакцию. Это соответствует 24×103 копиям ДНК в 1 мл.
Источники информации
1. Вирусные болезни животных / Сюрин, В.Н., Самуйленко, А.Я., Соловьев, Б.В., Фомина, Н.В. - М.: ВНИТИБП, 1998. - С.41-43.
2. Получение моноклональных антител и их использование для выявления антител, специфичных к вирусу болезни Ибараки / Новикова, М.Б., Малоголовкин, С.А., Черных, А.А., Вишняков, И.Ф. // Институт эксперим. клин. вет. мед. Информ. бюл. - Харьков, 1995. - С.56.
3. An outbreak of Ibaraki disease in Kagoshima Prefecture in 1997 and properties of the virus isolated from bovine aborted and stillborn fetuses / Watanabe, Y., Makiuchi, H., Imafuji, Т., Yamasaki, K., Onitsuka, Т., Ohashi, S. // J. of the Japan Vet. Med. Ass. - 2000. - vol.53, №5. - P.302-306.
4. An outbreak of Ibaraki disease in Korea / Bak, U.B., Cheong, C.K., Choi, H.I., Lee, C.W., Oh, H.S., Rhee, Y.O., Cho, M.R., Lim, Y.I. // Korean J. Vet. Res. - 1983. - vol.23, №1. - P.81-89.
5. A survey of antibodies to arthropod-borne viruses in Indonezian cattie / Muira, Y., Inaba, Y., Tsuda, Т., Tokuhisa, S., Sato, K., Akashi, H., Matsumoto, M. // J. Vet. Med. Sci. - 1982. - vol.44. - P.857-863.
6. Australian-Indonesian collaboration in veterinary arbovirology a rewiew / Daniels, P.W., Sendow, I., Soleha, E., Sukarsih, N.T. Hunt, Bahri, S. // Vet. Microbiol. - 1995. - vol.46, №1-3. - P.151-174.
7. Differences in Ibaraki virus RNA segment 3 sequences from three epidemics / Uchinuno, Y., Ito, Т., Goto, Y., Miura, Y., Ishibashi, K., Itou, Т., Sakai, T. //J. Vet. Med. Sci. - 2003. - vol.65. - P.1257-1263.
8. Doyle, K.A. An overview and perspective on orbivirus disease prevalence and occurrence of vector in Australia and Oceania / Doyle, K.A. // Blue-tongue, African horse sickness and related orbiviruses / Walton, T.L., Osburn, B.I. - CRC Press, Inc., Boca Raton, Fla, 1992. - P.44-57.
9. Etiological and epidemiological studies on Ibaraki disease in Taiwan / Liao, Y., Lu, Y., Huang, S., Lee, S. // J. of the Chinese of Vet. Sci. - 1996. - vol.22, №1-3. - P.183-191.
10. Ibaraki virus, an agent of epizootic disease of cattle resembling bluetongue. I. Epidemiologic, clinical and pathologic observations and experimental transmission to calves / Omori, Т., Inaba, Y., Morimoto, Т., Tanaka, Y., Ishitani, R., Kurogi, H., Munakata, K., Matsuda, K., Matumoto M. // Japan J. Microbiol. - 1969. - vol.13. - P.139-157.
11. Identification and PCR-restriction fragment length polymorphism analysis of a variant of the Ibaraki virus from naturally infected cattle and aborted fetuses in Japan / Ohashi, S., Yoshida, K., Watanabe, Y., Tsuda, T. // J. Clin. Microbiol. - 1999. - vol.37, №12. - P.3800-3803.
12. Isolation and identification of Ibaraki virus in the 1991 epidemics of acute febrile disease of cattle in Korea / Park, B.K., Chang, C.H., Chung, C.W., Rhee, J.C., Son, D.S., Lee, K.W. // RDA. J. Agri. Sci. - 1994. - vol.36, №1. - P.558-561.
13. Kitano, Y. Ibaraki disease in cattle / Kitano, Y. // Infectious Disease of livestock / Coetzer, J.A.W., Tustin, R.C. - Oxford: Oxford University Press, 2004. - P.1221-1226.
14. Lu, Y. Aetiological and epidemiological studies on Ibaraki disease in Taiwan / Lu, Y., Li, Y., Liou, P. // Proceedings of the First Southeast Asia and Pacific Regional Bluetongue Symposium. - Cnina, 1996. - P.91.
15. Monitoring of five bovine arboviral diseases transmitted by arthropod vectors in Korea / Shin, Y.-K., Oem, J.-K., Yoon, S., Hyun, B.-H., Cho, I.-S., Yoon, S.-S., Song, J.-Y. // J. of Bacteriology and Virology. - 2009. - vol.39, №4. - P.353-362.
16. Suzuki, Y. Double-stranded RNA of Ibaraki virus / Suzuki, Y., Nakagawa, S., Saito, Y. // Virology. - 1977. - vol.76. - P.670-674.
17. Occurrences of Ibaraki disease in two successive years: possibly caused by virus overwintering / Uchinuno, Y., Ishibashi, K., Yokoyama, A., Ka-wanabe, M., Takagi, E. // J. of the Japan Vet. Med. Ass. - 2000. - vol.53, №6. - P.372-376.
18. RNA and protein of Ibaraki virus / Suzuki, Y., Nakagawa, S., Saito, Y., Namiki, M. // Kitasato Arch. Exp. Med. - 1978. - vol.51. - P.61-71.
1. Пара праймеров, используемых для выявления фрагмента генома вируса болезни Ибараки и имеющих следующий нуклеотидный состав:IbarF 5'-GATCAAACCATTTTGCGCTT-3'IbarR 5'-CTCATCCTCACCGCCTCATTG-3'.
2. Зонд, используемый для выявления фрагмента генома вируса болезни Ибараки, имеющий следующий состав:IbarZ 5'-[HEX]TCTTGTATGGTCAATCCGCTGGCT[ВН2]-3'.
3. Способ выявления РНК вируса болезни Ибараки, включающий выделение РНК из биологического материала, постановку реакции обратной транскрипции для синтеза кДНК, постановку полимеразной цепной реакции в режиме реального времени с использованием пары праймеров по п.1 и зонда по п.2, амплификацию РНК вируса, оценку проведения реакции, где денатурацию цепей РНК проводят с указанной парой праймеров в течение 10 мин при 88°С, синтез кДНК проводят на матрице РНК ВБИ в течение 30 мин при 42°С, о наличии/отсутствии РНК ВБИ судят по кривым флуоресценции, при этом результат реакции считается положительным, если кривая флуоресценции для анализируемой пробы пересекает пороговую линию.