Композиции рекомбинантных антител против рецептора эпидермального фактора роста
Иллюстрации
Показать всеИзобретение относится к биохимии и представляет собой композицию антител для применения в способе лечения злокачественного новообразования у субъекта, который проходил предшествующий курс лечения с применением антитела против EGFR человека, или злокачественного новообразования, являющегося устойчивым или частично устойчивым к лечению по меньшей мере одним другим антителом против EGFR человека, выбранным из группы, состоящей из цетуксимаба, панитумумаба, залутумумаба, нимотузумаба, ICR62, mAb806, матузумаба и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител, при этом указанная композиция антител содержит по меньшей мере первую молекулу антитела против EGFR человека и вторую молекулу антитела против EGFR человека и ее использование. Изобретение позволяет осуществить эффективную терапию второй линии рака, не реагирующего на предшествующее лечение. 14 н. и 43 з.п. ф-лы, 47 ил., 19 табл., 25 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области рекомбинантных антител для применения в противораковой терапии человека.
Уровень техники
Рецептор эпидермального фактора роста (EGFR) играет важную роль в клеточной пролиферации, а также в апоптозе, ангиогенезе и распространении метастазов, процессах, которые являются критическими для развития опухоли (Salomon et al, Crit. Rev. Oncology/Haematology, 19:183-232 (1995); Wu et al, J. Clin. Invest., 95:1897-1905 (1995); Karnes et al, Gastroenterology, 114:930-939 (1998); Woodburn et al, Pharmacol. Therap. 82: 241-250 (1999); Price et al, Eur. J. Cancer, 32A:1977-1982 (1996)). Действительно, исследования показали, что EGFR-опосредованный клеточный рост увеличивается в ряде солидных опухолей, включая немелкоклеточный рак легкого, рак простаты, рак груди и опухоли головы и шеи (Salomon DS et al, Critical Reviews in Oncology/Haematology, 19:183-232 (1995)). Кроме того, в настоящий момент известно, что повышенная активация EGFR на поверхности раковой клетки связана с прогрессированием заболевания, развитием метастатического фенотипа и неблагоприятным прогнозом для раковых пациентов (Salomon DS et al., Critical Reviews in Oncology/Haematology 19:183-232 (1995)).
Кроме того, экспрессия EGFR часто сопровождается продуцированием EGFR-лигандов, среди прочего, TGF-альфа и EGF, экспрессирующими EGFR клетками опухоли, что предполагает участие аутокринной петли в развитии данных клеток (Baselga, et al.(1994) Pharmac. Therapeut. 64: 127-154; Modjtahedi, et al. (1994) Int. J. Oncology. 4: 277-296). Блокирование взаимодействия между такими EGFR-лигандами и EGFR, следовательно, может подавить рост и выживаемость опухоли (Baselga, et al. (1994) Pharmac. Therapeut. 64: 127-154).
EGFR представляет собой мембраносвязанный гликопротеин с молекулярным весом около 170 кДа. EGFR состоит из гликозилированного внешнего лиганд-связывающего домена (621 остаток) и цитоплазматического домена (542 остатка), соединенных коротким 23-аминокислотным трансмембранным линкером. Внеклеточная часть EGFR содержит 25 дисульфидных связей и 12 N-связанных сайтов гликозилирования, и обычно считается, что она состоит из четырех субдоменов. Полученные посредством рентгеноструктурного анализа структуры кристаллов EGFR предполагают, что рецептор принимает как конформацию, связанную с аутоингибированием, которая не может связывать EGF (Ferguson et al, Mol Cell, 2003, vol 11: 507-517), так и активную конформацию, которая может опосредовать связывание лиганда EGF и димеризацию рецептора (Garret et al, Cell 2002, vol 1 10:763-773; Ogiso et al, Cell, 2002, vol 1 10:775-787). В частности, предполагалось, что домен I и домен III обеспечивают аддитивный вклад в формирование сайта высокоаффинного связывания лиганда. Домены II и IV представляют собой богатые цистеином ламинин-подобные области, которые стабилизируют укладку белка и содержат возможную границу димеризации EGFR.
Известно, что EGFR существует в различных конформациях на поверхности клетки, при этом связанная или закрытая конформация встречается наиболее часто. Связанная конформация не может димеризоваться, и, следовательно, является неактивной. Известно, что терапевтическое антитело эрбитукс стабилизирует связанную конформацию путем связывания с доменом III и создания стерических помех рецептору в достижении несвязанного состояния. Однако некоторые рецепторы могут все еще быть способными к принятию несвязанной конформации, связыванию лиганда и димеризации. Моноклональное антитело (mAb) обычно будет эффективным только в связывании с одной из конформаций, и, следовательно, не может быть нацелено на раковые клетки, демонстрирующие другие конформации или раковые клетки, демонстрирующие множество конформаций.
Моноклональные антитела (mAb), нацеленные на лиганд-связывающий домен EGFR, могут блокировать взаимодействие с лигандами EGFR и, одновременно, результирующий внутриклеточный сигнальный путь.
Эрбитукс™ (цетуксимаб) представляет собой рекомбинантное химерное моноклональное антитело человека/мыши, которое специфично связывается с внеклеточным доменом человеческого EGFR. Эрбитукс состоит из Fv-областей мышиного антитела против EGFR с константными областями тяжелой и каппа-легкой цепи человеческого IgG1 и имеет молекулярный вес, приблизительно составляющий 152 кДа. Эрбитукс продуцируется в культуре клеток млекопитающего (мышиной миеломе). Эрбитукс одобрен для лечения пациентов с метастатическим колоректальным раком, опухоли которого экспрессируют EGFR. Кроме того, эрбитукс применяется в комбинации с радиационной терапией для лечения пациентов с плоскоклеточным раком головы и шеи, который не может быть удален хирургическим путем, или в качестве терапии второй линии для плоскоклеточного рака головы и шеи, для которого стандартная, основанная на платине терапия была неудачной.
Вектибикс™ (панитумумаб) представляет собой рекомбинантное человеческое каппа-моноклональное антитело IgG2, которое специфически связывается с человеческим EGFR. Вектибикс имеет молекулярный вес, приблизительно составляющий 147 кДа. Панитумумаб продуцируется в полученных методами генетической инженерии клетках млекопитающих (яичник китайского хомячка). Вектибикс одобрен для лечения пациентов с метастатическим колоректальным раком, опухоли которого экспрессируют EGFR, при прогрессировании заболевания во время или после курсов лечения химиотерапией, включающих применение фторпиримидина, оксалиплатина и иринотекана.
Цетуксимаб, продаваемый фирмой Imclone под торговым наименованием эрбитукс, описан в патенте США 4943533 и WO 96/40210. Панитумумаб, продаваемый фирмой Abgenix под торговым наименованием вектибикс, описан в патенте США 6235883. Залутузумаб (Humax-EGFR) представляет собой еще одно антитело против EGFR, в настоящее время проходящее клиническую разработку. Антитело было разработано Genmab и описано в WO 02/100348 и WO 2004/056847. Цетуксимаб, панитумумаб и залутумумаб связывают один и тот же эпитоп на EGFR.
Нимотузумаб (TheraCIM hR3), описанный в патентах США 5891996 и 6506883, одобрен для лечения рака в ряде стран мира, но не в Европе и США.
Другие моноклональные антитела против EGFR, которые находятся или находились на стадии клинической разработки, включают:
- ICR62, разработанное Институтом исследования рака. Антитело описано в WO 95/20045.
- mAb806, представляющее собой моноклональное антитело, направленное против мутантной формы EGFR (EGFR vIII). Антитело разработано Институтом исследований рака Людвига и описано в WO 02/092771.
- Матузумаб (EMD72000), разрабатываемый Merck-Serono, описан в WO 02/66058. Мышиный предшественник, mAb425, описан в WO 92/15683.
В технике известно, что продолжительное воздействие моноклонального антитела может привести к селекции устойчивых опухолей. Такая ситуация может иметь место у пациентов, получающих длительное лечение моноклональным антителом. При широкомасштабном использовании эрбитукса (от Imclone) и вектибикса (от Abgenix), двух моноклональных антител, связывающих один и тот же эпитоп, существует вероятность, что врачи-клиницисты будут встречаться с опухолями, устойчивыми к данным антителам. Другие моноклональные антитела проходят клинические испытания и могут выйти на рынок в ближайшие годы, среди них Humax-Egfr (залутумумаб от Genmab), который связывает тот же эпитоп, что и эрбитукс и вектибикс. Можно предположить, что опухоль, устойчивая к любому из этих трех моноклональных антител, также будет устойчивой и к двум другим.
Аналогично, могут иметься клинические примеры опухолей, устойчивых к любому другому моноклональному антителу против EGFR, находящемуся в настоящий момент в процессе клинических испытаний: нимотузумабу (YM Biosciences, Куба), матузумабу (Merck KGaA), mAb806 (институт Людвига) и ICR62 (Институт исследования рака).
Полная или частичная устойчивость опухоли к любому из этих моноклональных антител может быть проанализирована с использованием образца, выделенного у пациента, в результате чего будет заранее известно, является ли опухоль устойчивой или нет.
Помимо устойчивости к терапии моноклональным антителом (или рефракторных опухолей), другая проблема при лечении форм рака с экспрессией EGFR заключается в повторном появлении или прогрессировании опухоли после хирургического вмешательства, радиационной терапии и/или медицинского лечения с химиотерапевтическими средствами, ингибиторами тирозинкиназ (TKI) и/или моноклональными антителами. Существует предположение, что повторно появившаяся или прогрессирующая опухоль должна лечиться другим медикаментом, поскольку повторное появление или прогрессирование может быть следствием устойчивости или, по меньшей мере, частичной устойчивости. Таким образом, существует потребность в терапии второй или третьей линии для рака, не реагирующего на предшествующее лечение антителами против EGFR или прогрессирующего после вышеупомянутого предшествующего лечения антителами против EGFR.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения обнаружили, что линия раковых клеток, устойчивая к эрбитуксу (цетуксимабу) может эффективно обрабатываться in vitro композицией антител по настоящему изобретению, при этом воздействие вектибикса (панитумумаба) на устойчивую клеточную линию является таким же неэффективным, как и обработка эрбитуксом. Ожидается, что залутумумаб также будет неэффективным против данной клеточной линии. Данные результаты привели к заключению, что композиция антител по настоящему изобретению является эффективной против опухолей, устойчивых к эрбитуксу, вектибиксу и залутумумабу. Таким образом, композиция антител по настоящему изобретению может применяться для лечения пациентов, не имеющих ответа на любой из этих продуктов. Аналогично, композиция антител по настоящему изобретению может применяться для лечения опухолей, которые с самого начала являются устойчивыми к любому из этих моноклональных антител. Устойчивость к моноклональному антителу, такому как эрбитукс, может быть проанализирована in vitro с использованием методов, описанных в примере 21. При этом если линия раковых клеток пролиферирует в среде, содержащей 10 мкг/мл эрбитукса, то она считается частично устойчивой к эрбитуксу. Устойчивость к панитумумабу и залутумумабу может быть проанализирована аналогично.
На основании данных наблюдений авторы также предполагают применение композиции антител по настоящему изобретению для лечения рака, устойчивого или частично устойчивого к любому из других антител против EGFR, которые в настоящий момент находятся в разработке, включая, но не ограничиваясь перечисленным, цетуксимаб, панитумумаб, залутумумаб, нимотузумаб, ICR62, mAb806, матузумаб и антитела, способные связывать тот же эпитоп, что и любое из перечисленных антител.
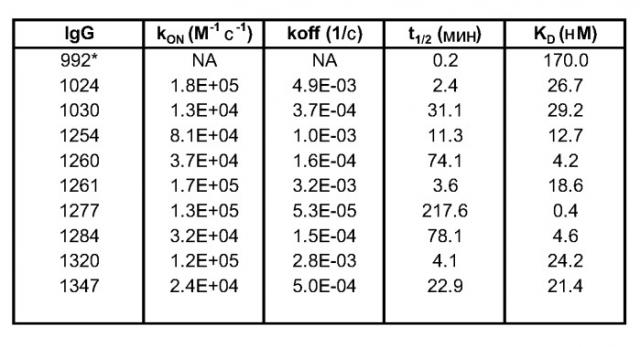
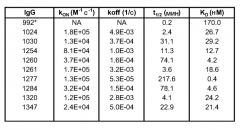
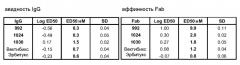
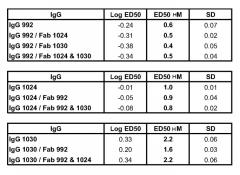
Результаты были подтверждены исследованием in vivo (Пример 23), в котором агрессивная линия раковых клеток была имплантирована мышам. После первоначального лечения эрбитуксом были отобраны мыши, имеющие частичный ответ, и были подвергнуты продолжительному лечению эрбитуксом или лечению композицией антител по настоящему изобретению. В последнем случае наблюдалось быстрое сокращение размера опухолей, тогда как продолжение лечения эрбитуксом приводило к поддержанию размера опухоли. Предклиническая эффективность достигалась даже несмотря на наличие частичного перекрытия в связывании между эрбитуксом и антителами 1024 и 992 по настоящему изобретению. Таким образом, сразу после переключения с терапии эрбитуксом на терапию 1024/992, в опухолях будет содержаться остаточный эрбитукс, и будет иметь место конкуренция за связывание между эрбитуксом и двумя антителами из композиции по настоящему изобретению, что потенциально может снизить эффективность композиции антител по настоящему изобретению. Однако это не оказало значительного влияния на эффективность терапии 1024/992.
Исследование in vivo также подтвердило (пример 25), что устойчивые к эрбитуксу клетки могут эффективно обрабатываться комбинацией антител по настоящему изобретению. Таким образом, приобретенный механизм устойчивости к эрбитуксу не влияет на эффективность композиции антител по настоящему изобретению.
В заключение, композиция антител изобретения может применяться для лечения рака, являющегося устойчивым или частично устойчивым к моноклональному антителу против EGFR, такому как эрбитукс, и для лечения рака у субъекта, который получил терапию моноклональным антителом против EGFR, таким как эрбитукс, в предшествующем курсе лечения.
На основании идентичности связывания эрбитукса, вектибикса и залутумумаба ожидается, что для этих трех mAb могут быть достигнуты аналогичные результаты. На основании данных наблюдений изобретатели также предполагают применение композиции антител по настоящему изобретению для лечения рака, который ранее подвергался лечению другим моноклональным антителом против EGFR, включая, но не ограничиваясь перечисленным, цетуксимаб, панитумумаб, залутумумаб, нимотузумаб, ICR62, mAb806, матузумаб и антитела, способные связывать тот же эпитоп, что и любое из перечисленных антител. Эффективность такого лечения может быть проверена в предклиническом исследовании, аналогичном исследованию, описанному в примере 23.
Кроме того, изобретатели настоящего изобретения определили, что рецидив роста опухоли после лечения композицией антител по настоящему изобретению может быть успешно устранен с использованием композиции антител по настоящему изобретению. Это было продемонстрировано в предклиническом исследовании, описанном в примере 22. Рецидивирующие опухоли были ликвидированы так же эффективно, как и исходно имплантированные опухоли, что указывает на то, что эти опухоли не были устойчивыми к лечению композицией антител изобретения.
Таким образом, в первом аспекте изобретение относится к композиции антител для применения в способе лечения рака у субъекта, который проходил предшествующий курс лечения с использованием антитела против человеческого EGFR, где указанная композиция антител содержит по меньшей мере 2 отдельных молекулы антител против человеческого EGFR,
a. при этом первая отдельная молекула антитела против EGFR выбрана из группы, состоящей из антитела 992, антитела, содержащего последовательности VL (аминокислоты 3-109 из SEQ ID (последовательности под идентификатором) No: 72) и VH (аминокислоты 3-124 из SEQ ID No: 40) антитела 992, антитела, имеющего CDR3 антитела 992 (SEQ ID No: 116 и 111), антитела, связывающего тот же эпитоп, что и антитело 992, и антитела, способного ингибировать связывание антитела 992 с человеческим EGFR; и
b. при этом вторая отдельная молекула антитела против EGFR выбрана из группы, состоящей из антитела 1024, антитела, содержащего последовательности VL (аминокислоты 3-114 из SEQ ID No: 73) и VH (аминокислоты 3-120 из SEQ ID No: 41) антитела 1024, антитела, имеющего CDR3 антитела 1024 (SEQ ID No: 120 и 114), антитела, связывающего тот же эпитоп, что и антитело 1024, и антитела, способного ингибировать связывание антитела 1024 с человеческим EGFR.
В одном из вариантов осуществления вышеупомянутый предшествующий курс лечения включает применение композиции антител, идентичных вышеупомянутой композиции антител.
В другом варианте осуществления вышеупомянутый предшествующий курс лечения включает применение антитела против человеческого EGFR, выбранного из группы, состоящей из цетуксимаба, панитумумаба, залутумумаба, нимотузумаба, ICR62, mAb806, матузумаба и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител. Предпочтительно, вышеупомянутое антитело против человеческого EGFR выбирают из группы, состоящей из цетуксимаба, панитумумаба и залутумумаба и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител. Более предпочтительно, вышеупомянутое антитело против человеческого EGFR выбирают из группы, состоящей из цетуксимаба и панитумумаба и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител. Более предпочтительно, вышеупомянутое антитело против человеческого EGFR представляет собой цетуксимаб или антитело, способное связывать тот же эпитоп, что и цетуксимаб.
Рак может быть выбран из группы, состоящей из рака головы и шеи, рака толстой кишки, рака груди, рака почки, рака легких, рака яичников, рака простаты, глиомы, рака поджелудочной железы, рака мочевого пузыря, немелкоклеточной карциномы легких (NSCLC), рака желудка, рака шейки матки, гепатоцеллюлярного рака, желудочно-пищеводного рака, колоректального рака, рака прямой кишки, эпителиоидной карциномы, RCC, плоскоклеточной карциномы головы и шеи (SCCHN), рака пищевода, мультиформной глиобластомы, плоскоклеточной карциномы и рака почек, меланомы, карциномы и саркомы, в соответствии с описанным в настоящем документе.
Лечение антителом может являться вспомогательной терапией, следующей за хирургическим вмешательством и/или радиационной терапией.
Лечение может представлять собой комбинационную терапию, включающую лечение химиотерапией и/или по меньшей мере одним ингибитором тирозинкиназы и/или по меньшей мере одним ингибитором ангиогенеза и/или по меньшей мере одним гормоном и/или по меньшей мере одним индуцирующим дифференциацию агентом.
Предшествующий курс лечения может представлять собой терапию первой линии, терапию второй линии или терапию третьей линии.
Терапия первой линии может дополнительно включать курс лечения химиотерапией и/или по меньшей мере одним ингибитором тирозинкиназы и/или по меньшей мере одним ингибитором ангиогенеза и/или по меньшей мере одним гормоном и/или по меньшей мере одним индуцирующим дифференциацию агентом.
Химиотерапия, предпочтительно, включает введение химиотерапевтического препарата, выбранного из группы, состоящей из адриамицина, цисплатина, таксола, доксорубицина, топотекана, фторпиримидина, оксалиплатина и иринотекана.
В некоторых вариантах осуществления изобретения субъект прогрессировал во время или после предшествующего курса лечения. В других вариантах осуществления объект прогрессировал после вышеупомянутого предшествующего курса лечения.
Рак может быть устойчивым или частично устойчивым к предшествующему курсу лечения.
В еще одном аспекте изобретение относится к композиции антител для применения в способе лечения рака, при этом вышеупомянутый рак является устойчивым или частично устойчивым к лечению по меньшей мере одним другим антителом против EGFR, выбранным из группы, состоящей из цетуксимаба, панитумумаба, залутумумаба, нимотузумаба, ICR62, mAb806, матузумаба, и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител; где указанная композиция антител содержит по меньшей мере 2 отдельных молекулы антител против человеческого EGFR,
a. при этом первая отдельная молекула антитела против EGFR выбрана из группы, состоящей из антитела 992, антитела, содержащего последовательности VL (аминокислоты 3-109 из SEQ ID No: 72) и VH (аминокислоты 3-124 из SEQ ID No: 40) антитела 992, антитела, имеющего CDR3 антитела 992 (SEQ ID No: 116 и 111), антитела, связывающего тот же эпитоп, что и антитело 992, и антитела, способного ингибировать связывание антитела 992 с человеческим EGFR; и
b. при этом вторая отдельная молекула антитела против EGFR выбрана из группы, состоящей из антитела 1024, антитела, содержащего последовательности VL (аминокислоты 3-114 из SEQ ID No: 73) и VH (аминокислоты 3-120 из SEQ ID No: 41) антитела 1024, антитела, имеющего CDR3 антитела 1024 (SEQ ID No: 120 и 1 14), антитела, связывающего тот же эпитоп, что и антитело 1024, и антитела, способного ингибировать связывание антитела 1024 с человеческим EGFR.
В соответствии с данным аспектом, композиция может применяться для терапии первой линии.
В других вариантах осуществления данного аспекта, композиция применяется для терапии второй линии, следующей после курса лечения, включающего лечение химиотерапией и/или по меньшей мере одним ингибитором тирозинкиназы и/или по меньшей мере одним ингибитором ангиогенеза и/или по меньшей мере одним гормоном и/или по меньшей мере одним индуцирующим дифференциацию агентом. Композиция также может применяться для терапии третьей линии.
Композиция может использоваться в комбинационной терапии вместе с химиотерапией и/или по меньшей мере одним ингибитором тирозинкиназы и/или по меньшей мере одним ингибитором ангиогенеза и/или по меньшей мере одним гормоном и/или по меньшей мере одним индуцирующим дифференциацию агентом.
В некоторых вариантах осуществления, композиция применяется для вспомогательной терапии после хирургического вмешательства и/или радиационной терапии.
Полная или частичная устойчивость предпочтительно определяется путем анализа образца раковых клеток, выделенных из вышеупомянутого субъекта. Данный анализ может включать измерение связывания цетуксимаба, панитумумаба, залутумумаба, нимотузумаба, ICR62, mAb806, матузумаба и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител, с раковыми клетками из вышеупомянутого субъекта. Отсутствие связывания указывает на устойчивость к антителу. В качестве альтернативы, полная или частичная устойчивость может быть определена в анализе пролиферации, аналогичном анализу в примере 21.
В других связанных аспектах изобретение относится к
- способу снижения передачи сигналов EGFR,
- способу уничтожения клеток, экспрессирующих EGFR,
- способу индуцирования апоптоза в клетках, экспрессирующих EGFR,
- способу подавления пролиферации клеток, экспрессирующих EGFR,
- способу индуцирования дифференциации клеток опухоли in vivo, и
- способу индуцирования интернализации EGFR,
при этом указанные способы включают введение композиции антител в композицию экспрессирующих EGFR клеток, при этом указанные клетки ранее подвергались воздействию антитела против EGFR, выбранного из группы, состоящей из цетуксимаба, панитумумаба, залутумумаба, нимотузумаба, ICR62, mAb806, матузумаба и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител, и где указанная композиция антител соответствует описанной в настоящей заявке.
В других аспектах изобретение относится к
- способу снижения передачи сигналов EGFR,
- способу уничтожения клеток, экспрессирующих EGFR,
- способу индуцирования апоптоза в клетках, экспрессирующих EGFR,
- способу подавления пролиферации клеток, экспрессирующих EGFR,
- способу индуцирования дифференциации клеток опухоли in vivo, и
- способу индуцирования интернализации EGFR,
при этом указанные способы включают введение композиции антител в композицию экспрессирующих EGFR клеток, при этом указанные клетки являются устойчивыми или частично устойчивыми к антителу против EGFR, выбранному из группы, состоящей из цетуксимаба, панитумумаба, залутумумаба, нимотузумаба, ICR62, mAb806, матузумаба и антител, способных связывать тот же эпитоп, что и любое из перечисленных антител, и где указанная композиция антител соответствует описанной в настоящей заявке.
В данных аспектах изобретения композиция антител по настоящему изобретению может представлять собой любую композицию, описанную в настоящем документе. Предпочтительно, композиция антител по настоящему изобретению соответствует описанной в разделе, озаглавленном «предпочтительная композиция антител», то есть, композиции антител, основанной на антителах 1024 и 992, в соответствии с описанным в настоящем документе.
Определения
Термин "антитело" описывает функциональный компонент сыворотки крови и часто относится к множеству молекул (антитела или иммуноглобулин) или к одной молекуле (молекула антитела или молекула иммуноглобулина). Молекула антитела способна к связыванию или реагированию со специфичной антигенной детерминантой (антигеном или антигенным эпитопом), которая, в свою очередь, может привести к индуцированию иммунологических эффекторных механизмов. Отдельная молекула антитела обычно называется моноспецифичной, а композиция молекул антитела может быть моноклональной (то есть, состоящей из идентичных молекул антитела) или поликлональной (то есть, состоящий из двух или более различных молекул антитела, реагирующих с одним и тем же или разными эпитопами на одном и том же антигене или даже на различных антигенах). Каждая молекула антитела имеет уникальную структуру, которая позволяет ей специфически связываться с соответствующим ей антигеном, и все природные молекулы антител имеют одну и ту же общую базовую структуру из двух идентичных легких цепей и двух идентичных тяжелых цепей. Антитела в совокупности также известны как иммуноглобулины. Термины «антитело» или «антитела» при использовании в настоящем документе также предназначены для включения химерных и одноцепочечных антител, а также связывающих фрагментов антител, таких как фрагменты Fab, Fv или фрагменты scFv, а также мультимерных форм, таких как димерные молекулы IgA или пятивалентные IgM. Антитело может быть человеческим, мышиным, химерным, гуманизированным или реорганизованным.
Термин "пара, кодирующая родственные VH и VL" описывает исходную пару последовательностей, кодирующих VH и VL, содержащихся или полученных из одной и той же продуцирующей антитело клетки. Таким образом, пара родственных VH и VL представляет собой парное соединение VH и VL, исходно присутствующее у донора, из которого была получена такая клетка. Термин "антитело, экспрессируемое из пары, кодирующей VH и VL" указывает, что антитело или фрагмент антитела продуцируется из вектора, плазмиды или аналогичной структуры, содержащей последовательность, кодирующую VH и VL. При экспрессировании пары, кодирующей родственные VH и VL, в виде полного антитела или его стабильного фрагмента, они сохраняют связывающую способность и специфичность антитела, исходно экспрессированного из клетки, из которой они были получены. Библиотека родственных пар также называется репертуаром или коллекцией родственных пар, и может храниться отдельно или в виде пула.
Термин "CDR" - участок, отвечающий за комплементарное взаимодействие с антигеном, определен в соответствии с работой Lefranc et al (2003) IMGT unique numbering for immunoglobulin and T cell receptor variable domains and Ig superfamily V-like domains. Dev. Comp Immunol 27, 55-77.
Термины "отдельный элемент рекомбинантного поликлонального белка" обозначают одну молекулу белка из белковой композиции, содержащей различные, но гомологичные молекулы белка, при этом каждая молекула белка гомологична другим молекулам композиции, но также содержит один или более фрагментов вариабельной полипептидной последовательности, который(-ые) характеризуется(-ются) различиями в аминокислотной последовательности между отдельными элементами поликлонального белка.
Термин "промоторы типа голова-к-голове" относится к паре промоторов, помещаемых в непосредственной близости, с тем чтобы транскрипция двух фрагментов генов, управляемая промоторами, происходила в противоположных направлениях. Промотор типа «голова-к-голове» также может быть создан с наполнителем, состоящим из не относящихся к делу нуклеиновых кислот между двумя промоторами. Такой фрагмент-наполнитель легко может содержать более 500 нуклеотидов. Промоторы типа «голова-к-голове» также могут называться двунаправленными промоторами.
Термин "иммуноглобулин" обычно используется в качестве собирательного обозначения смеси антител, обнаруженных в крови или сыворотке крови, но также может использоваться для обозначения смеси антител, полученных из других источников.
Термин "молекула иммуноглобулина" обозначает отдельную молекулу антитела, например, являющуюся частью иммуноглобулина, или частью композиции поликлональных или моноклональных антител.
Термин "библиотека различных представляющих интерес молекул нуклеиновых кислот" используется для описания набора молекул нуклеиновых кислот, которые в совокупности кодируют "представляющий интерес рекомбинантный поликлональный белок". При использовании для трансфекции, библиотека различных представляющих интерес молекул нуклеиновых кислот содержится в библиотеке экспрессионных векторов. Такая библиотека обычно содержит, по меньшей мере, 2, 3, 5, 10, 20, 50, 1000, 104, 105 или 106 различных представителей.
Термин "массовый перенос" используется для описания переноса представляющих интерес последовательностей нуклеиновых кислот из одной популяции векторов в другую популяцию векторов, что выполняется одновременно для каждой ДНК без обращения к выделению отдельной представляющей интерес ДНК. Такие популяции векторов могут представлять собой библиотеки, содержащие, например, представляющие интерес вариабельные области, промоторы, лидерные последовательности или энхансерные элементы. Данные последовательности могут затем быть перемещены без предшествующего выделения, например, из фагового вектора в экспрессионный вектор млекопитающего. В особенности, для последовательностей антител данная методика обеспечивает сохранение связи между многообразием VH и VL при перемещении библиотек, например, из вектора выбора (например, вектора фагового дисплея) в экспрессионный вектор млекопитающего. Таким образом, сохраняется исходное парное соединение VH и VL.
При использовании в настоящем документе, термин "функционально связанный" относится к сегменту, связываемому с другим сегментом в условиях функционального взаимодействия с другим сегментом. Например, ДНК, кодирующая сигнальную последовательность, функционально связана с ДНК, кодирующей полипептид, если она экспрессируются как лидерная последовательность, участвующая в переносе полипептида в эндоплазматический ретикулум. Также промотор или энхансер является функционально связанным с кодирующей последовательностью, если он стимулирует транскрипцию последовательности.
Термин "поликлональное антитело" описывает композицию различных молекул антител, которые способны связываться или реагировать с несколькими различными специфичными антигенными детерминантами на одном и том же антигене или на различных антигенах. Обычно считается, что вариабельность поликлонального антитела концентрируется в так называемых вариабельных областях поликлонального антитела. Однако в контексте настоящего изобретения поликлональность также может пониматься как описание различий между отдельными молекулами антитела, находящимися в так называемых константных областях, например, как в случае смесей антител, содержащих два или более изотипов антител, таких как человеческие изотипы IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2, или мышиные изотипы IgG1, IgG2a, IgG2b, IgG3 и IgA. Для целей настоящего изобретения такое поликлональное антитело также может называться "композицией антител".
Термин "эпитоп" широко используется для описания доли большей по размеру молекулы или части большей по размеру молекулы (например, антигена или антигенного сайта), имеющей антигенную или иммуногенную активность в животном, предпочтительно, млекопитающем, и, наиболее предпочтительно, у человека. Эпитоп, обладающий иммуногенной активностью, является долей большей по размеру молекулы, которая устанавливает выработку антитела у животного. Эпитоп, обладающий антигенной активностью, является долей большей по размеру молекулы, с которой антитело иммуноспецифично связывается, что определяется любым методом, хорошо известным в технике, например, посредством иммунных анализов, описанных в настоящем документе. Антигенные эпитопы не обязательно должны быть иммуногенными. Антиген представляет собой вещество, с которым иммуноспецифично связывается антитело или фрагмент антитела, например, токсин, вирус, бактерия, белки или ДНК. Антиген или антигенный сайт обычно имеет более одного эпитопа, если они не очень маленькие, и часто имеет способность стимулирования иммунного ответа. Эпитопы могут быть линейными или конформационными. Линейный эпитоп состоит из от около 6 до 10 смежных аминокислот в молекуле белка, которые распознаются антителом. В отличие от этого, конформационный эпитоп состоит из аминокислот, которые не расположены последовательно. В этом случае антитело распознает только 3-мерную структуру. При сворачивании молекулы белка в трехмерную структуру аминокислоты, формирующие эпитоп, помещаются рядом друг с другом, что позволяет антителу распознать последовательность. В денатурированном белке может быть распознан только линейный эпитоп. Конформационный эпитоп, по определению, должен находиться с внешней стороны свернутого белка. Антитело, которое распознает конформационный эпитоп, может связываться только при мягких, не приводящих к денатурации процедурах. Антитела, связывающиеся с различными эпитопами на одном антигене, могут иметь различное влияние на активность антигена, который они связывают, в зависимости от размещения эпитопа. Антитело, связывающееся с эпитопом в активном сайте антигена, может полностью блокировать функционирование антигена, тогда как другое антитело, связывающееся с другим эпитопом, может само по себе не иметь влияния или иметь слабое влияние на активность антигена. Такие антитела все же могут, однако, активировать комплементарный участок, что в результате приводит к устранению антигена, и может приводить к синергетическим эффектам при комбинировании с одним или более антителами, связывающимися с различными эпитопами на одном и том же антигене. В настоящем изобретении эпитоп предпочтительно представляет собой часть внеклеточного домена EGFR. Антигены по настоящему изобретению предпочтительно являются белками внеклеточного домена EGFR, их полипептидами или фрагментами, с которыми иммуноспецифично связывается антитело или фрагмент антитела. Ассоциированный с EGFR антиген также может быть аналогом или производным от внеклеточного домена полипептида EGFR или его фрагментом, с которым иммуноспецифично связывается антитело или фрагмент антитела.
Антитела, способные к конкурированию друг с другом за связывание с одним и тем же антигеном, могут связывать одни и те же или перекрывающиеся эпитопы, или могут иметь сайты связывания, расположенные близко друг от друга, в результате чего конкуренция возникает в основном из-за стерического препятствия. Методы определения конкуренции между антителами описаны в примерах.
При использовании в настоящем документе, термин "поликлональный белок" или "поликлональность" относится к композиции белков, содержащей различные, но гомологичные молекулы белка, предпочтительно выбранные из суперсемейства иммуноглобулинов. Таким образом, каждая молекула белка является гомологичной к другим молекулам композиции, но также содержит один или более участков вариабельной полипептидной последовательности, которые характеризуются различиями в аминокислотной последовательности между отдельными элементами поликлонального белка. Известные примеры таких поликлональных белков включают молекулы антитела или иммуноглобулина, рецепторы T-клеток и рецепторы B-клеток. Поликлональный белок может состоять из определенного подмножества белковых молекул, которое было определено по общему свойству, такому как общая связывающая активность с определенной мишенью, например, в случае поликлонального антитела против желаемого целевого антигена.
Под "белком" или "полипептидом" понимается произвольная цепочка аминокислот, независимо от длины или посттрансляционной модификации. Белки могут существовать в форме мономеров или мультимеров, содержащих две или более собранных полипептидных цепей, фрагментов белков, полипептидов, олигопептидов или пептидов.
Термин "RFLP" относится к "полиморфизму длины фрагментов рестрикции", методу, посредством которого подвижный гелевый профиль фрагментов молекулы нуклеиновой кислоты анализируется после расщепления рестрикционными ферментами.
Термин "перемешивание" описывает ситуации, в которых два или более различных элемента поликлонального белка, содержащего две различных полипептидных цепи, например, из суперсемейства иммуноглобулинов, экспрессируются из отдельной клетки. Данная ситуация может возникнуть в случае, когда отдельная клетка имеет более одной пары сегментов генов, интегрированных в геном, при этом каждая пара сегментов генов кодирует отдельный элемент поликлонального белка. В таких ситуациях могут быть получены непредусмотренные комбинации полипептидных цепей, экспрессируемых из сегментов генов. Эти непредусмотренные комбинации полипептидных цепей могут не иметь терапевтического эффекта.
Термин "перемешивание цепей VH-VL" является примером перемешивания, определенного выше. В данном пр