Способы, композиции и наборы для лиофилизации
Иллюстрации
Показать всеИзобретение относится к способу лиофилизации композиции, содержащей очищенный антитромбин III (AT III) и кристаллизующееся вещество, выбранное из аланина, маннита, глицина или NaCl. Заявленный способ включает замораживание композиции при температуре от -52°C до -60°C в течение 6-15 часов, отжиг композиции при -30°C в течение 1 часа, повторное замораживание композиции при температуре от -52°C до -60°C в течение 2-15 часов при поддержании температуры продукта между -48°C и -52,7°C в течение 4-10 перед лиофилизацией и высушивание композиции с получением лиофилизованного кека. Также изобретение относится к фармацевтическому набору, который содержит указанный лиофилизированный кек и жидкий реагент. Изобретение обеспечивает получение лиофилизированной композиции, содержащей AT III, который сохраняет свою активность и стабильность. 3 н. и 11 з.п. ф-лы, 24 ил., 5 табл., 2 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка заявляет приоритет заявки США № 61/264014, поданной 24 ноября 2009 г., которая включена в настоящее описании посредством ссылки во всей полноте.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к способам лиофилизации композиций, в частности водных фармацевтических составов, содержащих по меньшей мере один активный ингредиент, и композиций, получаемых из них, в частности к композициям, наборам и способам лиофилизации антитромбина-III (AT III).
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Лиофилизация является широко применяемым способом получения активных ингредиентов в виде более твердых форм фармацевтических препаратов. Например, было показано, что активный ингредиент, такой как AT III, который представляет собой альфа-гликопротеин, обычно присутствующий в плазме, и представляет собой плазматический ингибитор тромбина, обладает относительно низкой стабильностью в растворе. Соответственно, AT III перерабатывают в лиофилизированные препараты.
Предполагается, что лиофилизация уменьшает или ингибирует деградацию активного ингредиента посредством удаления компонентов растворителя в составе до таких количеств, которые уже не поддерживают химические реакции или биологический рост. Кроме того, полагают, что удаление растворителя уменьшает молекулярную подвижность, уменьшая возможность деструктивной реакции. К тому же, желательно, чтобы кристаллизующиеся вспомогательные вещества (например, аминокислоты и соли), которые широко применяются в лиофилизированных продуктах, кристаллизовались насколько возможно полностью во время замораживания, для того чтобы обеспечить твердую матрицу для поддержки структуры кека. Однако в ряде предыдущих попыток лиофилизировать водные фармацевтические составы не удалось достигнуть удовлетворительной степени кристаллизации. Например, было показано, что различные стадии замораживания и/или отжига типичного протокола лиофилизации как такового неэффективно поддерживают кристаллизацию. Более того, предполагается, что присутствие определенных кристаллизующихся вспомогательных веществ (например, аланина и хлорида натрия) может ингибировать или уменьшать кристаллизацию любого вспомогательного вещества, тем самым также ограничивая степень кристаллизации.
При том, что было сделано несколько попыток лиофилизировать водные фармацевтические составы, сохраняется необходимость в способах лиофилизации и композициях, получаемых с их помощью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте настоящее изобретение предлагает способ лиофилизации композиции, содержащей по меньшей мере один активный ингредиент и по меньшей мере одно кристаллизующееся вспомогательное вещество. Данный способ включает в себя: выдерживание данной композиции при первой температуре в течение первого периода времени, достаточного для того, чтобы получить первую композицию, содержащую по меньшей мере одно частично или полностью кристаллизованное кристаллизующееся вспомогательное вещество.
В другом аспекте настоящее изобретение предлагает способ лиофилизации жидкой композиции, содержащей получаемый из плазмы AT III, NaCl и аланин. Данный способ включает в себя:
(a) выдерживание данной композиции при приблизительно 54°C или ниже, так что температура композиции равна приблизительно 48°C или ниже в течение приблизительно 5 часов или более, для того чтобы обеспечить полную или почти полную кристаллизацию первой композиции, включающей в себя один или несколько компонентов; и
(b) высушивание первой композиции, для того чтобы получить лиофилизированный кек.
В некоторых аспектах настоящее изобретение предлагает композиции, включающие в себя лиофилизированные кеки, полученные в соответствии со способами, раскрытыми в настоящем описании.
В других аспектах настоящее изобретение предлагает набор, содержащий одну или несколько из композиций и/или лиофилизированных кеков, полученных в соответствии со способами, раскрытыми в настоящем описании.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 - ДСК термограмма во время замораживания и нагревания раствора NaCl (0,15M).
Фигура 2 - ДСК термограммы во время замораживания (A) и нагревания (B) раствора аланина (0,1M).
Фигура 3 - ДСК термограммы во время замораживания (A) и нагревания (B) восстановленного AT III.
Фигура 4 - оптимальные условия кристаллизации по анализу DOE.
Фигура 5: A - изменение теплоемкости (Cp) во время замораживания и отжига в цикле ETP-5807; B - изменение Cp во время первого замораживания; C - изменение Cp во время отжига; D - изменение Cp во время второго замораживания.
Фигура 6 - изменение теплового потока с температурой в цикле ETP-5807. Была определена теплота плавления для пика плавления, составившая 5,5 Дж/г.
Фигура 7: A - изменение Cp во время замораживания и отжига при увеличении времени выдержки при замораживании до 5 часов; B - изменение Cp во время первого замораживания; C - изменение Cp во время линейного нагревания от -52°C до -30°C; D - изменение Cp во время отжига; E - изменение Cp во время второго замораживания.
Фигура 8 - изменение теплового потока с температурой при увеличении времени выдержки при замораживании от 2 часов до 5 часов. Была определена теплота плавления для пика плавления, составившая 6,4 Дж/г.
Фигура 9 - профиль лиофилизации AT III в цикле ETP-5807, выполненном в аппарате lyostar II FTS.
Фигура 10 - данные по температуре продукта во время замораживания в цикле ETP-5807 в аппарате FTS.
Фигура 11 - профиль лиофилизации AT III при замораживании при -54°C в течение 2 часов.
Фигура 12 - данные по температуре продукта при замораживании при -54°C в течение 2 часов.
Фигура 13 - профиль лиофилизации AT III при замораживании при -54°C в течение 6 часов в аппарате FTS.
Фигура 14 - данные по температуре продукта при замораживании при -54°C в течение 6 часов в аппарате FTS.
Фигура 15 - профиль лиофилизации AT III при замораживании при -50°C в течение 6 часов в аппарате FTS.
Фигура 16 - данные по температуре продукта при замораживании при -50°C в течение 6 часов в аппарате FTS.
Фигура 17 - профиль лиофилизации AT III при замораживании при -60°C в течение 6 часов в Usifroid.
Фигура 18 - данные по температуре продукта при замораживании AT III при -60°C в течение 6 часов в Usifroid.
Фигура 19 - профиль лиофилизации AT III при замораживании при -52°C в течение 15 часов.
Фигура 20 - данные по температуре продукта при замораживании при -52°C в течение 15 часов.
Фигура 21 - растрово-электронный микроснимок кеков (200x увеличение). Масштабные метки равны 100 мкм. A: кек с нарушенной структурой. B: твердый кек.
Фигура 22 - растрово-электронный микроснимок NaCl, 200x увеличение слева и 1500x увеличение справа. Масштабная метка равна 100 мкм (A) и 10 мкм (B).
Фигура 23 - растрово-электронный микроснимок аланина, 50x увеличение слева и 200x увеличение справа. Масштабная метка равна 500 мкм (A) и 100 мкм (B).
Фигура 24 - порошковые рентгеновские дифракционные (РД) диаграммы с применением дифрактометра для NaCl, аланина, ETP 5807 (кека с нарушенной структурой) и материал от второго прохода ETP 5807 (твердого кека).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предлагает неожиданное открытие, что одной стадии низкотемпературного замораживания перед высушиванием достаточно, для того чтобы вызвать кристаллизацию способных кристаллизоваться вспомогательных веществ в составах, содержащих активный ингредиент, и, следовательно, настоящие способы предлагают надежную кристаллизацию вспомогательных веществ, в то же время предлагая также более эффективный, удобный и/или надежный протокол лиофилизации. Настоящие способы допускают повышенное количество кристаллических объемообразующих агентов по сравнению с предшествующими способами, при этом сохраняя стабильность и активность активного ингредиента, присутствующего в составах.
В одном аспекте настоящее изобретение предлагает способ лиофилизации композиции, содержащей по меньшей мере один активный ингредиент и по меньшей мере одно кристаллизующееся вспомогательное вещество. Данный способ включает в себя выдерживание данной композиции при первой температуре в течение первого периода времени, достаточного для того, чтобы получить первую композицию, содержащую по меньшей мере одно частично или полностью кристаллизованное кристаллизующееся вспомогательное вещество.
Композиция может представлять собой жидкую или полужидкую композицию. Например, композиция может представлять собой водный фармацевтический раствор или суспензию, содержащий по меньшей мере один активный ингредиент и по меньшей мере одно кристаллизующееся вспомогательное вещество.
В одном варианте осуществления композиция представляет собой жидкий состав, предпочтительно водный раствор. В другом варианте осуществления композиция представляет собой подходящую для фармацевтического применения, например, фармацевтическую композицию, содержащую фармацевтически приемлемый носитель или разбавитель.
В одном варианте осуществления композиция представляет собой фармацевтическую композицию, содержащую по меньшей мере один активный ингредиент, по меньшей мере одно кристаллизующееся вспомогательное вещество и фармацевтически приемлемый носитель. В контексте настоящего описания "фармацевтически приемлемый носитель" включает любые и все растворители, диспергирующие среды, покрытия и тому подобное, которые физиологически совместимы. Тип носителя может быть выбран на основании планируемого пути введения. В некоторых вариантах осуществления носитель подходит для введения посредством, без ограничения, внутривенных, ингаляционных, парентеральных, подкожных, внутримышечных, внутрисуставных, внутрибронхиальных, внутрибрюшных, внутрикапсульных, внутрихрящевых, внутриполостных, интрацелиальных, внутримозжечковых, интрацеребровентрикулярных, вводимых внутрь толстой кишки, интрацервикальных, внутрижелудочных, внутрипеченочных, интрамиокардиальных, внутрикостных, внутритазовых, интраперикардиальных, внутрибрюшинных, внутриплевральных, внутрипростатных, внутрилегочных, интраректальных, внутрипочечных, интраретинальных, интраспинальных, внутрисуставных, внутригрудных, внутриматочных, внутрипузырных, болюсных, вагинальных, ректальных, буккальных, сублингвальных, интраназальных или трансдермальных средств. Фармацевтически приемлемые носители включают, без ограничения, стерильные водные растворы или дисперсии для получения стерильных инъецируемых растворов или дисперсии.
Активный ингредиент
В некоторых вариантах осуществления по меньшей мере один активный ингредиент может представлять собой любой активный ингредиент, включая, без ограничения, белки, нуклеиновые кислоты и их комбинации. Белки могут включать, без ограничения, гликопротеины (например, AT III), факторы свертывания крови, факторы роста, цитокины, антитела и химерные конструкции. Термин "белок" в настоящем описании рассматривается как широкий и относится к индивидуальным или коллективным нативным белкам человека или другого млекопитающего; и/или гомогенному или гетерогенному распределению полипептидов, происходящих от одного или нескольких генных продуктов; и/или фрагментам белков, проявляющим определенную активность; и/или таким белкам и/или их активным фрагментам, получаемым посредством рекомбинантных методов, включая трансгенную технологию.
В некоторых вариантах осуществления по меньшей мере одним активным ингредиентом является белок. В одном варианте осуществления белок представляет собой AT III. В других вариантах осуществления композиция содержит только один активный ингредиент, причем данный активный ингредиент представляет собой AT III. В другом варианте осуществления AT III является единственным активным ингредиентом в композиции, однако композиция содержит другие белки, включая белки, не являющиеся AT III, и/или неактивные формы AT III. Например, функциональный AT III может составлять часть от общего содержания белка в композиции.
Термин "AT III" в контексте настоящего описания рассматривается как широкий, если иное не указано явно. Например, данный термин относится ко всем встречающимся в природе полиморфам AT III. Данный термин также включает в себя функциональные фрагменты AT III, химерные белки, содержащие AT III, или их функциональные фрагменты, гомологи, полученные посредством замещения аналогами одной или нескольких аминокислот AT III, и видовые гомологи. Данный термин также относится ко всем полипептидам AT III, которые являются продуктом технологии рекомбинантной ДНК, включая AT III, который является продуктом трансгенной технологии. Например, ген, кодирующий AT III, может быть вставлен в ген млекопитающего, кодирующий белок молочной сыворотки, таким образом, что последовательность ДНК экспрессируется в молочной железе, как описано, например, в патенте США № 5322775, который включен в настоящее описание посредством ссылки ради идеи способа получения белкового соединения. Данный термин также относится ко всем белкам AT III, химически синтезированным посредством способов, известных в данном уровне техники, таких как, например, твердофазный пептидный синтез. Данный термин также относится к AT III, полученному из плазмы. Данный термин также относится к AT III, который может быть получен коммерчески. AT III может соответствовать человеческому или не человеческому AT III.
В одном варианте осуществления AT III представляет собой получаемый из плазмы AT III. В другом варианте осуществления AT III получают из суспензии фракций плазмы. В других вариантах осуществления AT III получают из обедненной альбумином фракции плазмы или предварительно очищенной фракции для получения AT III. Патент США № 5561115, Tenold, включен в настоящее описание посредством ссылки ради идеи способа получения AT III из сыворотки или плазмы.
В других вариантах осуществления AT III представляет собой рекомбинантный AT III. Получение рекомбинантных белков, включая рекомбинантный AT III, описано, например, в патентах США №№ 4517294, 4632981, 4873316, 5420252, 5618713, 5700663, 5843705, 6441145, 6878813, 7019193, Fan et al., JBC, 268:17588 (1993), Garone et al., Biochemistry, 35:8881 (1996), международной публикации № WO02/02793; публикации США №№ US2003/096974 и US2006/0024793 и Gillespie et al., JBC, 266:3995 (1991), все они включены в настоящее описание посредством ссылки ради идеи получения рекомбинантных белков, включая рекомбинантный AT III.
В одном варианте осуществления композиция характеризуется как содержащая AT III, имеющий чистоту более чем 90%. В других вариантах осуществления AT III имеет чистоту более чем 95%, предпочтительно по меньшей мере приблизительно 99%. В некоторых вариантах осуществления по меньшей мере приблизительно 50%, для иллюстрации от приблизительно 50% до приблизительно 100%, от приблизительно 60% до приблизительно 90%, от приблизительно 70% до приблизительно 80% от всего AT III в композиции составляет активный AT III.
В других вариантах осуществления лиофилизируемая композиция содержит по меньшей мере приблизительно 0,1 мг/мл AT III, для иллюстрации от приблизительно 0,1 до приблизительно 100 мг/мл, от приблизительно 0,5 до приблизительно 50 мг/мл, от приблизительно 1 до приблизительно 30 мг/мл и от приблизительно 5 до приблизительно 15 мг мл AT III, причем AT III составляет частично или полностью общий белок, присутствующий в композиции.
В одном варианте осуществления композиция содержит терапевтически эффективное количество AT III. "Терапевтически эффективное количество" относится к количеству, эффективному при необходимых дозировках и периодах времени в том, чтобы достигнуть необходимого терапевтического результата, такого как, например, антикоагуляция, связанная с наследственным дефицитом антитромбина. Терапевтически эффективное количество AT III может варьироваться в соответствии с такими факторами, как состояние заболевания, возраст, пол и вес отдельного субъекта и способность AT III добиваться необходимого отклика субъекта. Терапевтически эффективное количество также может быть таким, при котором любые токсические или вредные воздействия AT III перевешиваются терапевтически благоприятными воздействиями.
В других вариантах осуществления композиция содержит профилактически эффективное количество AT III. "Профилактически эффективное количество" относится к количеству, эффективному при необходимых дозировках и периодах времени в том, чтобы достигнуть необходимого профилактического результата, такого как, например, предупреждение или ингибирование тромбоэмболических эпизодов у субъектов, которые перенесли несколько тромбоэмболических эпизодов, или пациентов, которые подвержены риску будущих эпизодов. Профилактически эффективное количество может быть определено, как описано выше, для терапевтически эффективного количества.
Кристаллизующееся вспомогательное вещество
В одном варианте осуществления по меньшей мере одно кристаллизующееся вспомогательное вещество выбирают из группы, состоящей из аланина, маннита, глицина и NaCl.
В некоторых вариантах осуществления по меньшей мере одно кристаллизующееся вспомогательное вещество присутствует в композиции с общим количеством кристаллизующихся вспомогательных веществ, составляющим по меньшей мере приблизительно 0,01% (вес./об.), для иллюстрации от приблизительно 0,01% до приблизительно 10%, от приблизительно 0,1% до приблизительно 5% и от приблизительно 0,7% до приблизительно 1,8% (вес./об.).
В других вариантах осуществления лиофилизированный продукт содержит по меньшей мере приблизительно 20% (вес./об.) всех кристаллизующихся вспомогательных веществ, для иллюстрации от приблизительно 20 до приблизительно 80%, от приблизительно 30 до приблизительно 70% и от приблизительно 36 до приблизительно 60% (вес./об.) всех кристаллизующихся вспомогательных веществ.
В некоторых вариантах осуществления по меньшей мере одно кристаллизующееся вспомогательное вещество представляет собой аланин и NaCl. В одном варианте осуществления NaCl присутствует в количестве, равном от приблизительно 50 мМ до приблизительно 300 мМ, предпочтительно от приблизительно 100 мМ до приблизительно 250 мМ. В одном варианте осуществления хлорид натрия как таковой может применяться без какого-либо другого из вышеупомянутых кристаллизующихся вспомогательных веществ, в каком случае он может быть включен в состав в количестве, равном приблизительно 300 мМ или более. В других вариантах осуществления композиция (например, водный фармацевтический состав) представляет собой гипертонический раствор.
В дополнение к по меньшей мере одному активному ингредиенту и по меньшей мере одному кристаллизующемуся вспомогательному веществу композиция также может дополнительно содержать одно или несколько других вспомогательных веществ, т.е. одно или несколько других веществ, применяемых в сочетании с активным ингредиентом, для того чтобы составить композицию. Некоторые не ограничивающие примеры одного или нескольких других вспомогательных веществ включают стабилизирующие агенты, буферные агенты, двухвалентные катионы (например, соли кальция), связывающие вещества, смазывающие вещества, разрыхлители, разбавители, красители, корригенты, скользящие вещества, поверхностно-активные вещества, абсорбенты и подслащивающие вещества.
Комбинации активных ингредиентов и вспомогательных веществ в соответствии с настоящим изобретением могут обеспечить стабильность активного ингредиента в лиофилизированных препаратах; однако композиции настоящего изобретения также могут проявлять определенную стабильность в жидком или полужидком состоянии.
В других вариантах осуществления композиция дополнительно содержит стабилизирующий агент. Например, стабилизирующий агент может быть выбран из группы, состоящей из сахарозы, маннита и трегалозы. Перед лиофилизацией стабилизирующие агенты могут присутствовать в композиции с общим количеством стабилизирующих агентов, составляющим по меньшей мере приблизительно 1%, для иллюстрации от приблизительно 1% до приблизительно 4% и от приблизительно 2% до приблизительно 3%. В некоторых вариантах осуществления стабилизирующий агент присутствует в композиции в количестве, равном приблизительно 2%.
Буфер также может присутствовать в композициях настоящего изобретения, в частности, когда активный ингредиент подвержен неблагоприятному воздействию сдвигов pH во время лиофилизации. pH следует предпочтительно поддерживать в диапазоне приблизительно от 6 до 8 во время лиофилизации и более предпочтительно при pH, равном приблизительно 7. Буферный агент может представлять собой любое физиологически приемлемое химическое соединение или комбинацию химических соединений, которые обладают способностью действовать как буферы, включая, без ограничения, фосфатный буфер, цитратный буфер, ацетатный буфер, буфер лимонная кислота/фосфат, гистидин, трис-(гидроксиметил)аминометан (Трис), 13-бис-[трис-(гидроксиметил)метиламино]пропан (Бис-трис-пропан), пиперазин-N,N'-бис-(2-этансульфоновую кислоту) (PIPES), 3-(N-морфолино)пропансульфоновую кислоту (MOPS), N-2-гидроксиэтилпиперазин-N'-2-этансульфоновую кислоту (HEPES), 2-(N-морфолино)этансульфоноваую кислоту (MES) и N-2-ацетамидо-2-аминоэтансульфоновую кислоту (ACES).
В одном варианте осуществления буферный агент включают в композицию в концентрации, равной от приблизительно 10 до приблизительно 50 мМ. Когда в композиции добавляют гистидин, могут использоваться концентрации, равные по меньшей мере приблизительно 20 мМ, предпочтительно приблизительно 25 мМ, отдельно или в комбинации с другими буферами, такими как Трис.
В других вариантах осуществления композиция дополнительно содержит двухвалентный катион, например соль кальция. В одном варианте осуществления соль кальция присутствует в количестве, равном от приблизительно 1 мМ до приблизительно 5 мМ.
В одном варианте осуществления композиция дополнительно содержит поверхностно-активное вещество. Поверхностно-активное вещество может присутствовать в количестве, равном приблизительно 0,1% или менее. Неограничивающие примеры поверхностно-активных веществ включают POLYSORBATE 20 (например, TWEEN® 20), POLYSORBATE 80 (например, TWEEN® 80), полиоксиэтиленовый (80) эфир сорбита и жирной кислоты, плюрониловые полиолы (например, F-38, F-68) и додециловые эфиры полиоксиэтиленгликоля (например, Brij-35).
В соответствии с настоящим изобретением композиция также может дополнительно содержать антиоксидант. Антиоксидант может присутствовать в композиции в общем количестве, равном по меньшей мере 0,05 мг/мл, для иллюстрации от приблизительно 0,05 до приблизительно 50 мг/мл, от приблизительно 0,1 до приблизительно 10 мг/мл и от приблизительно 1 до приблизительно 5 мг/мл. Не ограничивающие примеры антиоксидантов включают N-ацетил-L-цистеин/гомоцистеин, глутатион, 6-гидрокси-2,5,7,8-тетраметилхроман-2-карбоновую кислоту (Trolox), липоевую кислоту, метионин, тиосульфат натрия, платину, глицин-глицин-гистидин (трипептид) и бутилированный гидрокситолуол (BHT). В некоторых вариантах осуществления композиция дополнительно содержит глутатион в количестве, равном от приблизительно 0,05 мг/мл до приблизительно 5 мг/мл.
Композиции настоящего изобретения также могут содержать кальций или другой двухвалентный катион, в частности когда катион обеспечивает взаимодействие с активным ингредиентом, для того чтобы сохранить его активность. В одном варианте осуществления композиция дополнительно содержит двухвалентный катион. В другом варианте осуществления двухвалентный катион предлагается в виде соли кальция, например хлорида кальция, но может также представлять собой другие соли кальция, такие как глюконат кальция, глубионат кальция или глюцептат кальция. В некоторых вариантах осуществления соль кальция присутствует в количестве, равном от приблизительно 1 мМ до приблизительно 5 мМ. В других вариантах осуществления соль кальция присутствует в количестве, равном от приблизительно 3 мМ до приблизительно 4 мМ, предпочтительно приблизительно 4 мМ.
В некоторых вариантах осуществления комбинация гистидина и глутатиона может оказывать синергически благоприятное воздействие на стабильность определенного активного ингредиента, присутствующего в композиции. Например, гистидин, действуя как буфер, также может действовать как хелатор металла. В тех случаях, когда, как полагают, на уровень активности активного ингредиента воздействует вызванное металлом окисление, гистидин, например, может, следовательно, действовать так, чтобы стабилизировать связывание окисляющими металлическими ионами. Полагают, что посредством связывания данных металлов глутатион (или любой другой присутствующий антиоксидант) тем самым способен обеспечить дальнейшую антиокислительную защиту, поскольку окисляющее воздействие металлических ионов, связанных гистидином, подавляется. Другие хелатирующие агенты также можно включать в композиции/составы настоящего изобретения. Такие хелатирующие агенты, предпочтительно, связывают металлы, такие как медь и железо, с большим сродством, чем кальций, например когда в композиции используется соль кальция. Одним примером такого хелатора является дефероксамин, который представляет собой хелатирующий агент, который облегчает удаление Al++ и железа.
Лиофилизация
Как правило, определенные температуры и/или температурные диапазоны способа лиофилизации относятся к температуре хранения лиофилизирующего оборудования, если не указано иное. Температура хранения относится к контрольной температуре холодоносителя, протекающего через хранение лиофилизатора, которой, как правило, управляют в качестве температуры во время лиофилизации. Температура образца (т.е. температура продукта) зависит от температуры хранения, давления в камере и/или скорости испарения/сублимации во время первичного высушивания (при испарительном охлаждении температуры продуктов ниже, чем температура хранения).
A. Замораживание
В одном варианте осуществления первая температура равна приблизительно -48°C или ниже. В другом варианте осуществления первая температура равна приблизительно -54°C или ниже. В других вариантах осуществления период времени составляет по меньшей мере приблизительно 30 минут, для иллюстрации от приблизительно 30 минут до приблизительно 20 часов, от приблизительно 1 до приблизительно 18 часов, от приблизительно 2 до приблизительно 16 часов, от приблизительно 3 до приблизительно 14 часов, от приблизительно 4 до приблизительно 10 часов, от приблизительно 5 до приблизительно 8 часов и от приблизительно 6 до приблизительно 7 часов. В одном варианте осуществления период времени составляет приблизительно 6 часов.
Температура и период времени могут зависеть от таких факторов, как объем раствора на флакон, вне зависимости от лиофилизируемой композиции.
Настоящее изобретение в некоторых случаях относится к цели полной или на 100% кристаллизации вспомогательного вещества, и специалист в данной области техники понимает, что "полную кристаллизацию" может быть сложно верифицировать, в частности, когда чувствительности метода недостаточно для полной уверенности в том, что вспомогательное вещество полностью или на 100% кристаллизовано. Поэтому на практике настоящее изобретение предлагает способы лиофилизации, которые по меньшей мере улучшают кристаллизацию вспомогательного вещества в сравнении с предыдущими способами. Соответственно, в контексте настоящего описания, "полностью кристаллизованные" продукты могут быть определены, например, посредством дифференциальной сканирующей калориметрии (ДСК), когда специалист в данной области техники определяет, что необратимый экзотермический акт при первом сканировании представляет акт кристаллизации, который указывает на то, что кристаллизующееся вспомогательное вещество не полностью кристаллизовалось во время лиофилизации. В некоторых вариантах осуществления по меньшей мере одно кристаллизующееся вспомогательное вещество частично кристаллизовано, причем частичная кристаллизация характеризуется как степень кристаллизации, составляющая приблизительно 50% или более, для иллюстрации по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, по меньшей мере приблизительно 99,5%, по меньшей мере приблизительно 99,8% и менее чем 100%.
B. Отжиг
В других вариантах осуществления способ дополнительно содержит выдерживание первой композиции при второй температуре в течение второго периода времени, для того чтобы получить вторую композицию, причем вторая температура выше первой температуры.
В одном варианте осуществления вторая температура по меньшей мере приблизительно на 5°C выше первой температуры, для иллюстрации от приблизительно на 5°C до приблизительно на 30°C и от приблизительно на 10°C до приблизительно на 20°C выше первой температуры. Например, в некоторых вариантах осуществления вторая температура равна приблизительно -30°C, причем первая температура равна приблизительно -50°C.
В некоторых вариантах осуществления второй период времени составляет по меньшей мере 10 минут, для иллюстрации от приблизительно 10 минут до приблизительно 10 часов, от приблизительно 30 минут до приблизительно 8 часов, от приблизительно 1 часа до приблизительно 6 часов и от приблизительно 2 часов до приблизительно 4 часов. В других вариантах осуществления второй период времени составляет менее чем, более чем или приблизительно равен первому периоду времени.
Без ограничения какой-либо конкретной теорией предполагается, что такие стадии отжига могут помочь улучшить скорости сублимации и/или уменьшить гетерогенность в пределах партии, зависящую от условий и конкретной композиции.
В одном варианте осуществления стадия отжига необязательна.
В других вариантах осуществления после второго периода времени вторую композицию подвергают третьей температуре в течение третьего периода времени, причем третья температура ниже второй температуры. Например, в некоторых вариантах осуществления третья температура является приблизительно такой же, как первая температура. В других вариантах осуществления третья температура по меньшей мере на 5°C ниже второй температуры, для иллюстрации от приблизительно на 5°C до приблизительно на 30°C и от приблизительно на 10°C до приблизительно на 20°C ниже второй температуры. Например, в некоторых вариантах осуществления вторая температура равна приблизительно -30°C, причем вторая температура равна приблизительно -50°C.
В некоторых вариантах осуществления настоящее изобретение предлагает способ лиофилизации композиции, содержащей по меньшей мере один активный ингредиент и по меньшей мере одно кристаллизующееся вспомогательное вещество. Данный способ включает в себя:
(a) выдерживание данной композиции при первой температуре в течение первого периода времени, достаточного для того, чтобы получить первую композицию, содержащую по меньшей мере одно частично или полностью кристаллизованное кристаллизующееся вспомогательное вещество;
(b) выдерживание первой композиции при второй температуре в течение второго периода времени, для того чтобы получить вторую композицию, причем вторая температура выше первой температуры; и
(c) выдерживание второй композиции при третьей температуре в течение третьего периода времени, для того чтобы получить третью композицию, причем третья температура ниже второй температуры.
В одном варианте осуществления период времени составляет по меньшей мере приблизительно 30 минут, для иллюстрации от приблизительно 30 минут до приблизительно 20 часов, от приблизительно 1 до приблизительно 18 часов, от приблизительно 2 до приблизительно 16 часов, от приблизительно 3 до приблизительно 14 часов, от приблизительно 4 до приблизительно 10 часов, от приблизительно 5 до приблизительно 8 часов и от приблизительно 6 до приблизительно 7 часов. В другом варианте осуществления период времени составляет приблизительно 6 часов. В других вариантах осуществления период времени составляет приблизительно 3 часа. В других вариантах осуществления третий период времени составляет менее чем, более чем или приблизительно равен первому периоду времени. В других вариантах осуществления условия (например, температура и время) на стадии (a) и (b) являются одинаковыми или по существу одинаковыми.
C. Высушивание
В других вариантах осуществления способы настоящего изобретения дополнительно включают в себя фазу высушивания. Фаза высушивания может включать в себя фазу первичного высушивания и фазу вторичного высушивания.
Соответственно, в некоторых вариантах осуществления настоящее изобретение предлагает способ лиофилизации композиции, содержащей по меньшей мере один активный ингредиент и по меньшей мере одно кристаллизующееся вспомогательное вещество. Данный способ включает в себя:
(a) выдерживание данной композиции при первой температуре в течение первого периода времени, достаточного для того, чтобы получить первую композицию, содержащую по меньшей мере одно частично или полностью кристаллизованное кристаллизующееся вспомогательное вещество; и
(b) высушивание первой композиции, для того чтобы сформировать лиофилизированный кек.
В других вариантах осуществления настоящее изобретение предлагает способ лиофилизации композиции, содержащей по меньшей мере один активный ингредиент и по меньшей мере одно кристаллизующееся вспомогательное вещество, причем данный способ включает в себя:
(a) выдерживание данной композиции при первой температуре в течение первого периода времени, достаточного для того, чтобы получить первую композицию, содержащую по меньшей мере одно частично или полностью кристаллизованное кристаллизующееся вспомогательное вещество;
(b) выдерживание первой композиции при второй температуре в течение второго периода времени, для того чтобы получить вторую композицию, причем вторая температура выше первой температуры;
(c) выдерживание второй композиции при третьей температуре в течение третьего периода времени, для того чтобы получить третью композицию, причем третья температура ниже второй температуры; и
(d) высушивание третьей композиции, для того чтобы сформировать лиофилизированный кек.
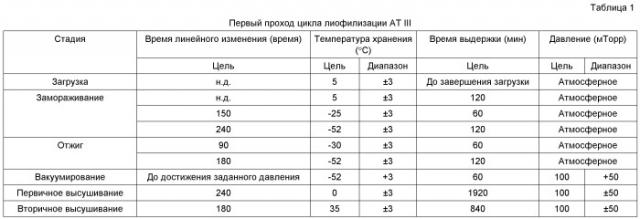
В одном варианте осуществления высушивание содержит стадию первичного высушивания. Первичное высушивание может удалить замерзшую воду (сублимация льда). Предпочтительно, несвязанный или легко удаляемый лед удаляют из образца посредством первичного высушивания. Несвязанная вода в начале стадии первичного высушивания может предпочтительно иметь форму свободного льда, который может быть удален посредством сублимации, т.е. превращения непосредственно из твердого состояния в пар.
В некоторых вариантах осуществления стадия первичного высушивания может проводиться при температуре, равной от приблизительно -35°C до приблизительно 20°C, или от приблизительно -25°C до приблизительно 10°C, или от приблизительно -20°C до приблизительно 0°C. В одном варианте осуществления стадию первичного высушивания проводят при приблизительно 0°C. В других вариантах осуществления стадия первичного высушивания может осуществляться в течение общего времени, составляющего по меньшей мере приблизительно 1 час, для иллюстрации от приблизительно 1 часа до приблизительно 1 недели, от приблизительно 10 часов до приблизительно 4 дней и от приблизительно 20 часов до приблизительно 40 часов. В другом варианте осуществления стадия первичного высушивания включает в себя высушивание первой или третьей композиции при давлении, равном от приблизительно 0 до приблизительно 200 мТорр, предпочтительно приблизительно 100 мТорр, при температуре, равной приблизительно -50°C, в течение приблизительно 1 часа и затем при 0°C в течение приблизительно 35 часов.
Необязательная стадия "линейного изменения перед первичным высушиванием" (т.е. повышения температуры от стадии, предшествующей первичному высушиванию, до температуры первичного высушивания) может осуществляться в соответствии со способами настоящего изобретения