Офтальмологический раствор для защиты внутренних структур глазного яблока от уф-а лучей или для лечения кератоконуса методом трансэпителиального кросс-линкинга
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой офтальмологический раствор, содержащий рибофлавин и витамин Е, для защиты внутренних структур глазного яблока от УФ-А-лучей или для лечения кератоконуса методом трансэпителиального кросс-линкинга. Изобретение обеспечивает расширение арсенала средств для защиты внутренних структур глазного яблока от УФ-А-лучей или для лечения кератоконуса методом трансэпителиального кросс-линкинга. 3 н. и 6 з.п. ф-лы, 10 ил.
Реферат
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение, в целом, относится к композициям для лечения и методам лечения кератоконуса и, более конкретно, к новому офтальмологическому раствору, применимому для защиты внутренних структур глазного яблока от УФ-А-лучей или при лечении с помощью роговичного кросс-линкинга.
УРОВЕНЬ ТЕХНИКИ
В книге [18] приводится обзор, описывающий проблемы и методы введения и усвоения офтальмологических растворов.
Роговичный (коллагеновый) кросс-линкинг (С3) с использованием рибофлавина (витамина В2), кратко называемый рибофлавин - С3, представляет собой инновационный метод лечения пациентов с кератоконусом и эктазией роговицы и заключается во введении рибофлавина и облучении ультрафиолетовым светом (УФ-А) для укрепления ткани роговицы [1], [2].
Лечение методом кросс-линкинга является относительно простым: рибофлавин по капле вливают в глаз (орошают глаз) и роговицу облучают соответствующей дозой УФ-А в течение пяти минут; процедуру затем повторяют шесть раз подряд, чтобы общее время УФ-А-облучения составляло 30 минут.
Наиболее важным клиническим показателем, который следует принимать во внимание при установлении пригодности для кросс-линкинга, является толщина роговицы, которая не должна быть менее 400 микрон.
Целью этого консервативного лечения кератоконуса является отсрочить или, как следует надеяться, исключить необходимость в пересадке (трансплантации) роговицы и повысить зрительную работоспособность пациентов, повышая качество их жизни [6], [7].
Метод кросс-линкинга применялся для лечения кератоконуса, патологии, характеризующейся прогрессирующим истончением роговицы по причине аномальной дряблости паренхимы роговицы вследствие пониженного сцепления коллагеновых волокон, из которых она состоит. При использовании УФ-А-излучения и рибофлавина между прилегающими молекулами коллагена роговицы образуются новые связи и обработанная роговица становится толще и крепче [3]. Роговица содержит несколько слоев коллагеновых нитей по толщине паренхимы; поперечные связи, так называемые "сшивки", которые связывают между собой различные слои коллагена, являются определяющими для жесткости роговицы. Целью кросс-линкинга роговичной ткани является повышение степени ее жесткости за счет образования большего числа этих поперечных связей.
Местное (топическое) применение (нанесение) рибофлавина на деэпителизированную роговицу с проницаемостью около 200 мкм и УФ-А-облучение молекул рибофлавина определяет нарушение химического равновесия молекул рибофлавина с последующим образованием свободных радикалов. Молекулы рибофлавина становятся неустойчивыми и стабилизируются путем связывания двух коллагеновых фибрилл. Между коллагеновыми фибриллами образуется ряд биохимических "мостиков" (т.е. сшивок), что приводит к общему укреплению роговичной ткани [3].
Фактически, лечение проводят после удаления наружного слоя роговицы (т.е. эпителия роговицы, роговичного эпителия). Этот способ осуществления кросс-линкинга (С3-R) кератоконуса и эктазии роговицы предполагает предварительное удаление роговичного эпителия с целью содействовать проникновению 0.1% стандартного раствора рибофлавин-декстрана (например, раствора, выпускаемого фирмой SOOFT ITALIA S.r.l. под торговой маркой RICROLIN™) в расположенную под ним строму, и стандарты этого лечения нормализуют к этим условиям. Согласно мнению сторонников этого метода, удаление эпителиального слоя необходимо для обеспечения (гарантии) наилучшей адсорбции раствора рибофлавина внутрь роговичной стромы и тем самым максимальной эффективности лечения.
К сожалению, удаление роговичного эпителия может вызвать зуд и жжение в глазах на следующий день после лечения и в последующие дни и временную нечеткость изображения; эти симптомы общеизвестны и сохраняются до восстановления роговичного эпителия и обычно лечатся в дни после C3-R [4-7] глазными каплями, содержащими нестероидные противовоспалительные препараты (НСПВС, NSAID), глазными каплями на основе заменителей натуральных слез и анальгетиков и применением терапевтических контактных линз.
Некоторые авторы доказывают, что можно осуществлять лечение C3-R по стандартной методике без удаления роговичного эпителия и что такое лечение будет эффективным и безопасным, как показывают полученные клинические результаты. Согласно этому методу лечение следует проводить без предварительного удаления роговичного эпителия (деэпителизации). Целью является избежать свойственных первому методу болезненных ощущений у пациентов, вызванных удалением эпителия, провести лечение в амбулаторных условиях и, в особенности, избежать риска послеоперационных инфекций, характерных для лечения, которое предполагает удаление эпителия с последующим обнажением нижних слоев роговицы. Сторонники такого способа осуществления лечения предлагают вводить рибофлавин в глаз (орошать глаз) в течение более продолжительного времени для обеспечения лучшей адсорбции рибофлавина в строму перед УФ-А-облучением [8].
Относительно того, удалять или нет эпителий при лечении кератоконуса и эктазии роговицы методом кросс-линкинга, в литературе имеются противоположные мнения.
С3-R лечение изучали и осуществляли после удаления роговичного эпителия с целью способствовать проникновению рибофлавина в строму роговицы. По имеющимся у авторов сведениям в литературе нет никакой информации об исследованиях по определению, проникает ли рибофлавин и в какой степени проникает в строму роговицы [9] при удалении или без удаления роговичного эпителия.
Осуществление кросс-линкинга без предварительной деэпителизации критикуется многими авторами, которые утверждают, что при таком способе рибофлавин не проходит через эпителий и что пока не показано, эффективно ли проникает или не проникает, а если проникает, то насколько, стандартный 0.1% раствор рибофлавин- декстрана в строму роговицы без удаления эпителия, и так же ли эффективно УФ-А облучение при трансэпителиальном способе, как и после удаления роговичного эпителия.
После попыток найти эффективные вещества для лечения кератоконуса методом кросс-линкинга без удаления роговичного эпителия Dr. Sporl предложил [17] использовать бензалкония хлорид для повышения проницаемости эпителия, а Dr. Pinelli предложил использовать смеси поверхностно-активных веществ с рибофлавином.
В итальянской патентной заявке No. MI2007A002162 [16] раскрывается новый раствор для лечения кератоконуса методом трансэпительного кросс-линкинга, содержащий рибофлавин и бензалкония хлорид.
Эксперименты, проведенные заявителями на роговице человека, результаты которых показаны ниже в данном описании, приводят к заключению, что второй метод, осуществляемый с применением стандартного раствора или композиции, предложенной Dr. Pinelli [16], не позволяет преодолеть трудности, вызванные удалением роговичного эпителия, так как он может разрушаться, при этом повышается риск инфицирования и изменения механизмов восстановления (репарации), которому подвергаются раскрытые (экспонированные) нижние слои.
Для осуществления кросс-линкинга роговицы было бы желательно иметь композицию, содержащую рибофлавин, которая могла бы проникать через роговичный эпителий за относительно короткое время и которая не поражала бы роговичный эпителий, что позволило бы избежать послеоперационных симптомов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Заявители провели тщательное исследование с целью определить, насколько рибофлавин проникает самостоятельно или в смеси с другими продуктами ("энхансерами проницаемости") через роговицу человека с предварительным удалением или без предварительного удаления роговичного эпителия, а также эффективность и безопасность последующего лечения с применением УФ-А-облучения.
Было идентифицировано несколько подходящих веществ, выбранных из группы, состоящей из незаменимых и условно незаменимых (таких как аргинин, цистеин, глицин, глутамин, гистидин, пролин, серии и тирозин) аминокислот, кофермента Q, витамина E, L-пролина, глицина, лизина гидрохлорида, L-лейцина, L-аргинина и соединений, предназначенных для стимуляции продуцирования металлопротеиназы ММР9, более подробно рассмотренных ниже в данном описании, которые можно эффективно применять в качестве носителей ("энхансеров проницаемости") в офтальмологических растворах, пригодных для введения рибофлавина, в частности, со стандартным раствором рибофлавин-декстрана, через эпителий роговицы. Полученные таким образом офтальмологические растворы, которые могут продаваться в виде глазных капель, или в виде геля, или в виде водных растворов или эмульсий, или наносится на терапевтические контактные линзы, можно применять для лечения кератоконуса методом трансэпителиального кросс-линкинга, тем самым сохраняя роговичный эпителий.
Офтальмологические растворы могут в конечном счете содержать эксципиенты, например, такие как уксусная кислота, или вышеуказанные вещества перед смешением с рибофлавином можно обрабатывать уксусной кислотой или другим эксципиентом.
Помимо этого, данное изобретение предлагает применение по меньшей мере одного вещества, выбранного из группы, состоящей из незаменимых и условно незаменимых аминокислот, кофермента Q, витамина Е, L-пролина, глицина, лизина гидрохлорида, L-лейцина, L-аргинина и соединений, предназначенных для стимуляции продуцирования металлопротеиназы ММР9, более подробно рассмотренных ниже в данном описании, для приготовления офтальмологического раствора, содержащего рибофлавин, предназначенного для защиты внутренних структур глазного яблока от УФ-А-излучения или для лечения кератоконуса методом трансэпителиального кросс-линкинга и с применением соответствующего офтальмологического раствора, содержащего рибофлавин, в качестве носителя ("энхансера проницаемости") в композиции, пригодной для введения рибофлавина через роговичный эпителий.
Далее настоящее изобретение предлагает способ приготовления офтальмологического раствора, заключающийся в добавлении к раствору рибофлавина по меньшей мере одного из идентифицированных выше носителей.
Каждое из предлагаемых в качестве носителя веществ можно добавлять самостоятельно или в комбинации с другими предлагаемыми носителями к раствору, содержащему рибофлавин, в концентрациях, выбранных в интервалах концентраций, указанных в нижеприведенном описании типичных вариантов изобретения.
Объем изобретения определяется в прилагаемой Формуле изобретения.
КРАТКОЕ ОПИСАНИЕ ФИГУР
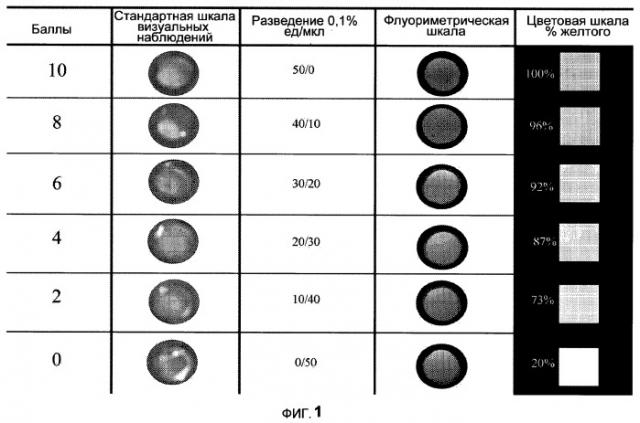
На Фиг.1 представлена визуальная, флуорометрическая, колориметрическая оценочная шкала, принятая для оценки прохождения 0.1% раствора рибофлавина через роговицу после нанесения трансэпителиальным способом.
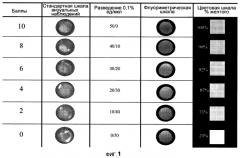
На Фиг.2а представлено флуороскопическое изображение среза роговицы, на которую трансэпителиальным способом наносят четвертую тестируемую (тест-) композицию (орошают ею), через 15 минут.
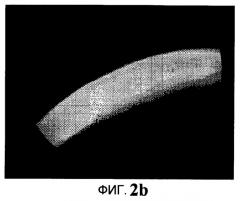
На Фиг.2b представлено флуороскопическое изображение среза роговицы, на которую трансэпителиальным способом наносят четвертую тестируемую (тест-) композицию, через 30 минут.
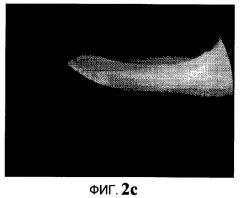
На Фиг.2c представлено флуороскопическое изображение среза роговицы, пролеченной методом трансэпителиального кросс-линкинга с применением четвертого нового раствора, на котором после обработки можно обнаружить интенсивную флуоресценцию вследствие прохождения четвертой композиции и релевантную жесткость ткани.
На Фиг.3а показана степень искривления роговицы, пролеченной трансэпителиальным кросс-линкингом с применением стандартного раствора.
На Фиг.3b показана степень искривления роговицы, пролеченной трансэпителиальным кросс-линкингом с применением четвертого нового тест-раствора.
На Фиг.4 представлено изображение, сделанное с помощью сканирующего микроскопа, на котором видны ламеллы в срезе роговицы, пораженной кератоконусом.
На Фиг.5 представлено сделанное с помощью сканирующего микроскопа увеличенное изображение роговицы на Фиг.4.
На Фиг.6 представлено изображение, сделанное с помощью сканирующего микроскопа, на котором видны ламеллы в срезе роговицы, пораженной кератоконусом, после трансэпителиального кросс-линкинга, проведенного с применением четвертой новой тестируемой композиции.
На Фиг.7 представлено изображение, сделанное с помощью сканирующего микроскопа, на котором показана морфология микроворсинок и поверхностных слоев эпителия в здоровой (нормальной) роговице.
На Фиг.8 представлено изображение, сделанное с помощью сканирующего микроскопа, на котором показана роговица, пролеченная стандартной дозой УФ-А-облучения после трансэпителиального нанесения стандартного 0.1% раствора рибофлавин-декстрана.
На Фиг.9 представлено изображение, сделанное с помощью сканирующего микроскопа, на котором показана роговица, пролеченная стандартной дозой УФ-А-облучения после трансэпителиального нанесения четвертой новой тестируемой композиции.
На Фиг.10 представлено изображение, сделанное с помощью сканирующего микроскопа, на котором показана роговица, пролеченная стандартной дозой УФ-А-облучения после трансэпителиального нанесения физиологического раствора.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Все испытания проводят на человеческой роговице доноров, полученной из Azienda Ospedaliera Napoli 1 - Banca Occhi ("Eye Bank") - Regione Campania - Ospedale dei Pellegrini, после согласия, как предусмотрено протоколом эксплантации и в соответствии с разрешением Комиссии по этике - No. 0009304/2009 - Решение No.1269.
Наблюдают проникновение (пенетрацию) испытуемых композиций через целую человеческую роговицу, т.е. без предварительного удаления эпителия, причем роговица имеет толщину между 500 и 600 микрон, композиции представляют собой стандартный раствор рибофлавин-декстрана, композицию, приготовленную из рибофлавина-декстрана плюс бензалкония хлорид, предлагаемую в [16] и [17], и новые тестируемые (тест-) композиции, полученные смешением рибофлавина по меньшей мере с одним веществом, выбранным из группы, включающей витамин E, кофермент Q, L-пролин, глицин, лизина гидрохлорид, L-лейцин, в определенных концентрациях.
Концентрации веществ, используемые для создания (осуществления) новых тестируемых композиций, составляют следующие интервалы:
витамин Е: интервал концентраций составляет от 0.0001 мг % мл до 2000 мг % мл. Согласно более предпочтительному варианту изобретения интервалы концентраций составляют от 0.01 мг % до 1500 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 10 мг % мл до 1000 мг % мл. Согласно еще более предпочтительному варианту изобретения концентрация равна, примерно, 500 мг % мл;
витамин Q: интервал концентраций составляет от 0.0001 мг % мл до 2000 мг % мл. Согласно более предпочтительному варианту изобретения интервалы концентраций составляют от 0.01 мг % до 1500 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 1 мг % мл до 1000 мг % мл. Согласно еще более предпочтительному варианту изобретения концентрация равна, примерно, 100 мг % мл;
L-пролин: интервал концентраций составляет от 0.0001 мг % мл до 2000 мг % мл. Согласно более предпочтительному варианту изобретения интервалы концентраций составляют от 0.001 мг % до 100 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.005 мг % мл до 10 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.01 мг % мл до 1 мг % мл. Согласно еще более предпочтительному варианту изобретения концентрация равна, примерно, 0.1 мг % мл;
глицин: интервал концентраций составляет от 0.0001 мг % мл до 2000 мг % мл. Согласно более предпочтительному варианту изобретения интервалы концентраций составляют от 0.001 мг % до 100 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.005 мг % мл до 10 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.01 мг % мл до 1 мг % мл. Согласно еще более предпочтительному варианту изобретения концентрация равна, примерно, 0.1 мг % мл;
лизина гидрохлорид: интервал концентраций составляет от 0.0001 мг % мл до 2000 мг % мл. Согласно более предпочтительному варианту изобретения интервалы концентраций составляют от 0.001 мг % до 100 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.005 мг % мл до 10 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.01 мг % мл до 1 мг % мл. Согласно еще более предпочтительному варианту изобретения концентрация равна, примерно, 0.05 мг % мл;
L-лейцин: интервал концентраций составляет от 0.0001 мг % мл до 2000 мг % мл. Согласно более предпочтительному варианту изобретения интервалы концентраций составляют от 0.001 мг % до 100 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.005 мг % мл до 10 мг % мл. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.01 мг % мл до 1 мг % мл. Согласно еще более предпочтительному варианту изобретения концентрация равна, примерно, 0.08 мг % мл.
Новые растворы, применимые для лечения кератоконуса методом трансэпителиального кросс-линкинга или для защиты глазного яблока от УФ-А-излучения, получают смешением одного или нескольких вышеописанных веществ в указанных интервалах концентраций, с раствором, содержащим рибофлавин, например с раствором рибофлавин-декстрана в концентрации, выбранной из интервала концентраций от 0.0001% до 0.5%. Согласно более предпочтительному варианту изобретения интервалы концентраций раствора рибофлавин-декстрана составляют от 0.001% до 0.4%. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют от 0.005% до 0.3%. Согласно еще более предпочтительному варианту изобретения интервалы концентраций составляют, примерно, от 0.01% до 0.2%. Согласно еще более предпочтительному варианту изобретения концентрация равна, примерно, 0.1%.
Результаты испытаний показывают, что каждое из веществ идентифицированной группы применимо для содействия проникновению (пенетрации) рибофлавина и, в частности стандартного раствора рибофлавин-декстрана, через эпителий роговицы и для защиты роговицы от УФ-А-излучения.
Роговицу, применяемую (принимаемую во внимание) в испытании, отбракованную в банке роговицы из-за непригодности для трансплантации, хранят в соответствующих растворах, а перед испытаниями ее снова проверяют методом оптической микроскопии и путем изучения эндотелиальных клеток.
Используют только роговицу с высокой прозрачностью, толщиной в интервале от 500 до 600 микрон, с хорошей эндотелиальной мозаикой, в соответствии с тем, что предлагается в [10-15].
Роговицу располагают таким образом, чтобы накрыть цилиндрическую камеру, содержащую 0.4 мл заданного (предварительно определенного) раствора гиалуроната натрия плюс ксантановая камедь. На поверхность роговицы накладывают водозащитное герметизирующее металлическое кольцо того же диаметра, что и цилиндрический бокс. Затем на поверхность роговицы наносят испытуемые композиции, содержащие флуоресцентное вещество (рибофлавин). Измеряя флуоресценцию раствора внутри бокса в различные моменты, можно определить, какой объем новых растворов проникает в роговицу и какое время затрачивается на это.
Эффективность указанных веществ в качестве носителей в композициях для трансэпителиального введения рибофлавина и композиций, полученных смешением рибофлавина по меньшей мере с одним из указанных веществ, описывают на нижеприведенных примерах испытаний, только для иллюстрации, а не с целью ограничения.
Для краткости описываются только результаты испытаний, полученные при обработке роговицы следующими композициями:
1) стандартным 0.1% раствором рибофлавин-декстрана;
2) стандартным 0.1% раствором рибофлавин-декстрана+0.01% бензалкония хлорида в соответствии с [16];
3) первой новой тестируемой композицией, содержащей 0.1% рибофлавин-декстран+витамин E TPGS (D-альфа токоферил полиэтиленгликоль 1000 сукцинат) в концентрации 500 мг % мл;
4) второй новой тестируемой композицией, содержащей 0.1% рибофлавин-декстран+витамин Q 100 мг % мл;
5) третьей новой тестируемой композицией, содержащей 0.1% рибофлавин декстран+L-пролин 0.1 мг %+глицин 0.1 мг %, лизина гидрохлорид 0.05 мг %+L-лейцин 0.08 мг %;
6) четвертой новой тестируемой композицией, содержащей 0.1% рибофлавин-декстран+витамин Е (D-альфа токоферил полиэтиленгликоль 1000 сукцинат) 500 мг % мл+витамин Q 100 мг % мл+L-пролин 0.1 мг %+глицин 0.1 мг %+лизина гидрохлорид 0.05 мг %+L- лейцин 0.08 мг %.
Каждую из шести указанных композиций наносят на поверхность роговицы, выбранной и размещенной, как описано выше, и через 15 минут и через 30 минут оценивают пропитывание стромы роговицы вместе с присутствием флуоресцентного вещества в растворе гиалуроната натрия+ксантановая камедь 0.4 мл, помещенном внутрь контейнера под обрабатываемой роговицей.
Определение проникновения рибофлавина в строму роговицы проводят, делая срезы стромы с последующей оценкой под флуоресцентным микроскопом.
Присутствие рибофлавина в растворе гиалуроната натрия+ксантановая камедь 0.4 мл, которое демонстрирует проникновение через роговицу, оценивают как качественно, используя визуальную и флуоресцентную шкалу, как показано на Фиг.1, так и количественно по колориметрической шкале. Две цифры около каждого образца цвета обозначают соответственно число частей стандартного раствора рибофлавина, которое дает показанный цвет, и число частей раствора ксантановой камеди и гиалуроната натрия. Стандартную шкалу определяют, готовя разведения раствора рибофлавин- декстран 0.1% с ксантановой камедью+гиалуронатом натрия в следующих пропорциях (единицы/мл): 50/0, 40/10, 30/20, 20/30, 10/40, 0/50. Готовят визуальную шкалу и флуориметрическую шкалу, соответствующие определенным значениям в единицах/мл, и каждое разведение оценивают в баллах от 10 до 0. На колориметрической шкале предполагается минимальное процентное содержание желтого, равное 20% в отсутствие рибофлавина, оно соответствует колориметрическому спектру вещества, выбранного в качестве разбавителя.
Оценку по визуальной шкале проводят в условиях стандартного освещения путем непосредственного сравнения экспериментальных образцов со стандартным образцом и методом цифровой фотографии. Флуориметрическую оценку проводят с помощью флуоресцентного сканирующего микроскопа, снабженного цифровой фотокамерой, в темной комнате. Относительную оценку по визуальной и колориметрической шкале проводит третий исследователь на основании средних значений, полученных двумя методами.
Колориметрическую оценку осуществляют, помещая материал, имеющийся в конце эксперимента, внутрь цилиндрической камеры (и, следовательно, под роговицу) в прозрачную тару, и с помощью компьютерного анализа, сканируя при высоком разрешении предварительно определенные (готовые) растворы и оценивая процентное содержание желтого цвета с применением программы Photoshop™ 7.0 и монохромного фильтра. Таким способом можно сравнивать детектируемое процентное содержание желтого цвета в экспериментальных образцах с точно определенными концентрациями, выражаемыми в ед./мл, стандартного 0.1% раствора рибофлавина, как показано на Фиг.1.
На Фиг.2а представлено флуороскопическое изображение среза роговицы, обработанной методом трансэпителиального кросс-линкинга, после нанесения четвертого нового раствора (орошения четвертым новым раствором) в течение 15 минут. На Фиг.2b представлено флуороскопическое изображение среза роговицы, обработанной методом трансэпителиального кросс-линкинга, после нанесения четвертого нового раствора (орошения четвертым новым раствором) в течение 30 минут. На Фиг.2с представлено флуороскопическое изображение среза роговицы, обработанной методом трансэпителиального кросс-линкинга четвертым новым раствором. На этой последней фигуре можно заметить, что рибофлавин проник по всей роговице и что после кросс-линкинга ткань стала более жесткой.
Проведенные испытания показывают, что:
а) после 15 минут трансэпителиального нанесения (орошения) стандартного 0.1% раствора рибофлавин-декстрана строма роговицы частично пропитана, а флуоресцентный раствор не обнаруживается в веществе внутри контейнера, причем колориметрический спектр налагается на спектр (совместим со спектром) раствора гиалуронат натрия+ксантановая камедь 0.4 мл (оценка 0, как на Фиг.1 и процентное содержание желтого цвета на выше 20%);
б) после 30 минут трансэпителиального нанесения (орошения) стандартного 0.1% раствора рибофлавин-декстрана строма роговицы, по- видимому, полностью пропитана флуоресцентным раствором; можно оценить флуоресценцию в растворе гиалуронат натрия+ксантановая камедь 0.4 мл в контейнере 2- 3 баллами (Фиг.1), а процентное содержание желтого цвета, определенное вышеуказанным компьютерным методом, находится в диапазоне 75%- 80%;
в) после 15 минут трансэпителиального нанесения (орошения) первого нового тест-раствора (испытуемого, тестируемого раствора) 0.1% рибофлавин-декстран+витамин E TPGS (D-альфа-токоферил полиэтиленгликоль 1000 сукцинат) в концентрации 500 мг % мл, роговица полностью пропитана и внутри контейнера имеется флуоресцентный раствор (оценка 2-3 на Фиг.1, процентное содержание желтого цвета составляет 72-76%);
г) после 30 минут трансэпителиального нанесения (орошения) первого нового тест-раствора все слои роговицы полностью пропитаны, а внутри контейнера наблюдается высокая концентрация рибофлавина, что демонстрирует хорошую проницаемость ткани роговицы для самого продукта при контакте с поверхностью (оценка 3- 4 на Фиг.1, процентное содержание желтого цвета составляет 79- 84%);
д) композиция, предложенная в [16], и новые тест-растворы второй и третий, содержащие, соответственно: бензалкония хлорид 0.01%; витамин Q 100 мг % мл; L-пролин 0.1 мг %, глицин 0.1 мг %, лизина гидрохлорид 0.05 мг % и L-лейцин 0.08 мг %, демонстрируют, в тех же самых условиях, лучшее проникновение (пенетрацию) рибофлавина как в количественном отношении, так и с точки зрения скорости проникновения, чем один стандартный раствор (рибофлавин- декстран 0.1%) (оценка 3-4 на Фиг.1 через 15 минут и оценка 4-6 через 30 минут, с процентным содержанием желтого цвета 70-79% через 15 минут и 78-86% через 30 минут);
е) четвертая новая тестируемая композиция дает результаты, даже превосходящие результаты всех других тестируемых композиций. Различные концентрации окрашивающего вещества, обнаруживаемые с помощью флуоресценции и компьютерным анализом флуоресцентного вещества внутри контейнера после 15 минут и после 30 минут нанесения (орошения) продукта на поверхность эпителия, являются исключительно высокими (оценка 5- 6 на Фиг.1 через 15 минут, процентное содержание желтого цвета составляет 88- 91%; оценка 6-7 через 30 минут, содержание желтого цвета выше 90%»); более высокая концентрация флуоресцентного вещества в растворе, находящемся под роговицей, после трансэпителиального применения (орошения) четвертого нового тестируемого раствора (тест-раствора) становится, в частности, очевидной через 15 минут, в особенности по сравнению с результатами, полученными при применении стандартного раствора, который даже не обнаруживается в растворе внутри контейнера через то же самое время. Это можно объяснить, если предположить, что энхансеры проницаемости, при совместном применении (при смешении), проявляют синергический эффект, способствуя прохождению рибофлавина через роговичный эпителий.
Проиллюстрированные результаты показывают, что по меньшей мере следующие вещества:
- витамин E
где R1 обозначает CH3 или Н; R2 обозначает CH3 или Н; R3 обозначает CH3; можно привести, только в качестве примера витамин Е TPGS (D- альфа-токоферил полиэтиленгликоль 1000 сукцинат);
- кофермент Q
в окисленной форме,
в форме полухинона,
в восстановленной форме,
независимо от числа изопреноидных звеньев кофермента Q; только в качестве примера можно привести кофермент Q10;
- L- пролин
;
- глицин
;
- лизин
или лизина гидрохлорид;
- L-лейцин
;
самостоятельно или в их комбинации друг с другом, в конечном счете в комбинации с эксципиентами, такими как уксусная кислота, и в концентрации, выбранной в указанных выше интервалах, способствуют проникновению (пенетрации) рибофлавина через эпителий роговицы за более короткие временные интервалы, нежели временные интервалы, требующиеся для стандартного раствора рибофлавин-декстрана, и в количествах, достаточных для последующего кросс-линкинга.
Комбинация всех указанных соединений с рибофлавином проявляет неожиданный синергический эффект, давая лучшие результаты с точки зрения концентрации продукта, который проходит через ткани роговицы, и с точки зрения скорости, с которой он проникает через эти ткани.
Заявители проверяют in vitro эффективность трансэпителиального кросс-линкинга на человеческой роговице, нанося четвертую новую тестируемую композицию на человеческую роговицу и облучая УФ-А-лучами при потоке мощности 3 мВт/см в соответствии со стандартным протоколом. Роговицу для испытания готовят как в предыдущем эксперименте, фиксируя ее на соответствующей опоре и нанося (орошение) стандартный 0.1% раствор рибофлавин-декстрана и четвертую новую тестируемую композицию на поверхность эпителия (т.е. трансэпителиально) соответствующей роговицы в течение тридцати минут. Затем проводят стандартное УФ-А-облучение в течение тридцати минут, облучение проводят ступенчато (постадийно), по 5 минут стадия, с предшествующим повторным нанесением каждого раствора на поверхность роговицы. В конце эксперимента степень жесткости роговицы оценивают следующим образом: каждую роговицу поддерживают за концевой участок длиной 2 мм пинцетом для роговицы, находящимся в горизонтальном положении, и измеряют угол, образованный противоположным концом роговицы относительно горизонтали.
На Фиг.3а показана роговица после трансэпителиального кросс-линкинга, проводимого с применением стандартного 0.1% раствора рибофлавин-декстрана, которая изгибается вниз, примерно, на 40°, а на Фиг.3b показана другая роговица после кросс-линкинга, проводимого с применением четвертой новой тестируемой композиции и без предварительного удаления эпителия роговицы. При сравнении двух фигур становится очевидным, что трансэпителиальный кросс-линкинг с применением четвертой новой тестируемой композиции укрепляет роговицу, которая изгибается книзу только на 25°, что и требовалось.
Для дополнительного подтверждения эффективности трансэпителиального кросс-линкинга с применением четвертой новой тестируемой композиции этот метод лечения осуществляют in vitro на концевых участках человеческой роговицы от больных с кератоконусом, которые подверглись перфоративной кератопластике; в этих случаях вместо уничтожения роговицы, эксплантированной у пациента, ее использовали в лаборатории, обратив внимание на то, что в этом случае избегают диатермии в ходе операции, так что сохраняются поверхности слоев роговицы (трансплантация полной толщины). Лимбы (края) роговиц фиксируют на подходящей опоре. Стандартный 0.1% раствор рибофлавин-декстрана наносят на первую роговицу, а четвертый новый тестируемый раствор наносят на вторую роговицу, орошая поверхность роговиц растворами в течение тридцати минут без удаления эпителия. Затем осуществляют стандартное 340 нм УФ-А-облучение только роговицы, обработанной четвертым тестируемым раствором с потоком мощности 3 мВт/см в течение тридцати минут, разделенные на стадии по 5 минут каждая с предшествующим повторным нанесением композиции на поверхность роговицы. Другой концевой участок кератоконуса, фиксированный на подходящей подложке, обрабатывают только нанесением на роговицу стандартного раствора 0.1% рибофлавин- декстрана без последующего УФ-А-облучения. По окончании эксперимента проводят изучение паренхимы роговицы под сканирующим электронным микроскопом.
На Фиг.4 показано изображение ламелл среза роговицы пациента с непролеченным (необработанным) кератоконусом под сканирующим микроскопом. На Фиг.5 дано увеличенное изображение фрагмента Фиг.4. Эти две фигуры показывают ослабление ламелл на концевом участке роговицы, на которую наносят стандартный 0.1% раствор рибофлавин-декстрана, без УФ-А-облучения.
На Фиг.6 дано изображение под сканирующим микроскопом, на котором видно, как выглядят ламеллы среза роговицы, пораженной кератоконусом, после трансэпителиального кросс-линкинга с применением нового четвертого тестируемого раствора. Концевой участок кератоконуса (конической роговицы), пролеченного четвертым новым раствором, применяемым трансэпителиально, и УФ-А-облучением согласно стандартному протоколу, в течение тридцати минут, демонстрирует очень плотно (густо) распределенные и компактные ламеллы роговицы, которые показывают, что образовались новые биохимические поперечные связи.
Хорошие результаты получены также с новыми тестируемыми композициями первой, второй и третьей. Полученные результаты с применением новых тест-композиций также опровергают возражения некоторых авторов, заявляющих о гипотетическом ослаблении эффекта кросс-линкинга при осуществлении его трансэпителиальным методом, так как эпителий задерживает УФ-А-лучи. Предположение о снижении эффективности трансэпителиального кросс-линкинга неверно, как доказывают гистологические образцы, полученные в случае, когда к рибофлавину в качестве носителя (энхансера проницаемости) добавляют по меньшей мере одно из предлагаемых в данном описании веществ и облучение проводят в соответствии со стандартным протоколом.
Помимо этого, с помощью сканирующего электронного микроскопа (7500х) проводят сравнительное исследование действия трансэпителиального кросс-линкинга на морфологическую целостность или отсутствие целостности эпителиальных слоев роговицы и микроворсинок на поверхности эпителиальных клеток. Это исследование осуществляют с целью оценки переносимости трансэпителиального кросс-линкинга с применением четвертой новой тестируемой композиции на эпителии роговицы по сравнению со стандартным 0.1% раствором рибофлавин-декстрана и со смесью стандартная композиция+бензалкония хлорид 0.01%, предлагаемой в [16].
Этот тест проводят потому, что эпителиальные клетки представляют собой первые органические структуры, облучаемые потоком УФ-А, и могут поражаться вследствие поглощения этих лучей. По-видимому, ни в одной из имеющихся публикаций не рассматривается этот аспект, и в литературе отсутствуют соответствующие данные.
Показатели, рассматриваемые как наиболее надежные для оценки жизнеспособности эпителиальных клеток, получают в ходе цитологического исследования "впечатления", "оттиска" и, в частности, исследования под электронным микроскопом микроворсинок клеток поверхностного слоя эпителия роговицы. Наличие внешних изгибов мембраны (микроворсинок) цельных поверхностных клеточных элементов, содержащих в высокой концентрации муцины и достаточно гликокаликса, способствует оптимальному связыванию свободного муцина, из которого состоит глубокий слой предроговичной слезной пленки. Напротив, обусловленная болезнью (патологическая) утрата микроворсинок определяет трудность адгезии слоя слезной пленки к поверхности глаза и явления раздражения эпителия, вызванные дисфункцией самой предроговичной слезной пленки и, как следствие, воспаление.
Морфологию микроворсинок изучают под сканирующим электронным микроскопом после трансэпителиальной обработки in vitro УФ-А-лучами в соответствии со стандартными