Препарат инсулина, содержащий метионин
Иллюстрации
Показать всеГруппа изобретений относится к области фармацевтики, а именно к водной фармацевтической композиции, содержащей инсулин, аналог инсулина или производное инсулина и метионин; а также к способу ее получения, применению для лечения сахарного диабета и к лекарственному средству для лечения сахарного диабета. Группа изобретений обеспечивает стабильность указанных белков в растворе. 6 н. и 23 з.п. ф-лы, 10 пр., 6 ил.
Реферат
Изобретение относится к водной фармацевтической композиции, содержащей инсулин, аналог инсулина или производное инсулина и метионин; а также к способу ее получения, применению для лечения сахарного диабета и к лекарственному средству для лечения сахарного диабета.
Во всем мире все большее количество людей страдает от сахарного диабета. В том числе все больше так называемых диабетиков I типа, для которого заместительная терапия недостаточной эндокринной секреции инсулина является единственным возможным лечением. Пациентам пожизненно, как правило, несколько раз в день, предписаны инъекции инсулина. В противоположность диабету I типа при диабете II типа недостаток инсулина не является принципиальным, однако во множестве случаев, прежде всего на прогрессирующей стадии, лечение инсулином, при необходимости в комбинации с оральными антидиабетическими средствами, рассматривают как благоприятную форму лечения. У здорового человека высвобождение инсулина поджелудочной железой строго связано с концентрацией глюкозы в крови. Повышенный уровень глюкозы в крови, который образуется после еды, вскоре компенсируется соответствующим повышением секреции инсулина. В состоянии натощак уровень инсулина падает до самого низкого значения, которого хватает, чтобы гарантировать непрерывное снабжение чувствительных к инсулину органов и тканей глюкозой и держать выработку глюкозы в печени ночью на низком уровне. Возмещением физиологической секреции инсулина экзогенной, в большинстве случаев подкожным введением инсулина, как правило, не достигают вышеописанного качества физиологического регулирования уровня глюкозы в крови. Часто доходит до бесконтрольного повышения или понижения уровня глюкозы в крови, которые могут вызывать угрозу для жизни в самых тяжелых формах. Однако наряду с этим также повышенный в течение многих лет уровень глюкозы в крови без первоначальных симптомов представляет значительный риск для здоровья.
Крупномасштабное DCCT-исследование в USA (The Diabetes Control and Complications Trial Research Group (1993) N. Engl. J. Med. 329, 977-986) однозначно подтвердило, что хронически повышенный уровень глюкозы в крови является в значительной мере ответственным за развитие диабетических поздних осложнений. Диабетические поздние осложнения представляет собой микро- и макрососудистые повреждения, которые проявляют себя при известных обстоятельствах, таких как ретинопатия, нефропатия или невропатия, и могут приводить к потере зрения, почечной недостаточности, а так же к потере конечностей и, кроме того, сопровождаются повышенным риском для сердца и связанными с нарушением кровообращения болезнями. Из этого следует, что улучшение лечения диабета должно быть нацелено в первую очередь на то, чтобы удерживать уровень глюкозы в крови по возможности ближе к физиологической области. После программы усиленного инсулинового лечения, вышеуказанной цели необходимо достигать неоднократными ежедневными инъекциями быстро и замедленно действующих препаратов инсулина. Быстродействующие формы принимают перед приемом пищи для того, чтобы выравнивать возникающий после приема пищи подъем уровня глюкозы в крови. Замедленно действующий базальный инсулин должен обеспечивать основное снабжение инсулином, в частности ночью для исключения гипогликемии.
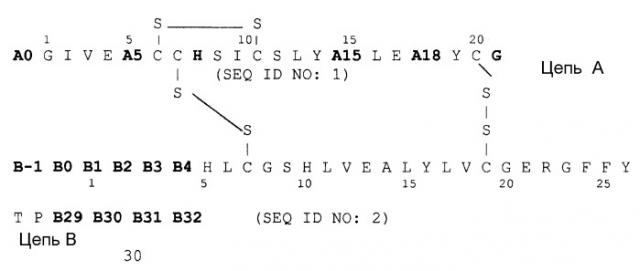
Инсулин представляет собой полипептид из 51 аминокислот, которые распределены на 2 аминокислотных цепи: цепь A из 21 аминокислоты и цепь B из 30 аминокислот. Цепи связаны друг с другом 2 дисульфидными мостиками. Препараты инсулина много лет применяют для лечения диабета. При этом применяют инсулин не только природного происхождения, а в последнее время также производные инсулина и его аналоги.
Аналоги инсулина представляют собой аналоги инсулина природного происхождения, а именно человеческого инсулина или инсулина животных, которые отличаются от, соответственно, в остальном такого же инсулина природного происхождения замещением по меньшей мере одного аминокислотного остатка природного происхождения остатком другой аминокислоты и/или добавлением/удалением по меньшей мере одного аминокислотного остатка. При этом может речь идти также об аминокислотах, которые не являются природными.
Производные инсулина представляют собой производные инсулина природного происхождения или аналога инсулина, которые получены химическим модифицированием. Химическое модифицирование может состоять, например, в добавлении одной или нескольких определенных химических групп к одной или нескольким аминокислотам. Как привило производные инсулина и аналоги инсулина оказывают по сравнению с человеческим инсулином немного измененное действие.
Аналоги инсулина с ускоренным наступлением действия описаны в EP 0214826, EP 0375437 и EP 0678522. EP 0124826 относится к замещению B27 и B28. EP 0678522 описывает аналоги инсулина, которые в положении B29 имеют различные аминокислоты, предпочтительно пролин, но не глютаминовую кислоту.
EP 0375437 охватывает аналоги инсулина с лизином или аргинином в B28, которые необязательно могут быть модифицированы в B3 и/или A21.
В EP 0419504 описаны аналоги инсулина, которые защищены от химической модификации, в которых изменены аспарагин в B3 и по меньшей мере одна дополнительная аминокислота в положениях A5, A15, A18 или A21.
Как правило, производные инсулина и аналоги инсулина имеют по сравнению с человеческим инсулином немного измененное действие.
В WO 92/00321 описаны аналоги инсулина, у которых по меньшей мере одна аминокислота в позициях B1-B6 заменена лизином или аргинином. Данные инсулины имеют согласно WO 92/00321 пролонгированное действие. Замедленное действие также имеют описанные в EP-A 0368187 аналоги инсулина. Программа усиленного инсулинового лечения пытается уменьшить риски для здоровья, в то время как стабильного контроля за уровнем сахара в крови добиваются ранним введением базального инсулина. Примером распространенного базального инсулина является препарат Lantus® (Действующее вещество: инсулин гларгин = Gly(A21),Arg(B31),Arg(B32) инсулин человека).
Принципиально, необходимо при разработке нового улучшенного базального инсулина минимизировать число гипогликемических явлений. При этом идеальный базальный инсулин, безусловно, должен действовать у каждого пациента по меньшей мере 24 часа. В идеальном варианте действие инсулина является замедленным и по возможности с ровным временем/профилем действия, так, чтобы минимизировать опасность внезапной гипогликемии и чтобы применение было возможно даже без предшествующего приема пищи. Хорошее обеспечение базальным инсулином происходит тогда, когда действие инсулина по возможности дольше остается неизменным, то есть тело обеспечивается постоянным количеством инсулина. Вместе с этим опасность гипогликемических явлений низка и нестабильность в зависимости от пациента и от времени дня минимизирована. Фармакокинетический профиль идеального базального инсулина должен отличаться замедленным началом действия и замедленным, то есть продолжительным и равномерным действием.
Имеющиеся в продаже препараты инсулина из инсулина природного происхождения для инсулинзаместительной терапии различаются в происхождении инсулина (например, инсулин крупного рогатого скота, инсулин свиньи, инсулин человека), а также составом, что может оказывать влияние на профиль действия (начало действия и время воздействия). Благодаря комбинации различных препаратов инсулина можно достигать различных профилей действия и устанавливать как можно более физиологические значения сахара крови. В настоящее время технология рекомбинации ДНК делает возможным получение данных модифицированных инсулинов. К ним причисляют инсулин гларгин (Gly(A21)-Arg(B31)-Arg(B32)-инсулин человека) с длительным временем воздействия. Инсулин гларгин вводят в виде кислого, чистого раствора, и затем он вследствие его растворимых свойств в физиологической области pH выпадает в подкожной ткани в виде стабильных ассоциатов гексамеров. Инсулин гларгин вводится один раз в день и отличается от других инсулинов длительного действия ровным профилем в жидкой фазе и связанным с этим уменьшением опасности ночных гипогликемий (Schubert-Zsilavecz et al., 2:125-130(2001)). Специальный препарат инсулина гларгина, который приводит к удлиненному времени воздействия, отличается от до сих пор описанных препаратов прозрачным раствором с кислым значением рН. Как раз при кислых значениях рН инсулины показывают сниженную стабильность и повышенную склонность к образованию агрегатов при термической и физико-механической нагрузке, которая может проявляться в виде помутнений и осадка (образование частиц) (Brange et al., J. Ph.Sci 86:517-525(1997)).
Было обнаружено, что такие аналоги инсулина приводят к описанным желаемым базальным профилям продолжительности и действия и при этом характеризуются следующими признаками:
- концы цепей B состоят из амидированных основных остатков аминокислот, таких как лизин или аргининамид, то есть в амидированном остатке аминокислоты в конце цепи B находится карбоксильная группа концевой аминокислоты в амидированной форме, и
- оканчивающиеся N остатки аминокислот цепей A инсулина представляют собой остатки лизина или аргинина, и
- положение аминокислоты A8 занято остатком гистидина, и
- положение аминокислоты A21 занято остатком глицина, и
- имеют два замещения нейтральных аминокислот кислыми аминокислотами, два присоединения отрицательно заряженных остатков аминокислот, в случае если данные замещения и присоединения произошли в каком-либо из положений A5, A15, A18, B-1, B0, B1, B2, B3 и B4.
Общее для всех водных составов инсулина, аналогов инсулина и производных инсулина то, что упомянутые белки не абсолютно стабильны химически, а в зависимости от времени, температуры хранения, перемещений, которым подвергается состав, и многого другого, в инсулине, аналогах инсулина и производных инсулина, может происходить ряд молекулярных процессов, которые отрицательно влияют на качество состава. Веществом, которое наносит вред химической стабильности инсулина, аналогов инсулина и производных инсулина, является кислород, контакт которого с соответствующими составами не предотвращен по причине присутствия кислорода в воздухе, в частности в случае составов в упаковках для многократного введения. Предполагают, что кроме всего, окислительный потенциал кислорода наносит вред химической стабильности.
Неожиданно было обнаружено, что добавление аминокислоты метионин к составам инсулина, аналогов инсулина и производных инсулина приводит к улучшению стабильности данных белков.
Поэтому объектом данного изобретения являются водные фармацевтические составы, содержащие инсулин, аналог инсулина или производное инсулина, или их фармакологически совместимые соли и метионин.
Следующим объектом данного изобретение является фармацевтическая композиция, как описано выше, причем инсулин выбирают из группы, содержащей инсулин человека, инсулин свиньи и инсулин крупного рогатого скота.
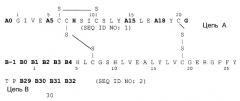
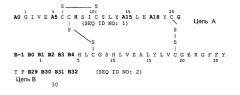
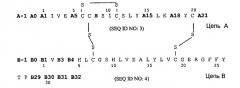
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, причем аналог инсулина выбирают из группы, состоящей из Gly(A21),Arg(B31),Arg(B32)-инсулин человека, Lys(B3),Glu(B29)-инсулин человека, Asp(B28)-инсулин человека, Lys(B28),Pro(B29)-инсулин человека, Des(B30)-инсулин человека и аналога инсулина формулы I
причем
A0 Lys или Arg;
A5 Asp, Gln или Glu;
A15 Asp, Glu или Gln;
A18 Asp, Glu или Asn;
B-1 Asp, Glu или аминогруппа;
B0 Asp, Glu или химическое соединение;
B1 Asp, Glu или Phe;
B2 Asp, Glu или Val;
B3 Asp, Glu или Asn;
B4 Asp, Glu или Gln;
B29 Lys или химическое соединение;
B30 Thr или химическое соединение;
B31 Arg, Lys или химическое соединение;
B32 Arg-амид, Lys-амид или аминогруппа
соответственно, причем два остатка аминокислоты в группе, содержащей A5, A15, A18, B-1, B0, B1, B2, B3 и B4 одновременно и независимо друг от друга соответствуют Asp или Glu, в частности аналог инсулина выбирают группы, которая включает:
Arg(A0), His(A8), Glu(A5), Asp(A18), Gly (A21), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Asp(A18), Gly(A21), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu (A15), Asp(A18), Gly(A21), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Asp(A18), Gly(A21), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Glu(A15), Gly(A21), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Glu(A15), Gly(A21), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Asp(B3), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Asp(B3), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Asp(B3), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Asp(B3), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Asp(B3), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Asp(B3), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Gly(A21), Asp(B3), Glu(B4), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Gly(A21), Asp(B3), Glu(B4), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Glu(B4), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Glu(B4), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Glu(B4), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Glu(B4), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Glu(B4), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Glu(B4), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Glu(B0), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Glu(B0), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Glu(B0), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Glu(B0), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Glu(B0), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Glu(B0), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Asp(B1), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A5), Gly(A21), Asp(B1), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Asp(B1), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Glu(A15), Gly(A21), Asp(B1), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Asp(B1), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Asp(B1), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Gly(A21), Glu(B0), Asp(B1), Arg(B31), Arg(B32)-NH2 инсулин человека,
Arg (A0), His(A8), Gly(A21), Glu(B0), Asp(B1), Arg(B31), Lys(B32)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Asp(B3), Arg(B30), Arg(B31)-NH2 инсулин человека,
Arg(A0), His(A8), Asp(A18), Gly(A21), Asp(B3), Arg(B30), Lys(B31)-NH2 инсулин человека.
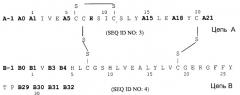
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, причем аналог инсулина выбирают из группы, которая состоит из аналогов инсулина формулы II
причем
A-1 Lys, Arg или аминогруппа;
A0 Lys, Arg или химическое соединение;
A1 Arg или Gly;
A5 Asp, Glu или Gln;
A15 Asp, Glu или Gln;
A18 Asp, Glu или Asn;
A21 Ala, Ser, Thr или Gly;
B-1 Asp, Glu или аминогруппа;
B0 Asp, Glu или химическое соединение;
B1 Asp, Glu, Phe или химическое соединение;
B3 Asp, Glu или Asn;
B4 Asp, Glu или Gln;
B29 Arg, Lys или аминокислота, которую выбирают группы, которая состоит из аминокислот Phe, Ala, Thr, Ser, Val, Leu, Glu или Asp, или химическое соединение;
B30 Thr или химическое соединение;
B31 Arg, Lys или химическое соединение;
B32 Arg-амид или Lys-амид
соответственно, причем не больше чем один остаток аминокислоты в группе, содержащей A5, A15, A18, B-1, B0, B1, B2, B3 и B4 одновременно и независимо друг от друга соответствует Asp или Glu, в частности аналог инсулина выбирают группы, которая включает:
Arg(A-1), Arg(A0), Glu(A5), His(A8), Gly(A21), Arg(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), Glu(A5), His(A8), Gly(A21), Lys(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), Glu(A15), His(A8), Gly(A21), Arg(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), Glu(A15), His(A8), Gly(A21), Lys(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), Asp (A18), His(A8), Gly(A21), Arg(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), Asp(A18), His(A8), Gly(A21), Arg(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Glu(B0), Arg(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Glu(B0), Lys(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Asp(B3), Arg(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Asp(B3), Lys(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Glu(B4), Arg(B30)-NH2 инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Glu(B4), Lys(B30)-NH2 инсулин человека,
Arg(A0), His(A8), Gly(A21), Arg(B31), Arg(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Arg(B31), Lys(B32)-NH2-инсулин человека,
Arg(A0), Glu(A5), His(A8), Gly(A21), Arg(B31), Arg(B32)-NH2-инсулин человека,
Arg(A0), Glu(A5), His(A8), Gly(A21), Arg(B31), Lys(B32)-NH2-инсулин человека,
Arg(A0), Asp(A18), His(A8), Gly(A21), Arg(B31), Arg(B32)-NH2-инсулин человека,
Arg(A0), Asp(A18), His(A8), Gly(A21), Arg(B31), Lys(B32)-NH2-инсулин человека,
Arg(A0), Glu(A15), His(A8), Gly(A21), Arg(B31),Arg(B32)-NH2-инсулин человека,
Arg(A0), Glu(A15), His(A8), Gly(A21), Arg(B31), Lys(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Asp(B3), Arg(B31), Arg(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Asp(B3), Arg(B31), Lys(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Glu(B4), Arg(B31), Arg(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Glu(B4), Arg(B31), Lys(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Glu(B0), Arg(B31), Arg(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Glu(B0), Arg(B31), Lys(B32)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Arg(B30)-NH2-инсулин человека,
Arg(A0), His(A8), Gly(A21), Lys(B30)-NH2-инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Arg(B30)-NH2-инсулин человека,
Arg(A-1), Arg(A0), His(A8), Gly(A21), Lys(B30)-NH2-инсулин человека,
Arg(A0), Arg(A1), His(A8), Gly(A21), Arg(B30)-NH2-инсулин человека,
Arg(A0), Arg(A1), His(A8), Gly(A21), Lys(B30)-NH2-инсулин человека,
His(A8), Gly(A21), Arg(B31), Arg(B32)-NH2-инсулин человека.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, причем производное инсулина выбирают из группы, которая состоит из B29-N-миристоил-des(B30) инсулин человека, B29-N-пальмитоил-des(B30) инсулин человека, B29-N-миристоил инсулин человека, B29-N-пальмитоил инсулин человека, B28-N-миристоил LysB28ProB29 инсулин человека, B28-N-пальмитоил-LysB28ProB29 инсулин человека, B30-N-миристоил-ThrB29LysB30 инсулин человека, B30-N-пальмитоил-ThrB29LysB30 инсулин человека, B29-N-(N-пальмитоил-γ-глутамил)-des(B39) инсулин человека, B29-N-(N-литохолил-γ-глутамил)-des(B30) инсулин человека, B29-N-(ω-карбоксигептадеканоил)-des(B30) инсулин человека и B29-N-(ω-карбоксигептадеканоил) инсулин человека.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, которая содержит
от 0,001 до 0,2 мг/мл цинка,
от 0,1 до 5,0 мг/мл консерванта и
от 5,0 до 100 мг/мл изотонизирующего средства, и значение рН которой равно 5 или меньше.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой консервант выбирают из группы, содержащей фенол, м-крезол, хлоркрезол, бензиловый спирт, парабены.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой изотонизирующее средство выбирают из группы, содержащей маннитол, сорбитол, лактозу, декстрозу, трегалозу, хлорид натрия, глицерин.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, со значением рН в области pH 2,5-4,5, предпочтительно pH 3,0-4,0, особенно предпочтительно pH около 3,75.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, причем инсулин, аналог инсулина и/или производное инсулина находятся в концентрации 240-3000 нмоль/мл.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой глицерин находится в концентрации от 20 до 30 мг/мл.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой глицерин находится в концентрации 25 мг/мл.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой м-крезол находится в концентрации от 1 до 3 мг/мл, предпочтительно 2 мг/мл.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой цинк находится в концентрации 0,01 или 0,03 или 0,08 мг/мл.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой дополнительно содержится глюкагоноподобный белок-1(GLP1) или его аналог или производное, или эксендин-3 или -4, или его аналог, или производное, предпочтительно эксендин-4.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой аналог эксендина-4 выбирают из группы, содержащей
H-desPro36-эксендин-4-Lys6-NH2,
H-des(Pro36,37)-эксендин-4-Lys4-NH2 и
H-des(Pro36,37)-эксендин-4-Lys5-NH2,
или их фармакологически совместимую соль, или в которой аналог эксендина-4 выбирают из группы, содержащей
desPro36[Asp28]эксендин-4(1-39),
desPro36[IsoAsp28]эксендин-4(1-39),
desPro36[Met(O)14,Asp28]эксендин-4(1-39),
desPro36[Met(O)14,IsoAsp28]эксендин-4(1-39),
desPro36[Trp(O2)25,Asp28]эксендин-2(1-39),
desPro36[Trp(O2)25,IsoAsp28]эксендин-2(1-39),
desPro36[Met(O)14Trp(O2)25,Asp28]эксендин-4(1-39) и
desPro36[Met(O)14Trp(O2)25,IsoAsp28]эксендин-4(1-39),
или их фармакологически совместимую соль.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой к C-концевому аналогу эксендина-4 присоединен белок -Lys6-NH2.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой аналог эксендин-4 выбирают из группы, содержащей
H-(Lys)6-desPro36[Asp28]эксендин-4(1-39)-Lys6-NH2
desAsp28Pro36,Pro37,Pro38эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Trp(О2)25,Asp28]эксендин-4(1-39)-Lys6-NH2,
H-desAsp28Pro36,Pro37,Pro38[Trp(О2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(О2)25,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(О2)25,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Trp(О2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Trp(О2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Trp(О2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Asp28]эксендин-4(1-39)-Lys6-NH2,
desMet(O)14Asp28Pro36,Pro37,Pro38эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-Lys6-NH2,
H-Asn-(Glu)5desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36[Met(O)14,Trp(О2)25,Asp28]эксендин-4(1-39)-Lys6-NH2,
desAsp28Pro36,Pro37,Pro38[Met(O)14,Trp(О2)25]эксендин-4(1-39)-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(О2)25,Asp28]эксендин-4(1-39)-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Asp28]эксендин-4(1-39)-NH2,
desPro36,Pro37,Pro38[Met(O)14,Trp(О2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-(Lys)6-desPro36,Pro37,Pro38[Met(O)14,Trp(О2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
H-Asn-(Glu)5-desPro36,Pro37,Pro38[Met(O)14,Trp(О2)25,Asp28]эксендин-4(1-39)-(Lys)6-NH2,
или их фармакологически совместимую соль.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, которая дополнительно содержит Arg34,Lys26(Nε(γ-глутамил(Nα-гексадеканоил))) GLP-1(7-37) [лираглутид] или его фармакологически совместимую соль.
Следующим объектом данного изобретения является фармацевтическая композиция, как описано выше, в которой метионин находится в области концентраций до 10 мг/мл, предпочтительно до 3 мг/мл.
Следующим объектом данного изобретения является способ получения описанного выше состава, в котором
(a) компоненты вводят в водный раствор и
(b) устанавливают значение рН.
Следующим объектом данного изобретения является применение описанной выше композиции для лечения сахарного диабета.
Следующим объектом данного изобретения является лекарственное средство для лечения сахарного диабета, состоящее из описанной выше композиции.
Далее, данная заявка подробно описана с помощью нескольких примеров, которые ни в коем случае не должны являться ограничительными.
Подписи к фигурам:
Фигура 1: Снижающее сахар в крови действие новых аналогов инсулина формулы I у крыс.
Фигура 2: Снижающее сахар в крови действие новых аналогов инсулина формулы I у собаки.
Фигура 3: Снижающее сахар в крови действие YKL205 у собаки.
Фигура 4: Зависимость от цинка гипогликемического действия YKL205 у собаки.
Фигура 5: Снижающее сахар в крови действие аналогов инсулина по изобретению формулы II у крыс.
Фигура 6: Снижающее сахар в крови действие инсулина гларгина у крыс.
Примеры:
Следующие примеры объясняют подробнее идею изобретения, не являясь ограничительными.
Пример 1: Исследование розлива раствора с применением азота, кислорода и розлив при нормальных условиях.
Получение раствора происходило таким образом: брали примерно 25% 0,1 M HCl и добавляли 0,2% концентрированного раствора полисорбата 20. Последовательно добавляли SAR161271 и концентрированный раствор хлорида цинка и перемешивали. Благодаря добавлению 1 M HCl до значения pH 2, SAR161271 растворялся. Раствор перемешивали, затем добавляли 1 M NaOH для установки значения pH 4,0. Водой для инъекций доводили состав до 90%. К раствору последовательно добавляли глицерин 85% и m-крезол при перемешивании. Водой для инъекций доводили состав до желаемого конечного веса. Раствор фильтровали шприцевым фильтром. Состав делили на три части: не обработанную газом (как эталон), обработанную азотом и обработанную кислородом (для сравнения). Обработку газом проводили как выдерживание с соответствующим газом.
Необработанный
Содержание SAR161271
1 M + 5°C: 3,67 мг/мл
1 M + 25°C: 3,46 мг/мл
1 M + 37°C: 3,41 мг/мл
Примеси
1 M + 5°C: 3,0%
1 M + 25°C: 3,6%
1 M + 37°C: 5,6%
Высокомолекулярные белки
1 M + 5°C: 0,2%
1 M + 25°C: 0,3%
1 M + 37°C: 1,4%
Обработанный азотом
Содержание SAR161271
1 M + 5°C: 3,73 мг/мл
1 M + 25°C: 3,50 мг/мл
1 M + 37°C: 3,35 мг/мл
Примеси
1 M + 5°C: 3,1%
1 M + 25°C: 3,5%
1 M + 37°C: 5,2%
Высокомолекулярные белки
1 M + 5°C: 0,2%
1 M + 25°C: 0,3%
1 M + 37°C: 1,2%
Обработанный кислородом
Содержание SAR161271
1 M + 5°C: 3,54 мг/мл
1 M + 25°C: 3,34 мг/мл
1 M + 37°C: 3,26 мг/мл
Примеси
1 M + 5°C: 3,2%
1 M + 25°C: 3,9%
1 M + 37°C: 7,2%
Высокомолекулярные белки
1 M + 5°C: 0,2%
1 M + 25°C: 0,5%
1 M + 37°C: 2,9%
Розлив с применением азота не показал после 1 месяца явного снижения количества примесей по сравнению с необработанной пробой.
Розлив с применением кислорода показал незначительное увеличение количества примесей и высокомолекулярных белков. На основе данных результатов выбрали розлив при нормальных условиях.
Пример 2: Исследование стабильности с 3 различными антиоксидантами.
Раствор получали как описано в примере 1. Дополнительно между добавлением глицерина 85% и м-крезола к композиции добавляли антиоксидаты метионин или глутатион, или аскорбиновую кислоту для того, чтобы снизить содержание побочных продуктов окисления. Композиции, которые содержали либо глутатион (0,183 мг/мл), либо аскорбиновую кислоту (0,105 мг/мл), показали уже через 3 месяца хранения явное изменение окраски. Содержащие метионин (0,089 мг/мл) композиции не показали какого-либо изменения окраски и были после 1 месяца хранения при 5°C стабильными.
Содержание SAR161271
1 M + 5°C: 3,43 мг/мл
1 M + 25°C: 3,43 мг/мл
1 M + 37°C: 3,53 мг/мл
Примеси
1 M + 5°C: 2,9%
1 M + 25°C: 3,4%
1 M + 37°C: 5,7%
Высокомолекулярные белки
1 M + 5°C: 0,2%
1 M + 25°C: 0,3%
1 M + 37°C: 1,1%
Пример 3: Состав амидированного производного инсулина.
Примеры 3-7 служат только для определения биологических, фармакологических и физико-химических свойств аналогов инсулина формулы I, сначала получали составы (пример 3) и затем производили соответствующие испытания (примеры 4-7). Из соединений получали растворы следующим образом: аналог инсулина по изобретению для получения заданной концентрации 240±5 мкМ растворяли в 1 мМ соляной кислоты с 80 мкг/мл цинка (в виде хлорида цинка).
В качестве растворителя применяли следующие составы:
a) 1 мМ соляной кислоты
b) 1 мМ соляной кислоты, 5 мкг/мл цинка (в виде хлорида цинка или с добавлением соляной кислоты)
c) 1 мМ соляной кислоты, 10 мкг/мл цинка (в виде хлорида цинка или с добавлением соляной кислоты)
d) 1 мМ соляной кислоты, 15 мкг/мл цинка (в виде хлорида цинка или с добавлением соляной кислоты)
e) 1 мМ соляной кислоты, 30 мкг/мл цинка (в виде хлорида цинка или с добавлением соляной кислоты)
f) 1 мМ соляной кислоты, 80 мкг/мл цинка (в виде хлорида цинка или с добавлением соляной кислоты)
g) 1 мМ соляной кислоты, 120 мкг/мл цинка (в виде хлорида цинка или с добавлением соляной кислоты).
Кроме того, для получения желаемой концентрации из лиофилизированного материала необходимо отвешивать массу, примерно на 30% большую основанной на молекулярной массе. После этого полученную концентрацию определяли с помощью аналитической HPLC (ВЭЖХ) и затем к раствору для достижения заданной концентрации добавляли необходимый объем с 5 мМ соляной кислоты и 80 мкг/мл цинка. В случае необходимости, значение рН устанавливали на значении 3,5±0,1. После окончательного анализа с помощью HPLC (ВЭЖХ), для обеспечения заданной концентрации 240±5 мкМ готовый раствор с помощью шприца с фильтрующей насадкой 0,2 мкм помещали в закрытый обжимным колпачком стерильный пузырек. Для краткосрочных, однократных исследований производных инсулина по изобретению никакой оптимизации составов, например, относительно добавления изотонических агентов, консервантов или буферных веществ, не производили.
Пример 4: Определение снижающего сахар в крови действия новых аналогов инсулина у крыс.
Снижающее сахар в крови действие выбранных новых аналогов инсулина проверяли на самцах здоровых, с нормальной гликемией крыс Вистар. Самцам крыс подкожно вводили дозу 9 нмоль/кг аналога инсулина. Непосредственно перед инъекциями аналога инсулина и с равномерными интервалами до восьми часов после инъекции у животных брали анализы крови и определяли содержание сахара в крови. Эксперимент явно показал (сравните, фигура 1), что введение аналога инсулина по изобретению приводит к явному замедлению начала действия и к продленному, равномерному времени воздействия.
Пример 5: Определение снижающего сахар в крови действия новых аналогов инсулина у собаки.
Снижающее сахар в крови действие выбранного нового аналога инсулина проверяли у здорового самца, с нормальной гликемией, собаки породы бигль. Самцу животного подкожно вводили дозу 6 нмоль/кг аналога инсулина. Непосредственно перед инъекциями аналога инсулина и с равномерными интервалами до сорока восьми часов после инъекции у животных брали анализы крови и определяли содержание сахара в крови. Эксперимент явно показал (сравните, фигура 2), что введение аналога инсулина по изобретению приводит к явному замедлению начала действия и к продленному, равномерному времени воздействия.
Пример 6: Определение снижающего сахар в крови действия у собак при двукратно повышенной дозе.
Снижающее сахар в крови действие выбранного нового аналога инсулина проверяли у здорового самца, с нормальной гликемией, собаки породы бигль. Самцу животного подкожно вводили дозу 6 нмоль/кг и 12 нмоль/кг аналога инсулина. Непосредственно перед инъекциями аналога инсулина и с равномерными интервалами до сорока восьми часов после инъекции у животных брали анализы крови и определяли содержание сахара в крови. Эксперимент явно показал (сравните, фигура 3), что примененный аналог инсулина по изобретению действует в зависимости от дозы, но, однако, несмотря на двукратное повышение дозы, действие проходит ровно, то есть не наблюдается никакой выраженной низшей точки (надир). Из этого следует, что инсулин по изобретению по сравнению с известными замедленными инсулинами приводит к явному уменьшению гипогликемических событий.
Пример 7: Определение снижающего сахар в крови действия у собак при различных концентрациях цинка в составах.
Эксперимент проводят, как описано в примере 35. На фигуре 4 представлен результат. В соответствии с ним на кривую время-действие аналога инсулина по изобретению содержание ионов цинка в составе при одинаковой концентрации инсулина влияет таким образом, что при нуле или незначительном содержании цинка наблюдают быстрое наступление действия, и действие продолжается более 24 часов, в то время как при высоком содержании цинка наблюдают плавное начало действия, и действие инсулина продолжается значительно больше 24 часов.
Пример 8: Состав амидированного производного инсулина.
Примеры 8-10 служат только для определения биологических, фармакологических и физическо-химических свойств аналогов инсулина формулы II. Сначала получали составы (пример 8) и затем производили соответствующие испытания (примеры 9 и 10). Аналог инсулина по изобретению для получения целевой концентрации 240±5 мкМ растворяли в 1 мМ соляной кислоты с 80 мкг/мл цинка (в виде хлорида цинка). Кроме того, для получения желаемой концентрации из лиофилизированного материала необходимо было отвешивать массу, примерно на 30% большую основанной на молекулярной массе. После этого полученную концентрацию определяли с помощью аналитической HPLC (ВЭЖХ) и затем к раствору для достижения заданной концентрации добавляли необходимый объем с 5 мМ соляной кислоты и 80 мкг/мл цинка. В случае необходимости, значение рН устанавливали на значении 3,5±0,1. После окончательного анализа с помощью HPLC (ВЭЖХ), для обеспечения заданной концентрации 240±5 мкМ готовый раствор с помощью шприца с фильтрующей насадкой 0,2 мкм помещали в закрытый обжимным колпачком стерильный пузырек. Для краткосрочных, однократных исследований производных инсулина по изобретению никакой оптимизации составов, например, относительно добавления изотонических агентов, консервантов или буферных веществ, не производили.
Пример 9: Определение снижающего сахар в крови действия нового аналога инсулина у крыс.
Снижающее сахар в крови действие выбранных новых аналогов инсулина проверяли на самцах здоровых, с нормальной гликемией крыс Вистар. Самцам крыс подкожно вводили дозу 9 нмоль/кг аналога инсулина. Непосредственно перед инъекциями аналога инсулина и с равномерными интервалами до восьми часов после инъекции, у животного брали анализы крови и определяли содержание сахара в крови. Эксперимент явно показал (сравните, фигура 5), что введение аналога инсулина по изобретению приводит к явному замедлению начала действия и к продленному, равномерному времени воздействия.
Пример 10: Определение снижающего сахар в крови действия новых аналогов инсулина у собаки.
Снижающее сахар в крови действие выбранного нового аналога инсулина проверяли у здорового самца, с нормальной гликемией, собаки породы бигль. Самцу животного подкожно вводили дозу 6 нмоль/кг аналога инсулина. Непосредственно перед инъекциями аналога инсулина и с равномерными интервалами до сорока восьми часов после инъекции у животных брали анализы крови и определяли содержание сахара в крови. Эксперимент явно показал, что введение аналога инсулина по изобретению приводит к явному замедлению начала действия и к продленному, равномерному времени воздействия.
1. Водная фармацевтическая композиция для лечения сахарного диабета, содержащая аналог инсулина,