Способ получения вещества с противоопухолевой активностью при гепатоцеллюлярном раке печени
Иллюстрации
Показать всеИзобретение относится к фармацевтической промышленности и представляет собой способ получения вещества с противоопухолевой активностью при гепатоцеллюлярном раке печени, заключающийся в том, что слизистую оболочку тонкой кишки человека гомогенизируют с водой в соотношении 1:3-5 при +3-+5°С, гомогенат центрифугируют, супернатант прогревают в течение 7-10 мин при температуре от 20° до 38°С, доводят до 100°С и прогревают 15-20 мин при этой температуре, вновь центрифугируют, к охлажденному до +4-+6°С супернатанту добавляют охлажденный до (-15)-(-20)°С этанол до концентрации 65-70%, через 15-17 ч вновь центрифугируют, из супернатанта удаляют спирт, полученный целевой продукт замораживают и хранят при (-65)-(-70)°С до использования. Изобретение обеспечивает расширение ассортимента средств, обладающих противоопухолевой активностью. 1 табл., 1 пр.
Реферат
Настоящее изобретение относится к способам получения биологически активных соединений, которые могут найти применение в медицине для подавления роста злокачественных опухолей.
Известен способ получения противоопухолевых агентов из слизистой оболочки тонкой кишки свиньи, включающий гомогенизацию, обработку этиловым спиртом, прогревание до 70°С, ультрафильтрацию и лиофилизацию [United States Patent 6,015,878, Jan. 18, 2000. Trifonov В.В., Roussev Je. К., Boshev N.A. Antitumor aqents isolated from intestinal mucosa, a method for their isolation and their application]. Указанные агенты обладают противоопухолевой активностью к лимфоме и миеломе мышей, карциноме глотки и эпителиоидной карциноме мочевого пузыря, эмбриональной рабдомиосаркоме.
Задачей изобретения является способ получения противоопухолевого вещества (ПВ), обладающего активностью в отношении гепатоцеллюлярного рака.
Поставленная задача решается способом получения ПВ, заключающимся в том, что слизистую оболочку тонкой кишки человека гомогенизируют с водой в соотношении 1:3-5 при +3-+5°С, гомогенат центрифугируют, супернатант прогревают в течение 7-10 мин при температуре от 20 до 38°С, доводят до 100°С и прогревают 15-20 мин при этой температуре, вновь центрифугируют, к охлажденному до +4-+6°С супернатанту добавляют охлажденный до (-15)-(-20)°С этанол до концентрации 65-70%, выдерживают 15-17 ч при (-15)-(-20)°С, вновь центрифугируют, из супернатанта удаляют спирт, полученный целевой продукт замораживают и хранят при (-65)-(-70)°С до использования.
Отличительными признаками предлагаемого способа являются использование в качестве исходного сырья слизистой оболочки тонкой кишки человека, центрифугирование гомогената в дистиллированной воде, прогревание супернатанта при температуре от 20 до 38°С, доведение температуры до 100°С и выдерживание в течение 15-20 мин при этой температуре, центрифугирование после прогревания, обработка этанолом до концентрации 65-70%, выдерживание с этанолом 15-17 ч при (-15)-(-20)°С, центрифугирование.
Испытания заявляемого ПВ на цитотоксическую (цитостатическую) и противоопухолевую активности были проведены на культурах опухолевых клеток (in vitro) и на крысах с перевиваемыми опухолями (in vivo).
Далее приведены примеры, иллюстрирующие способ получения ПВ и определение его биологической активности.
1. Пример получения ПВ.
Во время резекции тонкой кишки человека производят забор резецированного участка тонкой кишки длиной 5 см, в котором отсутствуют какие-либо образования. Тотчас после забора отделяют слизистую оболочку. Вес ее составляет 2,5 г. Слизистую оболочку измельчают, добавляют 7,5 мл дистиллированной воды, гомогенизируют при +3-+5°С, гомогенат центрифугируют для осаждения ядер (1000 об/мин, 10 мин). Полученный постъядерный нативный супернатант прогревают на водяной бане в течение 7-10 мин при температуре от 20 до 38°С, доводят до 100°С и выдерживают 15-20 мин при 100°С. Образовавшийся осадок термолабильного материала удаляют центрифугированием (5000 об/мин, 15 мин). К супернатанту, охлажденному до +4-+6°С, добавляют 16,1 мл 96% этанола, охлажденного до (-15)-(-20)°С и оставляют при этой температуре на 15-17 ч, центрифугируют в том же режиме, который указан выше. Спирт из супернатанта удаляют на роторном испарителе. Полученный экстракт (4 мл) имеет концентрацию белка 14,0-17,0 мг/мл по оптическому поглощению при D280. Экстракт (ПВ) замораживают и хранят при 65-70°С до использования.
2. Определение активности заявленного ПВ на культуре опухолевых клеток гепатомы-27, находящихся в стадии роста.
Для выполнения данной работы гепатома-27 была переведена в культуру из подкожной опухоли путем трипсинизации. Для этого забивали крысу с подкожной гепатомой, стерильно удаляли опухоль, выбирали участок, свободный от некрозов. Отделяли его, помещали в охлажденный раствор трипсина : версена (1:1) и 24 ч держали при +4°С. Через сутки сливали трипсин : версен, промывали несколько раз раствором Хенкса, заливали стандартной питательной средой с 10% фетальной сыворотки и 100 мкг/мл гентамицина и высевали на флаконы Карреля. Через 24 ч проводили смену среды для удаления не прикрепившихся клеток. Клетки культивировали на среде ДМЕМ+RPMI (1:1) с добавлением 5% эмбриональной телячьей сыворотки (Flow).
Клетки высевали на 96-луночные планшеты (Costar) в 100 мкл питательной среды (ДМЕМ+RPMI (1:1)). Количество клеток, вносимое в лунку, зависело от длительности эксперимента: 1 сутки - 4 тыс./лунка, 3 суток - 2 тыс./лунка, 6 суток - 1 тыс./лунка. Преинкубацию (культивирование клеток без препаратов) проводили в течение 24 ч при 37°С в атмосфере 5% СО2. Оттаянный ПВ вносили в лунки в концентрациях 0,25; 0,5; 1,0 и 2,0 мг/мл культуральной среды. Инкубацию проводили при 37°С в течение 1, 3 и 6 суток.
МТТ [3-(4,5-димелтиазол-2)2,5 дифенилтетразолиум бромид] (Sigma), растворенный в воде, добавляли в количестве 20 мкл (исходный раствор 5 мг/мл) в каждую лунку на 3 часа при тех же условиях. Затем среду отбирали и для лизиса клеток использовали диметилсульфоксид (60 мкл/лунку). Для гомогенного распределения красителя лизат тщательно перемешивали на шейкере (300 об/мин) в течение 3 минут. Количественное определение формазана проводили на приборе Multiskan (фильтр 540). Жизнеспособность клеток оценивали по соотношению оптической плотности растворов в лунках с контрольными клетками и в лунках с клетками, обработанными ПВ.
Ингибирование пролиферации клеток в культуре гепатомы-27 вычисляли по формуле:
,
где
ИП - ингибирование пролиферации;
По - уровень пролиферации в опыте;
Пк - уровень пролиферации в контроле.
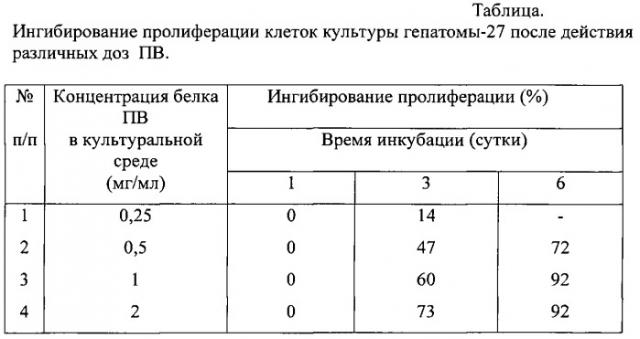
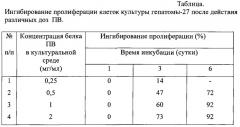
В таблице представлены данные о влиянии ПВ на рост культуры клеток гепатомы-27 при различных концентрациях белка ПВ в 1 мл культуральной среды.
Из таблицы следует, что на 1 сутки инкубации ПВ во всех представленных концентрациях не оказывал ингибирующего действия на пролиферацию опухолевых клеток. На 3 сутки инкубации ПВ во всех концентрациях оказывал цитостатическое влияние на опухолевые клетки. Наибольшим ингибирующим эффектом обладал ПВ в концентрации 2 мг на 1 мл среды. На 6 сутки инкубации по сравнению с 3 сутками цитостатический эффект всех ПВ возрастал, ингибирование пролиферации клеток было наиболее выражено у экстрактов с концентрацией белка, равной 1 и 2 мг/ мл культуральной среды.
Таким образом, заявляемый ПВ характеризуется высоким уровнем ингибирования пролиферации в культуре клеток гепатомы-27, достигающим 73% (на 3 сутки инкубации) и 92% (на 6 сутки).
3. Определение активности заявленного ПВ in vivo.
Исследование проведено на беспородных крысах-самцах массой 100-150 г с перевитой внутрипеченочной гепатомой-27. Для этого на 10 сутки после прививки опухоли печени производили повторную лапаротомию, измеряли размеры опухоли (2 наибольших размера), после чего рану передней брюшной стенки ушивали. Животных делили на 2 группы. В 1 группе осуществляли внутрибрюшинное введение ПВ из расчета 100 мг белка на кг массы в объеме 1 мл. Введение производили через день в течение 14 дней (всего 7 введений). Животные 2 группы являлись контролем, ПВ им не вводили. Через 6 дней после последней инъекции крысам 1 группы (через 20 дней после начала лечения и 30 дней после прививки опухоли) животных обеих групп забивали и вновь измеряли опухоль.
Показатель торможения роста опухоли (ТРО) рассчитывали по формуле:
,
где
Р оп. контр - размеры опухоли в контроле,
Р оп. опыт - размеры опухоли в опыте.
Было выявлено следующее. Через 10 дней после прививки опухоли (на момент начала лечения крыс 1 группы) достоверных различий в размерах опухоли печени в 1 и 2 группах не было: площадь опухоли составляла соответственно 27,0±6,7 и 24,7±7,5 мм2, Р>0,05. Через 30 дней после прививки опухоли размеры ее у крыс 1 группы увеличились недостоверно, составили 55,3±18,8 мм2, Р>0,05, тогда как у животных 2 группы размеры опухоли достоверно увеличились до 167,7±46,4 мм2, Р<0,05. Различия между группами через 30 дней после прививки опухоли были достоверными, что позволяет рассчитать показатель ТРО. Он составил 67%.
Таким образом, использование заявленного ПВ позволяет эффективно подавить рост гепатомы 27, а именно прекратить пролиферацию раковых клеток (in vitro) и способствовать торможению роста опухоли у крыс (in vivo).
Предлагаемый способ позволяет расширить ассортимент веществ, обладающих противоопухолевой активностью.
Способ получения вещества с противоопухолевой активностью при гепатоцеллюлярном раке печени, заключающийся в том, что слизистую оболочку тонкой кишки человека гомогенизируют с водой в соотношении 1:3-5 при +3-+5°С, гомогенат центрифугируют, супернатант прогревают в течение 7-10 мин при температуре от 20 до 38°С, доводят до 100°С и прогревают 15-20 мин при этой температуре, вновь центрифугируют, к охлажденному до +4-+6°С супернатанту добавляют охлажденный до (-15)-(-20)°С этанол до концентрации 65-70%, через 15-17 ч вновь центрифугируют, из супернатанта удаляют спирт, полученный целевой продукт замораживают и хранят при (-65)-(-70)°С до использования.