Способ получения 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов
Иллюстрации
Показать всеИзобретение относится к области получения 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, которые обладают свойствами органических люминофоров и полупроводников и потенциально могут быть использованы в промышленности при создании флуоресцентных красок, пластиковых сцинтилляторов, электропроводящих слоев органических светодиодов, а также в активных средах жидкостных лазеров. Способ получения изомеров 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов включает две стадии, выделение целевых продуктов путем выливания реакционной смеси в воду со льдом, фильтрование осадка, перекристаллизацию. На первой стадии проводят ацилирование гидразида ароматической карбоновой кислоты малеиновым ангидридом в ледяной уксусной кислоте при комнатной температуре, при мольном соотношении гидразид : малеиновый ангидрид от 1:1 до 1:1,5 в течение 5-30 минут. Выпавшую из реакционной смеси в виде осадка (Z)-4-(N′-ароилгидразино)-4-оксо-2-бутеновую кислоту отфильтровывают, промывают ледяной уксусной кислотой, высушивают и на второй стадии подвергают циклизации в апротонном диполярном растворителе с использованием дегидратирующего реагента, с мольным соотношением реагент : (Z)-4-(N′-ароилгидразино)-4-оксо-2-бутеновая кислота от 1:1 до 3:1 в течение 10-90 минут, при температуре от 15 до 50°C, с получением смеси изомеров 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов в виде раствора в используемом растворителе и с последующим выделением целевых продуктов. Для выделения целевых продуктов полученную смесь изомеров выливают в воду со льдом, сразу отфильтровывают выпавший осадок - (Е)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол, оставшийся фильтрат выдерживают в течение шести и более часов при комнатной или более низкой температуре и отфильтровывают выпавший за это время в виде осадка (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол. Технический результат - безопасный и энергетически выгодный метод синтеза 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, использующий доступные реагенты и позволяющий получать целевые продукты как (E)-, так и (Z)-конфигурации. 3 табл., 5 пр.
Реферат
Изобретение относится к области получения 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, имеющих в своей структуре систему сопряженных π-электронов, способствующую эффективному внутримолекулярному переносу заряда. Такие соединения обладают свойствами органических люминофоров и полупроводников и потенциально могут быть использованы в промышленности при создании флуоресцентных красок, пластиковых сцинтилляторов, электропроводящих слоев органических светодиодов, а также в активных средах жидкостных лазеров.
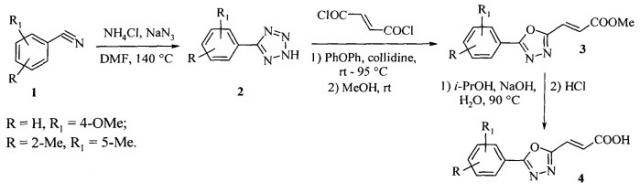
Известен метод синтеза 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов. Метод включает в себя конденсацию ароматического нитрила (1) с азидом натрия с получением 5-арилтетразола (2), синтез (E)-2-арил-5-(2-(3-метокси-3-оксопропен-1-ил))-1,3,4-оксадиазола (3) путем взаимодействия 5-арилтетразола с фумарил хлоридом и последующий гидролиз полученного эфира (Detert Heiner, (E)-1,2-Bis(5-aryl-1,3,4-oxadiazol-2-yl)ethenes / Heiner Detert, Dieter Schollmeier // Synthesis. - 1999. - №6. - P.999-1004).
Смесь исходного ароматического нитрила (1) (0,1 моль), NH4Cl (0,13 моль), NaN3 (0,13 моль) и 60 мл безводного ДМФА выдерживают при температуре 140°C в течение 48 часов. Охлажденную реакционную массу выливают в 300 мл воды и доводят полученную смесь с помощью концентрированной HCl до кислой среды pH 2. После выдерживания в течение 12 часов при 4°C суспензию фильтруют, промывают водой и этиловым спиртом. Высушенный осадок перекристаллизовывают из изопропилового спирта. Выход 5-арилтетразолов (2) составляет 94-97%. Полученный 5-арилтетразол (0,01 моль) и фумарил хлорид (0,03 моль) смешивают с 10 мл дифенилового эфира. При перемешивании постепенно добавляют коллидин (0,011 моль) и медленно нагревают смесь до прекращения выделения газа (95°C). После этого нагревание продолжают в течение 15 мин. Смесь выливают в 60 мл абсолютного метилового спирта и перемешивают в течение 30 мин. Метиловый спирт отгоняют и промывают образовавшийся осадок водой. Выход (E)-2-арил-5-(2-(3-метокси-3-оксопропен-1-ил))-1,3,4-оксадиазолов (3) составляет 78-84%. Полученный продукт (0,005 моль) растворяют в изопропиловом спирте (15 мл) и прибавляют раствор NaOH (0,02 моль) в 4 мл воды. Смесь кипятят с обратным холодильником до полного гидролиза эфира. Раствор нейтрализуют HCl, отгоняют изопропиловый спирт и фильтруют полученный осадок. Для очистки проводят перекристаллизацию из этилацетата. Выход (E)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов (4) составляет 73-75%.
Главными недостатками данного способа являются его высокая энергозатратность и длительность. Большие энергозатраты обусловлены тем, что все используемые в методе реакции требуют интенсивного нагрева, а длительность обусловлена большим количеством используемых операций и продолжительностью химических превращений, так, синтез 5-арилтетразолов на первой стадии занимает как минимум 60 часов. Кроме того, с помощью данного метода возможно получение лишь (E)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолы данным способом получить нельзя.
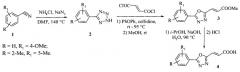
Наиболее близкий метод синтеза 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов включает в себя взаимодействие гидразида ароматической карбоновой кислоты (5) и малеинового ангидрида с получением замещенного малеинимида (6), который далее подвергают реакции перегруппировки в присутствии избытка хлорсульфоновой кислоты (US Pat. 2765304 New oxadiazole compounds and process for their manufacture / A.E. Siegrist, E. Moergeli, K. Hoelzle; Applicant Ciba Limited, Switzerland; filed 21.05.1952; published 02.10.1956. - 9 p. - Режим доступа http://ep.espacenet.com).
Малеинимид (6) получают путем конденсации гидразида моноэтилтерефталата (5) с малеиновым ангидридом в бензоле или хлорбензоле. Продукт очищают перекристаллизацией из этилового спирта. Тпл=166-167°C. Полученный малеинимид (0,1 моль) вводят в хлорсульфоновую кислоту (1 моль) при комнатной температуре, после чего температуру начинают медленно увеличивать. Суспензия полностью переходит в раствор после выдерживания при температуре 50°C в течение получаса. Раствор охлаждают и выливают в смесь льда и воды. Осажденный 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол (7) фильтруют и промывают водой. Далее проводят перекристаллизацию из этилового спирта. Информация о выходах отсутствует. В публикации не указывается конфигурация целевого соединения, поэтому неизвестно, какой из продуктов (E)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол, (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол или их смесь можно получить данным методом.
Недостатком этого способа является его небезопасность как для человека, так и для технологического оборудования, что обусловлено применением большого количества агрессивного реагента - хлорсульфоновой кислоты, используемой в методе и как реагент, и как растворитель. Кроме того, можно предположить, что использование такого активного химического реагента, как хлорсульфоновая кислота, сильно ограничивает набор 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, которые могут быть получены таким методом.
Задача изобретения - разработка безопасного и энергетически выгодного метода синтеза 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов с использованием доступных реагентов, позволяющего получать целевые продукты как (E)-, так и (Z)-конфигурации.
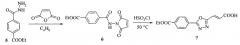
Заявляется способ получения 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, позволяющий получать индивидуальные (E)- и (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолы общей формулы (10) и (11) соответственно.
Способ включает в себя две стадии, выделение целевых продуктов путем выливания реакционной смеси в воду со льдом, фильтрование осадка, перекристаллизацию.
где R3 - Н, алкил, алкокси, NO2, галоген в одном из положений ароматического кольца с 1 по 5; R4 - Н, алкил, алкокси, NO2, галоген в одном из положений ароматического кольца с 1 по 5, отличном от положения заместителя R3.
На первой стадии проводят ацилирование гидразида ароматической карбоновой кислоты (8) малеиновым ангидридом в ледяной уксусной кислоте при комнатной температуре, при мольном соотношении гидразид : малеиновый ангидрид от 1:1 до 1:1,5 в течение 5-30 минут. Выпавшую из реакционной смеси в виде осадка (Z)-4-(N′-ароилгидразино)-4-оксо-2-бутеновую кислоту (9) отфильтровывают, промывают ледяной уксусной кислотой и высушивают. На второй стадии полученную кислоту подвергают циклизации в апротонном диполярном растворителе с использованием дегидратирующего реагента, с мольным соотношением реагент : (Z)-4-(N′-ароилгидразино)-4-оксо-2-бутеновая кислота от 1:1 до 3:1 в течение 10-90 минут, при температуре от 15 до 50°C. В качестве дегидратирующего реагента могут быть использованы хлорокись фосфора, пентахлорид фосфора, пентаоксид фосфора, полифосфорная кислота, концентрированная серная кислота. В примерах приводится способ с применением хлорокиси фосфора. Остальные реагенты дают идентичные результаты. В результате реакции получают смесь изомеров 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов в виде раствора в используемом растворителе. Для выделения в индивидуальном виде целевых продуктов полученную смесь изомеров выливают в воду со льдом, сразу отфильтровывают выпавший осадок - (E)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол (10). Оставшийся фильтрат выдерживают в течение шести и более часов при комнатной или более низкой температуре и отфильтровывают выпавший за это время в виде осадка (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол (11).
Изобретение иллюстрируется следующими примерами:
Пример 1
На первой стадии проводят ацилирование гидразида бензойной кислоты малеиновым ангидридом в ледяной уксусной кислоте при комнатной температуре путем прибавления раствора 0,1 моль гидразида бензойной кислоты в 35 мл ледяной уксусной кислоты к раствору 0,11 моль малеинового ангидрида в 30 мл ледяной уксусной кислоты. После окончания прибавления из реакционной смеси сразу выпадет осадок - (Z)-4-(N′-бензоилгидразино)-4-оксо-2-бутеновая кислота. Реакционную смесь выдерживают в течение 20 минут, затем осадок отфильтровывают, промывают ледяной уксусной кислотой, высушивают. На второй стадии проводят циклизацию (Z)-4-(N′-бензоилгидразино)-4-оксо-2-бутеновой кислоты, для чего растворяют 0,01 моль (Z)-4-(N′-бензоилгидразино)-4-оксо-2-бутеновой кислоты в 10 мл ДМФА, постепенно добавляют 0,02 моль дегидратирующего реагента POCl3 и выдерживают смесь при комнатной температуре в течение одного часа. Далее реакционную смесь выливают в смесь воды и льда. Выпавший белый осадок - (E)-2-фенил-5-(2-карбоксивинил)-1,3,4-оксадиазол сразу отфильтровывают. Оставшийся фильтрат выдерживают в течение 12 часов при комнатной температуре и отфильтровывают выпавший за это время в виде белого осадка (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол. Для очистки полученных продуктов проводят перекристаллизацию из этилового спирта.
Примеры 2-5
Получение других (E)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов общей формулы (10) и (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов общей формулы (11) проводят аналогично примеру 1. Выходы целевых и промежуточных продуктов реакций, результаты анализов приведены в таблицах 1-3.
Результатом изобретения является новый безопасный и энергетически выгодный метод синтеза 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, использующий доступные реагенты и позволяющий получать целевые продукты как (E)-, так и (Z)-конфигурации.
| Таблица 1 | ||||||
| Получение (Z)-4-(N′-ароилгидразино)-4-оксо-2-бутеновых кислот (9) | ||||||
| Пример | R3 | R4 | Выход, % | Тпл,°C | 1Н ЯМР ([2H6] ДМСО) δ, J (Гц) | ИК ν, см-1 |
| 1 | 4-Н | Н | 91 | 177-179 | 6.35 (1H, d, J=12.2), 6.41 (1H, d, J=12.4), 7.48 (2H, t, J=7.35), 7.56 (1H, t, J=7.2), 7.90 (2H, t, J=7.5), 10.65 (1H, s), 10.90 (1H, s), 13.20 (1H. s) | 3210 (NH), 2720 (OH), 1707 (C=O), 1651 (IA C-O), 1628 (C-C), 1588 (Ar), 1538 (IIA N-C=O), 920 (ОН), 714 (монозамещение Ar) |
| 2 | 4-CH3 | Н | 88 | 170-173 | 2.36 (3H, s), 6.34 (1H, d, J=12.0), 6.43 (1H, d, J=12.3), 7.29 (2H, d, J=8.1), 7.79 (2H, d, J=8.1), 10.53 (1H, s), 10.58 (1H, s). 13.26 (1H, s) | 3215 (NH), 2725, 2607 (ОН), 1707 (СО), 1662 (IA C=O), 1624 (С=С), 1545 (IIA N-C=O), 1597, 1517 (Ar), 921 (ОН), 846 (1,4-замещение Ar) |
| 3 | 4-OCH3 | Н | 81 | 162-165 | 3.82 (3H, s), 6.35 (1H, d, J=12.6), 6.42 (m, d, J=12.1), 7.03 (2H, d, J=8.4), 7.88 (2H, d, J=8.4), 10.45 (1H, s), 11.40 (1H, s), 13.01 (1H, s) | 3320 (NH), 2720 (ОН), 1722 (C=O), 1663 (IA C=O), 1630 (C-C), 1606 (Ar), 1555 (IIA N-C=O), 1265 (C-O), 945 (OH), 838 (1,4-замещение Ar) |
| 4 | 4-NO2 | Н | 95 | 182-183 | 6.32 (1H, d, J=12.1), 6.43 (1H, d, J=11.9), 8.11 (2H, d, J=8.2), 8.35 (2H, d, J=8.4), 10.65 (1H, s), 10.97 (1H, s), 13.10 (1H, s) | 3229 (NH), 2605 (ОН), 1710 (CO), 1679 (IA C=O), 1635 (C=C), 1568 (IIA N-C=O), 1590 (Ar), 1523, 1346 (NO2), 917 (ОН), 837 (1,4-замещение Ar). |
| 5 | 4-Cl | Н | 87 | 183-185 | 6.34 (1H, d, J=12.5), 6.40 (1H, d, J=12.4), 7.55 (2H, d, J=8.1), 7.9 (2H, d, J=8.1), 10.62 (1H, s), 11.76 (1H.s). 13.11 (1H.s) | 3239 (NH), 2721 (ОН), 1699 (C=O), 1672 (IA C=O), 1624 (ОС), 1594, 1508 (Ar), 1543 (IIA N-CO), 952 (ОН), 850 (1,4-замещение Ar) |
| Таблица 2 | ||||||
| Получение (E)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов (10) | ||||||
| Пример | R3 | R4 | Выход % | Тпл,°C | 1Н ЯМР ([2Н6] ДМСО) δ, J (Гц) | ИК ν, см-1 |
| 1 | 4-Н | Н | 64 | 191-193 | 6.94 (1H, d, J=15.9), 7.47 (1H, d, J=16.2), 7.61 (3H, m), 8.09 (2H, d, J=8.4), 13.19 (1H, s) | 2627, 2541 (ОН), 1714 (СО), 1650 (C-С), 1604 (Ar), 1520 (C=N), 1262, 1175, 1022 (C-O-C), 964 (транс CH-CH), 927 (ОН), 688 (монозамещение Ar) |
| 2 | 4-CH3 | Н | 54 | 208-211 | 2.39 (3H, s), 6.90 (1H, d, J=15.9), 7.41 (2H, d, J=7.6), 7.42 (1H, d, J=16.1), 7.98 (2H, d, J=8.2), 13.22 (1H, s) | 2674, 2570 (ОН), 1685 (С=O), 1643 (С-С), 1518 (ON), 1612, 1516 (Ar), 1279, 1215, 1093 (C-O-C), 970 (транс CH=CH), 826 (1,4-замещение Ar) |
| 3 | 4-OCH3 | Н | 60 | 225-227 | 3.84 (3H, s), 6.85 (1H, d, J=15.9), 7.13 (2H, d, J=8.1), 7.40 (1H, d, J=16.2), 8.01 (2H, d, J=8.1). 13.20 (1H, s) | 2617, 2524 (ОН), 1715 (С=O), 1647 (C=C), 1617 (Ar), 1558 (C-N), 1264, 1231, 1178, 1090 (C-O-C), 986 (транс CH-CH), 926 (ОН), 832 (1,4-замещение Ar) |
| 4 | 4-NO2 | Н | 39 | 234-236 | 7.00 (1H, d, J=16.0), 7.48 (1H, d, J=15.8), 8.21 (2H, d, J=8.1), 8.36 (2H, d, J=8.2), 13.20 (1H, s) | 2670 (ОН), 1692 (С=O), 1644 (С=С), 1607 (Ar), 1527 (C-N), 1542, 1351 (NO2), 1294, 1178, 1111 (C-O-C), 970 (транс CH=CH), 934 (ОН), 855 (1,4-замещение Ar) |
| 5 | 4-Cl | Н | 59 | 231-234 | 6.94 (1H, d, J=15.8), 7.44 (1H, d, J=15.5), 7.67 (2H, d, J=8.2), 8.11 (2H, d, J=8.4), 13.23 (1H, s) | 2590 (ОН), 1710 (С=O), 1642 (C=C), 1546 (C=N), 1600 (Ar), 1263, 1170, 1083 (C-O-C), 915 (ОН), 967 (транс CH-CH), 832 (1,4-замещение Ar) |
| Таблица 3 | ||||||
| Получение (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов (10) | ||||||
| Пример | R4 | R4 | Выход % | Тпл,°C | 1Н ЯМР ([2H6] ДМСО) δ, J (Гц) | ИК ν, см-1 |
| 1 | 4-Н | H | 3 | 155-158 | 6,70 (1H; d; J=12,3); 6,93 (1Н; d; J=12,6); 7,65 (3H; m); 8,00 (2H; d; J=7,9); 13,38 (1H; s) | 2735, 2517 (ОН), 1712 (С=O), 1649 (С=С), 1604, 1513 (Ar), 1550 (C=N), 1217, 1184, 1022 (С-O-С), 814 (цис CH=CH), 927 (ОН), 684 (монозамещение Ar) |
| 2 | 4-CH3 | Н | 10 | 169-171 | 2.39 (3H, s), 6.66 (1H, d, J=12.5), 6.88 (1H, d, J=12.1), 7.44 (2H, d, J=8.5), 7.88 (2H, d, J=8.3), 13.23 (1Н, s) | 2585, 2507 (ОН), 1710 (С=O), 1647 (ОС), 1612, 1494 (Ar), 1553 (C-N), 1273, 1175, 1094 (С-O-С), 814 (цис CH=CH), 927 (ОН), 816 (цис CH-CH), 825 (1,4-замещение Ar) |
| 3 | 4-OCH3 | Н | 7 | 178-181 | 3.84 (3H, s), 6.64 (m, d, J=12.5), 6.87 (1H, d, J=12.4), 7.11 (2H, d, J=8.5), 7.90 (2H, d, J=8.5), 13.21 (1Н, s) | 2726, 2525 (ОН), 1721 (С=O), 1640 (С=С), 1610 (Ar), 1584 (C=N), 1265, 1217, 1175(C-O-С), 814 (цис CH-CH), 929 (ОН), 836 (1,4-замещение Ar) |
| 4 | 4-NO2 | Н | 20 | 206-208 | 6.72 (1H, d, J=12.5), 6.96 (1H, d, J=12.6), 8.21 (2H, d, J=8.5), 8.44 (2H, d, J=8.4), 13.24 (1H, s) | 2656 (ОН), 1697 (C=O), 1644 (ОС), 1607 (Ar), 1550(C=N) 1520, 1351 (NO2), 1278, 1175, 1089 (C-O-C), 820 (цис CH=CH), 933 (ОН), 854 (1,4-замещение Ar). |
| 5 | 4-Cl | Н | 19 | 211-214 | 6.68 (1H, d, J=12.6), 6.91 (1H, d, J=12.3), 7.69 (2H, d, J=8.4), 7.95 (2H, d, J=8.4), 13.24 (1H, s) | 2652, 2590 (ОН), 1708 (СО), 1645 (С-С), 1580 (C=N), 1604, 1507 (Ar), 1287, 1178, 1094 (C-O-C), 911 (ОН), 819 (цис CH=CH), 833 (1,4-замещение Ar) |
Способ получения изомеров 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов, включающий две стадии, выделение целевых продуктов путем выливания реакционной смеси в воду со льдом, фильтрование осадка, перекристаллизацию, отличающийся тем, что на первой стадии проводят ацилирование гидразида ароматической карбоновой кислоты малеиновым ангидридом в ледяной уксусной кислоте при комнатной температуре, при мольном соотношении гидразид : малеиновый ангидрид от 1:1 до 1:1,5 в течение 5-30 минут, выпавшую из реакционной смеси в виде осадка (Z)-4-(N′-ароилгидразино)-4-оксо-2-бутеновую кислоту отфильтровывают, промывают ледяной уксусной кислотой, высушивают и на второй стадии подвергают циклизации в апротонном диполярном растворителе с использованием дегидратирующего реагента, с мольным соотношением реагент : (Z)-4-(N′-ароилгидразино)-4-оксо-2-бутеновая кислота от 1:1 до 3:1 в течение 10-90 минут, при температуре от 15 до 50°C, с получением смеси изомеров 2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазолов в виде раствора в используемом растворителе и с последующим выделением целевых продуктов, для чего полученную смесь изомеров выливают в воду со льдом, сразу отфильтровывают выпавший осадок - (Е)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол, оставшийся фильтрат выдерживают в течение шести и более часов при комнатной или более низкой температуре и отфильтровывают выпавший за это время в виде осадка (Z)-2-арил-5-(2-карбоксивинил)-1,3,4-оксадиазол.