Композиции и способы для смягчения дыхательной недостаточности, вызванной передозировкой опиоидов
Иллюстрации
Показать всеИзобретение относится к опиатному анальгетическому лекарственному препарату, который включает твердую, с контролируемым высвобождением, пероральную лекарственную форму, содержащую большое количество многослойных пеллет. Каждая пеллета содержит водорастворимую сердцевину, слой антагониста, содержащий налтрексон, который покрывает сердцевину, изолирующий полимерный слой, который покрывает слой антагониста, слой агониста, содержащий оксикодон, который покрывает изолирующий полимерный слой, и слой контролируемого высвобождения, который покрывает слой агониста. Лекарственный препарат предназначен для ослабления у человека угнетения дыхания, которое возникает, если препарат был поврежден перед введением человеку, за счет высвобождения налтрексона. 2 н. и 6 з.п. ф-лы, 5 ил., 3 табл., 4 пр.
Реферат
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Платформа деактивированной сердцевины компании King Pharmaceuticals, внедрение связанного налтрексона в сердцевину опиоидной дозированной формы с контролируемым высвобождением, который высвобождается только при разрушении связующей полимерной матрицы, была развита как способ снижения действия избыточно опиоида и лекарственного средства, предпочтительно, когда продукт неправильно используют или злоупотребляют им. Технология деактивированной сердцевины описывается в деталях в патентах США №7,682,633 и 7,682,634, заявках на патент США №US 20080233156, US 20090131466, US 20040131552, US 20100152221, US 20100151014 и US 20100143483 и заявках PCT №PCT/US08/087030, PCT/US08/087043, PCT/US08/87047 и PCT/US08/087055, включенных в данный документ в виде ссылок.
Анальгетическое лекарственное средство Embeda® (также известное как ALO-01) представляет собой пример находящегося на рынке лекарственного препарата, внедряющего технологию деактивированной сердцевины. (Предписывающая информация: Embeda® (морфина сульфат и налтрексона гидрохлорида) капсулы с пролонгированным действием. Alpharma Pharmaceuticals LLC, дочерняя компания, полностью находящаяся в собственности компании King Pharmaceuticals, Inc., Bristol, TN. June 2009.) Коммерциализированное в 2009 Embeda® представляет собой капсульный препарат, содержащий пеллеты с контролируемым высвобождением, которые медленно по прошествии длительного времени высвобождают терапевтические количества морфина сульфата. Налтрексон НС1 изолируют во внутреннем ядре в соотношении 1:20 с морфином и высвобождается он только, когда разрушается связующая полимерная матрица. Когда капсула взята целиком, внутреннее ядро остается неповрежденным, и налтрексон не оказывает воздействия на анальгетический потенциал морфина. Однако, когда Embeda® разжевывают, раздавливают или совершают другие физические манипуляции, налтрексон высвобождается, адсорбируется перорально и конкурентно связывается с мю-опиодным рецептором, таким образом, ослабляя или уменьшая эйфористические эффекты морфина.
Количество налтрексона в основе деактивированной сердцевины варьируется в зависимости от силы опиоидного анальгетического средства. Embeda использует 4% налтрексона (морфин и налтрексон в соотношении 20:1). Исследования продемонстрировали, что 12% налтрексона или больше могут быть оптимальными для оксикодона и гидрокодона. В то время как был исследован ответ дозы по отношению к эйфории и лекарственное средство, находящееся в комбинациях с опиоидами и антагонистами опиоидов, малоизвестно о взаимоотношении доза-ответ налтрексона по отношению к другим фармакологическим действиям опиоидов, включая первичный механизм смертельной передозировки опиоида: угнетение дыхания (White JM and Irvine RJ. Mechanisms of fatal opioid overdose. Addiction. 1999; 94 (7): 961-72; Dahan A, Aarts L, and Smith TW. Incidence, reversal, and prevention of opioid-induced respiratory depression. Anesthesiology. 2010; 112: 226-38).
В настоящее время налоксон представляет собой лекарственное средство из варианта для терапевтического применения как средство экстренной терапии в быстрой отмене активности, вызванной опиоидом, и побочных реакций (Longnecker DE, Grazis PA, and Eggers GWN. Naloxone for antagonism of morphine-induced respiratory depression. Anesthesia and Analgesia Current Researches 1973; 52(3): 447-53). При парентеральном введении были хорошо охарактеризованы фармакодинамические эффекты налоксена по отношению к отмене угнетения дыхания, вызванного опиоидами (Yassen A, Olofsen Е, van Dorp Е, Sarton Е, Teppema L, Danhof M, and Dahan A. Mechanism-based pharmacokinetic-pharmacodynamic modelling of the reversal of buprenorphine-induced respiratory depression by naloxone. Clin Pharmacokinet. 2007; 46 (II): 965-80; Kaufman RD, Gabthuler ML, and Bellville W. Potency, duration of action and pA2 in man of intravenous naloxone measured by reversal of morphine-depressed respiration. J of Pharmacol and Exp.Ther. 1981; 219:156-62). При известной или подозреваемой передозировке опиоида, чтобы аннулировать угнетение дыхания, вызванное опиоидом, обычная IV доза налоксона составляет 0,4-2 мг (Amercian Hospital Formulary Services (AHFS) Information. Naloxone hydrochloride. 2003: 2088-89). Данная первоначальная инфузия может быть дополнена многочисленными инъекциями налоксона при частых интервалах или непрерывной внутривенной инфузией. В послеоперационный период доза болюса налоксона может быть дополнена непрерывной IV инфузией налоксона 3,7 мкг/кг на час, чтобы аннулировать угнетение дыхания.
Патент США №5,834,477 описывает композиции гомогенной смеси, которая содержит, как опиоидный агонист, так и антагонист, которые вызывают минимальное угнетение дыхания. Патент описывает применение суфентанила оксалата и налмефена в молярном соотношении 15:1.
Эффекты от комбинирования гидрокодона битартрата и налтрексона гидрохлорида на угнетение дыхания у крыс были оценены (К. Hew, S. Mason, and Н. Penton, A Respiratory Safety Pharmacology Assessment of Hydrocodone Bitartrate and Naltrexone Hydrochloride). Было проведено сравнение действия оксикодона и морфина по отношению к угнетению дыхания у пациентов (Change et. al., A comparison of the respiratory effects of oxycodone versus morphine: a randomized, double-blind, placebo controlled investigation, Anaesthesia 2010). Данное исследование определило, что степень и скорость возникновения угнетения дыхания, вызванного оксикодоном, была зависимой от дозы большей, чем эквивалентная доза морфина.
Использование налтрексона как средства экстренной терапии у людей является новым применением данного лекарственного средства, так как налтрексон первоначально вводят перорально и постоянно, чтобы лечить опиатную и алкогольную зависимость. Если нет изолирования в препарате с дезактивирующей сердцевиной, например, после дробления или разжевывания препарата и дальнейшего проглатывания, то налтрексон адсорбируется также быстро, как и опиоид (фигура 2) несмотря на то, что опиоид сохраняется дольше, чем налтрексон. Это предполагало бы, что налтрексон имеет столько же потенциала, чтобы предотвратить угнетение дыхания при состоянии острой опиоидной передозировке как и в случае, когда это было или в реверсирующем, или ослабляющем состоянии, зависящем от количества каждого лекарственного средства, которое адсорбировалось. Вследствие этого развитие лучшего понимания взаимосвязи доза-ответ между налтрексоном и угнетением дыхания, вызванным опиоидом, представляет собой вопрос клинической важности.
КРАТКОЕ ОПИСАНИЕ СУТИ ИЗОБРЕТЕНИЯ
Представленное изобретение касается опиоидных композиций, содержащих изолированный опиоидный антагонист, которые, когда приняты внутрь после повреждения (например, раздавливания, разжевывания или растворения), высвобождают опиоидный антагонист и ослабляют угнетение дыхания, когда введены или приняты внутрь после повреждения. Композиции представленного изобретения содержат опиатные анальгетические лекарственные препараты, которые включают твердую, с контролируемым высвобождением, пероральную дозированную форму, содержащую большое количество многослойных пеллет, где каждая пеллета, содержит водорастворимую сердцевину, слой антагониста, содержащий налтрексон или фармацевтически приемлемую соль налтрексона, который покрывает сердцевину, изолирующий полимерный слой, который покрывает слой антагониста, слой агониста, содержащий опиоид или фармацевтически приемлемую соль опиоида, который покрывает изолирующий полимерный слой, и слой контролированного высвобождения, который покрывает слой агониста. Когда композиции вводят человеку нетронутым, что означает, что композиции не были повреждены, что, главным образом, все остатки налтрексона изолированы. Если, однако, композиции повреждены, что означает, что композиции были раздавленными, разжеванными, растворенными или видоизменены любым другим способом так, что налтрексон и опиоид в композиции высвобождаются с исходной дозированной формы, композиции имеют достаточное количество налтрексона, чтобы ослабить угнетение дыхания, опосредованное опиоидом, у индивидуума, который принял поврежденную форму композиций.
Представленное изобретение касается опиатных анальгетических лекарственных препаратов, которые включают твердую, с контролируемым высвобождением, пероральную дозированную форму, содержащую большое количество многослойных пеллет, где каждая пеллета, содержит водорастворимую сердцевину, слой антагониста, содержащий налтрексон или фармацевтически приемлемую соль налтрексона, который покрывает сердцевину, изолирующий полимерный слой, который покрывает слой антагониста, слой агониста, содержащий опиоид или фармацевтически приемлемую соль опиоида, который покрывает изолирующий полимерный слой, и слой контролированного высвобождения, который покрывает слой агониста, в которых налтрексон или фармацевтически приемлемая соль налтрексона в значительной степени не высвобождается при введении неповрежденного препарата человеку, и где минимальное угнетение дыхания вызывается у человека, когда препарат был поврежден до введения человеку.
Представленное изобретение, кроме того, касается способов ослабления угнетения дыхания у человека, опосредованного лекарственным средством, в случае введения человеку лекарственного средства, которое вызывает угнетение дыхания, где способ включает введение человеку опиатного анальгетического лекарственного препарата, который включает твердую, с контролируемым высвобождением, пероральную дозированную форму, содержащую большое количество многослойных пеллет, где каждая пеллета, содержит водорастворимую сердцевину, слой антагониста, содержащий налтрексон или фармацевтически приемлемую соль налтрексона, который покрывает сердцевину, изолирующий полимерный слой, который покрывает слой антагониста, слой агониста, содержащий опиоид или фармацевтически приемлемую соль опиоида, который покрывает изолирующий полимерный слой, и слой контролированного высвобождения, который покрывает слой агониста.
ФИГУРЫ
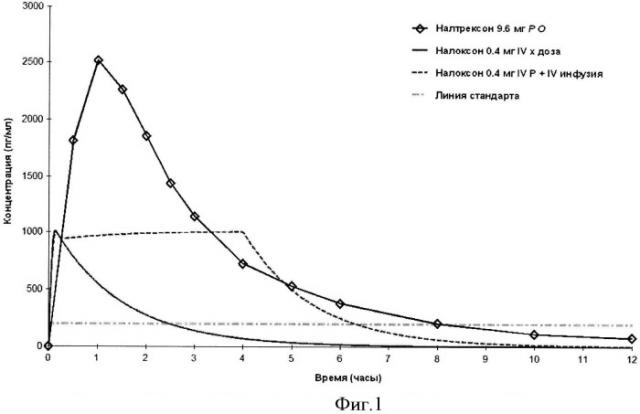
Фигура 1. График, сравнивающий концентрации налоксона и налтрексона в плазме после IV терапии налоксоном (красная) и при полном высвобождении из 80 мг пероральной дозы ALO-02 или ALO-04, содержащей 12% налтрексона (синяя).
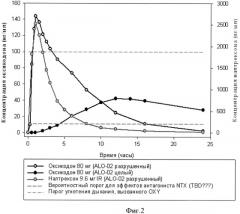
Фигура 2. График, сравнивающий концентрации налтрексона и оксикодона в плазме после теоретического раздавливания дозы ALO-02, содержащей 80 мг оксикодона и 12% (9,6 мг) налтрексона.
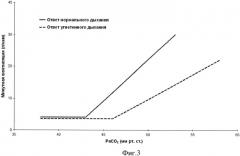
Фигура 3. График модифицированной реакции вентиляции возвратного дыхания.
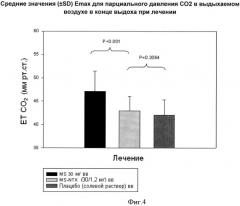
Фигура 4. График средних (±SD) Emax значений парциального давления СO2 в выдыхаемом воздухе в конце выдоха при лечении.
Фигура 5. График средних (+/- SE) насыщенных кислородом (SpO2) уровней в течение времени, определенного из пульсовой оксигемометрии после перорального введения оксикодона 60 мг, оксикодона 60 мг + налтрексона 7,2 мг (12% - текущее соотношение налтрексона в ALO-02) и плацебо.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предусмотренными данным документом являются композиции и способы введения композиций, содержащие различные активные агенты, млекопитающим в форме и способом, который минимизирует действия одного из активных агентов на другой in vivo. В частности, представленное изобретение касается опиоидных композиций, которые ослабляют угнетение дыхания, когда вводятся человеку. В конкретных вариантах осуществления изобретения, по меньшей мере, два активных агента формулируют как часть фармацевтической композиции. Первый активный опиоидный агент может обеспечивать терапевтическое действие in vivo. Второй активный агент может быть антагонистом первого активного агента и может быть полезным для ослабления угнетения дыхания, если композиция является поврежденной. Композиция остается неповрежденной во время нормального употребления пациентами и антагонист не высвобождается. Однако при повреждении композиции (например, раздавливание, разжевывание или растворение композиции) антагонист может высвобождаться, таким образом, предупреждая, уменьшая или ослабляя действие опиоида при стимулировании значительного угнетения дыхания. В конкретных вариантах осуществления изобретения активные агенты заключены оба в отдельные единицы, такие как пеллеты или гранулы, в форме слоев. Активные агенты могут быть сформулированы, главным образом, с непроницаемым барьером как, например, композиция с контролируемым высвобождением, таким образом, что высвобождение антагониста из композиции минимизируется. В конкретных вариантах осуществления изобретения, антагонист высвобождается при исследовании in vitro, но, главным образом, не высвобождается in vivo. In vitro и in vivo высвобождение активного агента из композиции может быть измерено каким-либо из нескольких хорошо известных методик. Например, высвобождение in vivo может быть определено путем измерения уровней активного агента или его метаболитов в плазме (то есть AUC, Сmax).
В одном варианте осуществления изобретения изобретение предусматривает изолирование субъединицы, содержащей опиоидный антагонист и блокирующий агент, где блокирующий агент в значительной степени предотвращает высвобождение опиоидного антагониста из изолированной субъединицы в желудочно-кишечный тракт на протяжении периода времени, который больше, чем 24 часа. Данную изолированную субъединицу вводят в отдельную фармацевтическую единицу, которая, кроме того, включает опиоидный агонист. Фармацевтическая единица, таким образом, включает сердцевинную часть, на которую нанесен опиоидный антагонист. Запечатанная оболочка затем наносится на антагонист. На запечатанную оболочку затем наносят композицию, содержащую фармацевтически активный агент в способной к высвобождению форме. Дополнительный слой, содержащий такой же или отличный блокирующий агент затем может быть нанесен таким образом, что опиоидный агонист высвобождается в желудочно-кишечный тракт на протяжении времени (то есть контролированное высвобождение). Альтернативно, слой опиоидного агониста может быть в форме непосредственного высвобождения. Таким образом, опиоидный антагонист и опиоидный агонист оба содержатся в отдельной фармацевтической единице, которая, как правило, находится в форме гранулы.
Термин "изолирующая субъединица", как использовано в данном документе, касается какой-либо фармацевтической единицы (например, гранулы или пеллеты), содержащей средства для содержания антагониста и предотвращающей или в значительной степени предотвращающей его высвобождение в желудочно-кишечный тракт, когда она не нарушена, то есть, когда нет повреждений. Термин "блокирующий агент", как использовано в данном документе, касается средств, за счет которых изолирующая единица способна в значительной степени предотвращать высвобождение антагониста. Блокирующий агент может представлять собой связывающий полимер, например, как описано очень детально ниже.
Термины "в значительной степени предотвращает", "предотвращает" или какие-либо слова, которые происходят отсюда, как использовано в данном документе, означают что антагонист в значительной степени не высвобождается из изолированной единицы в желудочно-кишечный тракт. Под термином "в значительной степени не высвобождается" подразумевают, что антагонист может высвобождаться в маленьком количестве, но высвобождаемое количество не оказывает влияние или не оказывает значительного влияния на анальгетическое действие, когда дозированную форму вводят перорально хозяину, например млекопитающему (например, человеку), как предназначено. Термины "в значительной степени предотвращает", "предотвращает" или какие-либо слова, которые происходят отсюда, как использовано в данном документе, не предусматривают обязательно полное или 100% предотвращение. Предпочтительнее, существуют варьирующие степени предотвращения, о которых какой-либо квалифицированный специалист в данной области отдает себе отчет, как имеющих потенциальное преимущество. В этом отношении блокирующий агент в значительной степени предотвращает или предотвращает высвобождение антагониста до предела, при котором предотвращается высвобождение, по меньшей мере, около 80% антагониста из изолирующей субъединицы в желудочно-кишечный тракт на протяжении периода времени, который составляет больше, чем 24 часа. Предпочтительно блокирующий агент предотвращает высвобождение, по меньшей мере, около 90% антагониста из изолирующей субъединицы в желудочно-кишечный тракт на протяжении периода времени, который составляет больше, чем 24 часа. Более предпочтительно блокирующий агент предотвращает высвобождение, по меньшей мере, около 95% антагониста из изолирующей субъединицы. Наиболее предпочтительно блокирующий агент предотвращает высвобождение, по меньшей мере, около 99% антагониста из изолирующей субъединицы в желудочно-кишечный тракт на протяжении периода времени, который составляет больше, чем 24 часа.
По результатам представленного изобретения количество высвобожденного антагониста после перорального введения может быть измерено in vitro путем исследования растворения, как описано в фармакопеи США (United States Pharmacopeia) (USP26) в главе <711> «Растворение». Например, используют 900 мл 0,1 N НС1, аппарат 2 (лопатка), 75 оборотов в минуту, при 37°С, чтобы измерить высвобождение при различных периодах времени из дозированной единицы. Другие способы измерения высвобождения антагониста из изолирующей субъединицы на протяжении заданного периода времени известны в данной области с уровня техники (смотри, например, USP26).
Без привязки к какой-либо определенной теории полагают, что изолирующая субъединица изобретения преодолеет ограничения изолированных форм антагониста, известных с уровня техники, в которых изолирующая субъединица изобретения понижает осмотически регулируемое высвобождение антагониста из изолирующей субъединицы. Кроме того, полагают, что в представленном изобретении изолирующая субъединица уменьшает высвобождение антагониста на протяжении более длительного периода времени (например, больше, чем 24 часа) по сравнению с изолированными формами антагонистов, известных с уровня техники. Факт, что изолированная субъединица изобретения предусматривает более длительное предотвращение высвобождения антагониста, является чрезвычайно релевантным, впоследствии быстрая отмена могла бы происходить после времени, на протяжении которого терапевтический агент высвобождается и действует. Хорошо известно, что время транзита через желудочно-кишечный тракт для индивидуумов значительно варьирует внутри популяции. Отсюда, остаток дозированной формы может удерживаться в тракте на протяжении более длительного времени, чем 24 часа, и в некоторых случаях более длительном, чем 48 часов. Кроме того, хорошо известно, что опиоидные анальгетики становятся причиной снижения моторики кишечника, что в дальнейшем продлевает время транзита через желудочно-кишечный тракт. В настоящее время формы с пролонгированным высвобождением, имеющим действие на протяжении 24 часового периода времени утверждены Food and Drug Administration. В этом отношении изолирующая субъединица представленного изобретения обеспечивает предотвращение высвобождения антагониста на протяжении периода времени, который составляет больше, чем 24 часа, когда изолирующая субъединица не была поврежденной.
Предполагается, что изолирующая субъединица изобретения в значительной степени предотвращает высвобождение антагониста, когда не повреждена. Под "неповрежденной" подразумевают, что дозированная форма не подвергалась повреждению. В качестве такового, антагонист и агонист отделены друг от друга внутри неповрежденной дозированной формы. Подразумевается, что термин "повреждение" включает какую-либо манипуляцию механическим, термическим и/или химическим способами, которые изменяют физические свойства дозированной формы. Повреждением может быть, например, раздавливание (например, с помощью ступки и пестика), разрезание, размалывание, разжевывание, растворение в растворителе, нагревание (например, больше, чем около 45°С) или какое-либо их комбинирование. Когда изолирующая субъединица изобретения повреждается, антагонист непосредственно высвобождается из изолирующей субъединицы. Дозированная форма, которая повредилась, таким образом, что антагонист оттуда высвобождается, рассматривается "в значительной степени разрушенной", где при введении дозированной формы субъекту (например, человеку), антагонист ингибирует или иным способом мешает активности агониста у субъекта, включая вмешательство в способность агониста вызывать угнетение дыхания. В любом случае антагонист ингибирует или иным способом вмешивается в активность агониста, что может быть определено, используя какие-либо фармакодинамические (PD) или фармакокинетические (РК) измерения, имеющиеся в распоряжении квалифицированного специалиста в данной области с уровня техники, включая, но не ограничиваясь, теми, которые описаны в данном документе. Если антагонист вмешивается в действие агониста, то статистически значительная разница в измерениях одного или более измерений PD или РК, как правило, наблюдается между дозированными формами.
Под "субъединицей" подразумевают то, что она включает композицию, смесь, частицу и т.п., что может обеспечить дозированную форму (например, пероральную дозированную форму), когда комбинируют с другой субъединицей. Субъединица может быть в форме драже, пеллеты, гранулы, сфероида или подобного и может быть комбинированным с дополнительными такими же или отличающимися субъединицами, в форме капсул, таблеток или им подобного, чтобы обеспечить дозированную форму, например, пероральную дозированную форму. Субъединица, кроме того, может быть компонентом более большой, отдельной единицы, который образует часть такой единицы, например, слой. Например, субъединица может быть сердцевиной, покрытой антагонистом и защитным слоем; данная субъединица затем может быть покрыта дополнительными композициями, включая фармацевтически активный агент, такой как опиоидный агонист.
Под "антагонистом терапевтического агента" подразумевают какое-либо лекарственное средство или молекулу природного происхождения или синтетическое, которое связывается с такой же молекулой-мишенью (например, рецептором) терапевтического агента, которое не вырабатывает терапевтический, внутриклеточный или in vivo ответ. В этом отношении антагонист терапевтического агента связывается с рецептором терапевтического агента, таким образом, предотвращая терапевтический агент от действия на рецептор. В случае опиоидов антагонист может предотвращать угнетение дыхания.
Стандартные фармакодинамические (PD) и фармакокинетические (РК) измерения могут быть использованы для сравнения действий различных дозированных форм (например, неповрежденных в противоположность "поврежденным" или "в значительной степени разрушенным") на субъект или чтобы определить, если дозированная форма была повреждена или оказалась в значительной степени разрушенной. Стандартные измерения включают, например, известные PD стандарты и шкалы, включая, но не ограничиваясь этим, один или более из визуальной аналоговой шкалы (VAS) сродства препарата (Balster & Bigelow, 2003; Griffiths et al., 2003), VAS общего сродства препарата, ARCI короткой формы (Martin et al., 1971), Cole/ARCI (Cole et al., 1982), Cole/ARCI-стимулированной эйфории, субъективной оценки лекарственного средства (Girffiths, et al., 1993; Griffiths, et al., 1996), Cole/ARCI аддиктивного протенциала, ARCI-морфин-бензедриновой группы (MBG), VAS-хороших эффектов, VAS-испытываемого наслаждения, VAS-нежелательных эффектов, VAS-испытываемой тошноты, VAS-отвращения, ARCI-LSD, Cole/ARCI-вызывания неприятных физических ощущений, Cole/ARCI-вызывания неприятных ощущений дисфории, VAS-каких-либо эффектов, VAS-головокружения, ARCI-амфетамина, ARCI-BG, Cole/ARCI-стимулирования моторики, VAS-сонливости, ARCI-PCAG, Cole/ARCI-успокоения сознания, успокоения моторики, и/или пуппилометрии (Knaggs, et al., 2004), наряду с прочим. Измерения могут включать среднее и/или усредненную площадь под кривой эффекта через 0-2 часа после введения дозы (AUE (0-2 ч)), площадь под кривой эффекта через 0-8 часов после введения дозы (AUE(0-8 ч)), площадь под кривой эффекта через 0-24 часа после введения дозы (AUE(0-24 ч)), возникающий после введения дозы диаметр зрачка (например, PCmin, РАОС(0-2 ч), РАОС(0-8 ч), РАОС(0-24 ч)), исходная оценка через 1,5 часа после введения дозы (HR1,5), максимальный эффект (Еmах), время для достижения максимального эффекта (ТЕmах).
Особенно информативными являются измерения Еmах по VAS-сродства препарата, VAS-общего сродства препарата, Cole/ARCI-стимулированной эйфории, субъективной оценке лекарственного средства, Cole/ARCI-аддитивного потенциала, ARCI-MBG, VAS-хороших эффектов, VAS-испытываемого наслаждения и пуппилометрии.
Для композиций, описанных в данном документе, РК-измерения, относящиеся к высвобождению морфина и налтрексона, могут быть пригодными. Измерения уровней морфина, налтрексона и/или 6-β-налтрексола в крови (например, плазме) или у пациентов, которым были введены различные дозированные формы, являются подходящими. Специфические РК-параметры, которые могут быть измерены, включают, например, среднюю и/или серединную пиковую концентрацию, максимальную концентрацию в плазме (Сmах), время до максимальной концентрации (Тmах), константу скорости элиминации (λz), конечный период полувыведения (Т1/2), площадь под кривой концентрация-время от 0 часов после введения дозы до 8 часов после введения дозы (AUC0-8 ч) (пг*ч/мл), площадь под кривой временной концентрации в плазме от начала отсчета времени до времени последней концентрации, поддающейся количественному определению (AUClast) (пг*ч/мл), и площадь под кривой временной концентрации в плазме от начала отсчета времени, экстраполированного на бесконечность (AUQinf) (пг*ч/мл), скорость элиминации (kе) (1/ч), коэффициент очищения (л/ч), и/или объем распределения (л). Образцы (например, кровь) могут быть забраны с тех, которым вводили дозированную форму в различные точки времени (например, через приблизительно какие-нибудь 0,5, 1, 1,5, 2, 3, 4, 6, 8, 10, 12 часов после введения). Когда образцом является кровь, плазма может быть получена из таких образцов, используя стандартные методики, и измерения могут быть сделаны из этого. Средние и/или серединные измерения в плазме затем могут быть рассчитаны и сравнены для различных дозированных форм.
В конкретных вариантах осуществления изобретения могут быть приняты во внимание одно или более из таких стандартных измерений, которые наблюдались после введения дозированной формы, отличающейся сниженной или повышенной по сравнению с той, которая наблюдалась после введения отличающейся дозированной формы, где различие между действиями дозированных форм отличается на приблизительно какой-либо из следующих диапазонов: 5-10%, 10-15%, 15-20%, 10-20%, 20-25%, 25-30%, 20-30%, 30-35%, 35-40%, 30-40%, 40-45%, 45-50%, 40-50%, 50-55%, 55-60%, 50-60%, 60-65%, 65-70%, 60-70%, 70-75%, 75-80%, 70-80%, 80-85%, 85-90%, 80-90%, 90-95%, 95-100%, и 90-100%. В некоторых вариантах осуществления изобретения могут быть приняты во внимание измерения "подобные" друг другу, где существует меньше, чем приблизительно какой-либо из 0%, 5%, 10%, 15%, 20% или 25% разницы. Разница, кроме того, может быть выражена как дробь или соотношение. Например, измерение, которое наблюдали для неповрежденной дозированной формы или в значительной степени разрушенной дозированной формы может быть выражен как дробь, например, приблизительно какая-либо из 1/2 (одной второй), 1/3 (одной третей), 1/4 (одной четвертой), 1/5 (одной пятой), 1/6 (одной шестой), 1/7 (одной седьмой), 1/8 (одной восьмой), 1/9 (одной девятой), 1/10 (одной десятой), 1/20 (одной двадцатой), 1/30 (одной тридцатой), 1/40 (одной сороковой), 1/50 (одной пятидесятой), 1/100 (одной сотой), 1/250 (одной двести пятидесятой), 1/500 (одной пятисотой) или (1/1000 одной тысячной) из тех, что в значительной степени разрушенной или неповрежденной дозированной формы, соответственно. Разница, кроме того, может быть выражена как соотношение (например, приблизительно какое-либо из 0,001:1, 0,005:1, 0,01:1, 0,1, 0,2:1, 0,3:1, 0,4:1, 0,5:1, 0,6:1, 0,7:1, 0,8:1, 0,9:1, 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9 или 1:10).
Следует рассматривать как "значительный", "статистически разный", "значительно уменьшенный" или "значительно выше", например, численные значения или измерения, относящиеся к наблюдаемой(ым) разнице(отличиям), могут быть подвергнуты статистическому анализу. Измерения предельно допустимого содержания вещества в организме могут быть собраны, и может быть определен значительный эффект от предельно допустимого содержания. Эффект от лечения может быть оценен после ковариации предельно допустимого содержания, регулирование было сделано в анализе модели ковариантности (ANCOVA). Модель может включать лечение, период и последовательность как фиксированные эффекты, и объекты вводятся в последовательности как произвольное действие. Для фармакодинамических измерений, которые имеют значения предварительной дозы, модель может включать значение предварительной дозы предельно допустимого содержания, как ковариацию. Модель линейных смешанных эффектов может быть основана из расчета протокола популяции. 5% ошибка типа I рассматривает р-значение меньшее чем 0,05, может считаться "статистически значительной" для всех индивидуальных исследований гипотезы. Все статистические исследования могут быть выполнены, используя двусторонний критерий. Для каждого из основных эффектов нулевой гипотезой может быть "не существовала главная гипотеза" и альтернативной гипотезой может быть "существовала главная гипотеза." Для каждой из противоположностей нулевой гипотезой может быть "не существовала разница от эффектов между исследуемыми парами" и альтернативной гипотезой может быть "существовала разница от эффектов между исследуемой парой." Процедура по Benjamin и Hochberg может быть использована для контролирования ошибки типа I, возникающей при сравнении многократной терапии для всех основных конечных точек.
Статистическое значение, кроме того, может быть измерено, используя анализ вариантности (ANOVA) и критерий Шуирманна двух односторонних проверок по критерию Стьюдента при 5% уровне значения. Например, подвергнутые log-преобразованию РК-параметры Cmax, AUQlast и AUQinf могут быть сопоставлены, чтобы определить статистически значительные различия между дозированными формами. 90% доверительный интервал для соотношения средних геометрических (Тест/Эталон) может быть рассчитан. Как упоминалось, в конкретных вариантах осуществления изобретения дозированные формы могут быть "биоэквивалентными", или "биоэквивалентность" может быть заявлена, если нижний или верхний доверительные интервалы log-преобразованных параметров находятся приблизительно в каком-либо из 70-125%, 80%-125% или 90-125% друг друга. Биоэквивалентный или биоэквивалентность предпочтительно заявляется, когда нижний и верхний доверительные интервалы log-преобразованных параметров находятся около 80%-125%.
Высвобождение морфина, налтрексона и 6-β-налтрексола из разных композиций in vitro может быть определено, используя стандартные методики исследования растворения, такие как описано в Фармакопее США (United States Pharmacopeia (USP26)) в главе <711> Растворение (например, 900 мл 0,1 N НСl, Прибор 2 (лопастный), 75 оборотов в минуту, при 37°С; 37°С и I00 оборотов в минуту) или 72 часа в подходящем буфере, как 500 мл 0,05М pH 7,5 фосфатный буфер), чтобы измерить высвобождение при разных временах из дозированной единицы. Другие способы измерения высвобождения антагониста из изолированной субъединицы на протяжении заданного периода времени известны из уровня техники (смотри, например, USP26) и, кроме того, могут быть использованы. Такие исследования, кроме того, могут быть использованы в модифицированной форме, например, путем применения буферной системы, содержащей поверхностно-активное вещество (например, 72 часа в 0,2% Тритон X-100/0,2% ацетат натрия/0,002 N HCl, pH 5,5). Уровни в крови (включая, например, уровни в плазме) морфина, налтрексона и 6-β-налтрексола могут быть измерены, используя стандартные методики.
Антагонистом может быть какой-либо агент, который сводит на нет действие терапевтического агента или вызывает понижение губительных эффектов опиоидов, которые вызывали угнетение дыхания.
Терапевтический агент может быть опиоидным агонистом. Под "опиоидом" подразумевают, что он включает лекарственное средство, гормон или другое химическое или биологическое вещество, природное или синтетическое, имеющее седативный, наркотический или другой(ие) подобный(е) эффект(ы) к тем, которые содержат опиум или его природные или синтетические производные. Под "опиоидным агонистом" иногда в данном документе взаимозаменяемо использовали с терминами "опиоид" и "опиоидный анальгетик" подразумевают, что он включает один или больше опиоидных агонистов, или самостоятельно, или в комбинации, и, кроме того, подразумевают, что он включает основание опиоида, смешанные или комбинированные агонисты-антагонисты, частичные агонисты, их фармацевтически приемлемые соли, их стереоизомеры, их простые эфиры, их сложные эфиры, и их комбинации.
Опиоидные агонисты включают, например, альфентанил, аллилпродин, альфапродин, анилэридин, бензилморфин, безитрамид, бупренорфин, буторфанол, клонитазен, кодеин, циклазоцин, дезоморфин, декстроморамид, дезоцин, диампромид, дигидрокодеин, дигидроэторфин, дигидроморфин, дименоксадол, димефептанол, диметиламбутен, диоксафетил бутират, дипипанон, эптазоцин, этогептазин, этилметилтиамбутен, этилморфин, этонитазен, эторфин, фентанил, героин, гидрокодон, гидроморфон, гидроксипетидин, изометадон, кетобемидон, леваллорфан, леворфанол, левофенацилморфан, лофентанил, меперидин, мептазинол, метазоцин, метадон, метопон, морфин, мирофин, налбуфин, нарцеин, никоморфин, норлеворфанол, норметадон, налорфин, норморфин, норпипанон, опиум, оксикодон, оксиморфон, папаверетум, пентазоцин, фенадоксон, феназоцин, феноморфан, феноперидин, пиминодин, пиритрамид, профептазин, промедол, проперидин, пропирам, пропоксифен, суфентанил, трамадол, тимидин, их производные или комплексы, их фармацевтически приемлемые соли, и их комбинации. Предпочтительно опиоидный агонист выбирают из группы, состоящей из гидрокодона, гидроморфона, оксикодона, дигидрокодеина, кодеина, дигидроморфина, морфина, бупренорфина, их производных или комплексов, их фармацевтически приемлемых солей и их комбинаций. Наиболее предпочтительно опиоидный агонист представляет собой морфин, гидроморфон, оксикодон или гидрокодон. В предпочтительном варианте осуществления изобретения опиоидный агонист включает оксикодон или гидрокодон и присутствует в дозированной форме в количестве от около 15 до около 45 мг, и опиоидный антагонист включает налтрексон и присутствует в дозированной форме в количестве от около 0,5 до около 5 мг. Эквианальгетические рассчитанные дозы (мг) данных опиоидов по сравнению с 15 мг дозой гидрокодона, являются следующими: оксикодон (13,5 мг); кодеин (90,0 мг), гидрокодон (15,0 мг), гидроморфон (3,375 мг), леворфанол (1,8 мг), меперидин (15,0 мг), метадон (9,0 мг), и морфин (27,0).
Гидрокодон представляет собой полусинтетическое наркотическое анальгетическое и противокашлевое средство с множественными действиями на нервную систему и желудочно-кишечный тракт. Химически гидрокодон представляет собой 4,5-эпокси-3-метокси-17-метилморфинан-6-он, и, кроме того, известен как дигидрокодеинон. Подобно другим опиоидам, гидрокодон может быть характеробразующим и из него может быть получено лекарственное средство в зависимости от морфинового типа. Подобно другим производным опиума избыточные дозы гидрокодона будут угнетать дыхание.
Пероральный гидрокодон, кроме того, является доступным в Европе (например, Бельгии, Германии, Греции, Италии, Люксембурге, Норвегии и Швейцарии) как противокашлевый агент. Парентеральный препарат, кроме того, является доступным в Германии как противокашлевый агент. Для использования как анальгетик, гидрокодона битартрат, как правило, является доступным в Соединенных Штатах только как фиксированная комбинация с неопиатными лекарственными средствами (например, ибупрофеном, ацетаминофеном, аспирином; и т.д.) для облегчения умеренной до умеренно сильной боли.
В вариантах осуществления изобретения, в которых опиоидный агонист включает гидрокодон, пероральные дозированные формы пролонгированного высвобождения могут включать дозы анальгетиков от около 8 мг до около 50 мг гидрокодона на дозированную единицу. В пероральных дозированных формах пролонгированного высвобождения, в которых гидроморфон является терапевтически активным опиоидом, он включен в количестве от около 2 мг до около 64 мг гидроморфона гидрохлорида. В другом варианте осуществления изобретения опиоидный агонист содержит морфин, и пероральные дозированные формы пролонгирован