Способ одновременного детектирования нескольких маркеров врожденных заболеваний в сухих пятнах крови
Иллюстрации
Показать всеИзобретение относится к иммунологическим методам анализа и может быть использовано для массового скрининга врожденных заболеваний у новорожденных. Для этого в лунке микропланшета иммобилизуют первые иммуноспецифические компоненты к тиротропину, иммунореактивному трипсину, тироксину и 17α-ОН-прогестерону в виде дискретных микрообластей, размещают в лунке бумажный диск образца сухой крови, экстрагируют детектируемые маркеры из сухого пятна крови путем добавления в лунку буфера, содержащего даназол и 8-анилинонафталин-1-сульфоновую кислоту и антитела к 17α-ОН-прогестерону, которые связывают с экстрагируемым 17α-ОН-прогестероном для одновременного образования иммунного комплекса с антивидовыми антителами в соответствующей микрообласти, затем добавляют в лунку микропланшета реакционный раствор вторых иммуноспецифических компонентов, содержащий смесь биотинилированных антител к тиротропину, иммунореактивному трипсину и тироксину и конъюгат 17α-ОН-прогестерон-белок-биотин для получения иммунных меченных биотином комплексов в дискретных микрообластях, удаляют бумажный диск сухого образца крови, добавляют конъюгат стрептавидина с Pt-копропорфирином для образования фосфоресцирующих биотин-стрептавидиновых комплексов в микрообластях на дне лунки микропланшета и детектируют эмиссию фосфоресценции метки, последовательно сканируя дискретные микрообласти сфокусированным лазерным пучком. Использование данного способа позволяет специфически и количественно детектировать биомаркеры в образце сухого пятна капиллярной крови новорожденных, что позволяет одновременно диагностировать три врожденные патологии новорожденных. 9 з.п. ф-лы, 7 ил., 10 табл.
Реферат
Изобретение относится к иммунологическим методам анализа и может быть использовано для массового скрининга врожденных заболеваний у новорожденных.
Ранняя диагностика врожденных аномалий у новорожденных, подлежащих терапевтической коррекции при своевременном их выявлении, позволяет обеспечить полноценное физическое и психическое развитие ребенка. Диагностика основана на количественном определении концентрации маркеров врожденных заболеваний при использовании в качестве исследуемого клинического материала сухих пятен капиллярной крови новорожденных. Ограниченное количество тестируемого материала вызывает необходимость одновременного количественного детектирования нескольких маркеров из одного образца крови. Проведение анализа в сухих пятнах цельной крови предъявляет дополнительные требования к точности, чувствительности и специфичности используемых методик. При этом способ детектирования должен быть адаптирован для проведения массовых обследований.
Известен диагностический тест для определения тироидных заболеваний (заявка США №2007/0178604, класс НКИ 436/500). В изобретении представлен способ иммунологического исследования биологических маркеров в биологическом образце, используемом для выявления тироидных расстройств путем использования комбинации «сэндвич»-анализа, последовательного конкурентного анализа и серологических исследований. В качестве твердой фазы используют различные группы частиц, покрытых различными иммунологическими связывающими агентами, иммунологическую реакцию осуществляют на поверхности частиц. Для детектирования биологических маркеров, связанных с мечеными частицами, используют проточную цитометрию. Способ позволяет одновременно выявлять в биологическом образце тиротропин, тироксин, трииодтиронин и тироид-пероксидазу.
Способ не предназначен для выявления 17α-ОН-прогестерона и иммунореактивного трипсина одновременно с тироидными гормонами.
Известен способ многоаналитного иммуноанализа (патент России №2184970, класс МПК GOIN 33/53). Способ предназначен для многоаналитного анализа образцов сухих пятен крови и может быть использован для массового скрининга врожденных аномалий у новорожденных. Способ заключается в том, что на дне лунок микротитровальной платы иммобилизуют первые биоспецифические компоненты в виде дискретных микрообластей, экстрагируют определяемые аналиты из сухого пятна крови путем добавления в лунку смеси буфера и конъюгата со вторыми биоспецифическими компонентами к определяемым аналитам. Реакцию биоспецифического связывания с мечеными Pt-копро- или уропорфирином биоспецифическими компонентами проводят в дискретных областях первых иммобилизованных биоспецифических компонентов, а эмиссию флуоресценции детектируют путем последовательного сканирования микрообластей сфокусированным лазерным пучком.
Недостатком способа является низкая чувствительность при количественном детектировании аналитов.
Известен способ детектирования биомаркеров (заявка США №2011/01599530, класс НКИ 435/28). В изобретении описан способ детектирования двух и более биомаркеров, используемых при скрининге новорожденных для выявления врожденных заболеваний. В способе используют образец сухого пятна крови диаметром 3,2 мм, который помещают в лунку микротитровальной платы (микропланшет), экстрагируют кровь путем добавления универсального буфера, который позволяет экстрагировать все искомые биомаркеры, в частности тиротропин, тироксин, иммунореактивный трипсин и 17α-ОН-прогестерон. В качестве твердой фазы используют набор микрочастиц, меченных двумя флуоресцентными метками для детектирования типа частиц и соответствующего биомаркера, при этом концентрацию биомаркеров уточняют путем определения величины гематокрита из измеренной концентрации гемоглобина. Детектирование осуществляют путем использования проточной цитометрии.
Недостатком способа является большое количество операций и использование проточной цитометрии, что усложняет и удорожает способ.
Наиболее близким является способ обнаружения нескольких аналитов в образце сухой крови (Jong-Juan, at all. Simaltaneous Quadruple-Label Fluorometric Immunoassay of Thiroid-Stimulating Hormone, 17α-hidroxyprogesterone, Immunoreactive Tripsin, and Creative Kinase MM Isoenzyme in Dried Blood Spots. B: CLIN.CHEM., vol.38, №10, 1992, p.2038-2043). Способ позволяет одновременно обнаруживать четыре аналита в образце сухой крови: тиротропиц (ТТГ), 17α-ОН-прогестерон, иммунореактивный трипсин (ИРТ) и креатин киназу ММ. Анализ осуществляют в лунках микротировального стрипа, поверхность которых покрыта смесью моноклональных антител против β-ТТГ, ИРТ и КК-ММ и поликлональных антител против 17α-ОН-прогестерона, для выявления искомых аналитов в качестве меток используют ионы лантанидов: Eu3+, Sm3+, Tb3+ и Dy3+. Интенсивность флуоресценции каждой метки измеряют на флуопиметре с временным разрешением. Для достижения необходимой чувствительности в способе осуществляют перекомплексацию ионов лантанидов из одного хелатного комплекса в другой и добавление раствора, усиливающего люминесценцию меток, что приводит к усложнению способа.
Недостатком способа является сложность осуществления анализа из-за использования большого количества операций. Кроме того, точность анализа снижается из-за перекрестного влияния эмиссии люминесценции меток при определении количественного значения аналитов.
Задачей является создание способа детектирования маркеров врожденных заболеваний новорожденных.
Техническим результатом, достигаемым при использовании изобретения, является повышение точности и специфичности количественного детектировании биомаркеров в образце сухого пятна крови, взятого у новорожденных.
Технический результат достигается тем, что в известном способе одновременного детектирования нескольких маркеров врожденных заболеваний в сухих пятнах крови, включающем иммобилизацию в лунке микропланшета первых иммуноспецифических компонентов к тиротропину, иммунореактивному трипсину и 17α-ОН-прогестерону, размещение в лунке бумажного диска образца сухой крови, экстрагирование детектируемых маркеров из сухого пятна крови путем добавления в лунку буфера, содержащего даназол, проведение иммунной реакции со специфическими моноклональными антителами и 17α-ОН-прогестероном, меченными люминесцентной меткой, и детектирование в режиме временного разрешения эмиссии люминесценции метки, связанной с комплексами, в лунке микропланшета дополнительно иммобилизуют первые иммуноспецифические компоненты для детектирования тироксина, все иммуноспецифические компоненты для каждого маркера иммобилизуют на дне лунки микропланшета в виде дискретных областей, в буфер для экстрагирования маркеров добавляют 8-анилинонафталин-1-сульфоновую кислоту и антитела к 17α-ОН-прогестерону, которые связывают с экстрагируемым 17α-ОН-прогестероном для одновременного образования иммунного комплекса с антивидовыми антителами в соответствующей микрообласти, затем в лунку микропланшета добавляют реакционный раствор вторых иммуноспецифических компонентов, содержащий смесь трех биотинилированных антител к тиротропину, иммунореактивному трипсину и тироксину (Т4) и конъюгат 17α-ОН-прогестерон-белок-биотин для получения иммунных меченных биотипом комплексов на дискретных микрообластях, удаляют бумажный диск сухого образца крови, добавляют конъюгат стрептавидина с Pt-копропорфирином для образования фосфоресцирующих биотин-стрептавидиновых комплексов на микрообластях на дне лунки микротитровальной платы, а эмиссию фосфоресценции метки детектируют, последовательно сканируя дискретные микрообласти сфокусированным лазерным пучком.
Технический результат достигается тем, что при экстрагировании даназол используют для вытеснения 17α-ОН-прогестерона из комплексов с белками.
Технический результат достигается тем, что при экстрагировании 8-анилинонафталин-1-сульфоновую кислоту используют для разрушения комплексов тироксина с белками.
Технический результат достигается также тем, что дискретные микррообласти наносят на дно лунки микропланшета в виде по крайней мере трех микрозон для каждого маркера.
Технический результат достигается тем, что в качестве иммунопецифического компонента для выявления тиротропина используют моноклональные антитела к тиротропину.
Технический результат достигается также тем, что в качестве иммуноспецифического компонента для выявления тироксина используют гетерогенный конъюгат трииодтиронина с белковым носителем.
Технический результат достигается также и тем, что в качестве иммуноспецифического компонента для выявления 17α-ОН-прогестерона используют антивидовые антитела к иммуноглобулинам кролика.
Технический результат достигается также тем, что в качестве иммуноспецифического компонента для выявления иммунореактивного трипсина используют моноклональные антитела к трипсину.
Технический результат достигается также тем, что в качестве второго иммуноспецифического компонента для выявления тироксина используют мышиные моноклональные антитела.
Технический результат достигается также тем, что в качестве второго иммуноспецифического компонента для выявления 17а-ОН-прогестерона используют поликлональные кроличьи антитела.
Авторам не известны технические решения с совокупностью признаков, подобной заявляемой, следовательно, предлагаемое изобретение соответствует критерию новизны.
Известны технические решения, используемые для выявления--маркеров врожденных заболеваний новорожденных в сухом пятне крови (Jong-Juan, at all. Simaltaneous Quadruple-Label Fluorometric Immunoassay of Thiroid-Stimulating Hormone, 17α-hidroxyprogesterone, Immunoreactive Tripsin, and Creative Kinase MM Isoenzyme in Dried Blood Spots, заявка США №2011/01599530, класс НКИ 435/28, патент России №2184970, класс МПК GOIN 33/53 и др.). В известных технических решениях детектируют два и более маркеров врожденных заболеваний новорожденных, или несколько тироидных гормонов, используя иммобилизацию биоспецифических компонентов к детектируемым маркерам в лунке или на дне лунки микропланшета, экстрагирование маркеров из образца сухого пятна крови, проведение биоспецифических реакций с образованием биоспецифических комплексов, меченных флуоресцентной или люминесцентной меткой и детектирование эмиссии люминесценции метки тем или иным известным способом. В предлагаемом техническом решении за счет введения в лунку реакционного раствора, содержащего биотинилированные антитела к тиротропину, иммунореактивному трипсину и тироксину и конъюгата 17α-ОН-прогестерон-белок-биотин, 8-анилинонафталин-1-сульфоновую кислоту и даназол в совокупности с остальными признаками создается возможность с большей точностью выделить из пробы крови и детектировать указанные маркеры, что повышает точность и специфичность количественного анализа образца сухого пятна крови, взятого у новорожденных. Следовательно, предлагаемое изобретение соответствует критерию уровня техники.
Изобретение может быть использовано в здравоохранении, в частности в педиатрии и неонаталогии для скрининга, своевременного выявления врожденных аномалий развития детей и проведения соответствующей коррегирующей терапии. Следовательно, предлагаемое изобретение соответствует критерию промышленной применимости.
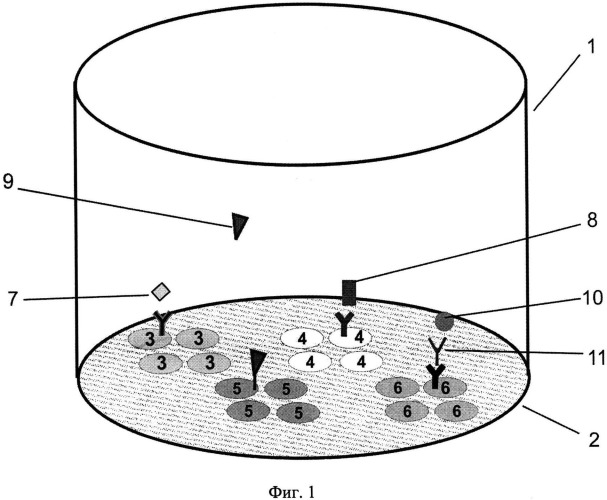
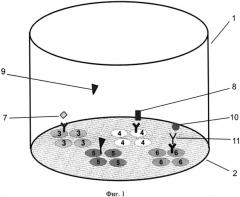
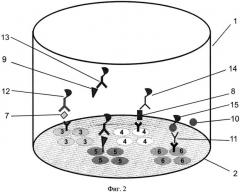
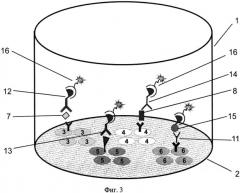
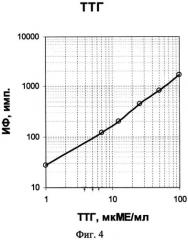
На фиг.1, 2 и 3 представлены схемы различных стадий проведения детектирования маркеров из образца сухого пятна крови, где 1 - лунка 96-луночного микропланшета, 2 - дно лунки, 3 - микрообласти для детектирования тиротропина (ТТГ), 4 - микрообласти для детектирования иммунореактивного трипсина (ИРТ), 5 - микрообласти для детектирования общего тироксина (T4), 6 - микрообласти для детектирования 17α-ОН-прогестерона (17ОП), 7 - исследуемый ТТГ из крови, 8 - исследуемый ИРТ, 9 - исследуемый Т4, 10 - исследуемый 17ОП, 11 - антитела к 17ОП, 12 - меченные биотином анти-ТТГ антитела, 13 - меченные биотином анти-Т4 антитела, 14 - меченные биотином анти-ИРТ антитела, 15 - конъюгат 17ОП-биотин и 16 - конъюгат стрептавидин-Pt-копропорфирин; на фиг.4 представлена, калибровочная кривая для определения концентрации ТТГ; на фиг.5 представлена калибровочная кривая для определения концентрации ИРТ; на фиг.6 представлена калибровочная кривая для определения концентрации Т4; на фиг.7 представлена калибровочная кривая для определения концентрации 17ОП;
Способ осуществляется следующим образом.
В образцах сухих пятен капиллярной крови новорожденных одновременно количественно детектируют четыре аналита, которые служат маркерами врожденных заболеваний у новорожденных. Низкий уровень в крови новорожденного гормона щитовидной железы тироксина в сочетании с высоким уровнем гормона тиротропина являются маркерами возможного развития у ребенка врожденного гипотиреоза. Одновременное определение значений концентрации двух гормонов позволяет более точно диагностировать различные формы этого заболевания. Для диагностики врожденной гиперплазии надпочечников, адреногенитального синдрома, используют обнаружение в крови новорожденных повышенного уровня кортикостероидного гормона 17α-ОН-прогестерона а для диагностики другого врожденного заболевания, муковисцидоза, используют обнаружение повышенного уровня иммунореактивного трипсина.
Схема детектирования маркеров показана на фигурах 1, 2, 3.
На дне каждой лунки 1 микропланшета формируют дискретные микрообласти для количественного выявления указанных четырех маркеров. Для этого на дне 2 лунки 1 иммобилизуют в виде дискретных микрообластей первые иммуноспецифические компоненты: микрообласть 3 для выявления ТТГ - мышиные моноклональные антитела к ТТГ, микрообласть 4 для выявления ИРТ - мышиные моноклональные антитела к иммунореактивному трипсину, микрообласть 5 для выявления Т4 - конъюгат трииодтиронина с бычьим сывороточным альбумином (БСА), микрообласть 6 для выявления 17ОП - антивидовые антитела к иммуноглобулинам кролика. На дне каждой лунки планшета для выявления каждого из четырех маркеров иммобилизуют по крайней мере три одинаковые микрообласти, что позволяет снизить вариабельность и повысить точность результатов количественного анализа маркеров в крови.
Диаметр каждой микрообласти составляет примерно 0,5 мм. При таком размере микрообласти на твердую фазу иммобилизуется малое количество иммуноспецифических компонентов. В связи с этим при иммобилизации микрообласти для выявления 17ОП используют антивидовые антитела 6 к иммуноглобулинам кролика, потому что непосредственная иммобилизация специфических кроличьих антител к 17ОП не обеспечивает необходимого уровня и диапазона регистрируемого сигнала. При иммобилизации микрообласти 5 для выявления тироксина применяют гетерологичный конъюгат с трииодтиронином, так как известно, что для некоторых моноклональных антител к Т4, это может приводить к ингибированию связывания антител в ходе конкурентной реакции при более низких уровнях исследуемого аналита в крови, что, соответственно, повышает чувствительность анализа. В раствор для иммобилизации добавляют глицерин для снижения скорости высыхания капель и, соответственно, повышения полноты и равномерности сорбции биоспецифических компонентов.
Для проведения анализа из высушенного на фильтровальной бумаге пятна исследуемой крови вырезают диск диаметром 3,2 мм и помещают в сенсибилизированную лунку микропланшета. Анализ проводят в три стадии: две стадии иммуноаналитические (фиг.1 и фиг.2) и одна - детектирующая (фиг.3). На первой стадии (см. фиг.1) в лунку микропланшета добавляют экстрагирующий буфер, содержащий даназол, 8-анилинонафтален-1-сульфоновую кислоту (8-АНС) и высоко специфические кроличьи поликлональные антитела к 17ОП. В процессе экстрагирования из пропитанного кровью бумажного диска в раствор экстрагируют четыре исследуемых маркера. Два экстрагируемых маркера ТТГ7 и ИРТ8 связывают с соответствующими моноклональными антителами, иммобилизованными в виде дискретных областей 3 и 4 на дне лунки планшета (см. фиг.1). Два других маркера 17ОП 9 и Т4 10 экстрагируют в виде комплексов с белками крови, что препятствует их связыванию с антителами и, следовательно, правильному измерению. Для вытеснения 17ОП из комплексов с белками используют стероидное соединение даназол, а для разрушения комплексов тироксина - кислоту 8-АНС. Разрушение комплексов в присутствии данных химически активных реагентов на стадии экстрагирования позволяет снизить известное их негативное влияние на аффинность моноклональных антител, специфичных к другим маркерам. Освобожденный 17ОП 9 связывают в растворе со специфическими кроличьими антителами 11 с одновременным образованием иммунного комплекса с антивидовыми антителами, иммобилизованными в микрообласти 6 для выявления 17ОП (см. фиг.1).
Для проведения второй стадии анализа (см. фиг.2) в лунку микропланшета добавляют реакционный раствор вторых иммуноспецифических компонентов, содержащий смесь трех биотинилированных моноклональных антител: к ТТГ, Т4 и ИРТ, и конъюгат 17α-ОН-прогестерон-БСА-биотин, соответственно, поз.12, 13, 14 и 15 на фиг.2. При этом одновременно проводят четыре иммунореакции (фиг.2): меченные биотипом вторые моноклональные антитела к ТТГ12 и ИРТ14 образуют «сэндвич»-комплексы па соответствующих микрообластях 3 и 4; Т4 из пробы 9 конкурирует за связывающие центры меченных биотином моноклональных антител к тироксину 13 с иммобилизованным трииодтиронином 5; а конъюгат 17α-ОН-прогестерон-БСА-биотин 15 вытесняет 17ОП 10 из иммунного комплекса на микрообласти 6 для выявления 17ОП. Биотинилирование вторых иммуноспецифических компонентов применяют для усиления сигнала иммунных комплексов, образующихся на специфических микрообластях.
Для конкурентного анализа 17ОП используют конъюгат 17α-ОН-прогестерон-БСА-биотин, полученный присоединением биотина к 17α-ОН-прогестерону, предварительно конъюгированному с БСА, что позволяет, во-первых, увеличить нагрузку меченного конъюгата, соотношение биотин/конъюгат, и, во-вторых, пространственно разнести 17ОП и биотин в конъюгате, и тем самым упростить взаимодействие с антителами и последующее связывание биотина со стрептавидином. Использование конъюгата с такими свойствами приводит к увеличению интенсивности регистрируемого сигнала и расширению динамического диапазона измерений и, соответственно, к повышению точности измерения концентрации маркера.
Проведение иммуноаналитических реакций в две стадии: сначала связывание высвобождаемых маркеров с антителами (см. фиг.1), а затем конкуренция с добавленным конъюгатом 17α-ОН-прогестерон-БСА-биотин для 17α-ОН-прогестерона или связывание со вторыми меченными биотином моноклональными антителами для ТТГ и ИРТ (см. фиг.2), позволяет повысить специфичность анализа, снизить влияние других структурно схожих соединений крови, что особенно важно при определении уровня 17ОП у новорожденных с малым сроком гестации, в крови которых может содержаться очень высокий уровень промежуточного стероидного гормона 17α-ОН-прегненолона. Данный способ проведения иммунореакции позволяет снизить количество ложноположительных результатов, особенно у недоношенных новорожденных и тем самым значительно повысить специфичность и точность детектирования маркеров.
После инкубирования диск с образцом крови удаляют и микропланшет отмывают.
Для проведения третьей стадии анализа (см. фиг.3) в лунки микропланшета добавляют детектирующий раствор, содержащий конъюгат стрептавидина с Pt-копропорфирином 16, который образует фосфоресцирующие биотин/стрептавидин комплексы на всех специфических микрообластях на дне лунок микропланшета. Затем микропланшет отмывают и высушивают. Детектирование эмиссии фосфоресценции проводят в режиме временного разрешения люминесценции путем последовательного сканирования сфокусированным лазерным лучом каждой микрообласти на дне лунки микропланшета.
По результатам анализа мультианалитных калибровочных проб строят четыре калибровочные кривые для определения значения концентраций маркеров в исследуемом образце крови, показанные на фиг.4-7. Мультианалитные калибровочные пробы представляют собой набор высушенных пятен крови, каждое из которых содержит смесь четырех исследуемых маркеров в различных соотношениях.
Регистрируемый сигнал при анализе ТТГ и ИРТ прямо пропорционален концентрации маркеров в крови (см. фиг.4 и 5), а сигнал, регистрируемый при анализе Т4 и 17ОП, обратно пропорционален концентрации этих маркеров в крови (см. фиг.6 и 7).
С помощью данного способа проводят одновременное количественное определение четырех маркеров, экстрагируемых в лунку микропланшета из одного пропитанного исследуемой кровью бумажного диска диаметром 3,2 мм, то есть анализ проводят в одинаковом разведении образца исследуемой крови в одном реакционном растворе для всех маркеров. При этом для каждого из маркеров характерен свой клинически значимый диапазон концентраций для постановки диагноза, в частности, необходимо одновременно измерять низкие концентрации ТТГ (от 2 мкМЕ/мл) и очень высокие уровни ИРТ (до 300 нг/мл). Повышение точности и специфичности одновременного измерения концентрации четырех маркеров в клинически значимых диапазонах получают за счет всей совокупности признаков, включающей иммобилизацию нескольких микрозон биоспецифических реагентов в каждой микрообласти, использование иммуноспецифических компонентов (гетерологичного конъюгата Т3-БСА, высокоаффинных специфических и антивидовых антител, конъюгата 17ОП-БСА-биотин), а также биотин-стрептавидинового комплекса, высокофосфоресцирующей метки и способа детектирования фосфоресценции на поверхности микрозон. Особое значение имеет последовательность проведения операций при добавлении реагентов в сенсибилизированную лунку планшета при проведении мультианализа: на первой стадии проводят экстракцию маркеров из образцов сухих пятен крови, высвобождение из комплексов с белками крови и связывание со специфическими антителами, а на второй - связывание с меченными вторыми специфическими антителами и проведение конкурентных иммунных реакций. Такой способ проведения анализа позволяет избежать перекрестного влияния присутствующих в реакционной смеси реагентов, специфических к различным маркерам, и повысить чувствительность и специфичность одновременного детектирования маркеров в крови, что необходимо для эффективного выявления новорожденных с подозрением на врожденный гипотиреоз, адреногенитальный синдром и муковисцидоз при проведении неопаталыюго скрининга.
Пример 1. Детектирование тиротропина в сухих пятнах крови.
На поверхности дна лунки полистиролового 96-луночного микропланшета (Labsystems, кат. №95029140) иммобилизуют специфические дискретные микрообласти для выявления маркеров ТТГ, ИРТ, Т4 и 17ОП. Для детектирования каждого маркера иммобилизуют по 4 идентичные микрообласти диаметром 0,5 мм, всего 16 микрообластей на дне каждой лунки. Для этого на дно каждой лунки микропланшета с помощью прибора для печатания чипов наносят в строго отведенные точки микрокапли объемом по 25 нл растворов соответствующих иммуноспецифических компонентов в концентрации 0,1 мг/мл. Для создания микрообластей, специфичных к ТТГ, используют мышиные моноклональные антитела к ТТГ, для микрообластей для выявления ИРТ используют мышиные моноклональные антитела к иммунореактивному трипсину, для микрообластей, специфичных к Т4, используют гетерологичный конъюгат трииодтиронина с БСА, а для микрообластей для выявления 17ОП используют антивидовые антитела к иммуноглобулинам кролика. Конъюгат трииодтиронина с БСА синтезируют карбидиимидным методом (Бекман Н.И. и др. Клин.лаб.диагностика 2004, №8). Для снижения скорости высыхания капель в раствор для сорбции добавляют 5% глицерина (Sigma). Микропланшет инкубируют в течение 18 часов при 4°C, промывают и обрабатывают блокирующим раствором 15 мМ фосфатного буфера, содержащего 1% БСА (бычий сывороточный альбумин), в течение 1 часа при комнатной температуре, удаляют блокирующий раствор и высушивают микропланшет.
Для проведения анализа из высушенного на фильтровальной бумаге пятна крови с известным содержанием ТТГ (производство ЗАО «ИММУНОСКРИН», Россия) вырезают диск диаметром 3,2 мм и помещают в лунку сенсибилизированного микропланшета. Затем в лунку микропланшета добавляют 25 мкл реакционного буфера, универсального для детектирования всех четырех маркеров, содержащего 15 мМ трис-буфер при рН 7,75, 0,05% твин 20, 5% БСА (все реагенты SIGMA, США), 0,15 мг/мл 8-анилинонафтален-1-сульфоновой кислоты (Biomedicals, США) и 0,3 мг/л даназола (SIGMA, США). Микроланшет инкубируют при встряхивании при температуре 18-25°C в течение 5 минут, добавляют 25 мкл раствора биотинилированных мышиных моноклональных антител к ТТГ в концентрации 2,5 мкг/мл в реакционном буфере. Для присоединения биотиновой метки к антителам используют реакцию с биотин-N-гидроксисукцинимидным эфиром Sigma, США, кат. № H1759). Микропланшет инкубируют при встряхивании в течение 1 минуты при температуре 18-25°C и 18 часов при температуре 2-8°C без встряхивания. Удаляют диски из лунок и промывают планшет. После инкубирования в лунку микропланшета добавляют 25 мкл раствора конъюгата стрептавидина с Pt-копропорфирином и инкубируют в течение 15 минут при комнатной температуре, промывают и высушивают микропланшет. Конъюгат синтезируют через N-гидроксисукцинимид Pt-копропорфирина, полученный карбодиимидным методом (De Haas R.R. et.al., J.Histochem.&Cytochem. 1997. - 45. - 1279-1292).
Детектирование эмиссии фосфоресценции осуществляют путем последовательного сканирования дна лунки сухого микропланшета лазерным лучом с длиной волны возбуждения 365 нм и регистрации сигнала в режиме измерения длительной фосфоресценции Pt-копропорфирина на длине волны 645 нм. По результатам сканирования для каждого исследуемого маркера рассчитывают среднее число фотоимпульсов по всем специфическим для маркера микрообластям.
Полученные результирующие значения интенсивностей сигнала от микрообластей приведены в таблице 1. Как видно из представленных результатов, нарастание сигнала на специфических к ТТГ микрообластях при увеличении концентрации ТТГ в образцах имеет линейный характер, со значительным, более чем в 6 раз, превышением сигнала при анализе образца ТТГ 10 мкМЕ/мл над сигналом от образца с нулевым содержанием ТТГ, что свидетельствует о высокой чувствительности способа и возможности точного измерения низких концентраций маркера. Интенсивность специфического сигнала сохраняется и в присутствии активных добавок (8-АНС и даназола) в составе реакционного буфера. Вместе с тем, значения интенсивности сигнала от микрообластей, специфичных к другим трем маркерам, варьируют в пределах, не превышающих значений, полученных для нулевого образца ТТГ (см. табл.1), что доказывает отсутствие перекрестных взаимодействий при данном способе проведения мультианалитного анализа и, соответственно, высокую специфичность способа.
Пример 2. Детектирование общего тироксина в сухих пятнах крови.
В лунку микропланшета, сенсибилизированного, как описано в примере 1, помещают пропитанный кровью диск диаметром 3,2 мм, вырезанный из высушенного на фильтровальной бумаге пятна крови с известным содержанием Т4 (производство ЗАО «Иммуноскрин», Россия), добавляют 25 мкл универсального реакционного буфера, описанного в примере 1, и инкубируют микропланшет при встряхивании при температуре 18-25°C в течение 5 минут. В лунку микропланшета добавляют 25 мкл раствора биотинилированных мышиных моноклональных антител к Т4 в реакционном буфере в концентрации 1 мкг/мл. Для соединения биотиновой метки с антителами используют реакцию с биотин-аминогексан-N-гидроксисукцинимидным эфиром (Sigma, США, кат. № В2643). Микропланшет инкубируют при встряхивании в течение 1 минуты при температуре 18-25°C и 18 часов без встряхивания при температуре 2-8°C, удаляют диски из лунок и промывают микропланшет.
Детектирование осуществляют так, как описано в примере 1.
Результаты детектирования приведены в таблице 2. Как и в примере 1, зависимость сигнала на специфических к Т4 микрообластях от концентрации Т4 в исследуемом образце имеет линейный характер. Как видно из таблицы 2, в данном примере показано, что уровень общего тироксина в крови возможно измерять при условии разделения иммуноанализа на две стадии и проведения его в универсальном реакционном буфере. Значения интенсивности сигнала от микрообластей, специфичных к другим трем маркерам, не превышают фоновых значений, что подтверждает отсутствие перекрестных взаимодействий и высокую специфичность способа.
Пример 3. Детектирование иммунореактивного трипсина в сухих пятнах крови.
В лунку микропланшета, сенсибилизированного, как описано в примере 1, помещают пропитанный кровью диск диаметром 3,2 мм, вырезанный из высушенного на фильтровальной бумаге пятна крови с известным содержанием ИРТ (производство ЗАО «ИММУНОСКРИН», Россия), добавляют 25 мкл универсального реакционного буфера состава, описанного в примере 1, и инкубируют при встряхивании при температуре 18-25°C в течение 5 минут. Затем в лунку микропланшета добавляют 25 мкл раствора биотинилированных моноклональных антител к ИРТ в реакционном буфере в концентрации 2,5 мкг/мл. Для соединения биотиновой метки с антителами используют реакцию с биотин-N-гидроксисукцинимидным эфиром (Sigma, США, кат. № Н1759). Микропланшет инкубируют при встряхивании в течение 1 минуты при температуре 18-25°C и 18 часов при температуре 2-8°C без встряхивания. Удаляют диск из лунки и промывают микропланшет.
Детектирование осуществляют так, как описано в примере 1.
Из результатов детектирования, приведенных в таблице 3, видно, что при анализе образцов, содержащих ИРТ, способ позволяет регистрировать высокий уровень сигнала от соответствующих микрообластей со значительным, более чем в 50 раз, отрывом результата исследования образца с минимальным уровнем ИРТ от исследования нулевого образца, что свидетельствует о высокой чувствительности способа. Как видно из таблицы 3, специфичность способа подтверждается отсутствием значимых сигналов на микрообластях, специфических к другим маркерам.
Пример 4. Детектирование 17α-ОН-прогестерона в сухих пятнах крови.
В лунку микропланшета, сенсибилизированного, как описано в примере 1, помещают пропитанный кровью диск диаметром 3,2 мм, вырезанный из высушенного на фильтровальной бумаге пятна крови с известным содержанием 17ОП (производство ЗАО «ИММУНОСКРИН», Россия), добавляют 25 мкл раствора кроличьих поликлональных анти-17ОП антител в реакционном буфере и инкубируют при встряхивании в течение 5 минут при температуре 18-25°C. Затем в лунку микропланшета добавляют 25 мкл раствора конъюгата 17ОП-БСА-биотин в концентрации 1 мкг/мл в реакционном буфере, который синтезируют с использованием биотин-аминогексан-N-гидроксисукцинимидного эфира (Sigma, США, кат. № В2643) из конъюгата 17ОП-БСА, полученного присоединением карбодиимидным методом 17α-ОН-прогестерон-3-оксима (Sigma, США) к БСА (Sigma, США). Микропланшет инкубируют при встряхивании в течение 1 минуты при температуре 18-25°C и 18 часов при температуре 2-8°C без встряхивания.
Детектирование осуществляют так, как описано в примере 1.
Результаты детектирования, приведенные в таблице 4, свидетельствуют о том, что проведение иммуноанализа в универсальном буфере с образованием комплексов антивидовых антител со специфическими антителами и конъюгатом 17ОП-БСА-биотин позволяет достичь величин специфических сигналов, достоверно отличающихся от фоновых значений, при этом сигналы, регистрируемые на специфических к другим маркерам микрообластях, не превышают уровня фоновых значений, что видно из таблицы 4.
Как видно из примеров 1-4 способ позволяет получить высокую специфичность и чувствительность одновременного детектирования каждого из четырех исследуемых в сухих образцах крови маркеров.
Пример 5. Построение калибровочных кривых для одновременного количественного определения маркеров ТТГ, ИРТ, Т4 и 17ОП в сухих пятнах крови.
Мультикомпонентные калибровочные пробы, содержащие ТТГ, ИРТ, Т4 и 17ОП, готовят из очищенной от маркеров цельной крови доноров добавлением соответствующих количеств тиротропина (ICN, США), трипсина (USBiological, США), тироксина (ICN, США) и 17α-ОН-прогестерона (ICN, США) и нанесением полученных растворов крови в виде капель по 100 мкл на специальные бланки фильтровальной бумаги (Schleicher & Schuell, Германия, кат. №903) с последующим высушиванием образующих пятен крови на воздухе. Приготовленные пробы аттестуют по уровню маркеров, используя коммерческие лантанидные моно-тесты «ТТГ-НЕОСКРИН», «ИРТ-НЕОСКРИН», «Т4-скрин» и «17α-ОН-ПРОГЕСТЕРОН-НЕОСКРИН» (ЗАО «ИММУНОСКРИН», РФ). Полученные результаты аттестации представлены в таблице 5.
Для проведения анализа из сухих мультикомпонентных калибровочных проб вырезают пропитанные кровью диски диаметром 3,2 мм и помещают по одному в лунки сенсибилизированного микропланшета, как описано в примере 1. Анализ каждого калибратора проводят в дублях. В каждую лунку микропланшета добавляют по 25 мкл раствора кроличьих поликлональных анти-17ОП антител в универсальном реакционном буфере, содержащем 15 мМ трис-буфер при рН 7,75, 0,05% твин 20, 5% БСА (все реагенты SIGMA, США), 0,15 мг/мл 8-анилинонафтален-1-сульфоновой кислоты (Biomedicals, США) и 0,3 мг/л даназола (SIGMA, США). Микропланшет инкубируют при встряхивании в течение 5 минут при температуре 18-25°C. Затем в каждую лунку микропланшета добавляют по 25 мкл смеси трех биотинилированных мышиных моноклональных антител к ТТГ в концентрации 2,5 мкг/мл, к ИРТ в концентрации 2,5 мкг/мл и к Т4 в концентрации 1 мкг/мл и 1 мкг/мл конъюгата 17ОП-БСА-биотин в реакционном буфере. Микропланшет инкубируют при встряхивании в течение 1 минуты при температуре 18-25°C и 18 часов при температуре 2-8°C без встряхивания.
Детектирование осуществляют так, как описано в примере 1.
При окончательной оценке результатов определения каждого гормона используют средние значения данных сканирования лунок микропланшета, в которых был проведен повторный анализ калибровочных проб. По результатам анализа мультианалитных калибровочных проб строят четыре калибровочные кривые зависимости средних значений интенсивности измеренного на соответствующих микрообластях сигнала от концентрации маркеров в мультианалитных пробах. Полученные кривые для определения ТТГ представлены на фиг.4, для ИРТ - на фиг.5, для Т4 - на фиг.6 и для 17ОП - на фиг.7. Результирующий уровень сигнала, характеризующий ТТГ или ИРТ, прямо пропорционален, а уровень сигнала, характеризующий Т4 или 17ОП, обратно пропорционален концентрации соответствующих маркеров в исследуемом образце крови, так как одновременно в одной реакционной смеси проходят две «сэндвич» иммунные реакции с ТТГ и с ИРТ, и две конкурентные иммунные реакции с низкомолекулярными маркерами Т4 и 17ОП. Как следует из калибровочных кривых, показанных на фиг.4-7, предложенный способ позволяет проводить одновременное количественное определение маркеров в высушенных образцах крови в диапазонах концентраций от 0 до 250 мкМЕ/мл ТТГ, от 0 до 300 нг/мл ИРТ, от 0 до 200 нмоль/л Т4 и от 0 до 300 нмоль/л 17ОП, что вполне соответствует диапазонам измерения концентраций маркеров, которые необходимы для диагностики врожденного гипотиреоза, врожденной гиперплазии надпочечников и муковисцидоза у новорожденных. При этом чувствительность способа детектирования составляет 2 мкМЕ/мл для ТТГ, 4 нг/мл для ИРТ, 10 нмоль/л для Т4 и 2 нмоль/л для 17ОП, что также удовлетворяет признанным критериям эффективности способа анализа крови для целей неонатального скрининга заболеваний.
Пример 6. Количественное определение концентрации маркеров ТТГ, ИРТ, Т4 и 17ОП в контрольных сухих пятнах крови.
Способ осуществляют так, как описано в примере 5. В качестве исследуемых образцов используют контрольные образцы сухих пятен крови с известным содержанием маркеров в крови (Centers for Disease Control and Prevention, US).
Для детектирования маркеров из исследуемого пятна крови вырезают пропитанный кровью диск диаметром 3,2 мм и помещают в лунку микропланшета. Анализ каждого образца проводят в десяти повторах. Далее анализ про