Питательные композиции
Иллюстрации
Показать всеИзобретение относится к предназначенным для детей питательным композициям. Питательная композиция для детей содержит источник жиров, источник углеводов, источник белков и источник β-глюкана, содержащий β-1,3;1,6-глюкан в виде микрочастиц. Как вариант вышеуказанная питательная композиция для детей представляет собой матрицу на основе молока. Предложен также способ усиления функции иммунной системы у детей, предусматривающий введение матрицы на основе молока, содержащей β-глюкан в виде микрочастиц β-1,3;1,6-глюкана. Изобретение позволяет получить питательную композицию с улучшенной усвояемостью, а также усилить и улучшить иммунный ответ у детей. 3 н. и 14 з.п. ф-лы, 3 ил., 1 табл., 1 пр.
Реферат
Область техники
Настоящее изобретение относится к предназначенным для детей питательным композициям, таким как питательные композиции на основе молока, более точно смесям для детского питания и питательным продуктам для детей. Кроме того, изобретение также относится к способам усиления иммунной функции у детей, включающим введение эффективного количества β-глюкана, в особенности в составе матрицы на основе молока.
Уровень техники
Младенцы и дети подвержены воздействию разнообразных болезнетворных микроорганизмов, при этом частота возникновения инфекционных заболеваний является максимальной в течение четырех первых лет жизни. Новорожденные обычно защищены антителами, поступающими в их организм через плаценту до рождения и затем с материнским молоком после рождения; тем не менее, поскольку у новорожденных не сформирована иммунная система, их организм часто не способен вырабатывать эффективный иммунный ответ. В действительности, на клеточном уровне организм младенцев обладает сниженной способностью увеличивать концентрацию лейкоцитов там, где это необходимо (Maternity and Gynecologic Care, Bobak, Jensen, Zalar, 4-е издание, стр. 470). Соответственно, новорожденные не способны ограничивать проникновение в организм болезнетворных микроорганизмов по причине в целом пониженной деятельности их механизмов противовоспалительной и иммунной защиты. Усиление иммунного ответа как такового у младенцев и(или) детей обеспечило бы возможность снизить частоту возникновения инфекционных заболеваний и поддерживать или улучшать их общее состояние здоровья.
Кишечная микрофлора младенцев, которая быстро формируется в течение нескольких первых недель после рождения, оказывает огромное влияние на их иммунную систему. Характер этого образования колоний микроорганизмов в кишечнике определяется ранним воздействием на организм-хозяин природных источников микроорганизмов, а также здоровьем младенца. На кишечную микрофлору также сильно влияет, получает ли младенец материнское молоко или смесь для детского питания.
В материнском молоке содержится ряд факторов, которые могут способствовать росту и количеству кишечной микрофлоры у младенцев. В число этих факторов входит сложная смесь более чем 130 различных олигосахаридов, содержание которых достигает 8-12 г/л в переходном и зрелом молоке. Kunz и др., Oligosaccharides in Human Milk: Structure, Functional, and Metabolic Aspects, Ann. Rev. Nutr. 20: 699-722 (2000). Эти олигосахариды обладают устойчивостью к ферментативному перевариванию в верхнем отделе желудочно-кишечного тракта и в исходном виде достигают толстой кишки, где они затем служат субстратами для переваривания в толстой кишке.
Поскольку в коровьем молоке и предлагаемых на рынке смесях для детского питания на основе коровьего молока содержатся лишь микроколичества олигосахаридов, в качестве добавки к рациону получающих смеси младенцев могут использоваться пребиотики. Согласно данному им определению пребиотики представляют собой неусвояемые компоненты пищевых продуктов, которые благоприятно влияют на организм-хозяин путем избирательной стимуляции роста и(или) активности одной или ограниченного числа клеток в толстой кишке, которые способны улучшать здоровье организма-хозяина.
Поскольку взаимодействия как между компонентами пищевых продуктов, так и между микрофлорой кишечной экосистемы являются очень сложными, основа смеси для детского питания или другой питательной добавки для детей может влиять на эффективность пребиотиков и олигосахаридов, когда такие компоненты используются в качестве добавок в рационе получающего смесь младенца. Кроме того, кишечная микробиота также может изменяться в зависимости от типа и содержания белков, используемых в основе смеси (Boehm и др., Structural and Functional Aspects of Prebiotics Used in Infant Nutrition, The Journal of Nutrition). Поскольку материнское молоко является предпочтительным источником питания младенцев, желательно создать матрицу смеси, которая имитирует свойства материнского молока с возможностью эффективного применения пребиотиков и олигосахаридов в качестве функциональных компонентов пищевых продуктов.
Соответственно, было бы выгодно создать питательную композицию для детей, содержащую питательную добавку, которая стимулирует иммунную систему, при этом добавка используется в основе композиции, которая не подавляет ее благоприятный эффект. Кроме того, было бы выгодно создать способы усиления и улучшения иммунного ответа у детей посредством введения питательной композиции, хорошо переносимой детьми.
Сущность изобретения
Таким образом, в одном из вариантов осуществления настоящего изобретения предложена питательная композиция, в особенности питательная композиция на основе молока для детей, содержащая липид или жир, источник белков и источник β-глюкана. В некоторых вариантах осуществления источником β-глюкана является источник β-1,3-глюкана. В других вариантах осуществления источником β-глюкана является источник β-1,3;1,6-глюкана. Кроме того, в некоторых вариантах осуществления питательная композиция дополнительно содержит источник длинноцепочечных полиненасыщенных жирных кислот, который включают докозагексаеновую кислоту (DHA) и(или) пребиотическую композицию, которая включает множество олигосахаридов, в результате чего общий профиль скорости ферментации пребиотической композиции обеспечивает увеличение численности полезных бактерий в кишечнике человека в течение длительного времени. Пребиотическая композиция может включать множество олигосахаридов, при этом по меньшей мере один из олигосахаридов имеет относительно высокую скорость ферментации, и один из олигосахаридов имеет относительно низкую скорость ферментации, а сочетание олигосахаридов обеспечивает благоприятную общую скорость ферментации. В некоторых вариантах осуществления пребиотик представляет собой сочетание галактоолигосахарида и полидекстрозы.
В изобретении также предложена питательная композиция, содержащая в некоторых вариантах осуществления:
а) до около 7 г/100 ккал жира или липида, более предпочтительно от около 3 до около 7 г/100 ккал жира или липида,
б) до около 5 г/100 ккал источника белка, более предпочтительно от около 1 до около 5 г/100 ккал источника белка,
в) от около 5 до около 100 мг/100 ккал источника длинноцепочечных полиненасыщенных жирных кислот, который включают DHA, более предпочтительно от около 10 до около 50 мг/100 ккал источника длинноцепочечных полиненасыщенных жирных кислот, который включают DHA,
г) от около 1,0 до около 10,0 г/л, более предпочтительно от около 2,0 г/л до около 8,0 г/л пребиотической композиции, содержащей множество олигосахаридов, в результате чего общий профиль скорости ферментации пребиотической композиции обеспечивает увеличение численности полезных бактерий в кишечнике человека в течение длительного времени, и
д) источник β-глюкана.
В некоторых вариантах осуществления питательная композиция содержит матрицу на основе молока.
В еще одном варианте осуществления изобретения предложена питательная композиция с улучшенной усвояемостью, содержащая матрицу на основе молока, липид или жир, источник белков, источник длинноцепочечных полиненасыщенных жирных кислот, который включает докозагексаеновую кислоту (DHA), пребиотическую композицию, которая содержит по меньшей мере 20% смеси олигосахаридов, содержащей полидекстрозу и галактоолигосахарид, и источник β-1,3-глюкана.
В еще одном варианте осуществления настоящего изобретения предложен способ усиления функции иммунной системы детей путем введения β-глюкана, содержащегося в матрице на основе молока.
Подразумевается, что как в вышеизложенном описании, так и следующем далее подробном описании рассмотрены варианты осуществления изобретения с целью обеспечения общего представления или основы для понимания природы и характера заявленного изобретения. Описание служит пояснению принципов и действия заявленного объекта. Другие и дополнительные признаки и преимущества настоящего изобретения станут ясны специалистам в данной области техники после ознакомления со следующим далее раскрытием.
Краткое описание чертежей
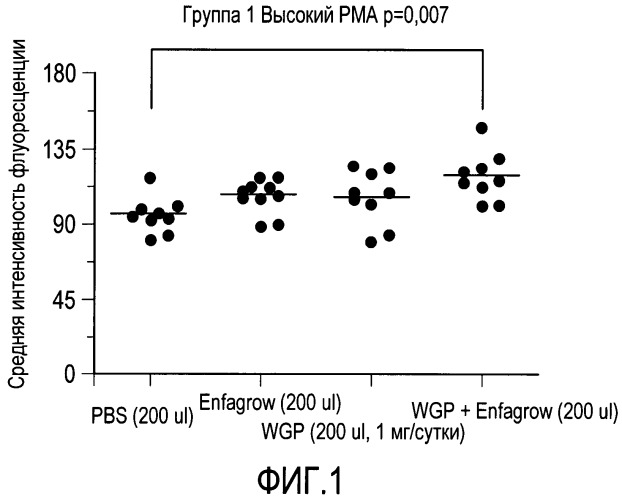
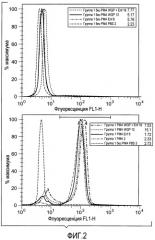
На фиг.1 проиллюстрирована средняя интенсивность флуоресценции (MFI) нескольких образцов, демонстрирующих усиленный респираторный всплеск гранулоцитов у мышей, получавших матрицу композиции на основе молока плюс глюкан WGP, по сравнению с мышами, получавшими только глюкан WGP или только матрицу, на фиг.2 проиллюстрирована флуоресценция FL1-H нескольких образцов, демонстрирующих усиленный респираторный всплеск у мышей, получавших матрицу композиции на основе молока плюс глюкан WGP, по сравнению с мышами, получавшими только глюкан WGP или только матрицу, на фиг.3 проиллюстрированы повышенные уровни интерлейкина-6 (IL-6) у мышей, получавших глюкан WGP плюс матрицу на основе молока.
Подробное описание изобретения
Далее будут подробно рассмотрены варианты осуществления настоящего изобретения, один или несколько примеров которых описаны далее. Каждый пример приведен с целью пояснения, а не ограничения питательной композиции согласно настоящему изобретению. В действительности, специалисты в данной области техники поймут, что в идеи настоящего изобретения могут быть внесены различные усовершенствования и изменения, не выходящие за пределы объема и существа раскрытия. Например, признаки, проиллюстрированные или описанные в составе одного варианта осуществления, могут использоваться в сочетании с другим вариантом осуществления с целью создания еще одного варианта осуществления.
Таким образом, подразумевается, что такие усовершенствования и изменения в пределах объема и существа прилагаемой формулы изобретения и ее эквивалентов входят в настоящее изобретение. Другие задачи, признаки и особенности настоящего изобретения раскрыты в следующем далее подробном описании или вытекают из него. Специалистам в данной области техники следует учесть, что далее будут рассмотрены лишь примеры осуществления, которые не имеют целью ограничить более общие особенности настоящего изобретения.
"Питательная композиция" означает вещество или состав, который обеспечивает по меньшей мере часть потребностей субъекта в питательных веществах.
"Объект педиатрии" означает ребенка в возрасте менее 13 лет. В некоторых вариантах осуществления объект педиатрии означает ребенка в возрасте менее 8 лет.
"Младенец" означает ребенка в возрасте от момента рождения до около одного года, включая младенцев в скорректированном возрасте от 0 до около 12 месяцев. Термин младенец включает младенцев с низкой массой тела при рождении, младенцев с очень низкой массой тела при рождении и недоношенных младенцев. Термин "скорректированный возраст" означает календарный возраст младенца минус время, раньше которого родился младенец. Соответственно скорректированным возрастом является возраст младенца, если бы он был выношен полный срок.
"Ребенок" означает ребенка в возрасте от около 12 месяцев до около 13 лет. В некоторых вариантах осуществления термин ребенок означает ребенка в возрасте от одного года до 12 лет. В других вариантах осуществления термины "дети" или "ребенок" означают детей в возрасте двух, трех, четырех, пяти или шести лет. В других вариантах осуществления термины "дети" или "ребенок" означают детей в любом возрасте от около 12 месяцев до около 13 лет.
"Питательный продукт для детей" означает композицию, которая обеспечивает по меньшей мере часть потребностей ребенка в питательных веществах.
"Смесь для детского питания " означает композицию, которая обеспечивает по меньшей мере часть потребностей младенца в питательных веществах. В США состав смесей для детского питания регламентирован федеральными правилами, изложенными в статьях 100, 106 и 107 раздела 21 Свода федеральных правил. Этими правилами определены уровни содержания питательных макроэлементов, витаминов, минералов и других ингредиентов, имеющих целью имитировать питательные и другие свойства материнского молока.
"С полной питательной ценностью" означает композицию, которая может использоваться в качестве единственного источника питания и обеспечивает преимущественно все из необходимых суточных количеств витаминов, минералов и(или) микроэлементов в сочетании с белками, углеводами и жирами.
"Пробиотик" означает микроорганизм с низкой патогенностью или непатогенный микроорганизм, который имеет благоприятный эффект на здоровье организма-хозяина.
"Пребиотик" означает неусвояемый компонент пищевого продукта, который благоприятно влияет на организм-хозяин путем избирательной стимуляции роста и(или) активности одной или ограниченного числа клеток в толстой кишке, которые способны улучшать здоровье организма-хозяина.
"Эффективное количество" означает количество, которое обеспечивает стимулирующее иммунитет действие на организм.
"β-глюкан" означает все β-глюканы, включая β-1,3-глюкан и β-1,3; 1,6-глюкан, поскольку каждый из них является особым типом β-глюкана. Кроме того, β-1,3; 1,6-глюкан является одним из типов β-1,3-глюкана. Соответственно, термин "β-1,3-глюкан" включает β-1,3; 1,6-глюкан.
"Матрица на основе молока" означает среду, содержащую по меньшей мере один компонент, который был выделен или извлечен из молочной железы млекопитающего.
В некоторых вариантах осуществления матрица на основе молока описанной питательной композиция содержит компоненты молока, которые получены от одомашненных копытных, жвачных, людей, или любые их сочетания. Кроме того, в некоторых вариантах осуществления матрица на основе молока содержит казеин, белок молочной сыворотки, лактозу или любое их сочетания. Кроме того, матрица на основе молока согласно настоящему изобретению может содержать любой известный полученный из молока продукт или продукт на основе молока.
В настоящем изобретении предложена питательная композиция, содержащая в некоторых вариантах осуществления матрицу на основе молока, источник углеводов, источник липидов, источник белков и источник β-глюкана, в особенности β-1,3;1,6-глюкана, при этом β-глюкан и матрица на основе молока обеспечивают синергетический эффект, стимулирующий иммунную систему у детей.
В настоящем изобретении также предложен способ усиления иммунной функции ребенка, включающий введение эффективного количества питательной композиции, содержащей источник углеводов, источник липидов, источник белков и источник β-глюкана.
Применимые источники жиров или липидов для практического осуществления настоящего изобретения могут представлять собой любой известный источник липидов, включая без ограничения источники животного происхождения, например молочный жир, масло, масляный жир, липид яичного желтка; источники морского происхождения, такие как рыбий жир, жир морепродуктов, жир одноклеточных; жиры растительного происхождения, такие как кукурузное масло, масло канолы, подсолнечное масло, соевое масло, пальмовое масло, кокосовое масло, подсолнечное масло с высоким содержанием олеина, масло энотеры, рапсовое масло, оливковое масло, льняное масло, хлопковое масло, сафлоровое масло с высоким содержанием олеина, пальмовый стеарин, соевый лецитин, косточковое пальмовое масло, масло пшеничных зародышей, триглицерид со средней цепью.
Источники белков коровьего молока, применимые для практического осуществления настоящего изобретения, включают без ограничения молочный белок в порошках, концентраты молочного белка, изоляты молочного белка, обезжиренные сухие вещества молока, обезжиренное молоко, обезжиренное сухое молоко, белок молочной сыворотки, изоляты белка молочной сыворотки, концентраты белка молочной сыворотки, сладкую сыворотку, кислую сыворотку, казеин, кислый казеин, казеинат (например, натриевый казеинат, натриево-кальциевый казеинат, кальциевый казеинат) и любые их сочетания. В одном из вариантов осуществления белки используются в виде цельных белков. В других вариантах осуществления белки используются в виде сочетания цельных белков и частично гидролизованных белков со степенью гидролиза от около 4% до 10%. В некоторых других вариантах осуществления белки подвергают более полному гидролизу. В еще одном варианте осуществления в источник белков могут добавляться содержащие глутамин пептиды.
В одном из частных вариантов осуществления изобретения соотношение сыворотки и казеина в источнике белков аналогично соотношению в материнском молоке. В одном из вариантов осуществления источник белков содержит от около 40% до около 80% белка молочной сыворотки и от около 20% до около 60% казеина.
В некоторых вариантах осуществления изобретения питательная композиция может содержать один или несколько пробиотиков. В этом варианте осуществления применим любой известный пробиотик при условии, что он обеспечивает достижение заданного результата. В одном из частных вариантов осуществления пробиотик может быть выбран из бактерий любого из следующих видов: Lactobacillus, Lactobacillus rhamnosus GG, Bifidobacterium, Bifidobacterium longum и Bifidobacterium animalis subsp.lactis BB-12 или их сочетаний.
При использовании в композиции количество пробиотика может составлять от около 104 до около 1010 колониеобразующих единиц (КОЕ) на килограмм веса тела в сутки. В другом варианте осуществления количество пробиотика может составлять от около 10 до около 109 КОЕ на килограмм веса тела в сутки. В еще одном варианте осуществления количество пробиотика может составлять по меньшей мере около 10 КОЕ на килограмм веса тела в сутки.
В одном из вариантов осуществления пробиотик(-и) могут являться жизнеспособными или нежизнеспособными. Используемый в описании термин "жизнеспособный" означает живые микроорганизмы. Термин "нежизнеспособный" или "нежизнеспособный пробиотик" означает неживые пробиотические микроорганизмы, их клеточные компоненты и(или) их метаболиты. Такие нежизнеспособные пробиотики могут быть убиты нагреванием или иначе инактивированы, но сохраняют способность благоприятно влиять на здоровье организма-хозяина. Пробиотики, применимые в настоящем изобретении, могут встречаться в природе, быть синтезированы или созданы путем генетической манипуляции с организмами независимо от того, известен ли на данный момент такой новый источник или будет создан позднее.
Питательная композиция содержит один или несколько пребиотиков. Используемый в описании термин "пребиотик" означает неусвояемые компоненты пищевых продуктов, которые приносят пользу для здоровья организма-хозяина. Такая польза для здоровья может включать без ограничения избирательную стимуляцию роста и(или) активности одной или ограниченного числа полезных кишечных бактерий, стимуляцию роста и(или) активности принимаемых пробиотических микроорганизмов, избирательное сокращение числа кишечных патогенных микроорганизмов и благоприятное влияние на профиль кишечных жирных кислот с короткой цепью. Такие пребиотики могут встречаться в природе, быть синтезированы или созданы путем генетической манипуляции с организмами и(или) растениями независимо от того, известен ли данный момент такой новый источник или будет создан позднее. Пребиотики, применимые в настоящем изобретении, могут включать олигосахариды, полисахариды и другие пребиотики, которые содержат фруктозу, ксилозу, сою, галактозу, глюкозу и маннозу. Более точно, пребиотики, применимые в настоящем изобретении, могут включать полидекстрозу, порошковую полидекстрозу, лактулозу, лактосахарозу, рафинозу, глюкоолигосахарид, инулин, фруктоолигосахарид, изомальтоолигосахарид, олигосахариды соевых бобов, лактосахарозу, ксилоолигосахарид, хитоолигосахарид, маннолигосахарид, арибиноолигосахарид, сиаллилолигосахарид, фукоолигосахарид, галактоолигосахарид и гентиоолигосахариды.
В одном из вариантов осуществления общее количество пребиотиков, присутствующих в питательной композиции, может составлять от около 1,0 г/л до около 10,0 г/л композиции. Более предпочтительно общее количество пребиотиков, присутствующих в питательной композиции, может составлять от около 2,0 г/л до около 8,0 г/л композиции. По меньшей мере 20% пребиотиков может содержать смесь галактоолигосахарида и полидекстрозы. В одном из вариантов осуществления количество каждого из следующего: галактоолигосахарида и полидекстрозы в питательной композиции может составлять от около 1,0 г/л до около 4,0 г/л.
В одном из вариантов осуществления количество галактоолигосахарида в питательной композиции может составлять от около 0,1 мг/100 ккал до около 1,0 мг/100 ккал. В другом варианте осуществления количество галактоолигосахарида в питательной композиции может составлять от около 0,1 мг/100 ккал до около 0,5 мг/100 ккал. В одном из вариантов осуществления количество полидекстрозы в питательной композиции может составлять от около 0,1 мг/100 ккал до около 0,5 мг/100 ккал. В другом варианте осуществления количество полидекстрозы может составлять около 0,3 мг/100 ккал. В одном из частных вариантов осуществления галактоолигосахарид и полидекстрозу добавляют в питательную композицию в общем количестве около по меньшей мере 0,2 мг/100 кка, и оно может составлять от около 0,2 мг/100 ккал до около 1,5 мг/100 ккал.
Питательная композиция согласно изобретению содержит источник длинноцепочечных полиненасыщенных жирных кислот (LCPUFA), который включает докозагексаеновую кислоту (DHA). Другие применимые LCPUFA включают без ограничения α-линолевую кислоту, γ-тнолеъую кислоту, линолевую кислоту, линоленовую кислоту, эйкозапентаеновую кислоту (ЕРА) и арахидоновую кислоту (ARA).
В одном из вариантов осуществления в питательную композицию добавляют как DHA, так и ARA. В этом варианте осуществления весовое соотношение ARA:DHA может составлять от около 1:3 до около 9:1. В одном из вариантов осуществления настоящего изобретения этот соотношение составляет от около 1:2 до около 4:1.
Количество длинноцепочечных полиненасыщенных жирных кислот в питательной композиции преимущественно составляет по меньшей мере около 5 мг/100 ккал и может составлять от около 5 мг/100 ккал до около 100 мг/100 ккал, более предпочтительно от около 10 мг/100 ккал до около 50 мг/100 ккал.
Содержащие DHA и ARA жиры могут добавляться в питательную композицию известными стандартными способами. Например, DHA и ARA могут добавляться в композицию путем замены эквивалентного количества масла, такого как подсолнечное масло с высоким содержанием олеина, которое обычно присутствует в композиции. В качестве другого примера содержащие DHA и ARA жиры могут добавляться в композицию путем замены эквивалентного количества всего остального смешанного жира, который обычно присутствует в композиции, которая не содержит DHA и ARA.
В случае использования источника DHA и ARA им может являться любой известный источник, такой как жир морепродуктов, рыбий жир, жир одноклеточных, липид яичного желтка и липид головного мозга. В некоторых вариантах осуществления источником DHA и ARA является жир одноклеточных Martek, DHASCO® или их разновидности. DHA и ARA могут использоваться в исходной форме при условии, что источник остальных LCPUFA не оказывает какого-либо существенного отрицательного воздействия на младенца. В качестве альтернативы DHA и ARA могут использоваться в переработанной форме.
В одном из вариантов осуществления настоящего изобретения источниками DHA и ARA являются жиры одноклеточных, как описано в патентах US 5374567, 5550156 и 5397591, содержание которых во всей полноте включено в настоящую заявку в порядке ссылки. Тем не менее, настоящее изобретение не ограничено только таким жирами.
Как отмечалось, в каждом варианте осуществления описанная питательная композиция включает источник β-глюкана. Глюканы представляют собой полисахариды, в частности полимеры глюкозы, которые встречаются в природе и могут содержаться в клеточных стенках бактерий, грибов, дрожжей и растений. Бета-глюканы (β-глюканы) как таковые представляют собой многообразное подмножество полимеров, состоящих их цепей мономеров глюкозы, связанных друг с другом гликозидными связями бета-типа и образующих сложные углеводы.
β-1,3-глюканы представляют собой углеводородные полимеры, выделенные, например, из дрожжей, грибов, бактерий, водорослей или злаков (Stone BA, Clarke AE. Chemistry and Biology of (1-3)-Beta-Glucans, Лондон, издательство Portland Press Ltd, 1993 г.). Химическая структура β-1,3-глюкана зависит от источника β-1,3-глюкана. Кроме того, определенное влияние на биологическую активность β-1,3-глюканов оказывают различные физико-химические параметры, такие как растворимость, первичная структура, молекулярная масса и разветвление (Yadomae Т., Structure and biological activities of fungal beta-1,3-glucans. Yakugaku Zasshi. 2000 г., 120:413-431).
β-1,3-глюканы представляют собой встречающиеся в природе полисахариды необязательно с боковыми цепями β-1,6-глюкозы, которые содержатся в клеточных стенках разнообразных растений, дрожжей, грибов и бактерий. β-1,3;1,6-глюканы являются соединениями, содержащими звенья глюкозы со связями (1,3), имеющими боковые цепи, присоединены в положении(-ях) (1,6). β-1,3; 1,6 глюканы представляют собой разнородную группу полимеров глюкозы, имеющих общее структурное сходство, включая основную прямую цепь из звеньев глюкозы, связанных связью β-1,3 с отходящими от этой основной цепи ветвями глюкозы, связанными связью β-1,6. Хотя эта структура является базовой для описанного в изобретении класса β-глюканов, могут существовать некоторые разновидности. Например, некоторые дрожжевые β-глюканы имеют дополнительные области разветвления β(1,3), отходящего от ветвей β(1,6), что дополнительно усложняет их соответствующие структуры.
β-глюканы, полученные из хлебопекарных дрожжей Saccharomyces cerevisiae, образованы цепями соединенных в 1-м и 3-м положениях молекул D-глюкозы и имеющих боковые цепи глюкозы, присоединенные в 1-м и 6-м положениях. Полученный из дрожжей β-глюкан представляет собой нерастворимый, волокнистый сложный сахар с общей структурой, образованной линейной цепью звеньев глюкозы, при этом в основную цепь β-1,3 вкраплены боковые цепи β-1,6, обычно содержащие 6-8 звеньев глюкозы. Более точно, β-глюкан, полученный из хлебопекарных дрожжей, представляет собой поли-(1,6)-β-D-глюкопиранозил-(1,3)-β-D-глюкопиранозу.
Кроме того, было обнаружено, что β-глюканы обладают способностью стимулировать иммунную систему взрослых. В действительности, доказано, что многие из этих полисахаридов связывают рецепторы β-1,3-глюкана в моноцитах, макрофагах и нейтрофилах (Czop, J.K., & Austen, K.F. (1985). β-glucans activate cellular immunity primarily through macrophages and neutrophils. Properties of glycans that activate the human alternate complement pathway and interact with the human monocyte beta glucan receptor. J. Immuno. 135, 3388-3393). Тем не менее, не было доказано, что β-глюкан является веществом, которое обеспечивает выгоды настоящего изобретения и может вводиться детям.
В действительности, известно, что кишечная микрофлора значительно менее развита у младенцев, чем у взрослых. Если микрофлора взрослого состоит из более 1013 микроорганизмов около 500 видов, кишечная микрофлора младенца содержит лишь часть этих микроорганизмов как в абсолютном исчислении, так и с точки зрения видового разнообразия. Поскольку численность кишечных бактерий и их видов в огромной степени различается у младенца или ребенка и у взрослого, нельзя предполагать, что пребиотик, который оказывает благоприятное воздействие на взрослых, также будет оказывать благоприятное воздействие на младенцев и(или) детей.
Как отмечалось, глюканы представляют собой полисахариды, относящиеся к группе физиологически активных соединений, известных как модификаторы биологической защиты. β-1,3; 1,6 глюканы представляют собой полисахаридный фрагмент, инициирующий иммунный надзор и способный уменьшать частоту связанных с микроорганизмами заболеваний у детей или младенцы путем стимуляции иммунной функции при его введении в составе питательной композиции согласно настоящему изобретению. Кроме того, β-глюканы хорошо переносятся и не вызывают у детей избыточного газообразования, вздутия живота или диареи. Эффективность β-глюкана в качестве стимулятора иммунной системы не была доказана ранее, когда β-глюкан вводился одновременной с матрицей на основе молока с целью получения синергетического стимулирующего иммунитет действия.
В некоторых вариантах осуществления питательная композиция согласно настоящему изобретению содержит β-глюкан и матрицу на основе молока, при этом сочетание двух ингредиентов в питательной композиции обеспечивает синергетический эффект. Полученная питательная композиция обладает стимулирующим действием на способность организма к респираторному всплеску. Более точно, в некоторых вариантах осуществления сочетание β-1,3;1,6-глюкана и матрицы на основе молока обеспечивает эффект увеличения числа нейтрофилов в организме.
Под действием определенных раздражителей фагоциты, включая нейтрофилы, эозинофилы и мононуклеарные фагоциты, потребляют значительно больше глюкозы и кислорода и начинают вырабатывать большие количества надперекиси (О2) и перекиси водорода (H2O2) в ходе последовательности изменений, известных как "респираторный всплеск". Кислородсодержащие соединения, образующиеся в результате респираторного всплеска, убивают внедряющиеся бактерии и патогенные микроорганизмы в ходе процесса, называемого кислородзависимым внутриклеточным лизисом. Соответственно, в результате стимуляции респираторного всплеска в организме усиливается его иммунная система.
Этот эффект может быть продемонстрирован путем оценки биологической активности β-глюкана в присутствии или отсутствии матрицы на основе молока в ходе экспериментов in vivo. Одной из матриц на основе молока, которая может использоваться для проведения экспериментов, является предлагаемая на рынке смесь Enfagrow® (производства компании Mead Johnson & Company, Эвансвилл, штат Индиана, США). β-глюкан может представлять собой глюкан Wellmune WGP® (производства компании Biothera, Иген, штат Миннесота, США).
В ходе исследований in vivo мыши получали β-глюкан (1 мг/мышь/сутки) по отдельности или в сочетании с матрицей на основе молока максимально в течение 10 дней. Мыши также получали только физиологический раствор или матрицу на основе молока в качестве контроля. В модели на мышах усвоение перорально вводимого β-глюкана происходит посредством пейеровых бляшек тонкого кишечника. Частицы, захваченные пейеровыми бляшками, затем поступают в большой круг кровообращения по мере их переноса посредством макрофагов. Затем происходит их разложение в макрофагах, в результате чего β-глюкан распадается на более мелкие фрагменты, которые впоследствии могут активизировать нейтрофилы. На основании вызванного активностью нейтрофилов респираторного всплеска, маркеров активирования макрофагов и дендритных клеток и уровней цитокина в сыворотке оценили общее количество клеток.
После перорального введения выделили и подсчитали клетки крови. Как показали подсчеты клеток, мыши, получавшие матрицу композиции или β-глюкан, имели значительно большее количество нейтрофилов на 10-й день, чем мыши, не получавшие забуференный фосфатом физиологический раствор (PBS). На основании этих данных можно предположить, что β-глюкан и матрица композиции могут стимулировать мобилизацию нейтрофилов и играть важную роль в антибактериальный защитных реакциях. У мышей, получавших только матрицу на основе молока, только β-глюкан и их сочетание, значительно увеличилось количество нейтрофилов по сравнению с контрольными группами.
На фиг.1 и 2 показан вызванный нейтрофилами респираторный всплеск, демонстрирующий наличие синергии между β-глюканом и матрицей на основе молока, которая значительно усиливает вызванный нейтрофилами респираторный всплеск. В отличие от этого, влияние только β-глюкана и только матрицы на основе молока на респираторный всплеск является лишь незначительно большим, чем в контрольных группах. В действительности, сочетание β-глюкана и матрицы на основе молока обладает значительно большим синергетическим эффектом на способность к респираторному всплеску, чем в контрольных группах. Кроме того, на фиг.1 и 2 показано, что β-глюкан и матрица на основе молока обладают синергетическим эффектом, способствующим вызванному нейтрофилами респираторному всплеску.
Как показано на фиг.3, у мышей, получавших β-глюкан плюс матрица композиции, значительно повысились уровни IL-6 по сравнению с мышами, получавшими только матрицу на основе молока. На фиг.3 показано, что у мышей, получавших только β-глюкан WGP®, а также получавших β-глюкан с матрицей на основе молока, значительно повысился уровень IL-6 по сравнению с мышами, получавшими только матрицу на основе молока.
Таким образом, исследования in vivo доказывают, что вводимый перорально β-глюкан с матрицей композиции на основе молока значительно увеличивает количество нейтрофилов периферической крови и способствует вызванному активностью нейтрофилов респираторному всплеску. В действительности, между матрицей композиции на основе молока и β-1,3; 1,6-глюканом существует синергия в том, что касается функции иммунных клеток, то есть вызванного нейтрофилами респираторного всплеска. Кроме того, испытания β-глюкана in vivo продемонстрировали его способность вызывать увеличение секреции IL-6 в присутствии или отсутствии матрицы на основе молока.
Соответственно, добавление β-глюкана в питательную композицию для детей на основе молока, такую как смесь для детского питания или питательный продукт для детей, улучшает иммунный ответ организма путем повышения сопротивления к проникающим болезнетворным микроорганизмам и тем самым поддерживает или улучшает общее здоровье. Кроме того, β-1,3; 1,6-глюкан способен стимулировать реакцию клеток врожденной иммунной системы. Они в свою очередь способны активизировать приобретенный иммунитет. Соответственно, способность β-1,3; 1,6-глюкана инициировать иммунную систему организма-хозяина путем увеличения количества нейтрофильных клеток и усиления способности к респираторному всплеску усиливает иммунный ответ организма.
При пероральном введении β-1,3-глюканы, такие как, например, β-1,3; 1,6-глюкан, непосредственно не всасываются в систему пищеварения в ходе процессов метаболизма. В действительности, после прием внутрь дрожжевой β-глюкан не подвергается значительному системному воздействию; тем не менее, небольшие количества нерастворимых частиц β-глюкана захватываются пейеровыми бляшками тонкого кишечника, и затем эти частицы поступают в большой круг кровообращения по мере их переноса посредством макрофагов. После фагоцитоза β-глюкана макрофагами из них выделяются небольшие фрагменты принятого β-глюкана. Эти фрагменты инициируют нейтрофилы и лимфоциты, такие как естественные клетки-киллеры (NK). Кроме того, β-глюкан способен стимулировать вырабатывание цитокина, а также может стимулировать T-лимфоциты (T-клетки). Этот механизм действия β-глюкана способен связывать активизацию врожденной иммунной системы с активизацией приобретенного иммунитета.
Соответственно, в некоторых вариантах осуществления применение β-1,3-глюкана или более точно β-1,3;1,6-глюкана усиливает функцию иммунной системы. Например, применение β-1,3;1,6-глюкана может повышать сопротивление инфекции и(или) ослаблять воспалительные реакции. По меньшей мере в одном варианте осуществления настоящего изобретения предложен способ усиления функции иммунной системы у детей, включающий введение источника β-1,3;1,6-глюкана в матрице на основе молока. В другом варианте осуществления настоящего изобретения предложен способ повышения сопротивления инфекции у детей, включающий введение β-1,3;1,6-глюкана в матрице на основе молока. В еще одном варианте осуществления настоящего изобретения предложен способ снижения длительности и тяжести инфекции, вызываемой широким спектром бактериальных и вирусных болезнетворных микроорганизмов у детей, включающий введение β-глюкана в матрице на основе молока. В еще одном варианте осуществления настоящего изобретения предложен способ ослабления воспалительных реакций, сопровождающих такие инфекции у детей, включающий введение β-глюкана в матрице на основе молока.
Питательная композиция согласно настоящему изобретению содержит β-1,3-глюкан. В некоторых вариантах осуществления β-1,3-глюканом является β-1,3; 1,6-глюкан. В некоторых вариантах осуществления β