Способ биологической оценки токсичности морской среды
Иллюстрации
Показать всеСпособ биологической оценки токсичности морской среды относится к биологическим способам оценки экологического риска и анализа загрязнения водной среды и может быть использован в марикультуре, водной токсикологии, рыбоводстве.
В способе в качестве биологических тест-объектов используются личинки черноморских рыб атерины (Atherina hepsetus, Atherina mochon pontica), которые помещаются в тестируемую среду и в стерилизованную морскую воду. Контролем служит тестируемая среда и стерилизованная морская вода без токсиканта. Проводят микрокалориметрические измерения теплопродукции личинок и на основании расчета удельной теплопродукции, а также ее снижения у тест-объектов, подвергнувшихся действию токсикантов по отношению к показателям интактных личинок, делают вывод об уровне токсичности морской среды.
Способ отличается высокой чувствительностью и позволяет произвести достоверную оценку состояния морской среды при низких уровнях концентрации токсикантов. Это дает возможность проводить раннюю диагностику уровня токсичности водной среды.
Реферат
Предполагаемое изобретение относится к биологическим способам оценки экологического риска, предназначено для анализа загрязнения водной среды и может быть использовано в марикультуре, водной токсикологии, рыбоводстве.
Анализ качества водной среды в целом, и морской, в частности, имеет не только экологическое значение, но и экономическое, что определяет необходимость оценки пригодности использования.водных ресурсов в рекреационных, пищевых, марикультурных и других целях. В связи с этим, разработка быстрых, хорошо воспроизводимых и адекватных способов тестирования морской среды является актуальной задачей.
Существующие способы анализа содержания химических и микробиологических загрязнителей длительны и дорогостоящи, требуют наличия специальной технической базы, которая состоит из комплекса дорогостоящих приборов и реагентов, специального оборудования и обученного персонала. Кроме того, получаемые данные, как правило, сравнивают с предельно допустимыми нормативами (ПДК и ПДС), которые отличаются в разных странах и не всегда отражают истинную опасность среды для живых организмов. В настоящее время все большую популярность приобретают способы биотестирования, то есть исследование ответных реакций различных живых организмов на действие токсических веществ или их смеси.
Известно, что пагубный эффект стрессового воздействия инициирует, в первую очередь, ответную реакцию клеточных систем, что предполагает проводить анализ именно этих откликов, как наиболее чувствительных. Молекулярные параметры ответных реакций (биомаркеры) имеют то преимущество, что отражают эффекты основных обменных процессов на клеточном уровне. Биомаркеры дают возможность оценить как ранние проявления стресса, предшествующие видимому ухудшению общего состояния жизнедеятельности, так и соответствующие параметры, измеряемые на уровне организма. В то же время, они позволяют определить механизмы адаптации и восстановления гомеостаза организма в условиях действия неблагоприятных факторов среды. В качестве таких биомаркеров используются ферменты защитных систем организма (МОГ и антиоксидантной, показатели перекисного окисления липидов и др.), индукция которых под действием неблагоприятных факторов у разных морских организмов была показана нами и другими авторами (Руднева, Жерко, 1994; Руднева и др., 2004 а, б, в; Goksoyr et al., 1996; Viarengo, 1989; Winston, 1991). Вместе с тем, реакции вышеперечисленных биохимических показателей не всегда четко выражены и имеют одинаковую направленность, их вектор во многом зависит от концентрации действующего фактора и физиологического состояния организма. Следует учитывать также, что все эти биохимические измерения возможны только после гибели животных, что вносит дополнительный стрессовый фактор. Именно поэтому особую значимость приобретают такие тест-системы, которые позволяют оценить среду обитания организма прижизненно в течение достаточно короткого времени и, не травмируя тест-объект.
Известен Способ биологической оценки токсичности водной среды (см. А.с. № 1294315, СССР, МКИ А01K 61/00), в котором тест-объекты - непитавшуюся молодь пиявок (Hirudo redicinalis), разделяли на 2 группы - опытную и контрольную и размещали в соответствующие емкости. Осуществляли подачу чистой и исследуемой воды в емкости, периодически регистрировали поведенческие функции тест-объектов в группах, сравнивали полученные результаты и определяли наличие токсичности веществ в воде по изменению поведенческой функции опытных тест-объектов по сравнению с контрольными. Недостатки способа заключаются в субъективности, вследствие визуального определения изменения поведенческой функции тест-объектов и его низкой чувствительности.
Известен Способ определения токсичности водных сред (см. А.с. № 1328756 G01N 33/18, СССР), который состоит в том, что гидробионтов предварительно адаптировали к условиям содержания в чистой водной среде, строили калибровочные кривые зависимости концентрации эталонного токсиканта от времени появления экстремумов показателей гидробионтов, и относительной величины этих экстремумов. Затем исследуемую водную среду нагревали и аэрировали до получения значения температуры и концентрации кислорода в ней, соответствующих тем, к которым ранее адаптировались гидробионты. Заменяли чистую водную среду в сосудах с гидробионтами на исследуемую водную среду, регистрировали изменения во времени величин показателей у гидробионтов в исследуемой водной среде, определяли время появления экстремумов показателей или относительную величину этих экстремумов. После этого определяли с помощью калибровочных кривых концентрацию эталонного токсиканта, соответствующую времени появления экстремумов показателей гидробионтов, находящихся в исследуемой водной среде, или относительной величины этих экстремумов. В качестве тест-объектов использовали рыб, моллюсков, речных раков, высшие водные растения. В качестве регистрируемого показателя рассматривали или двигательную активность, или интенсивность потребления кислорода гидробионтами, или их термоустойчивость. Известный способ имеет ряд недостатков:
- при проведении ранней диагностики состояния водной среды используемые в способе двигательная активность, интенсивность потребления кислорода, анализ поведенческих реакций, термоустойчивость являются субъективными, не способными продемонстрировать отклик системы и не обладают высокой чувствительностью;
- в способе ведется сравнение с ПДК;
- способ не позволяет зафиксировать ранние патологические изменения в физиологическом состоянии организма при действии неблагоприятных факторов в малых дозах;
- способ не способен дать экспресс-оценку состояния водной среды из-за длительности проведения.
В основу изобретения «Способ биологической оценки токсичности морской среды» поставлена задача путем микрокалориметрических измерений параметров биологических тест-объектов в прижизненном состоянии, обеспечить проведение ранней диагностики токсичности водной морской среды и повышение чувствительности способа.
Поставленная задача достигается тем, что в Способе биологической оценки токсичности морской среды в качестве биологических тест-объектов используются личинки черноморской рыбы атерины (Atherina hepsetus, Atherina mochon pontica). Личинки атерины помещаются в исследуемую среду и в стерилизованную морскую воду, а контролем является исследуемая среда и стерилизованная морская вода без токсиканта. Проводят микрокалориметрические измерения теплопродукции личинок и на основании расчета удельной теплопродукции, а также ее снижения у тест-объектов, подвергнувшихся действию токсикантов по отношению к показателям интактных личинок, делают вывод об уровне токсичности морской среды.
Применение микрокалориметрического метода имеет ряд преимуществ:
Во-первых, он позволяет провести прижизненные измерения основных энергетических параметров гидробионтов: общий метаболизм организма и его изменения при действии неблагоприятных факторов;
Во-вторых, микрокалориметрический метод наиболее адекватен при измерении показателей теплопродукции, отражающей состояние общей метаболической активности организма, и отличается высокой чувствительностью;
В-третьих, предлагаемый способ отражает неспецифические реакции биологических тест-объектов на действие неблагоприятных факторов.
Использование в качестве контроля 2-х ампул, содержащих морскую воду с токсикантом и стерилизованную морскую воду соответственно, позволяет получить достоверные данные.
Известно, что рыбы, особенно на ранних стадиях онтогенеза (икра, личинки, мальки), наиболее чувствительны к действию неблагоприятных факторов, что создает дополнительную возможность повысить чувствительность биотестирования с использованием в качестве тест-объекта икру или личинок рыб. Часто используются пресноводные рыбы (гуппи, данио), но для анализа морской среды выбор ихтиологических объектов крайне ограничен. Авторами был проведен анализ теплопродукции личинок черноморской атерины Atherina hepsetus и было показано снижение их теплопродукции при действии неблагоприятных факторов. Одновременно, по изменению биохимических маркеров было установлено, что личинки атерины являются весьма чувствительными объектами к действию токсикантов. Другими исследователями личинки атерины также были использованы в качестве тест-объектов в экотоксикологических исследованиях, однако, измеряемые параметры ограничивались исключительно оценкой выживаемости, роста и развития некоторых биологических параметров.
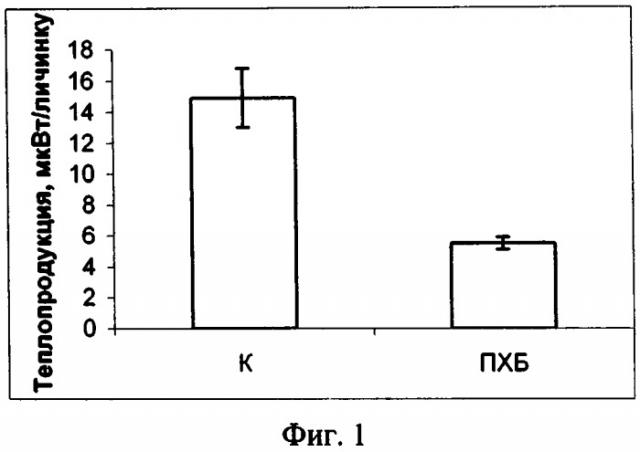
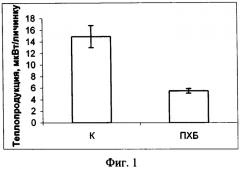
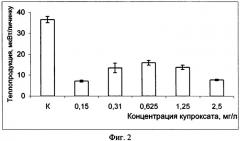
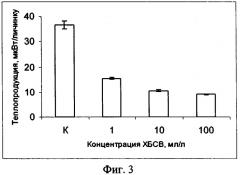
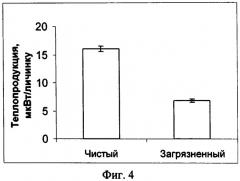
Изобретение поясняется фигурами: фиг. 1 - Действие ПХБ для личинок атерины; фиг. 2 - Действие фунгицида купросата; фиг. 3 - Действие сточных вод; фиг. 4 - Уровни метаболизма личинок рыб из чистого и загрязненного районов
Способ реализуется следующим образом.
Личинок атерины длиной 6-7 мм отлавливают с помощью сака в прибрежной части моря и переносят в емкости с профильтрованной морской водой в лабораторию. Исследование теплопродукции личинок осуществляют на Мониторе биологической активности ТАМ 2277 (Швеция, Thermometric). В две ампулы, содержащие по 2 мл морской воды с токсикантом и стерилизованной морской воды соответственно, помещают по одной личинке черноморской атерины Atherina hepsetus в прижизненном состоянии. Контролем служат ампулы с морской водой с токсикантом и со стерилизованной морской водой. Ампулы герметически закрывают и помещают в измерительные цилиндры Монитора биологической активности, где проводят измерение теплопродукции при температуре +20°С в течение 15-24 часов. Сигнал калориметра фиксируют через каждые 10 минут и пересчитывают интегральное значение теплопродукции с помощью специально адаптированной компьютерной программы Digitam. Дальнейший анализ результатов проводят по калориметрическим кривым, полученным в результате 3-4 параллельных измерений. При этом средние показатели теплопродукции рассчитывали на основании значений, полученных через каждый час, и обрабатывали статистически (М+т); достоверность различий анализировали с помощью критерия Стьюдента (р<0.05).
Примеры реализации способа
Пример 1.
Оценка токсичности морской среды, содержащей ПХБ, для личинок атерины Оценивали влияние ПХБ на теплопродукцию личинок атерины. Арохлор 1254 растворяли в гексане и добавляли в морскую воду из расчета 1 нг/л. Личинку атерины помещали в ампулу, содержащую 2 мл морской воды с токсикантом. Одновременно, в другую ампулу, содержащую чистую стерилизованную морскую воду, также помещали личинку атерины. Обе ампулы устанавливали в измерительные цилиндры Монитора биологической активности против контроля, которым в первом случае служила морская вода с растворенным токсикантом, во втором - стерилизованная морская вода. Исследования проводили в течение 15 часов и рассчитывали средние значения теплопродукции личинок атерины, подвергнутых действию ПХБ и интактных. Результаты показали снижение уровня теплового потока более, чем в 2 раза у личинок в среде с ПХБ (14.87 против 5.46 мквт/личинка, р<0.01) (см. фиг. 1).
Пример 2.
Оценка токсичности морской среды, содержащей фунгицид купроксат, для личинок атерины
Оценивали влияние фунгицида купроксата на теплопродукцию личинок атерины. Подготовку эксперимента проводили так же, как описано выше. Личинок атерины помещали в ампулы, содержащие морскую воду с соответствующей концентрацией фунгицида и стерилизованную морскую воду. Измерения теплопродукции проводили против холостой пробы, содержащей по 2 мл стерилизованной морской воды с соответствующими концентрациями купроксата. Купроксат использовали в концентрациях 0.156, 0.312, 0.625, 1.25 и 2.5 мг/л. Исследования проводили в течение 24 часов при температуре +20°С. Во всех опытных вариантах наблюдали достоверное снижение теплопродукции (р<0.01) (см. фиг. 2).
Пример 3.
Оценка токсичности морской среды, содержащей бытовые сточные воды, для личинок атерины
Оценивали влияние бытовых сточных вод, полученных на очистных сооружениях г. Севастополя, на теплопродукцию личинок атерины. Подготовку эксперимента проводили по схеме, описанной выше. Сточные воды использовали в концентрациях 1, 10, 100 мл/л. В качестве холостой пробы, против которой проводили измерения теплопродукции, использовали стерилизованную морскую воду, содержащую сточные воды в соответствующих концентрациях. Исследования проводили в течение 24 часов при температуре +20°С. Наблюдали достоверное снижение теплопродукции в опытных вариантах по отношению к контролю( р<0.01),
в качестве которого, как и в предыдущих случаях, использовали личинок атерины, помещенных в ампулу с 2-мл стерилизованной морской воды (см. фиг. 3). Пример 4.
Оценка токсичности морской среды для личинок атерины, отловленной в условно чистом и загрязненном районах
Оценивали влияние токсичности естественной морской среды с разным уровнем загрязнения на теплопродукцию личинок атерины. Подготовку эксперимента проводили так же, как описано выше. Личинок атерины отлавливали в условно чистом районе и в загрязненном. Исследования проводили в течение 24 часов при температуре +20°С. В качестве холостой пробы, против которой проводили измерения теплопродукции, использовали стерилизованную морскую воду из двух исследуемых районов. Наблюдали достоверное снижение теплопродукции (р<0.01) у личинок, отловленных в загрязненном районе по сравнению с соответствующими показателями личинок рыб из условно чистого района (см. фиг. 4).
Таким образом, результаты примеров свидетельствуют о снижении теплопродукции личинок атерины, подвергнутых действию различных токсикантов и их смеси (сточные воды, общее загрязнение естественной среды обитания).
Преимущества предложенного способа по сравнению с известным способом заключаются в том, что, благодаря использованию микрокалориметрии, а также личинок атерины в прижизнненном состоянии, он отличается высокой чувствительностью. Известные способы не в состоянии дать оценки состояния морской среды при низких уровнях концентрации токсикантов. Это позволяет проводить раннюю диагностику уровня токсичности водной среды.
Раннее определение сублетальных эффектов может быть использовано для разработки мероприятий по восстановлению локальных экосистем, подвергнутых действию стрессовых факторов. Способ может быть реализован для экспресс-оценки морской среды с положительным результатом.
1. Способ биологической оценки токсичности морской среды включающий внесение в исследуемую среду биологических тест-объектов, измерение параметров физиологического состояния биологических тест-объектов и сравнение их с контролем, отличающийся тем, что в качестве биологических тест-объектов используют личинок черноморской рыбы атерины (Atherina hepsetus, Atherina mochon pontica), у которых измеряют теплопродукцию микрокалориметрическим методом и на основании расчета удельной теплопродукции у тест-объектов, подвергнувшихся действию токсикантов относительно показателей интактных личинок, делают вывод о токсичности морской среды.
2. Способ по п. 1, отличающийся тем, что измеряют теплопродукцию личинок черноморской рыбы атерины (Atherina hepsetus, Atherina mochon pontica, помещенных в морскую воду с токсикантом и в стерилизованную морскую воду соответственно.
3. Способ по пп. 1 и 2, отличающийся тем, что контролем служит морская вода с токсикантом и стерилизованная морская вода соответственно.