Биосовместимый агент для диспергирования наночастиц в водной среде с использованием имитирующего адгезивный белок мидии полимера
Иллюстрации
Показать всеИзобретение относится к привитому полимеру, имитирующему адгезивный белок мидии, к способу получения привитого полимера, к диспергированным в водной среде наночастицам, коллоидному раствору и контрастному агенту. Привитой полимер представляет собой полиэтиленимин, привитый полиэтиленгликолем и полидигидроксифенилаланином (PEI-graft-(PEG; PDOPA)). Полидигидроксифенилаланин представляет собой конденсационный полимер 3,4-дигидроксифенилаланина (DOPA). Способ получения привитого полимера включает несколько стадий. На первой стадии проводят привитую сополимеризацию полиэтиленгликоля с полиэтиленимином. На второй стадии после защиты гидроксильных групп 3,4-дигидроксифенилаланина проводят синтез N-карбоксиангидрид 3,4-дигидроксифенилаланина в присутствии трифосгена в качестве катализатора. Далее проводят реакцию полимера, полученного на первой стадии, и N-карбоксиангидрид 3,4-дигидроксифенилаланина в органическом растворителе. Коллоидный раствор содержит диспергированные в водной среде наночастицы, при этом в качестве стабилизатора дисперсии используют вышеуказанный привитой полимер. Контрастный агент для магнитно-резонансной томографии (МРТ) включает вышеуказанный коллоидный раствор. Изобретение позволяет получить биосовместимый стабилизатор, обеспечивающий устойчивую дисперсию наночастиц в водной среде, а также получить высокоэффективные наночастицы в качестве контрастного агента для МРТ. 5 н. и 20 з.п. ф-лы, 8 ил., 2 табл., 6 пр.
Реферат
Область техники, к которой относится изобретение
В настоящем изобретении описаны имитирующий адгезивный белок мидии стабилизирующий дисперсию агент («стабилизатор») для диспергирования наночастиц в водной среде, коллоидный раствор, включающий наночастицы, диспергированные и стабилизированные стабилизирующим дисперсию агентом, и контрастный агент, включающий коллоидный раствор. Более конкретно, имитирующий адгезивный белок мидии стабилизатор дисперсии представляет собой полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином (PEI-graft-(PEG; PDOPA)). Привитый полимер состоит из двух частей, одна представляет собой полиэтиленимин привитый биосовместимым полимером на основе полиэтиленгликоля, который обладает сродством к водной среде (иногда сокращенно называется «полиэтиленгликоль привитый полиэтиленимином»), и другая представляет собой полидигидроксифенилаланин (pDOPA), который обладает сродством к поверхности наночастиц. Благодаря этим характеристикам стабилизатор обеспечивает устойчивую дисперсию наночастиц в водной среде.
Уровень техники
Наночастицы используют в различных областях применения, таких как наноэлектронная конвергентная технология, технология сканирования живого организма, медицинские приложения и т.д.
В частности, наночастицы суперпарамагнитного оксида железа широко используют в разнообразных биомедицинских приложениях, таких как, например, контрастные агенты для магнитно-резонансной томографии (МРТ), клеточная терапия, гипертермия, доставка лекарственных средств, выделение клеток, приготовление нуклеиновых кислот и т.п.
Наиболее важное требование для применения в биомедицинских приложениях представляет собой, в первую очередь, обеспечение высокого качества наночастиц и, кроме того, обеспечение наночастиц, обладающих превосходной способностью к диспергированию и устойчивостью дисперсии в водной среде. Здесь наночастицы высокого качества могут означать наночастицы, обладающие следующими признаками: (i) однородность размера частиц, (ii) легкий контроль размера частиц, (iii) кристалличность частиц, (iv) возможность контроля морфологии частиц и т.д.
Однако известные в технике наночастицы, которые имеются в продаже, в большинстве случаев синтезируют в водной системе, или их можно получать синтезом в газовой фазе. При синтезе наночастиц описанными выше способами трудно обеспечить получение частиц однородной формы, и, как правило, они обладают нарушенной кристалличностью. Кроме того, трудно изготавливать наночастицы, имеющие однородные размеры, и контролировать размеры частиц.
В последнее время проводятся многочисленные исследования для разработки нового способа изготовления в органической системе наночастиц оксидов металлов, которые обладают относительно высоким качеством, то есть однородным размером и благоприятной кристалличностью, по сравнению с наночастицами, синтезированными в водной системе согласно методам предшествующего уровня техники.
По существу, в том случае, когда наночастицы синтезируют в органическом растворителе, контроль однородности и размера наночастиц можно иногда обеспечивать путем их стабилизации, используя органическую добавку в процессе синтеза. В данном отношении, поскольку на состояние поверхности наночастиц влияет гидрофобная часть органической добавки, наночастицы оксидов металлов можно легко диспергировать в гидрофобном органическом растворителе. Однако при смешивании с водой они не обладают достаточной устойчивостью.
В случае таких наночастиц, изготовленных в органическом растворителе, гидрофобные свойства поверхности наночастиц могут препятствовать устойчивой дисперсии наночастиц в воде, таким образом, создавая проблему для использования в биомедицинских приложениях. Таким образом, при использовании наночастиц в вышеупомянутых приложениях существует потребность в разработке биосовместимого стабилизатора дисперсии, который преобразует (или модифицирует) поверхность наночастиц для придания им гидрофильных свойств и обеспечивает подходящее состояние, чтобы они были гомогенно диспергированы в водной среде. Кроме того, требуется также разработка стабилизатора дисперсии наночастиц, который изготавливают, используя описанный выше биосовместимый стабилизатор дисперсии, в котором состояние дисперсии устойчиво сохраняется в водной системе.
Среди способов диспергирования наночастиц в водной системе согласно соответствующей области техники использование тонкого слоя диоксида кремния, который недавно описан в статье (Journal of American Chemical Society, 2005 г., т. 127, с. 4990). Согласно вышеупомянутой статье, полиоксиэтиленнонилфениловый эфир вводят в циклогексановый раствор, и перемешивают с ним, получая капли микромицеллярной эмульсии. После этого индуцируют золь-гелевую реакцию тетраэтилортосиликата (TEOS), и наночастицы покрывают слоем диоксида кремния и диспергируют в воде. В вышеупомянутой статье описан способ покрытия внешней стороны наночастиц гидрофильным слоем диоксида кремния для диспергирования наночастиц в воде, в котором наночастицы изготавливали в органическом растворителе. В этом случае в способе покрытия диоксидом кремния с использованием микроэмульсии возникает проблема того, что поскольку число наночастиц, покрываемых за один раз является очень малым, количество дисперсии наночастиц в водной системе, изготавливаемой в одном процессе, также значительно уменьшается. Кроме того, согласно количеству коллоидов наночастиц, изготавливаемых в одном процессе, или количеству полиоксиэтиленнонилфенилового эфира, изменяется состояние микроэмульсии. Таким образом, существуют затруднения в тонком регулировании желательной толщины слоя диоксида кремния и достижении однородности покрытых частиц, поскольку изменяется число наночастиц, содержащихся в слое диоксида кремния. В том случае, когда наночастицы стабилизированы слоем диоксида кремния, вышеупомянутые способы соответствующей области техники вызывают проблемы в том, что силановые функциональные группы на поверхности диоксида кремния не являются достаточно устойчивыми, но реагируют друг с другом; таким образом, наночастицы, покрытые диоксидом кремния и диспергированные в воде, объединяются и агломерируются течением времени. В результате оказалось затруднительным обеспечивать устойчивость дисперсии при хранении в течение продолжительного периода времени.
В последние годы способ диспергирования наночастиц в воде с использованием полимера, состоящего из фосфиноксида и полиэтиленгликоля, описан в статье (Journal of American Chemical Society, 2005 г., т. 127, с. 4556). Более конкретно, в вышеупомянутой статье описан способ диспергирования наночастиц, в котором после реакции полиэтиленгликоля и 1,2-бис(дихлорфосфино)этана для синтеза полимера, в котором звенья полиэтиленгликоля связаны друг с другом, полимер вступает в реакцию обмена лигандов с наночастицами, диспергированными в гидрофобном растворителе, в результате чего обеспечивается стабилизация дисперсии наночастиц, которые однородно диспергируются в воде. Описанный способ получения является простым, и в нем использован обмен лигандов для диспергирования наночастиц в воде. Однако поскольку атом фосфора (P) склонен к окислению и превращению в фосфорильную группу, покрывающий полимер необходимо синтезировать в инертной атмосфере, используя азот или аргон. Кроме того, поскольку полимер находится в сшитом состоянии, по-прежнему остается проблема введения функциональной группы для связывания в живом организме функциональных лигандов, таких как ДНК, РНК, моноклональное антитело или другие функциональные белки.
В последнее время учеными проведен ряд исследований мидий как возможного источника биологических связующих материалов. Мидии вырабатывают, и выделяют клейкий материал, который функционально дифференцируется, позволяя мидиям оставаться в неподвижном или прикрепленном состоянии в воде, в морской среде, которую характеризуют соленость, влажность, приливные течения, турбулентные течения, волны и т.д. Мидия прочно прикрепляется к поверхности материала в воде, используя нити, состоящие из пучков волокон, выделяемых из ножек мидии. На конце каждого волокна присутствует бляшка, содержащая водостойкий связующий материал, который позволяет мидии прикрепляться к влажной твердой поверхности. Белок этой нити содержит большое количество 3,4-дигидроксифенил-L-аланина (DOPA), который представляет собой аминокислоту, образующуюся при гидроксилировании тирозиновых групп с использованием полифенолоксидазы. Катехин (3,4-дигидроксифенил) на боковой ветви DOPA может образовывать очень прочную водородную связь с гидрофильной поверхностью и/или прочно связывать ионы металлов, оксиды металлов (Fe3+, Mn3+), полуметаллы (кремний) и т.п.
Описание изобретения
Техническая проблема
Таким образом, в результате всесторонних исследований по решению вышеупомянутых проблем в соответствующей области техники авторы настоящего изобретения получили биосовместимый стабилизатор дисперсии, который может приводить поверхность наночастиц в гидрофильное состояние, чтобы диспергировать наночастицы в водной системе, и обнаружили, что при использовании этого стабилизатора можно обеспечить диспергирование и стабилизацию наночастиц (стабилизацию дисперсии) в водной системе, в результате чего его можно эффективно использовать для биомедицинских приложений. Кроме того, было также обнаружено, что наночастицы, диспергированные и стабилизированные биосовместимым стабилизатором дисперсии согласно настоящему изобретению, могут оказаться применимыми в области технологии наноэлектронной плавки для квантового точечного (Q-dot) светоизлучающего устройства, области сканирования биологических объектов в качестве контрастного агента для МРТ, области тканевой технологии в целях клеточной терапии, области биомедицины в отношении гипертермии, доставки лекарственных средств и так далее.
Задача настоящего изобретения заключается в том, чтобы предложить стабилизатор дисперсии, который имитирует белок мидии и преобразует поверхность разнообразных наночастиц в гидрофильное состояние посредством простого процесса таким образом, чтобы стабилизировать дисперсию наночастиц в водной среде, что обеспечивает их применение в областях биомедицины.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить биосовместимый стабилизатор дисперсии, который имитирует белок мидии и включает полимер разветвленного типа полидигидроксифенилаланин, в котором стабилизатор можно устойчиво соединять с наночастицами в процессе образования множества связей.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином (PEI-graft-(PEG; PDOPA)), включающий образование полиэтиленимина привитого биосовместимым полимером на основе полиэтиленгликоля, который обладает сродством к водной среде (иногда сокращенно называется «полиэтиленгликоль привитый полиэтиленимином»), и полидигидроксифенилаланином, который обладает сродством к поверхности наночастиц.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить способ получения биосовместимого стабилизатора дисперсии, включающего имитирующий белок мидии полимер, то есть полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить диспергированные в водной среде наночастицы, используя стабилизатор дисперсии.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить коллоидный раствор, содержащий наночастицы, диспергированные и стабилизированные в водной среде с помощью стабилизатора дисперсии.
Еще одна задача настоящего изобретения заключается в том, чтобы предложить контрастный агент, включающий коллоидный раствор, который описан выше.
Решение проблемы
В общих аспектах настоящее изобретение предлагает имитирующий адгезивный белок мидии стабилизатор дисперсии для диспергирования наночастиц в водной среде, коллоидный раствор, содержащий наночастицы, диспергированные и стабилизированные вышеупомянутым стабилизатором дисперсии, и контрастный агент, включающий коллоидный раствор, который описан выше. Более конкретно, имитирующий адгезивный белок мидии стабилизатор дисперсии представляет собой полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином (PEI-graft-(PEG; PDOPA)), включающий полимер полиэтиленимина привитый биосовместимым полимером на основе полиэтиленгликоля, который обладает сродством к водной среде (иногда сокращенно называется «полиэтиленимин привитый полиэтиленгликолем»), и полидигидроксифенилаланином, который обладает сродством к поверхности наночастиц.
Настоящее изобретение также предлагает способ получения полиэтиленимина привитого полиэтиленгликолем и полидигидроксифенилаланином, включающий: (a) соединение полиэтиленгликоля в качестве гидрофильного полимера с полиэтиленимином посредством образования ковалентных связей с получением полиэтиленимина привитого полиэтиленгликолем; (b) после защиты гидроксильных групп DOPA синтез N-карбоксиангидрида (NCA) DOPA в присутствии трифосгена в качестве катализатора; и (c) реакцию ковалентно связанных полиэтиленгликоля и полиэтиленимина, со стадии (a) и N-карбоксиангидрида (NCA) DOPA, полученного на стадии (b), в органическом растворителе, с получением таким способом полиэтиленимина привитого полиэтиленгликолем и полидигидроксифенилаланином.
Кроме того, настоящее изобретение предлагает диспергированные в водной среде наночастицы с использованием полиэтиленимина привитого полиэтиленгликолем и полидигидроксифенилаланином в качестве стабилизатора дисперсии и содержащий их коллоидный раствор. Кроме того, настоящее изобретение предлагает контрастный агент, включающий коллоидный раствор.
Далее настоящее изобретение будет описано более подробно.
Имитирующий адгезивный белок мидии стабилизатор дисперсии согласно настоящему изобретению представляет собой полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином, включающий полимер полиэтиленимина привитый биосовместимым полимером на основе полиэтиленгликоля, который обладает сродством к водной среде (иногда сокращенно называется «полиэтиленимин привитый полиэтиленгликолем»), и полидигидроксифенилаланином, обладающим сродством к поверхности наночастиц, который содержит адгезивную аминокислоту мидии, то есть, DOPA.
Чтобы получить полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином согласно настоящему изобретению, полиэтиленгликоль и полиэтиленимин сначала соединяются посредством образования ковалентных связей, образуя полиэтиленимин привитый полиэтиленгликолем. Полученный продукт используют в качестве биосовместимого макроинициатора.
Полиэтиленгликоль, используемый в настоящем изобретении, может представлять собой полиэтиленгликоль, имеющий среднечисловую молекулярную массу от 300 до 50000 и гидроксильную группу или карбоксильную группу на конце. Согласно одному варианту осуществления настоящего изобретения, полиэтиленгликоль представляет собой метоксиполиэтиленгликоль, содержащий в качестве заместителей метоксильную группу на одном конце и карбоксильную группу на другом конце.
Полиэтиленимин, используемый в настоящем изобретении, может представлять собой разветвленный полиэтиленимин, не являющийся токсичным, у которого среднечисловая молекулярная масса составляет от 100 до 10100, предпочтительно от 100 до 2000. Если среднечисловая молекулярная масса разветвленного полиэтиленимина составляет менее чем 100, полученный сополимер согласно настоящему изобретению не сможет надлежащим образом совмещаться с физиологически активным материалом, пригодным для данной цели. С другой стороны, когда среднечисловая молекулярная масса составляет 10100 или более, могут возникать затруднения в выведении вышеупомянутого материала из организма через почки. Соответственно, в настоящем изобретении следует предпочтительно использовать полиэтиленимин, у которого среднечисловая молекулярная масса находится в вышеупомянутом интервале.
Полидигидроксифенилаланин, используемый в настоящем изобретении, может представлять собой конденсационный полимер, для которого 3,4-дигидроксифенилаланин (DOPA) служит в качестве мономера. Повторяющиеся звенья соединены посредством амидных связей. Число повторяющихся звеньев составляет от 1 до 100. Полидигидроксифенилаланин можно полимеризовать путем твердофазного синтеза и жидкофазного синтеза, используя разнообразные способы образования связей, включая реакцию посредством карбодиимида, симметричный ангидридный способ, смешанный ангидридный способ, активный сложноэфирный способ, азидный способ, ацилхлоридный способ и N-карбоксиангидридный способ. Такие примерные способы, которые описаны выше, предложены, чтобы обеспечить четкое понимание полидигидроксифенилаланина. Однако полидигидроксифенилаланин не ограничивается полимерами, которые синтезируют вышеупомянутыми способами. Полидигидроксифенилаланин, используемый в настоящем изобретении, можно синтезировать несколькими способами, описанными выше, предпочтительно N-карбоксиангидридным способом.
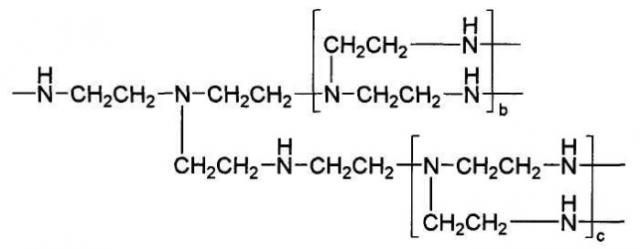
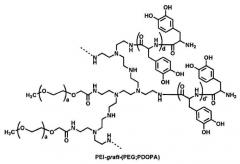
Полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином согласно настоящему изобретению может включать полиэтиленгликольное звено, представленное следующей структурой (A), звено полиэтиленимина, представленное следующей структурой (B), и звено полидигидроксифенилаланина, представленное следующей структурой (C):
где a составляет от 2 до 1200,
где A представляет собой разветвленный полиэтиленимин и x составляет от 1 до 100,
где d составляет от 1 до 100.
Вышеупомянутое звено полиэтиленимина (B) может, в частности, представлять следующая структура.
где каждое число из b и c независимо составляет от 1 до 100, предпочтительно от 1 до 30.
Полидигидроксифенилаланин согласно настоящему изобретению синтезируют из N-карбоксиангидрида (NCA) DOPA, где DOPA представляет собой одну из адгезивных аминокислот мидии и предпочтительно, по меньшей мере, одно вещество, выбранное из L-DOPA (L-3,4-дигидроксифенилаланин) и D-DOPA (D-3,4-дигидроксифенилаланин). Полидигидроксифенилаланин можно выбирать из группы, которую составляют L-полидигидроксифенилаланин, синтезированный из N-карбоксиангидрида (NCA) L-3,4-дигидроксифенилаланина (L-DOPA), D-полидигидроксифенилаланин, синтезированный из N-карбоксиангидрида (NCA) D-3,4-дигидроксифенилаланина (D-DOPA), и L,D-полидигидроксифенилаланин, синтезированный из N-карбоксиангидрида (NCA) L,D-3,4-дигидроксифенилаланина (L,D-DOPA, смесь L-DOPA и D-DOPA).
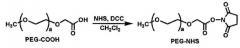
Стадия (a) представляет собой процесс получения биосовместимого макроинициатора, используемого в синтезе имитирующего белок мидии полимера для стабилизации наночастиц. На стадии (a) можно осуществить образование ковалентных связей между полиэтиленгликолем и полиэтиленимином, используя дициклогексилкарбодиимид (DCC)/N-гидроксисукцинимид (NHS) или, в качестве альтернативы, гексаметилендиизоцианат (HMDI). Здесь DCC и NHS активируют карбоксильную группу в полиэтиленгликоле, содержащем на концах как метоксильную, так и карбоксильную группу, чтобы взаимодействовать с первичной аминогруппой полиэтиленимина, образуя при этом пептидную ковалентную связь. В качестве альтернативы, HMDI активирует гидроксильную группу полиэтиленгликоля, содержащего на конце метоксильную группу, и служит для его соединения с первичной аминогруппой полиэтиленимина. Образование ковалентных связей между полиэтиленгликолем и полиэтиленимином, которое активируется HMDI, может включать любую реакцию с образованием ковалентной связи между двумя вышеупомянутыми полимерами. В одном варианте осуществления настоящего изобретения после растворения полиэтиленгликоля и активации полиэтиленимина DCC/NHS в хлороформе, соответственно, раствор полиэтиленгликоля добавляют каплями в раствор полиэтиленимина, обеспечивая, таким образом, образование ковалентных связей между данными двумя полимерами. После завершения реакции реакционный раствор концентрируют, и под действием диэтилового эфира осаждают в качестве продукта ковалентный сополимер полиэтиленгликоля и полиэтиленимина. Структура полиэтиленгликоля, активированного DCC/NHS, и структура содержащего ковалентные связи активированного полиэтиленгликоля и полиэтиленимина разветвленного типа (PEI) проиллюстрированы следующим образом:
(где a составляет от 2 до 1200.)
<Активация полиэтиленгликоля (PEG-NHS)>
(где, а составляет от 2 до 1200.)
<Полиэтиленимин, привитый полиэтиленгликолем (PEI-graft-PEG)>
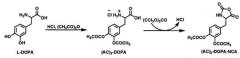
Синтез N-карбоксиангидрида (NCA) DOPA на стадии (b) можно осуществлять, используя, по меньшей мере, одно вещество, выбранное из адгезивных аминокислот мидии, то есть L-3,4-дигидроксифенилаланина (L-DOPA) и D-3,4-дигидроксифенилаланина (D-DOPA), в качестве исходного материала, и любой способ получения N-карбоксиангидрида (NCA) аминокислот, который известен в соответствующей области техники. Предпочтительно вышеупомянутое вещество (NCA) получают путем реакции адгезивной аминокислоты мидии (D-DOPA или L-DOPA или L,D-DOPA) в соответствующем растворителе в присутствии трифосгена в качестве катализатора.
Согласно одному варианту осуществления настоящего изобретения, как проиллюстрировано ниже, L-DOPA растворяют в уксусной кислоте, используя ангидрид уксусной кислоты, а также хлористоводородную кислоту, затем ацетилируют гидроксильную группу L-DOPA, чтобы синтезировать (AC)2DOPA, защищая при этом гидроксильную группу. После этого, используя трифосген в органическом растворителе, который представляет собой тетрагидрофуран (THF), синтезируют N-карбоксиангидрид (NCA) L-DOPA (см. ниже).
<Схема реакции N-карбоксиангидрида (NCA) DOPA>
Получение полиэтиленимина привитого полиэтиленгликолем и полидигидроксифенилаланином на стадии (c) можно осуществлять многократным инициированием полиэтиленимина, привитого полиэтиленгликолем, полученного на стадии (a) и N-карбоксиангидрида (NCA) DOPA, синтезированного на стадии (b), в органическом растворителе, что обеспечивает соответствующую полимеризацию. Полидигидроксифенилаланин синтезируют индуцированием полимеризации N-карбоксиангидрида DOPA, используя первичную аминогруппу, присутствующую в полиэтиленимине привитом полиэтиленгликолем, в качестве многократного инициатора. Согласно вышеупомянутым процессам, синтезированный полидигидроксифенилаланин соединяется с полиэтиленимином привитым полиэтиленгликолем, образуя конечный продукт, то есть полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином.
На стадии (c), регулируя добавляемое количество N-карбоксиангидрид (NCA) DOPA, который используют в качестве имитатора биологического связующего центра, можно придавать полимеру согласно настоящему изобретению регулируемую связующую способность и гидрофобные свойства (гидрофобность). Предпочтительно молярное отношение полиэтиленимина привитого полиэтиленгликолем к N-карбоксиангидриду (NCA) DOPA составляет от 1:1 до 1:50. Если молярное соотношение выходит за пределы вышеупомянутого интервала, могут возникать проблемы увеличения гидрофобности или уменьшения связующей способности имитирующего биологический белок стабилизатора дисперсии.
Органический растворитель, используемый на стадии (c), может включать, по меньшей мере, одно вещество, выбранное из диметилсульфоксида (DMSO), тетрагидрофурана (THF), и хлороформа (CHCl3).
После завершения полимеризации на стадии (c) можно дополнительно включить стадию (d), которая представляет собой процесс снятия защиты с защищенной гидроксильной группы полидигидроксифенилаланина. Согласно одному варианту осуществления настоящего изобретения, после завершения полимеризации полиэтиленимина привитого полиэтиленгликолем и полидигидроксифенилаланином продукт диспергируют в диметилформамиде (DMF). После этого путем добавления к смеси надлежащего количества пиперидина гидроксильную группу DOPA, защищенную ацетильной группой, можно деацетилировать, получая, в свою очередь, полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином PEI-graft-(PEG; PDOPA), представленный следующей структурой:
(где a составляет от 2 до 1200, и каждое из чисел d и d' независимо составляет от 1 до 100).
<Полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином PEI-graft-(PEG; PDOPA)>
Кроме того, предложены диспергированные в водной среде наночастицы, в которых использован стабилизирующий дисперсию агент, и коллоидный раствор, включающий наночастицы.
Полиэтиленимин привитый полиэтиленгликолем и полидигидроксифенилаланином, используемый в настоящем изобретении, может представлять собой биосовместимый стабилизатор дисперсии разветвленного типа, включающий имитирующий адгезивный белок мидии биосовместимый полимер и содержащий полидигидроксифенилаланин, который полезен для диспергирования и стабилизации наночастиц в водной среде.
Такие наночастицы могут включать одну или более неорганических наночастиц, выбранных из группы, которую составляют металл, халькогенид металла, оксид металла, магнитные вещества, магнитные сплавы, полупроводниковые материалы или многокомпонентные композитные структуры.
Более конкретно, металл можно выбирать из группы, которую составляют Pd, Pt, Au, Cu и Ag; халькогенид металла может представлять собой MxEy (M=Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zr, Mo, Ru, Rh, Ag, W, Re, Ta, Hf, Zn или Cd; E=O, S или Se; 0<x≤3; 0<y≤5); и оксид металла можно выбирать из группы, которую составляют оксид титана, оксид ванадия, оксид хрома, оксид марганца, оксид железа, оксид кобальта, оксид никеля, оксид меди, оксид циркония, оксид молибдена, оксид рутения, оксид родия, оксид серебра, оксид вольфрама, оксид рения, оксид тантала, оксид гафния и оксид цинка. Более предпочтительно оксид железа можно выбирать из FeO, Fe3O4 (магнетит), α-Fe2O3, β-Fe2O3, γ-Fe2O3 (маггемит), ε-Fe2O3, Fe(OH)2, Fe(OH)3, α-FeOOH, β-FeOOH, γ-FeOOH, δ-FeOOH, Fe5HO8•4H2O, 5Fe2O3•9H2O, FeOOH•4H2O, Fe8O8(OH)6(SO)•nH2O, Fe16O16(OH•SO4)12-13•10-12H2O и смесь Fe3O4 (магнетит) и γ-Fe2O3 (маггемит). В качестве альтернативы, магнитное вещество предпочтительно выбирают из группы, которую составляют Co, Mn, Fe, Ni, Gd, MM'2O4 и MxOy (M или M'= Co, Fe, Ni, Mn, Zn, Gd, Cr; 0<x≤3; 0<y≤5, соответственно); магнитные сплавы предпочтительно выбирают из группы, которую составляют CoCu, CoPt, FePt, CoSm, NiFe и NiFeCo. При этом полупроводниковый материал можно выбирать из группы, которую составляют полупроводники, включающие элементы, выбранные из группы 2 и группы 6, соответственно; полупроводники, включающие элементы, выбранные из группы 3 и группы 5, соответственно; полупроводники, включающие элементы группы 4; полупроводники, включающие элементы, выбранные из группы 4 и группы 6, соответственно; и полупроводники, включающие элементы, выбранные из группы 5 и группы 6, соответственно. Многокомпонентные композитные структуры могут включать, по меньшей мере, два материала, выбранных из группы, которую составляют металл, халькогенид металла, магнитные вещества, магнитные сплавы и полупроводниковые материалы, кроме того, включены материалы имеющие структуру с ядром и оболочкой или гетеропереходную структуру. Более предпочтительно можно использовать, по меньшей мере, один материал, выбранный из группы, состоящей из следующих сочетаний соединений, которые образуют структуру типа ядро/оболочка, соответственно: селенид кадмия/сульфид цинка (CdSe/ZnS), селенид кадмия/селенид цинка (CdSe/ZnSe), селенид кадмия/сульфид кадмия (CdSe/CdS), теллурид кадмия/сульфид цинка (CdTe/ZnS), теллурид кадмия/селенид цинка (CdTe/ZnSe), теллурид кадмия/сульфид кадмия (CdTe/CdS), теллурид кадмия/селенид кадмия (CdTe/CdSe), сульфид цинка (ZnS), сульфид кадмия (CdS), арсенид индия (InAs), фосфид индия (InP), арсенид индия/фосфид индия (InAs/InP), арсенид индия/селенид кадмия (InAs/CdSe), арсенид индия/сульфид цинка (InAs/ZnS), арсенид индия/селенид цинка (InAs/ZnSe), фосфид индия/селенид кадмия (InP/CdSe), фосфид индия/сульфид цинка (InP/ZnS), фосфид индия/селенид цинка (InP/ZnSe) и т.п.
Кроме того, предложен контрастный агент, включающий коллоидный раствор.
Полезные эффекты изобретения
Согласно настоящему изобретению, можно синтезировать имитирующий адгезивный белок мидии биосовместимый стабилизатор дисперсии, который способен модифицировать поверхность наночастиц и устойчиво диспергировать их в водной среде. Стабилизатор дисперсии, полученный согласно настоящему изобретению, содержит полидигидроксифенилаланин, синтезированный посредством многоинициаторной полимеризации и содержащий, в свою очередь, по меньшей мере, одно звено DOPA на молекулу, то есть представляющий собой многократно взаимодействующий лиганд (MIL) и проявляющий высокую прочность связи с гидрофильной поверхностью. Поскольку стабилизатор дисперсии, полученный согласно настоящему изобретению, обладает положительным зарядом, это может дополнительно усиливать электростатическое притяжение к поверхности наночастиц, обладающих отрицательным зарядом. Кроме того, поскольку многочисленные молекулы полиэтиленгликоля, обладающие гидрофильными свойствами, соединены с ветвями полиэтиленимина разветвленного типа, можно обеспечивать высокую степень стабилизации водной дисперсии за счет гидрофильных свойств и стереоскопических эффектов. Соответственно, биосовместимый стабилизатор дисперсии, полученный согласно приведенному выше описанию, может обеспечивать устойчивую дисперсию наночастиц в водной среде, в результате чего он оказывается применимым в разнообразных областях, включающих, например, наноэлектронные конвергентные технологии, такие как квантовые точечные (Q-Dot) светоизлучающие устройства; контрастные агенты для применения в технологиях сканирования биологических объектов, таких как магнитно-резонансная томография (МРТ); приложения клеточных технологий, такие как клеточная терапия; биомедицинские приложения, такие как гипертермия, доставка лекарственных средств и т.д. Кроме того, по сравнению с наночастицами, диспергированными стабилизаторами дисперсий, полученными согласно традиционным технологиям, оказывается возможным достижение превосходной устойчивости дисперсии.
Краткое описание чертежей
Перечисленные выше и другие задачи, отличительные особенности и преимущества настоящего изобретения становятся очевидными из следующего описания предпочтительных вариантов осуществления, приведенных в сочетании с сопровождающими чертежами, из которых:
фиг.1 иллюстрирует химическую структуру имитирующего адгезивный белок мидии биосовместимого стабилизатора дисперсии и стабилизацию наночастиц, используемых в настоящем изобретении;
фиг.2 иллюстрирует результаты анализа методом спектроскопии ЯМР 1H (в DMSO) полимера PEI-graft-(PEG; PDOPA5), полученного в примере <1-6>;
фиг.3 иллюстрирует результаты анализа методом спектроскопии ЯМР 1H (в CDCl3) полимера PEI-graft-(PEG; PDOPA5), полученного в примере <1-6>;
фиг.4 иллюстрирует результаты анализа методом спектроскопии ЯМР 1H (в DMSO) полимера PEI-graft-(PEG; PDOPA15), полученного в примере <1-6>;
фиг.5 иллюстрирует результаты анализа методом спектроскопии ЯМР 1H (в CDCl3) полимера PEI-graft-(PEG; PDOPA15), полученного в примере <1-6>;
фиг.6 иллюстрирует полученные методом просвечивающей электронной микроскопии (TEM) изображения наночастиц (a: 11 нм Fe3O4, b: 13 нм MnO, c: 5 нм Au, d: 3 нм CdSe/ZnS), диспергированных перед стабилизацией, а также наночастиц (e: 11 нм Fe3O4, f: 13 нм MnO, g: 5 нм Au, h: 3 нм CdSe/ZnS), которые диспергировали в воде после стабилизации, используя имитирующий адгезивный белок мидии биосовместимый стабилизатор дисперсии (MIL2); а также полученные с помощью устройства динамического рассеяния света (DLS) размеры частиц для разнообразных наночастиц, которые устойчиво диспергировали в воде, используя имитирующий адгезивный белок мидии биосовместимый стабилизатор дисперсии (i: Fe3O4, j: MnO, k: Au, l: CdSe/ZnS);
фиг.7 иллюстрирует экспериментальные результаты исследования устойчивости наночастиц оксида железа (Fe3O4) перед стабилизацией и после того, как их диспергировали и стабилизировали в воде, используя имитирующий адгезивный белок мидии стабилизатор дисперсии, при различных значениях pH (фиг.7 (а)) и концентрациях ионов (фиг.7 (b)), где гидродинамический диаметр (HD) измеряли, используя устройство DLS, после чего сравнивали результаты измерений (MIL0 (♦), MIL1 (▲) и MIL2 (○0)); и
фиг.8 иллюстрируют полученные в живом организме методом магнитно-резонансной томографии (МРТ) изображения стабилизации оксида железа имитирующим адгезивный белок мидии биосовместимым стабилизатором дисперсии (MIL2), включая изображения по результатам измерений перед введением стабилизатора (фиг.8 (А)) и после его введения через 24 часа (фиг.8 (В)) и 48 часов (фиг.8 (С)).
Варианты осуществления изобретения
Преимущества, отличительные особенности и аспекты настоящего изобретения становятся очевидными из следующего описания вариантов осуществления при рассмотрении сопровождающих чертежей, которые приведены после него. Однако данные варианты осуществления приведены, чтобы обеспечить более четкое понимание настоящего изобретения, и объем технических конфигураций настоящего изобретения не следует истолковывать как ограниченный приведенными в настоящем документе вариантами осуществления. Напротив, разнообразные модификации или изменения основных концепций настоящего изобретения и его осуществления смогут легко производить обычные специалисты в соответствующей области техники.
L-3,4-дигидроксифенилаланин (DOPA), PEG-OH (5000 Да), диметилформамид (DMF), N-гидроксисукцинимид (NHS), N,N'-дициклогексилкарбодиимид (DCC), ангидрид уксусной кислоты, ледяную уксусную кислоту, метиленхлорид (MC) и хлороформ приобретали от фирмы Sigma Chemical Company (Сент-Луис, штат Миссури), и PEI (1800 Да; PEI 1800) приобретали у фирмы Alfa Aesar. В течение 48 часов перед использованием данные материалы сушили при 40°C в вакууме.
[Пример 1] Синтез имитирующего адгезивный белок мидии биосовместимого стабилизатора дисперсии
<1-1> Активация полиэтиленгликоля
<1-1-1> Использование дициклогексилкарбодиимида/N-гидроксисукцинимида (DCC/NHS)
После установки дефлегматора метоксиполиэтиленгликолькарбоновую кислоту (PEG-COOH, 5000) (10 г) растворяли в метиленхлориде (CH2Cl2) (50 мл) в колбе объемом 250 мл. Затем в раствор добавляли N-гидроксисукцинимид (NHS) (0,52 г) и дициклогексилкарбодиимид (DCC) (0,74 г) и проводили реакцию при комнатной температуре в течение 20 часов. После отделения дициклогексилмочевины путем фильтрования данный материал осаждали в диэтиловом эфире, получая полиэтиленгликоль в активированном состоянии (PEG-NHS) (выход 87%). Спектр ЯМР 1H (300 МГц, CDCl3): 1H ЯМР(300 МГц, CDCl3): δ 4,1 (b, -CO-CH2-CH2-CH2 -0-), 3,5-3,8 (м, -CH2CH2O-), 2,8 (b, -CO-CH2-CH2-CO-), 1,8 (b, -CO-CH2-CH2-CH2-CH2-CH2-O-), 1,2 (b, -CO-CH2-CH2-CH2-CH2-CH2-O-).
<1-1-2> Использование гексаметилендиизоцианата (HDMI)
После установки дефлегматора метоксиполиэтиленгликоль (PEG-OH) (15,23 г) растворяли в хлороформе (CHCl3) (15 мл) в колбе объемом 100 мл. Затем в раствор добавляли гексаметилендиизоцианат (HMDI) (60 мл) и проводили реакцию в течение 24 часов для получения полим