Способ моделирования осевой близорукости
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к офтальмологии, и может быть использовано в научной и клинической практике при разработке консервативных и оперативных методов лечения осевой близорукости. Для этого в эксперименте моделируют осевую близорукость у кроликов породы шиншилла. Моделирование проводят ежедневным введением во внутреннюю сонную артерию в течение 6 месяцев 0,3-0,6 мл раствора трансретиноевой кислоты в концентрации 0,04-0,07 мг на 1 мл физраствора. Введение осуществляют в течение 6 месяцев. Способ позволяет повысить точность воспроизведения патологического процесса, приблизить модель к течению естественной патологии. 2 ил., 2 табл., 1 пр.
Реферат
Изобретение относится к медицине, а именно к офтальмологии, и может быть использовано в научной и клинической практике при разработке консервативных и оперативных методов лечения близорукости.
Известен способ моделирования экспериментальной близорукости, при котором кроликам под конъюнктиву глаза в зону экватора в четырех сегментах вводят свежеприготовленный раствор папаина на физиологическом растворе при 37°C из расчета 0,005 мг на 1 мл раствора по 0,25 мл в каждый сегмент. Клиническими, гистологическими и электронно-микроскопическими исследованиями было доказано развитие миопической болезни у экспериментального животного (патент СССР №1573466, 1990 г.). Макроскопически на поверхности склеры в области конъюнктивальных сводов определялись зоны истончения склеры в виде типичных миопических стафилом с просвечивающейся через склеру сосудистой оболочкой. Клинически на глазном дне авторы отмечали развитие хориоидальной дистрофии с диспигментацией пигментного эпителия сетчатки, прогрессирующим хориоваскулосклерозом и формированием в зоне экватора белых дистрофических очагов. При биомикроскопии выявлено развитие дистрофических изменений в радужке. Определялось усиление клинической рефракции, увеличение переднезаднего размера глаза. При исследовании гемодинамики выявлено уменьшение кровенаполнения сосудистой оболочки глаза. При гистологическом и электронно-микроскопическом изучении склеры и хориоидеи выявлено истончение фиброзной и сосудистой оболочек со значительными нарушениями в структуре коллагеновых волокон и фибрилл, вплоть до их зернистого распада.
Однако способ имеет ряд недостатков: моделирование осуществляют введением препарата в четырех сегментах, что травматично для глаза, нативный ферментный препарат папаин быстро инактивируется системой ингибиторов организма, что требует его ежедневного введения, приводящего к увеличению риска развития токсико-аллергических реакций.
Известен способ моделирования экспериментальной близорукости, основанный на повышении внутриглазного давления на фоне снижения давления в сосудах глаза при сочетанном воздействии 3,0% раствора натрия хлорида и 1,0% раствора никотиновой кислоты в период роста организма кролика (Барковская Т.Н., 2001). Автором на глазах кроликов породы шиншилла данным способом воспроизведена близорукость до 2,0 дптр. Переднезадний размер глаза увеличился с 20,5 до 23,9 мм, а морфологически выявлены изменения в виде истончения всех слоев склеры с фрагментацией ее волокон и повышенным накоплением гликозаминогликанов.
Однако данный способ не воспроизводит естественные условия формирования данного заболевания.
Результаты экспериментальных исследований показали, что различные ткани глазного яблока (хориоидея, пигментный эпителий сетчатки) способны синтезировать ретиноевую кислоту и она участвует в регуляции роста глазного яблока. Концентрация ретиноевой кислоты в организме должна поддерживаться на строго определенном уровне. Избыток ретиноевых кислот способен ингибировать синтез склеральных протеогликанов. Торможение синтеза протеогликанов ослабляет склеру и создает структурную основу для возникновения миопии.
На сегодняшний день в фибробластах склеры человека обнаружено 6 типов рецепторов к ретиноевой кислоте (RAR alpha, RAR beta, RAR gamma, RXR alpha, RXR beta, and RXR gamma). В отсутствие избытка ретиноевых кислот рецепторы в фибробластах неактивны. При избытке - активируется ген рецептора RAR alpha, который рассматривается как потенциальный ген развития миопии.
В то же время трансретиноевая кислота - это естественный эндогенный метаболит витамина А, относящийся к классу ретиноидов и в норме присутствующий в плазме крови в концентрации 0,5-1,5 нг/мл. Под действием внутриклеточных изомераз трансретиноевая кислота метаболизируется в 13-цисретиноевую кислоту и окисляется в печени цитохромом Р450 до 4-оксиметаболитов.
С учетом изложенного очевидно, что изменение концентрации ретиноевой кислоты в организме можно использовать для создания модели миопии.
По нашему мнению, ближайшим аналогом предлагаемого нами способа является использование трансретиноевой кислоты для моделирования миопии, которая вводится морским свинкам в составе корма 3 раза в количестве 25 мг/кг вместе с 0,4 мл арахисового масла на 7,9 и 11 день от рождения (Sally A. McFadden, Marc H.C. Howlett, James R. Mertz, Retinoic acid signals the direction of ocular elongation in the guinea pig eye, Vision Research 44 (2004) 643-653).
Однако столь краткое введение трансретиноевой кислоты, а также использование метаболита с пищей не позволяет контролировать уровень метаболита в крови и, как следствие, в тканях глаза, повысить точность воспроизведения патологического процесса и приблизить модель к течению естественной патологии, которая представляет собой патологический процесс, растянутый во времени.
Задачей данного изобретения является усовершенствование вышеописанного метода моделирования осевой близорукости.
Задача решается за счет того, что в способе моделирования осевой близорукости лабораторным животным во внутреннюю сонную артерию в течение 6 месяцев ежедневно вводится 0,3-0,6 мл раствора трансретиноевой кислоты в концентрации 0,04-0,07 мг трансретиноевой кислоты на 1 мл физраствора.
Способ осуществляется следующим образом:
Для премедикации животному, в частности кролику породы шиншилла, вводится 2% раствор ксилозина гидрохлорида (рометар). Через 10-15 мин внутривенно в краевую вену уха вводится золетил - 50 в дозе 6,6 мг/кг массы тела.
После проведения общей анестезии во внутреннюю сонную артерию экспериментального животного устанавливается постоянный катетер Vasofix Certo 24G.
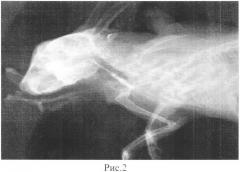
Правильное положение катетера контролируется проведением рентгенограммы черепа в боковой проекции после введения 0,5 мл рентгенконтрастного вещества Омнипак (Amersham Health, Cork, Ireland) в концентрации 300 мг/мл.
Через катетер в течение 6 месяцев ежедневно вводится 0,3-0,6 мл трансретиноевой кислоты в виде раствора с концентрацией 0,04-0,07 мг трансретиноевой кислоты на 1 мл физраствора.
Раствор для ежедневного введения трансретиноевой кислоты приготовляется в условиях приглушенного света. Порошок разводится в 100% этаноле, далее в полученный раствор добавляется NaCl 0,9% до конечной концентрации 0,04-0,07 мг/мл.
Предложенным способом было проведено моделирование осевой близорукости на 5 кроликах-самцах породы «шиншилла» с исходной массой тела 2,0-2,5 кг. Контрольную группу составили 5 животных, которым после установки катетера в левую внутреннюю сонную артерию трансретиноевая кислота не вводилась.
Предварительно у подопытных животных проводилось полное офтальмологическое обследование обоих глаз, включающее офтальмоскопию, биомикроскопию (щелевая лампа SL-30 фирмы «Opton», производство Германия), определение клинической рефракции (авторефрактометр «Mirae Optics Charops MRK-2000», производство Япония), определение переднезаднего размера глаза - эхобиометрия (офтальмобиометр «Ultrasonic Biometer Model 820»). Офтальмологический контроль по схеме проводили 1 раз в 3 месяца. Оценку результатов давали по результатам биомикроскопии, офтальмоскопии, авторефрактометрии, ЭХО-биометрии.
В результате исследований выявлено, что в контрольных глазах экспериментальных животных на всем сроке наблюдения сохранялась гиперметропическая рефракция. Ее величина в контрольных глазах животных на момент начала эксперимента составляла +4,05±0,17 и по истечении 6 месяцев уменьшилась до +3,62±0,48 (p<0,05). В опытных глазах отмечалось усиление рефракции с +3,92±0,4 до - 0,78±0,2 (p<0,05) (табл.1).
Переднезадняя ось глазного яблока в опытных глазах экспериментальных животных увеличилась с 16,00±1,59 до 18,84±1,47 (p<0,05), в то время как переднезадняя ось глазного яблока контрольных глаз животных достоверно не менялась (табл.2).
Разработанный нами метод позволил получить средний рефракционный эффект через 6 мес - 0,78±0,2 дптр.
Пример осуществления способа
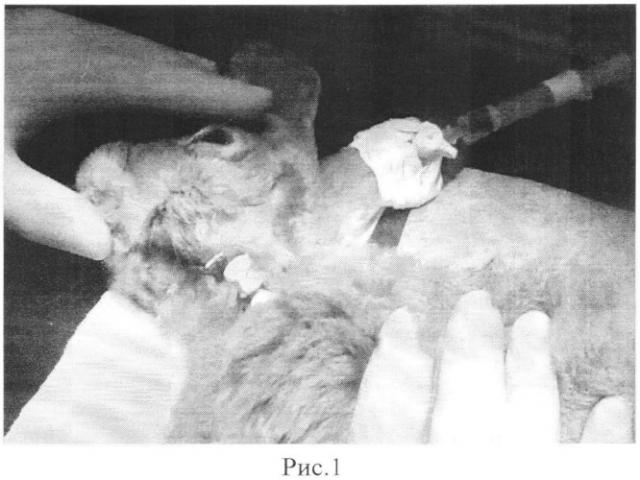
Кролик обследован путем биомикроскопии, офтальмоскопии, патологии не обнаружено. Проводили общую анестезию животного и устанавливали во внутреннюю сонную артерию катетер Vasofix Certo 24G (рис.1). Правильное положение катетера контролировалось проведением рентгенограммы черепа в боковой проекции после введения 0,5 мл рентгенконтрастного вещества Омнипак (Amersham Health, Cork, Ireland) в концентрации 300 мг/мл (Рис.2).
Через установленный катетер в течение 6 месяцев ежедневно вводили 0,5 мл раствора трансретиноевой кислоты в концентрации 0,06 мг на 1 мл физраствора. Токсико-аллергические реакции у животного не были выявлены на протяжении всего времени моделирования.
При обследовании экспериментального животного через 6 мес наблюдалось увеличение переднезаднего размера глазного яблока до 18,5 мм и усиление клинической рефракции до -0,5 дптр.
Таким образом, результаты проведенных нами экспериментальных исследований показали, что способ, основанный на воздействии через системную гемодинамику, является наиболее эффективным при моделировании осевой близорукости. Введение через катетер, установленный во внутреннюю сонную артерию 0,3-0,6 мл раствора трансретиноевой кислоты в концентрации 0,04-0,07 мг на 1 мл физраствора, способствует возникновению осевой формы близорукости с клиническими признаками, характерными для этого процесса.
Способ прост в исполнении, не требует дорогостоящей аппаратуры и препаратов, может быть использован в научной и клинической практике при разработке консервативных и оперативных методов лечения близорукости.
Таким образом, предложенный способ моделирования осевой близорукости по сравнению с прототипом позволяет повысить точность воспроизведения патологического процесса, приблизить модель к течению естественной патологии.
| Таблица 1 | ||
| Клиническая рефракция глаз экспериментальных животных до и после введения транс-ретиноевой кислоты | ||
| Сроки наблюдений | Клиническая рефракция глаз животных | |
| опытные | контрольные | |
| исход | +3,92±0,4 | +3,99±0,32 |
| 6 мес | -0,78±0,2* | +3,46±0,36* |
| Примечание: *p<0,05 по сравнению рефракцией до эксперимента |
| Таблица 2 | ||
| Переднезадний размер глаз опытных и контрольных животных до и после введения трансретиноевой кислоты | ||
| Сроки наблюдений | Переднезадний размер глаза | |
| опытные | контрольные | |
| исход | 16,00±1,59 | 15,17±1,16 |
| 6 мес | 18,84±1,47* | 15,62±0,98 |
| Примечание: *p<0,05 по сравнению с исходным ПЗР |
Способ моделирования осевой близорукости, включающий введение кролику породы шиншилла во внутреннюю сонную артерию в течение 6 месяцев ежедневно 0,3-0,6 мл раствора трансретиноевой кислоты в концентрации 0,04-0,07 мг на 1 мл физраствора.