Штамм макромицета trametes versicolor, используемый в качестве продуцента для получения биологически активных противоплесневых препаратов
Иллюстрации
Показать всеИзобретение относится к микробиологии. Предложен штамм Trametes versicolor, используемый для получения противоплесневых препаратов в отношении грибов рода Penicillium. Штамм депонирован в ВКПМ под номером F-1024. Штамм обладает высокими хитиназной и фунгицидной активностями. 4 ил., 1 табл., 5 пр.
Реферат
Изобретение относится к области микробиологии, касается нового штамма В 08/06 Trametes versicolor (L.: Fr.) Pilat. (ВКПМ F-1024) и может быть использовано для получения противоплесневых препаратов, используемых в пищевой промышленности.
В настоящее время для предотвращения плесневения пищевых продуктов с успехом используются антисептики, химические консерванты, фитонциды, органические кислоты, а также композиции химических веществ [Белова В.Ю. Предотвращение плесневения сырокопченых колбас // В.Ю. Белова, В.В. Вагин, Л.В. Зимина / Молочная и мясная промышленность. 1989. - №6. - С.39; Кузнецова Л.С. Состав плесневых грибов, поражающих поверхность мясной продукции // Л.С. Кузнецова, Н.В. Михеева, Е.В. Казакова, С.М. Озерская, Н.Е. Иванушкина / Мясная индустрия. 2009. - №3. - С.28-30]. Одним из перспективных направлений защиты поверхности пищевых продуктов от поражения плесневыми грибами является использование доброкачественных грибов или доброкачественной плесени. Большое количество сырокопченых колбас с доброкачественной плесенью производят в Румынии, Венгрии, Италии, Испании [Белова В.Ю. Применение препаратов, предотвращающих плесневение продукта при производстве сырокопченых колбас // В.Ю. Белова, В.В. Вагин, Л.В. Зимина и др./М.: АгроНИИТЭИИММП. 1990. -28 с.]. Плесневые грибы при созревании не только придают особый внешний вид колбасе - налет плотной белой или серой плесени на оболочке, но и регулируют выделение влаги при сушке сырокопченых колбас. Их использование позволяет в определенной степени компенсировать колебания влажности воздуха в камере созревания и способствует образованию специфического аромата колбасы [Шипулин В.И. Антимикробные препараты в производстве колбас // В.И. Шипулин, А.В. Серов, И.М. Шевченко / Мясная индустрия. 2009. - №4. -С.63-65].
При производстве венгерской салями на поверхности колбас выращивают слой плесени, в которой преобладают представители актиномицетов рода Sporichthya. Этот вид плесени способствует быстрому высыханию колбасы и обеспечивает равномерный ход сушки при большом диаметре батонов [Белова В.Ю. Предотвращение плесневения сырокопченых колбас // В.Ю. Белова, В.В. Вагин, Л.В. Зимина / Молочная и мясная промышленность. 1989. - №6. - С.39; Корнелаева Р.П. Микробиология мяса и мясопродуктов // Р.П. Корнелаева, М.А. Сидоров / Учебное пособие. 3-е издание. 2005. - 204 с.].
В Федеральном научно-исследовательском центре мясной промышленности (г. Кульмбах, ФРГ) выделен штамм Penicillium malgiovensies, названный ′′благородной плесенью Кульмбах′′ (Edelschimmell Kulbach), который применяется для созревания сырокопченых колбас. В США фирма San Francisco Sausage Со при изготовлении сырокопченой колбасы салями использует закваски молочнокислых бактерий для сохранения поверхности салями от порчи и придания ей специфических вкуса и аромата [Белова В.Ю. Предотвращение плесневения сырокопченых колбас // В.Ю. Белова, В.В. Вагин, Л.В. Зимина / Молочная и мясная промышленность. 1989. - №6. - С.39; Кузнецова Л.С. «Ромонат» - добавка для стабилизации качества мясных продуктов // Л.С. Кузнецова, Н.В. Михеева, Г.П. Чижов/Мясная индустрия. 2009. - №9. - С.30-33].
Большой потенциал для использования в пищевой промышленности имеют представители вида Trametes versicolor благодаря их антимикробному действию. Ксилотрофные макромицеты рода Trametes стали объектами различных исследований начиная с 60-х годов прошлого века. Авторы исследований в Японии предлагали в качестве продуцентов следующие виды этого рода: T. hirsuta, Т. pubescens, Т. versicolor и Т. zonatus [Белова Н.В. Перспективы использования биологически активных соединений высших базидиомицетов в России // Н.В. Белова / Микология и фитопатология. 2004. -Т.38, №2. -С.1-4; Горшина Е.С. Биотехнологический препарат лекарственного гриба кориола опушенного // Е.С. Горшина, М.М. Скворцова, В.Г. Высоцкий / Современная микология России. Тезисы докладов I конгресса микологов России. М.: Национальная академия микологии. 2002. -С.295; Шишкина Л.Н. Антиоксидантная активность липидов ксилотрофных базидиомицетов // Л.Н. Шишкина, А.Н. Капич / Успехи медицинской микологии. 2006. - Т.VII. - С.262-263].
В настоящее время базидиальные грибы рода Trametes широко используются народной медициной Японии и Китая в виде настоев порошка плодовых тел, а их высокоочищенные экстракты, содержащие полисахариды, известны как препараты, обладающие иммуномодулирующей и противоопухолевой активностью, усиливающие клеточный иммунитет, обладающие антиметастатической активностью и снижающие гематологическую супрессию, вызываемую противоопухолевыми лекарствами, а также эффективные при заболеваниях печени различной этиологии [Cui J. Polysaccharopeptides Coriolus versicolor: physiological activity, uses and production // J. Cui, Y. Chisti / Biotechnology advances. 2003. - V.21. - P.109-122; Sliva D. Ganoderma lucidum in cancer research // D. Sliva / Leukemia Research. 2006. - V.30. -P.767-768; Ooi V. Immunomodulation and anti-cancer activity of polysaccharide-protein complex // V. Ooi, F. Liu/Current medicinal chemistry. 2000. - V.7. - P.715-729; Zhang W. Effect Chinese medicinal fungus water extract on tumor metastasis and some parameters of immune function // W. Zhang, Y. Wang, Y. Hou / International Immunopharmacology. 2004. - V.4. - P.461-468].
В Иркутском филиале института ветеринарии Сибири и Дальнего Востока СО РАСХН с использованием современных методов биотехнологии на основе базидиального гриба Coriolus pubescens был разработан препарат «Леван-2», обладающий антимикробной активностью в отношении референтных штаммов микроорганизмов и штаммов, выделенных от больных животных из родов Salmonella, Escherichia, Staphylococcus, Streptococcus, Pseudomonas, Bacillus, Enterobacter [Чхенкели B.A. Антимикробное действие дереворазрушающего гриба Coriolus pubescens (Shum.: Fr.) Quel. // B.A. Чхенкели, Т.И. Никифорова, Р.Г. Скворцова / Микология и фитопатология. 1998. - Т. 32, №1 - С.69-71].
В работах Е.С. Горшиной и В.Г. Скворцовой показано, что препарат, полученный на основе сухой мицелиальной субстанции одного из штаммов С. pubescens, обладает высокой биологической активностью. Изучен его химический состав и препарат сертифицирован как пищевая добавка [Горшина Е.С. Биотехнологический препарат лекарственного гриба кориола опушенного // Е.С. Горшина, М.М. Скворцова, В.Г. Высоцкий / Современная микология России. Тезисы докладов I конгресса микологов России. М.: Национальная академия микологии. 2002. - С.295; Скворцова М.М. Иммунотропные свойства БАД «Трамелан». Биохимические, медико-биологические и клинические исследования // М.М. Скворцова, Е.С. Горшина / Успехи медицинской микологии. 2006 - Т.VII. - С.206-209].
Большинство работ по поиску и выделению биологически активных веществ базидиомицетов проведены с использованием плодовых тел. Использование плодовых тел не может служить надежной основой для производства биологически активных соединений. Известно, что биологически активные вещества высших грибов содержатся не только в базидиомах, но и в вегетативном мицелии гриба, получаемом путем жидкофазного и твердофазного культивирования. Важным преимуществом получения биомассы мицелия с помощью биотехнологических методов являются: неограниченная возможность и безотходность производства препаратов, не дефицитность сырьевых ресурсов. Поэтому важным преимуществом получения биомассы мицелия с помощью методов биотехнологии являются: экологическая чистота получаемых препаратов, неограниченная возможность производства, многообразие и дешевизна сырьевых ресурсов и безотходность производства [Феофилова Е.П. Новые биотехнологии получения биологически активных веществ из мицелиальных грибов // Е.П. Феофилова / Успехи медицинской микологии. 2007. - Т.IX. -С.195-196; Winther К. A combination of Japanese ginseng, Ganoderma lucidum and Trametes versicolor, referred to as the GOINO PROCEDURE, can lower blood glucose and LDL-cholesterol in patients with NIDDM // K. Winther, J. Mehlsen, E. Rein, A. Hansen, T. Goino / XIIIth International Symposium on Atherosclerosis, Japan. 2003. - P. 339].
Известно, что большинство штаммов Т. versicolor хорошо культивируется на агаризованных питательных средах с образованием густого разветвленного, септированного мицелия, с многочисленными пряжками одиночного типа. Учитывая современные научные тенденции, касающиеся сохранения качества и обеспечения микробиологической безопасности полноценной продукции, штаммы Т. versicolor могут послужить основой для разработки и внедрения в производство новых поколений экологически безопасных комплексных пищевых добавок, предназначенных для длительной и надежной антимикробной и противоплесневой защиты [Ковалева Г.К. Биологические особенности и биохимический состав ксилотрофных базидиомицетов Fomitopsis officinalis (Vill.: Fr.) Bond. Et Sing., Ganoderma applanatum (Pers.) Pat. Trametes versicolor (L.: Fr.) Pilat. // Автореф. дисс. канд. биол. наук. - М., 2009. - 21 с.; Чхенкели В.А. Антимикробное действие дереворазрушающего гриба Coriolus pubescens (Shum.: Fr.) Quel. // В.А. Чхенкели, Т.И. Никифорова, Р.Г. Скворцова / Микология и фитопатология. 1998. - Т. 32, №1. - С.69-71; Cui J. Polysaccharopeptides Coriolus versicolor: physiological activity, uses and production // J. Cui, Y. Chisti / Biotechnology advances. 2000. - V. 21. - P. 109-122].
В настоящее время мировой микробиологической промышленностью не освоено производство противоплесневых биологических препаратов на основе активных штаммов T. versicolor.
Техническим результатом изобретения является штамм В 08/06 Trametes versicolor (ВКПМ F-1024), обладающий противоплесневой активностью.
Цель достигается использованием штамма В 08/06 для подавления роста плесневых грибов. Штамм при глубинном и поверхностном культивировании выделяет в культуральную жидкость метаболиты, обладающие противоплесневыми свойствами в отношении микромицетов рода Penicillium. Продукты, выделяемые штаммом, обладают хитиназной активностью.
Предлагается применение этого штамма в качестве биопродуцента для создания на его основе противоплесневых препаратов.
Штамм выделен тканевым методом из плодового тела, собранного в Республике Тыва. Идентификация штамма проведена по макро- и микроморфологическим признакам [Определитель грибов России. Порядок Аффилофоровые. Вып.2. С-Пб. Наука, 1998. - 391 с.].
Штамм В 08/06 Trametes versicolor характеризуется следующими признаками:
Макроморфологические:
На среде: на сусло-агар (СА) - штамм обладает умеренным ростом; формирует приземистый кожистый воздушный мицелий с ярко выраженными концентрическими кругами; край колонии ровный, слегка приподнятый (фиг.1А).
Размер колонии на 7-10 сутки культивирования на этой среде составляет 90 мм. Цвет воздушного и субстратного мицелия белый. Обратная сторона колонии неокрашенная.
При культивировании на сусло-агаре в течение 20-24 сут воздушный мицелий темнеет от кремового до светло-коричневого цвета; появляются капли экссудата, воздушный мицелий сильно уплотняется и образует плодовые тела (фиг.1Б).
Быстрый рост с образованием густого и высокого воздушного мицелия достигается на сусло-агаре с добавлением 1% лиственничных опилок; умеренный рост на среде Чапека и на грибном агаре.
Микроморфология:
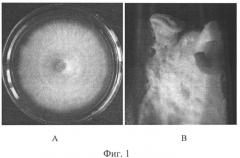
Мицелий септированный, тонкий, неокрашенный с пряжками (фиг.2А, 2Б). Спороношение конидиальное не выявлено, хламидоспоры и склероции отсутствуют.
Область применения штамма: биоконтроль плесневых грибов. Штамм проявляет гиперпаразитическое и фунгицидное действие в отношении грибов рода Penicillium, вызывающих плесневение пищевых продуктов. Гиперпаразитическая активность в отношении штаммов рода Penicillium определяется методом встречных культур [Егоров Н.С. Руководство к практическим занятиям по микробиологии // Н.С. Егоров / М.: Изд-во МГУ. 1995. - 224 с.].
При жидкофазном стационарном культивировании на пивном сусле, разбавленном дистиллированной водой в отношении 1:2 при температуре 24±1°C на 10-е сутки биомасса мицелия составляет 12,23 г/л, на 20-е - 21,70±0,28 г/л, на 30-е - 23,01±0,54 г/л. Накопление биомассы штамма изучается весовым методом.
На скошенном сусло-агаре при 4°C жизнеспособность штамма сохраняется в течение 5 месяцев. Оптимальной средой для размножения и поддержания штамма является сусло-агар (неохмеленное пивное сусло 6°Б разбавить дистиллированной водой в отношении 1:2, отфильтровать, добавить агар из расчета 20 г/л). Другие среды, используемые для культивирования, - сусло-агар с добавлением 1% лиственничных опилок, картофельно-декстрозный агар (КДА), мальтакс-агар.
Оптимальный рН: 6,0-6,2. Время инкубирования: 7-10 суток. Штамм одинаково хорошо растет с освещением и без него.
Наиболее оптимальная температура для роста мицелия штамма T. versicolor - 20-25°C, при понижении температуры культивирования до +15°C изменяется морфология колоний штамма: воздушный мицелий становился рыхлым, паутинистым.
Проведены исследования химического состава мицелия и плодовых тел T. versicolor и установлено, что количество экстрактивных веществ в мицелии бизидиомицета T. versicolor значительно превосходит их количество в плодовом теле. Количество общего белка в мицелии составляет около 14,6%, причем с возрастом его количество изменяется незначительно. В плодовых телах гриба Т. versicolor доля белка составляет 7,2%, что в два раза ниже, чем в мицелии.
Сравнительная оценка аминокислотного состава мицелия и плодовых тел T. versicolor показала, что содержание незаменимых аминокислот в плодовых телах гриба от общего количества аминокислот превосходит почти на 30% этот показатель в мицелии. Причем в мицелии наблюдается преобладание таких незаменимых кислот как изолейцин, лейцин и тирозин, в то время как в плодовых телах - лейцин и тирозин.
Известно, что Т. versicolor содержит большое количество полисахаридов, причем количество легкогидролизуемых углеводов в мицелии значительно отличается от количества трудно гидролизуемых углеводов. Содержание общего количества липидов в мицелии данного штамма составляет от 1,02 до 1,49%. Липидная фракция включает нейтральные липиды, гликолипиды и фосфолипиды. Наблюдается преобладание нейтральных липидов. Из представленных сведений видно, что доля биологически активных веществ в биомассе мицелия изучаемого штамма превосходит их содержание в плодовых телах и содержит все необходимые компоненты для создания биологических активных добавок.
Кроме того, входящие в состав мицелия биологически активные соединения обладают противоплесневой и антимикробной активностью. Наличие противогрибных свойств у штамма обусловлено наличием антигрибных соединений и ферментов хитиназ.
По заключению специалистов Красноярской краевой ветеринарной лаборатории данный штамм авирулентен, нетоксичен, нетоксигенен в отношении теплокровных организмов и не вызывает инфекционных заболеваний.
На фиг. 1-4 представлены следующие иллюстрации:
Фиг. 1. Морфология мицелия штамма В 08/06 Trametes versicolor и образование плодовых тел на сусло-агаре.
Фиг. 2. Микроморфология воздушного мицелия штамма В 08/06 Trametes versicolor (световая микроскопия, увеличение х 1350): стрелками указаны пряжки.
Фиг. 3. Гиперпаразитическая активность штамма В 08/06 Trametes versicolor в отношении штамма F - 4499 Penicillium chrysogenum: А - подсев тест-культуры к штриху T. verscolor, Б - активное развитие исследуемого базидиомицета T. verscolor на 3-и сутки культивирования, В и Г - подавление развития мицелия P.chrysogenum штаммом В 08/06 на 6-е сутки совместного культивирования.
Фиг. 4. Антигрибная активность культуральной жидкости Trametes versicolor В 08/06 в отношении Penicillium brevicompactum F - 4481: А - вискозная оболочка, обработанная культуральной жидкостью, Б - контрольная проба, В - белковая оболочка «Белкозин», обработанная культуральной жидкостью, Г - контрольная проба.
Пример 1. Определение антагонистических свойств культуральных фильтратов штамма В 08/06 Trametes versicolor методом «лунок»
Для исследований используют метаболиты культуральной жидкости штамма В 08/06 Trametes versicolor, полученные на 14-е сутки культивирования продуцента на среде сусло. Культивирование штамма проводят глубинным способом на качалке при 24-26°C в колбах объемом 750 мл в течение 10 суток пока гриб не достигнет стационарной фазы роста. Полученную культуральную жидкость центрифугируют и удаляют осадок, стерилизуют фильтрацией через фильтр с диаметром пор 0,22 мкм и тестируют на штаммах микромицетов: Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F - 4481.
Контролем в опыте используют дистиллированную воду. Для тестирования используют метод, основанный на радиальной диффузии в агар биологически активных веществ. Тест-штаммы рассевают «газоном» на поверхности сусло-агара в чашке Петри штамма из расчета 1,5-2×106 конидий на 1 мл питательной среды. В качестве посевного материала используют культуру тест-штамма, выращенную на скошенном сусло-агаре. Из пробирок делают смыв в колбы со стерильной водой, затем определяют титр спор в полученной суспензии микроскопическим способом в камере Горяева и методом пересчета на весь объем питательной среды используют необходимое количество суспензии для засева в чашки Петри.
Из агара стерильным пробойным сверлом делают лунку, в которую помещают культуральную жидкость штамма макромицета В 08/06 Trametes versicolor. Учет результатов проводят путем измерения миллиметровой линейкой диаметра зон подавления роста тест-культуры микроорганизма вокруг «лунки». Полученные результаты интерпретируют следующим образом: « - » - отсутствие активности; зона подавления до 12 мм - слабая чувствительность; зона подавления от 13 до 29 мм - средняя активность; зона подавления 30 мм и более - высокая чувствительность.
Исследования показали, что культуральные фильтраты штамма макромицета В 08/06 Trametes versicolor оказывают противогрибное действие, вызывая зоны угнетения роста тест-штаммов 16 мм (таблица 2).
Пример 2. Оценка гиперпаразитической активности штамма Trametes versicolor В 08/06
Гиперпаразитическую активность базидиомицета Trametes versicolor изучают в отношении тест-объектов: Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F - 4481 методом перпендикулярных штрихов и методом встречных культур на твердых агаризованных средах.
Испытуемый штамм Trametes versicolor В 08/06 высевают штрихом (полоской) на поверхность агаровой пластинки в чашке Петри. После того как микроорганизм разовьется, перпендикулярно его штриху подсевают тест-организм штаммы Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F - 4481. Принимая во внимание тот факт, что конкурентные грибы растут быстрее, в сравнении с Т. versicolor, базидиомицет культивируют на протяжении 3-х суток и только затем осуществляют посев спорами микромицетов рода Penicillum. Инкубирование культур проводят в термостате при температуре 25±1°C в течение всего срока наблюдения.
В другом варианте проводят исследования методом встречных культур. Для чего на одной половине чашки Петри делают посев штрихом штамма T. versicolor, а на другой штаммы - Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F - 4481. Исследования показали, что в обоих опытах T. versicolor проявляет активное антагонистическое действие и за 6-7 суток полностью подавляет рост и развитие грибов Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F - 4481 (фиг. 3).
Пример 3. Оценка колонизации пленок, используемых для колбасных покрытий, микромицетами рода Penicillum
Для исследования используют пищевые оболочки: белковая оболочка «Белкозин», производства ОАО «Лужский завод» (Россия), d=120 мм и вискозно-армированная оболочка «Fibrous SR SL», производство: ООО «Эдельвейс», Санкт-Петербург, d=120 мм. Оценку колонизации пленок, используемых для колбасных покрытий, проводят методом нанесения инокулянта споровой суспензии штаммами Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F - 4481 поэтапно на разных стадиях: на 1, 2, 3-й сутки. Оценку колонизации пленки микромицетами рода Penicillum проводят визуально.
Пример 4. Антигрибная активность штамма в отношении микромицета рода Penicillum
Для исследования используют пищевые оболочки: белковая оболочка «Белкозин», производства ОАО «Лужский завод» (Россия), d=120 мм и вискозно-армированная оболочка «Fibrous SR SL», производство: ООО «Эдельвейс», Санкт-Петербург, d=120 мм. Споровую суспензию тестируемой культуры гриба наносят шпателем на твердую питательную среду (Maltax 10) в чашках Петри. Затем стерильные пищевые оболочки d=2,5 см смачивают в культуральной жидкости исследуемого базидиомицета T. versicolor и выкладывают на посевы «газоном» тестируемыми культурами штаммов Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F - 4481. Чашки с посевами инкубируют при температуре 25±1°C. Измеряют зону задержки роста (зона подавления развития) плесневой культуры в течение срока наблюдений - 5 суток.
В результате исследований показано, что исследуемый штамм T. versicolor проявляет антигрибную активность за счет выделения антибиотических метаболитов (фиг.4А и В). Оболочки, обработанные культуральной жидкостью Т. versicolor, не инфицируются тест-культурами плесневых грибов, в то время как в контроле оболочка покрыта возбудителями плесневения - грибами рода Penicillium.
На основании проведенного исследования показано, что штамм при росте образует антимикробные соединения, которые являются активными в отношении штаммов Penicillium chrysogenum F - 4499, Penicillium polonicum F - 4497, Penicillium nalgiovense F - 4493, Penicillium brevicompactum F -4481.
Пример 5. Анализ хитиназной активности метаболитов в культуральной жидкости штамма Trametes versicolor В 06/08
Культуральную жидкость для определения хитиназной активности получают путем поверхностного культивирования на жидкой среде мaltax - 10, имеющей состав: мaltax - 10-50 г/л, вода - 1000 мл. Культивирование проводят в течение 14 суток при 27°C в статических условиях. После чего отделяют выросшую биомассу от культуральной жидкости. К суспензии коллоидного хитина (10 мг/мл) добавляют натрий ацетат - уксусной кислоты (рН 5,5), аликвоту анализируемого образца отфильтрованной культуральной жидкости, воду и инкубируют при температуре 37°C в течение 15 мин. Для определения активности хитиназы в полученных культуральных фильтратах микроорганизмов используют ДНС-метод (динитросалициловый), основанный на определении активности фермента по количеству образующихся в результате реакции редуцирующих сахаров с коллоидным хитином в качестве субстрата. Количество восстанавливающих сахаров определяют путем регистрации оптической плотности при длине волны 420 нм. Полученные значения переводят по калибровочной кривой, построенной с известными концентрациями N-ацетилглюкозамина. За единицу хитиназной активности принимают такое количество фермента, которое в описываемых условиях реакции вызывает прирост концентрации N-ацетилглюкозамина на 1,0 мкмоль х мин-1·мл-1 [Патент на изобретение №2213773. Продуцент комплекса хитинолитических ферментов и ламинариназы. Авторы Мелентьев А.И., Актуганов Г.Э., Усанов Н.Г., Кузьмина Л.Ю. Заявка: 2001101594/13. Опубликовано: 10.10.2003 г.]. Показано, что хитиназная активность культурального фильтрата штамма В 08/06 Trametes versicolor составляет 9,1 ед/мл.
Штамм Trametes versicolor (L.:Fr.) Pilat. ВКПМ F-1024, используемый для получения противоплесневых препаратов в отношении грибов рода Penicillium.