Лечение и/или предотвращение воспаления и фотоповреждения кожи и фотозащита кожи с помощью водорастворимого экстракта растения рода solanum
Иллюстрации
Показать всеНастоящее изобретение относится к фармацевтической композиции для предотвращения и лечения воспаления и фотоповреждения кожи, включающей водорастворимый экстракт растения рода Solarium. Композиция также обладает фотозащитным действием и может применяться в качестве косметической композиции. 2 н. и 4 з.п. ф-лы, 2 табл.
Реферат
Ссылки на близкородственные заявки
Настоящее изобретение заявляет приоритет тайваньской заявки №100116659, зарегистрированной 12 мая 2011 г.
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтической композиции для предотвращения и лечения воспаления и фотоповреждения кожи, содержащей водорастворимый экстракт растения рода Solanum, Композиция обладает также фотозащитным действием и может применяться в качестве косметической композиции.
Уровень техники
В аэробных организмах кислород применяется при аэробном дыхании, производя таким образом реактивные формы кислорода (ROS) и свободные радикалы. Ультрафиолет (УФ), ионизирующая радиация и отдельные лекарства или ксенобиотики также стимулируют продукцию ROS и свободных радикалов. По всей вероятности, ROS и свободные радикалы взаимодействуют с компонентами внутри клетки (например, ДНК, белком и липидами, и т.д.) благодаря своей нестабильности, приводя таким образом к окислительному повреждению клеток и тканей.
Обычно антиоксидантные ферменты образуют в организмах регулируемую систему для защиты клеток и тканей от окислительного повреждения. Окислительный стресс возникает, когда количество ROS и свободных радикалов превосходит антиоксидантную емкость, предоставляемую защитной системой клеток или тканей. Показано, что окислительный стресс играет важную роль в патологическом процессе воспаления и фотоповреждения (Simon R. et al. (2010), Free radical biology and Medicine, 49:1603-1616; Afaq F. et al. (2006), Experimenta Dematology, 15:678-684).
Воспаление представляет собой защитный ответ клеток или тканей на патоген или внешний раздражающий стимул. Во время воспаления клетки или ткани на поврежденном участке усиливают экспрессию специфических генов при участии NF-κB с последующей повышенной экспрессией хемокинов, что приводит к аккумуляции многоядерных лейкоцитов, моноцитов, макрофагов и тучных клеток на участке повреждения (т.е. инфильтрации). Вовлеченные в этот процесс макрофаги активируются липополисахаридами (LPS), которые экспрессируются на поверхности патогена. Активированные макрофаги индуцируют экспрессию провоспалительных генов (включая ген циклооксигеназы-2, СОХ-2, и ген индуцибельной синтазы окиси азота, iNOS) для усиления воспалительного ответа. Дополнительно, активированные макрофаги высвобождают ROS и свободные радикалы для уничтожения патогенов. Однако продолжительный воспалительный ответ приводит к окислительному стрессу и повреждению из-за избыточного накопления ROS и свободных радикалов, приводя таким образом к хроническому воспалению и, в конце концов, к возможности хронического заболевания или рака.
Фотоповреждение происходит, когда кожу организма подвергают действию ультрафиолета (особенно ультрафиолета типа В, УФ-В), приводящему к повреждению кожи. Облучение УФ радиацией ускоряет накопление ROS и свободных радикалов в клетках кожи, увеличивает окислительный стресс в коже и индуцирует экспрессию матриксных металлопротеиназ (ММР), что приводит к окислительному фотоповреждению. Симптомы окислительного фотоповреждения включают телангиоэкстазию, истончение эпидермиса, уменьшение коллагеновых волокон и эластических волокон, сухость, образование морщин, воспалительную инфильтрацию клеток, преждевременное старение кожи и патологическое изменение кожи.
В последние годы доказано, что фитохимические и фитохемопревентивные агенты, полученные из растений, обладают антиоксидантными противовоспалительными свойствами и уменьшают фотоповреждение. Примеры фитохимических агентов включают полифенолы зеленого чая (GTPs), эпигаллокатехингаллат (EGCG), генистеин, ресвератрол, куркумин, апигенин, ликопен и т.д. (Adhami VM et al. (2008) Photochem. Photobiol, 84:489-500). Показано, что фитохимические агенты более безопасны для клинического применения без нежелательных побочных эффектов и они привлекли внимание в области медицинских исследований.
Растения рода Solarium включают Solarium incanum L., синоним Solarium undatum, Solarium incanum Ruiz. and Pav., Solanum coagulans Forsskal, горькое яблоко по-английски), Solanum indicum, Solanum nigrum (Long Kui по-китайски, черная ночная тень по-английски), Solanum capsicastrum (ложная иерусалимская вишня по-английски), Solanum xanthocarpum, Solanum melongena, Solanum coagulans, Solanum tuberosum, Solanum sodomeum (содомское яблоко в Австралии), Solanum furburosum, Solanum aculeastrum, Solanum lycocarpum, Solanum khasianum, Solanum suaveolens, Solanum uporo, Solanum abutiloides, Solanum coccineum, Solanum unguiculatum, Solanum robustum, Solanum anguivi, Solanum platanifolium, Solarium mammosum и т.д. Известно, что из растений рода Solarium можно экстрагировать стероидные алкалоиды, обычно включающие соласонин и соламаргин.
В заявке US 7078063 В2, выданной авторам настоящего изобретения, раскрыт водорастворимый экстракт растения рода Solanum, конкретно Solanum incanum L., включающий по меньшей мере 60 вес.% соласонина и соламаргина, и способ получения водорастворимого экстракта. Патент таким образом включен посредством ссылки полностью.
В вышеуказанном патенте US авторы обнаружили, что водорастворимый экстракт может ингибировать рост опухолевых/раковых клеток (конкретно, клеток опухоли печени, клеток рака легкого и клеток рака груди). В этом изобретении изобретатели неожиданно обнаружили, что водорастворимый экстракт эффективно лечит и/или предотвращает воспаление и фотоповреждение кожи.
Раскрытие изобретения
Таким образом, в первом аспекте настоящее изобретение предоставляет фармацевтическую композицию для предотвращения и лечения фотоповреждения кожи, включающую водорастворимый экстракт растения рода Solanum, где водорастворимый экстракт включает соламаргин и соласонин.
Во втором аспекте изобретение предоставляет способ предотвращения и лечения фотоповреждения кожи, включающий применение к субъекту, который в этом нуждается, водорастворимого экстракта растения рода Solanum, где водорастворимый экстракт включает соламаргин и соласонин.
В третьем аспекте изобретение относится к применению водорастворимого экстракта растения рода Solanum для получения лекарства для предотвращения и лечения фотоповреждения кожи, где водорастворимый экстракт включает соламаргин и соласонин.
В четвертом аспекте изобретение предоставляет косметическую композицию, включающую водорастворимый экстракт растения рода Solanum, где водорастворимый экстракт включает соламаргин и соласонин.
В пятом аспекте изобретение предоставляет фармацевтическую композицию для предотвращения и лечения воспаления, включающую водорастворимый экстракт растения рода Solanum, где указанный водорастворимый экстракт включает по меньшей мере 60% соламаргина и соласонина.
В шестом аспекте изобретение предоставляет способ для предотвращения и лечения воспаления, включающий применение к субъекту, который в этом нуждается, такого лечения водорастворимым экстрактом растения рода Solanum, где указанный водорастворимый экстракт включает соламаргин и соласонин.
В седьмом аспекте изобретение относится к применению водорастворимого экстракта растения рода Solanum для получения лекарства для предотвращения и лечения воспаления, где водорастворимый экстракт - соламаргин и соласонин.
Краткое описание чертежей
Другие свойства и преимущества настоящего изобретения станут очевидными из нижеследующего детального описания предпочтительных осуществлений изобретения со ссылкой на сопровождающие чертежи, где
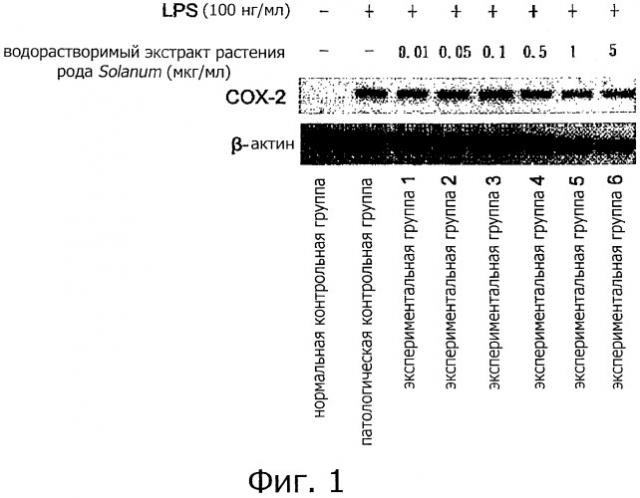
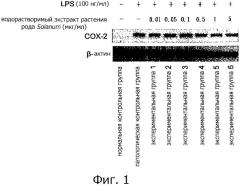
Фигура 1 представляет собой вестерн-блот, показывающий экспрессию СОХ-2 в клетках RAW264.7 после индуцированного LPS воспалительного ответа. Клетки нормальной контрольной группы не обрабатывают LPS и водорастворимым экстрактом растения рода Solanum, тогда как клетки патологической контрольной группы обрабатывают 100 нг/мл LPS. Экспериментальные группы 1-6 обрабатывают различными концентрациями водорастворимого экстракта (0,01, 0,05, 0,1, 0,5, 1 и 5 мкг/мл) вместе с 100 нг/мл LPS.
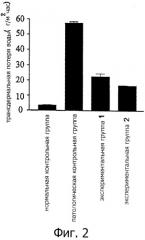
Фигура 2 показывает трансэпимдермальную потерю воды (TEWL) в дорзальной коже безволосых мышей линии HRS/J в нормальной контрольной группе, патологической контрольной группе и экспериментальных группах 1 и 2 через 6 недель облучения УФ-В. Безволосые мыши HRS/J в нормальной контрольной группе не подвергаются никакому воздействию, включая облучение УФ-В и обработку водорастворимым экстрактом. Безволосых мышей HRS/J в патологической контрольной группе подвергают облучению УФ-В и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 1 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают раствором Solanum incanum L., содержащим водорастворимый экстракт. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт.
Фигура 3 представляет собой вестерн-блот, показывающий экспрессию NF-κВ, СОХ-2 и iNOS в дорзальной кожной ткани безволосых мышей HRS/J через 60 недель экспериментального периода. Безволосые мыши HRS/J в нормальной контрольной группе не подвергаются никакому воздействию, включая облучение УФ-В и обработку водорастворимым экстрактом. Безволосых мышей HRS/J в патологической контрольной группе подвергают облучению УФ-В и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solarium incanum L., содержащим водорастворимый экстракт.
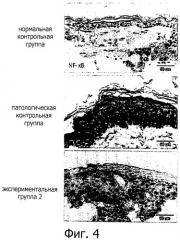
Фигура 4 демонстрирует иммуногистохимию экспрессии NF-кВ в дорзальной кожной ткани безволосых мышей HRS/J в конце 60 недель после первого облучения УФ-В. Безволосые мыши HRS/J в нормальной контрольной группе не подвергаются никакому воздействию, включая облучение УФ-В и обработку водорастворимым экстрактом. Безволосых мышей HRS/J в патологической контрольной группе подвергают облучению УФ-В и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solarium incanum L., содержащим водорастворимый экстракт.
Фигура 5 демонстрирует окрашивание толуидиновым синим дорзальной кожной ткани безволосых мышей HRS/J в конце 60 недель экспериментального периода. Безволосые мыши HRS/J в нормальной контрольной группе не подвергаются никакому воздействию, включая облучение УФ-В и обработку водорастворимым экстрактом. Безволосых мышей HRS/J в патологической контрольной группе подвергают облучению УФ-В и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт. Стрелки указывают на расположение инфильтрированных тучных клеток.
Фигура 6 представляет собой диаграмму, показывающую среднее количество тучных клеток в дорзальной кожной ткани безволосых мышей HRS/J в нормальной контрольной группе, патологической контрольной группе и экспериментальной группе 2 через 60 недель экспериментального периода. Безволосые мыши HRS/J в нормальной контрольной группе не подвергаются никакому воздействию, включая облучение УФ-В и обработку водорастворимым экстрактом. Безволосых мышей HRS/J в патологической контрольной группе подвергают облучению УФ-В и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт. «*» означает p<0,05 между экспериментальной группой 2 и нормальной контрольной группой. «***» означает p<0,01 между экспериментальной группой 2 и патологической контрольной группой. «####» означает p<0,001 между патологической контрольной группой и нормальной контрольной группой.
Фигура 7 представляет собой график, демонстрирующий среднее количество опухолей у мышей HRS/J, образованных в различные моменты времени в течение 60 недель экспериментального периода. Безволосых мышей HRS/J в патологической контрольной группе подвергают фотоповреждению, индуцированному облучением УФ-В, и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 1 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают раствором Solarium incanum L., содержащим водорастворимый экстракт В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solarium incanum L., содержащим водорастворимый экстракт. «*» означает p<0,05 между экспериментальной группой 2 и патологической контрольной группой. «**» означает p<0,01 между экспериментальной группой 2 и патологической контрольной группой.
Фигура 8 представляет собой график, показывающий средний размер опухолей у безволосых мышей HRS/J в различные моменты времени в течение 60 недель экспериментального периода. Безволосых мышей HRS/J в патологической контрольной группе подвергают фотоповреждению, индуцированному облучением УФ-В, и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 1 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают раствором Solarium incanum L., содержащим водорастворимый экстракт. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт. «#» означает p<0,05 между экспериментальной группой 1 и патологической контрольной группой. «##» означает p<0,01 между экспериментальной группой 1 и патологической контрольной группой. «###» означает p<0,001 между экспериментальной группой 1 и патологической контрольной группой. «**» означает p<0,01 между экспериментальной группой 2 и патологической контрольной группой. «***» означает p<0,001 между экспериментальной группой 2 и патологической контрольной группой.
Фигура 9 представляет собой диаграмму, показывающую время восстановления при щипковом тесте у безволосых мышей HRS/J через 60 недель экспериментального периода. Безволосые мыши HRS/J в нормальной контрольной группе не подвергаются никакому воздействию, включая облучение УФ-В и обработку водорастворимым экстрактом. Безволосых мышей HRS/J в патологической контрольной группе подвергают облучению УФ-В и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт. «***» означает p<0,001 между экспериментальной группой 2 и патологической контрольной группой. «###» означает p<0,001 между патологической контрольной группой и нормальной контрольной группой.
Фигура 10 показывает изображения эластических волокон дорзальной кожной ткани, окрашенной раствором резорцина-фуксина, железного гематоксилина Вейгерта и раствором Ван Гизона. Безволосых мышей HRS/J в патологической контрольной группе подвергают фотоповреждению, индуцированному облучением УФ-В, и не обрабатывают водорастворимым экстрактом. В экспериментальной группе 2 безволосых мышей HRS/J подвергают воздействию УФ-В и обрабатывают гелем Solarium incanum L., содержащим водорастворимый экстракт. Стрелки указывают на положение участков денатурации эластических волокон.
Фигура 11 показывает среднее число опухолей у безволосых мышей HRS/J в течение экспериментального периода. Безволосых мышей HRS/J подвергают действию радиации УФ-В и обрабатывают впитывающимся кремом AIROL в группе, получавшей третиноин. В группе, получавшей гель Solanum incanum L., безволосых мышей HRS/J подвергают действию радиации УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт.
Фигура 12 представляет собой график, показывающий трансэпимдермальную потерю воды (TEWL) в течение экспериментального периода. Безволосых мышей HRS/J в патологической контрольной группе подвергают облучению УФ-В и не обрабатывают водорастворимым экстрактом. Безволосых мышей HRS/J в группе, получавшей третиноин, подвергают действию радиации УФ-В и обрабатывают впитывающимся кремом AIROL в третиноидной группе. В группе, получавшей гель Solanum incanum L., безволосых мышей HRS/J подвергают действию радиации УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт. «*» означает p<0,05 между группой, получавшей третиноин, и группой, получавшей гель Solanum incanum L.
Фигура 13 представляет собой график, показывающий содержание воды в дорзальной коже безволосых мышей HRS/J в течение экспериментального периода. Безволосых мышей в патологической контрольной группе подвергают фотоповреждению, индуцированному облучением УФ-В, и не обрабатывают водорастворимым экстрактом. Безволосых мышей HRS/J в группе, получавшей третиноин, подвергают действию радиации УФ-В и обрабатывают впитывающимся кремом AIROL. В группе, получавшей гель Solanum incanum L., безволосых мышей HRS/J подвергают действию радиации УФ-В и обрабатывают гелем Solanum incanum L., содержащим водорастворимый экстракт. «*» означает p<0,05 между группой, получавшей третиноин, и группой, получавшей гель Solanum incanum L.
Осуществление изобретения
Следует понимать, что если в данном описании ссылаются на какую-либо публикацию прототипа публикации, то такая ссылка не означает, что публикация образует часть общепринятого основного знания в данной области техники в Тайване или любой другой стране.
Для целей данного описания следует ясно понимать, что слово «включающий» означает «включая, но не ограничиваясь этим» и что слова «включает», «содержит» и их варианты имеют соответствующее значение.
Если не указано другое, все технические и научные термины, применяемые здесь, имеют общепринятое значение, понятное специалисту в области техники, к которой относится изобретение. Специалист в данной области техники узнает многие способы и материалы, сходные или эквивалентные описанным здесь, которые можно применять на практике данного изобретения. Действительно, данное изобретение никоим образом не ограничено описанными способами и материалами. Для ясности здесь применены следующие определения.
Настоящее изобретение предоставляет фармацевтическую композицию для предотвращения и лечения воспаления, включающую водорастворимый экстракт растения рода Solanum. Водорастворимый экстракт включает соламаргин и соласонин. Предпочтительно, водорастворимый экстракт включает по меньшей мере 60 вес.% соламаргина и соласонина, более предпочтительно, по меньшей мере 60-90 вес.% соламаргина и соласонина.
Способ получения водорастворимого экстракта раскрыт в US 7078063 В2 и включает следующие стадии:
(а) подвергание растительного материала растения рода Solanum экстракции с применением кислого водного раствора со значением pH 3-5, в результате чего получается водный раствор;
(б) доведение pH водного раствора, полученного на стадии (а), до pH 8-10 с помощью основания, в результате чего образуется осадок;
(в) промывка осадка, полученного на стадии (б), водой с последующим высушиванием для получения сухого продукта;
(г) смешивание сухого продукта, полученного на стадии (в), с хлороформом с последующим добавлением соответствующего количества 100% спирта для получения хлороформ-спиртовой смеси;
(д) смешивание хлороформ-спиртовой смеси, полученной на стадии (г), с водно-спиртовым раствором, имеющим заданное соотношение воды и спирта, для получения смеси, содержащей слой с хлороформом и слой без хлороформа;
(е) удаление слоя, содержащего хлороформ, из смеси, полученной на стадии (д), с последующим добавлением соответствующего количества воды и
(ж) получение супернатанта из смеси, полученной на стадии (е), с последующим высушиванием супернатанта, где образующийся конечный продукт способен сразу растворяться в воде с образованием желтоватого чистого и прозрачного водного раствора.
Предпочтительно, водорастворимый экстракт растения рода Solanum получают по меньшей мере из плодов, корней, стеблей и листьев растения рода Solanum. Растение рода Solanum измельчают при предварительной обработке. В предпочтительном осуществлении настоящего изобретения растительный материал, применяемый на стадии (а), представляет собой плоды растения рода Solanum.
Авторы изобретения обнаружили, что определенные факторы могут влиять на содержание и соотношение соласонина и соламаргина в водорастворимом экстракте, полученном по вышеописанному способу. Эти факторы включают вид растения рода Solanum и части (часть) растения, применяемые в процессе экстракции, а также типы применяемого спирта и основания. Поэтому специалист в данной области техники может получить требуемый водорастворимый экстракт путем подбора соответствующих видов растения в сочетании с соответствующими условиями получения экстракта.
Предпочтительно, водорасторимый экстракт получают из растения рода Solanum, выбранного из группы, включающей Solanum incanum L., Solanum indicum, Solanum nigrum, Solanum capsicastrum, Solanum xanthocarpum, Solanum melongena, Solanum coagulans, Solanum tinigrum, Solanum sodomeum, Solanum turburosum, Solanum aculeastrum, Solanum lycocarpum, Solanum khasianum, Solanum suaveolens, Solanum uporo, Solanum abutiloides, Solanum coccineum, Solanum unguiculatum, Solanum robustum, Solanum anguivi, Solanum platanifolium, Solanum mammosum. В предпочтительном осуществлении настоящего изобретения водорастворимый экстракт получают из Solanum incanum L.
В предварительных экспериментах данные in vitro показывают, что водорастворимый экстракт растения рода Solanum может ингибировать воспалительный ответ, индуцированный LPS. Доказано также, что после обработки безволосых мышей с индуцированным УФ-В воспалением водорастворимым экстрактом растения рода Solanum экспрессия NF-κВ, СОХ-2 и iNOS в их кожной ткани существенно снижается вместе со снижением инфильтрации тучных клеток и воспалительного ответа.
Таким образом, настоящее изобретение предоставляет способ предотвращения и лечения воспаления, включающий применение к субъекту, который в таком лечении нуждается, водорастворимого экстракта или фармацевтической композицией.
Пути введения вышеуказанной фармацевтической композиции, предоставляемой настоящим изобретением, включают, не ограничиваясь этим, оральное, топикальное и парентеральное введение.
Фармацевтическая композиция, предоставленная данным изобретением, может быть приготовлена в виде лекарственной формы для орального введения с применением технологии, хорошо известной специалисту в данной области техники. Примеры лекарственной формы для орального введения включают, не ограничиваясь этим, асептический порошок, таблетку, лепешку, пастилку, осадок, капсулу, диспергируемый порошок или гранулы, раствор, суспензию, эмульсию, сироп, эликсир, густую массу и т.д.
Фармацевтическая композиция согласно настоящему изобретению дополнительно может включать фармацевтически приемлемый носитель, который широко применяется при производстве лекарств.
Фармацевтически приемлемый носитель включает один или более реагент, включая растворитель, буфер, эмульгатор, суспендирующий агент, декомпозер, дезинтегрирующий агент, диспергирующий агент, связующий агент, наполнитель, стабилизирующий агент, хелатор, консервант, увлажняющий агент, лубрикант, разжижитель, агент для задержки абсорбции, липосомы, подсластитель, ароматизатор, краситель и т.д. Выбор и количество фармацевтически приемлемого носителя известно специалисту в данной области техники.
Фармацевтически приемлемый носитель включает один или более реагент, включая, например, воду, обычный физиологический раствор, физиологический раствор с фосфатным буфером (PBS), раствор с глюкозой, водный раствор, содержащий спирт (например, этанол, пропандиол, гликоль, маннит и т.д.), масло (например, арахисовое масло, оливковое масло, кунжутное масло, касторовое масло, хлопковое масло, соевое масло и т.д), глицерин, органический растворитель и липосомы. В осуществлении настоящего изобретения растворитель представляет собой воду.
Фармацевтическая композиция согласно настоящему изобретению может быть составлена в виде соответствующей лекарственной формы для топикального применения с помощью технологии, хорошо известной специалисту в данной области техники, что включает, не ограничиваясь этим, препараты для наружного применения, шипучие таблетки, суппозитории и т.п.
В предпочтительном осуществлении настоящего изобретения фармацевтическая композиция согласно настоящему изобретению может быть составлена в виде препарата для наружного применения в форме геля путем смешивания водорастворимого экстракта с основой, которая хорошо известна и обычно применяется в данной области техники.
В настоящем изобретении соответствующая основа может включать одно или более из следующих вспомогательных веществ: воды, спиртов, гликоля, углеводородов (например, вазелина), восков (например, парафина и желтого воска), консервантов, антиоксидантов, поверхностно-активных веществ, усилителей абсорбции, стабилизирующих агентов, гелеобразующих агентов (например, карбопол 974Р, микрокристаллическая целлюлоза и карбоксиметилцеллюлоза), активных агентов, увлажнителей, поглотителей запаха, отдушек, агентов для доведения pH, хелаторов, эмульгаторов, окклюзивных агентов, увлажнителей, загустителей, солюбилизирующих агентов, усилителей проницаемости, агентов против раздражения, красителей и пропеллантов и т.д. Выбор и количество фармацевтически приемлемого вспомогательного вещества находятся в области компетенции специалиста в данной области техники.
Дозировка и частота введения этой фармацевтической композиции может варьировать в зависимости от следующих факторов: серьезности заболевания, которое надо лечить, пути введения и веса, возраста, физического состояния и ответа субъекта, которого надо лечить. Например, ежедневная дозировка фармацевтической композиции для топикального введения согласно настоящему изобретению может составлять 10-20 мг/см2 области повреждения и от 1 до 6 раз в день. Дозировка фармацевтической композиции для орального введения может составлять 1-30 мг/кг 1-4 раза в день.
Показано, что водорастворимый экстракт растения рода Solarium ослабляет патологические изменения кожи, индуцированные фотоповреждением в результате облучения УФ-В у безволосых мышей. Дополнительно, он способен эффективно улучшать эластичность кожи и солнечный эластоз, поддерживая в то же время влагоудерживающую емкость.
Таким образом, настоящее изобретение предоставляет фармацевтическую композицию для лечения и/или предотвращения фотоповреждения кожи, которая включает водорастворимый экстракт растения рода Solarium, как описано выше. Настоящее изобретение также предоставляет способ предотвращения и лечения фотоповреждения кожи, включающий применение к субъекту, который в этом нуждается, лечения вышеупомянутым водорастворимым экстрактом или фармацевтической композицией.
В настоящем изобретении термин «фотоповреждение кожи» означает повреждение кожи, обусловленное облучением кожи солнечным светом или УФ светом (особенно УФ-В). Фотоповреждение кожи включает, не ограничиваясь этим, истончение кожи, атрофию кожи, уменьшение коллагеновых волокон и эластических волокон, эластоз, утрату эластичности кожи, сухость, образование морщин, воспалительную инфильтрацию клеток, преждевременное старение кожи, сосудистые изменения (например, диффузная эритема, экхимоз или телангиоэкстазия), изменение пигментации (например, лентиго, веснушки, гипопигментация или гиперпигментация), комедон, кисту и патологическое изменение кожи.
Согласно настоящему изобретению путь введения, дозировка и фармацевтически приемлемый носитель сходны с таковыми, применяемыми для фармацевтических композиций для предотвращения и лечения воспаления. В предпочтительном осуществлении настоящего изобретения фармацевтическую композицию составляют в топикальной форме для нанесения на кожу.
Благодаря предотвращению/защите от фотоповреждения кожи с помощью водорастворимого экстракта можно предсказать, что водорастворимый экстракт может применяться в качестве косметического компонента для получения косметической композиции.
Поэтому настоящее изобретение предоставляет косметическую композицию с фотозащитным действием, которая включает водорастворимый экстракт, как описано выше.
В настоящем изобретении термин «фотозащитный» означает прекращение или ослабление отрицательных клинических, гистологических и иммунохимических проявлений, обусловленных действием солнца или ультрафиолета. Эти проявления включают острые реакции (например, эритема и воспаление) и хронические эффекты (например, эластоз и образование морщин).
Согласно настоящему изобретению косметическая композиция дополнительно включает косметически приемлемое вспомогательное вещество, широко применяемое в технике получения косметических препаратов.
Приемлемое косметическое вспомогательное вещество включает один или более реагент, включая растворитель, гелеобразующий агент, активирующий агент, консервант, антиоксидант, защитный агент, хелатор, поверхностно-активные вещества, красители, загустители, наполнители, отдушки и поглотители запаха. Выбор и количество вспомогательных веществ находятся в области компетенции специалиста в данной области техники.
Косметическую композицию, предоставленную данным изобретением, можно получать с помощью технологии, хорошо известной специалисту в данной области техники, в виде продукта для ухода за кожей, за волосами или декоративной косметики. Форма включает, не ограничиваясь этим, водный раствор, эмульсию, гель, мазь, крем, маску, пластырь, пудру, аэрозоль, спрей, лосьон, солнцезащитное средство и другие продукты для очищения тела.
Косметическую композицию согласно настоящему изобретению можно применять вместе со следующими агентами: отбеливающими агентами, увлажняющими агентами, бактерицидными веществами, поглотителями ультрафиолета, агентами против покраспения, агентами против прурита, агентами против гиперкератолита, агентами против псориаза, агентами против старения, агентами против морщин, агентами против себореи, агентами для загара и агентами для заживления ран. Выбор и количество таких агентов известны специалисту в данной области техники.
ПРИМЕРЫ
Экспериментальные материалы
1. Получение водорастворимого экстракта Solarium incanum L. и раствора Solarium incanum L., содержащего водорастворимый экстракт
Водорастворимый экстракт Solarium incanum L. Получают, в основном, по способу, раскрытому в примере 1 US 7078063 В2. Кокретно, 500 г зрелых плодов Solanum incanum L. измельчают с последующим добавлением 1000 мл очищенной воды. К полученной водной смеси по каплям добавляют 99,5% уксусную кислоту до получения pH 4,0 с последующим встряхиванием при комнатной температуре в течение 12 ч. Супернатант получают центрифугированием водной смеси и к нему по каплям добавляют 33% основной раствор аммиака до получения pH супернатанта 9,0 и образования осадка. Осадок отделяют путем центрифугирования при 4500 об/мин (Beckman Coulter, Avanti J-25, JA-14 rotor) и остаточный щелочной раствор удаляют путем промывки осадка водой с последующим центрифугированием при 4500 об/мин. Полученный таким способом осадок суспендируют в воде и подвергают лиофилизации (Virtis, Freezemobile 12ES) с получением 5 г сухого порошка.
2 г сухого порошка растворяют в 50 мл хлороформа (reagent grade) с последующим добавлением 40 мл 100% метанола и далее встряхивают для получения однородной суспензии. Супернатант получают центрифугированием при 4500 об/мин или фильтрацией. К супернатанту добавляют 70 мл смеси метанол-вода (1:1) и хорошо перемешивают. Полученную смесь центрифугируют при 12000 об/мин в течение 10 мин. Полученный супернатант отбирают и к нему добавляют 120 мл дистиллированной воды и хорошо перемешивают. Тем временем супернатант мутнеет. Супернатант дополнительно центрифугируют при 12000 об/мин в течение 10 мин для удаления осадка. Полученный супернатант подвергают концентрированию при пониженном давлении при 55°C для удаления метанола с последующей лиофилизацией с получением сухого порошка водорастворимого экстракта.
Водорастворимый экстракт растворяют в стерильной воде с получением раствора Solanum incanum L. для дальнейшего применения в нижеописанных экспериментах.
2. Получение геля Solarium incanum L., содержащего водорастворимый экстракт 4 г карбопола 974Р, применяемого в качестве гелеобразующего агента и выпускаемого Lubrizol Advanced Materials, Inc. KY 40258, USA, растворяют в 50 г очищенной воды с последующим добавлением 30 г пропиленгликоля и 7 г сухого порошка водорастворимого экстракта, полученного согласно разделу «I. Получение водорастворимого экстракта Solarium incanum L. и раствора Solarium incanum L., содержащего водорастворимый экстракт» в разделе «Экспериментальных материалы» и тщательно перемешивают. Смесь нагревают в сосуде для нагревания при температуре 50-60°С в течение 20 мин с последующим охлаждением до комнатной температуры. К охлажденной смеси добавляют триэтаноламин до получения pH 7,0±0,5. Затем добавляют воду до получения общего веса смеси 100 г, получая таким образом гель, содержащий 7% по весу водорастворимого экстракта (здесь и далее называемый гелем Solanum incanum L.).
Животная модель
Безволосых мышей HRS/J (в возрасте 6-8 недель, вес тела 20-22 г) получают из Jackson Laboratory (Bar Harbor, USA). Мышей содержат в помещении с циклом 12 ч/12 ч свет/темнота при температуре 21-22°С и влажности 30-70%. Пищу и воду предоставляют в достаточном количестве и доступности для мышей все время. Все опыты на животных проводят в соответствии с требованиями по уходу и применению лабораторных животных национального института здоровья (NIH).
Основные способы
1. Анализ белковых продуктов
Для анализа белков согласно настоящему изобретению применяют электрофорез в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттинг. Аппарат и реагенты для проведения SDS-PAGE и вестерн-блоттинга следующие:
(а) система для вертикального электрофореза (Hoefer SE600, GE Helthcare) применяется для анализа с помощью SDS-PAGE.
(б) Поливинвилидендифроридные мембраны (PVDF, Millipore) и полувлажные прокладки для блоттинга (Hoefer TE70X, GE Helthcare) применяются для переноса белков.
(в) Первичные и вторичные антитела, применяемые при вестерн-блоттинге, перечислены в таблице 1.
(г) Визуализацию белков осуществляют с помощью хемилюминисцентного окрашивания с применением субстрата ImmobilonTM Western Chemiluminiscent HRP substratr (Millipore, cat no WBKLS0500) с последующим детектированием путем авторадиографии пленок (Kodak Biomax, Kodak cat no. 1788207).
| Таблица 1 | ||
| Первичные и вторичные антитела, применяемые при вестерн-блоттинге | ||
| Белок-мишень | Первичные антитела | Вторичные антитела |
| СОХ-2 | Мышиные анти-СОХ-2 моноклональные антитела (BD Bioscience, cat. No.610203) | Овечьи антитела против мышиных IgG, конъюгированные с пероксидазой хрена (HRP) (Amersham, cat no NA931) |
| NF-κВ | Кроличьи анти-NF-κB моноклональные антитела (Abeam, cat no Ab7970) | Ослиные антитела против кроличьего IgG-HRP (Amersham, cat no NA934) |
| iNOS | Кроличьи анти-iNOS моноклональные антитела (Santa Cruz, cat no Sc-651) | Ослиные антитела против кроличьего IgG-HRP |
| β-актин | Мышиные анти-β-актин моноклональные антитела (Sigma, cat noA5441) | Овечьи антитела против мышиных IgG-HRP |
| GAPDH | Мышиные анти-GAPDH моноклональные антитела (Chemicon, cat no Mab374) | Овечьи антитела против мышиных IgG-HRP |
2. Индукция воспаления и фотоповреждения
Дорзальную кожу каждой мыши HRS/J подвергают облучению УФ-В три раза в неделю в течение 14 недель для индукции воспалительного ответа и фотоповреждения. Облучение УФ-В проводят с применением ультрафиолетового аппарата (crosslinker) BLX-312 (BIO-LINK, Viber Lourmat, France), снабженного УФ-В лампой 6×8 W T-8M (312 нм). Однократная доза УФ-В радиации для каждого сеанса облучения, доза УФ-В за неделю (доза/неделю) и кумулятивная доза приведены в таблице 2.
| Таблица 2 | |||
| Экспериментальный отсчет времени (неделя) | Однократная доза (мДж/см2) | Доза/неделю (мДж/см2) | Аккумулированная доза (мДж/см2) |
| 1 | 36 | 108 | 108 |
| 2 | 54 | 162 | 270 |
| 3 | 72 | 216 | 486 |
| 4 | 90 | 270 | 765 |
| 5 | 108 | 324 | 1080 |
| 6 | 126 | 378 | 1458 |
| 7 | 144 | 432 | 1890 |
| 8 | 162 | 486 | 2376 |
| 9 | 180 | 540 | 2916 |
| 10 | 216 | 594 | 3510 |
| 11 | 216 | 648 | 4158 |
| 12 | 216 | 648 | 4806 |
| 13 | 216 | 648 | 5454 |
| 14 | 216 | 648 | 6102 |
3. Срезы ткани
Ткани (полученные при комнатной температуре) фиксируют в 4% парафоральдегиде в PBS в течение по меньшей мере 12 ч с последующим обезвоживанием с помощью этанола. Дегидрированные ткани помещают в парафин и делают срезы для получения продольных секций.
4. Статистический анализ
Результаты приведены в виде средних ± стандарт