Композиции с немедленным высвобождением лекарственного средства
Иллюстрации
Показать всеПредложена группа изобретений, включающая твердую дозированную композицию и способ её получения. Твердая дозированная композиция содержит по меньшей мере один прессованный слой, содержащий ибупрофен, микрокристаллическую целлюлозу и гидроксипропилметилцеллюлозу (НРМС) K100LV, HPMC K4M и их комбинации, где НРМС присутствуют в количестве от 10 до 30% от массы прессованного слоя, где вязкость 2%-ного мас./мас. раствора K100LV, HPMC K4M и их комбинации составляет от 100 до 1414 сП, и где ибупрофен подвергнут влажному гранулированию. Способ изготовления указанной композиции включает предварительное смешивание ибупрофена с использованием влажного гранулирования с указанными ингредиентами. Техническим результатом изобретения является минимизация немедленного высвобождения ибупрофена благодаря созданию более устойчивой гелевой матрицы. 2 н. и 1 з.п. ф-лы, 9 ил., 2 табл., 24 пр.
Реферат
Немедленное высвобождение лекарственного средства из таблеток с гидрофильной матрицей для длительного высвобождения является развивающейся областью фармацевтики. В фармацевтической промышленности используют разные способы смешивания фармацевтических агентов в композициях в виде таблеток. Помимо активных ингредиентов композиции включают другие эксципиенты, такие как агенты контролируемого высвобождения, разбавители, связывающие вещества, разрыхлители, поверхностно-активные агенты, скользящие вещества, смазывающие вещества, красители, вещества для нанесения покрытия, сурфактанты и многие другие исходные вещества, которые придают разные свойства конечному дозированному продукту в твердой форме.
Кроме того, для приготовления, точного приготовления в виде препарата и/или изготовления твердых дозированных продуктов используют определенные стадии обработки. Самые обычные стадии обработки, связанные с получением твердых дозированных композиций, обобщены ниже.
Способы «влажного гранулирования» можно использовать при плохих характеристиках текучести соединения, такого как активный фармацевтический ингредиент («API»), которые приводят к проблемам однородности содержимого при приготовлении в виде сухой смеси. Влажное гранулирование обычно используют для улучшения технологических характеристик порошковой смеси, включая улучшенную текучесть, однородность содержимого и более однородный размер частиц.
Влажное гранулирование используют для улучшения текучести, прессуемости, биодоступности, гомогенности, электростатических свойств и стабильности твердых лекарственных форм. Гранулирование часто необходимо для улучшения текучести порошковых смесей и механических свойств таблеток. Гранулы обычно получают путем добавления жидкостей (растворы связывающего вещества или растворителей). Большие количества жидкости для гранулирования дают более узкий интервал размера частиц и более крупные и твердые гранулы, т.е. доля мелких частиц гранулята уменьшается. Размер частиц гранулята определяется количеством и скоростью подачи жидкости для гранулирования.
Способы влажного гранулирования можно использовать при плохих характеристиках текучести соединения, такого как активный фармацевтический ингредиент («API»), которые приводят к проблемам однородности содержимого при приготовлении в виде сухой смеси. Влажное гранулирование обычно используют для улучшения технологических характеристик порошковой смеси, включая улучшенную текучесть, однородность содержимого и более однородный размер частиц. Применение воды и нагревания при влажном гранулировании может вызывать химическую деградацию или изменение физической формы.
Переменные, с которыми сталкиваются при переработке гранул, могут приводить к значительным проблемам при таблетировании. На свойства образующихся гранул могут влиять вязкость раствора для гранулирования, скорость добавления раствора для гранулирования, тип используемого смесителя и продолжительность смешивания, способ и скорость сухого и влажного смешивания. Приведенные выше переменные могут изменять плотность и размер частиц образующихся гранул и могут иметь большое влияние на массу содержимого и качество прессования. Сушка может приводить к неблагоприятному разделению, так как растворимый API мигрирует к поверхности сохнущих гранул.
«Прямое прессование» определяют как способ, посредством которого таблетки прессуют непосредственно из порошковой смеси API и подходящих эксципиентов. Не требуется предобработка порошковой смеси посредством влажного или сухого гранулирования. Оно включает только смешивание и прессование. Это обеспечивает преимущество быстрого производства, так как требуется меньше однократных операций, меньше оборудования и обычно меньше технологического времени, в некоторых случаях, наряду с повышенной стабильностью продукта.
В случае таблеток, полученных прямым прессованием, после распада высвобождается каждая частица основного лекарственного средства. В то время как в случае таблеток, полученных прессованием гранул, маленькие частицы лекарственного средства с большей площадью поверхности слипаются в большие скопления, снижая, таким образом, площадь поверхности, доступной для растворения.
Имея все преимущества, которые может обеспечить способ гранулирования, такие как улучшение характеристик текучести вещества и однородности содержимого, «вальцевание» обеспечивает уникальные преимущества над влажным гранулированием для соединений, чувствительных к действию влаги, растворителей или нагревания.
При вальцевании порошок подается к двум валикам, вращающимся в противоположные стороны, которые затягивают порошок между собой из-за трения, что приводит к прессованию порошка. Вальцевание кажется простым способом, но фундаментальные механизмы являются сложными из-за большого числа участвующих свойств материалов и переменных установки, таких как свойства текучести материала, трение относительно поверхности валика, прессуемость, формуемость, эластические свойства, проницаемость для воздуха, поверхность валика, размер валика, давление валика, рабочий зазор между валиками, скорость валика, способ подачи и условия.
Обычно в способе вальцевания есть три контролируемых параметра: давление валика, рабочий зазор между валиками и скорость валика. Поскольку результатом механического напряжения (нормальное напряжение и напряжение сдвига) в порошке во время вальцевания является отверждение порошковой смеси в ленты, все параметры исследуют путем проверки их корреляции с нормальным напряжением (напряжение сжатия) и напряжением сдвига.
Вязкость представляет собой другую характеристику, которая является релевантной для твердых дозированных фармацевтических композиций, несмотря на то, что вязкость чаще всего рассматривают как свойство, которое характеризует природу потока жидкости. В фармацевтических областях вязкость становится релевантной в отношении твердых лекарственных форм, таких как таблетки и капсулы, как только их принимают перорально, и они подвергаются действию жидкостей в пищеварительном тракте, включая рот, глотку, желудок и кишечник.
В фармацевтические композиции в качестве эксципиентов обычно включают агенты контролируемого высвобождения. Такие агенты замедленного высвобождения, предпочтительно замещенное производное целлюлозы, такое как гидроксипропилметилцеллюлоза (НРМС), облегчают отложенное высвобождение фармацевтически активных ингредиентов из композиции так, что композицию можно вводить пациенту реже, как, например, один раз в сутки. Агент предпочтительно присутствует в количестве, которое обеспечивает образование гелевой матрицы, из которой постепенно высвобождается активный ингредиент. Кроме того, рассматриваемая здесь композиция может содержать дополнительные агенты замедленного высвобождения, предпочтительно агенты, которые набухают при контакте с водой, такие как поливинилпирролидон, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, другие простые эфиры и сложные эфиры целлюлозы, такие как метилцеллюлоза, метилэтилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, крахмал, прежелатинизированный крахмал, полиметакрилат, поливинилацетат, микрокристаллическая целлюлоза, декстраны или их смеси.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Авторы изобретения обнаружили, что определенные виды обработки ингредиентов в композициях, включающих фармацевтически активные вещества и агенты контролируемого высвобождения с определенными кажущимися вязкостями, имеют заметный эффект на растворение активных ингредиентов. В фармацевтических науках управление скоростью растворения активных ингредиентов может быть решающим для желательных сроков высвобождения и функциональности активного ингредиента(ов). Раскрытые здесь изобретения и композиции как таковые предлагают новые подходы для управления растворением активных ингредиентов через уникальные комбинации ингредиентов и применение подвергнутого специфичной обработке активного ингредиента(ов) в композициях.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Признаки, проиллюстрированные на Фигурах, изображены не для оценки, если иное не указано однозначно, и относительный размер некоторых признаков может быть преувеличен для лучшей иллюстрации признаков. Воплощения будут описаны со ссылкой на следующие Фигуры, на которых одинаковые числительные обозначают одинаковые позиции на всех Фигурах.
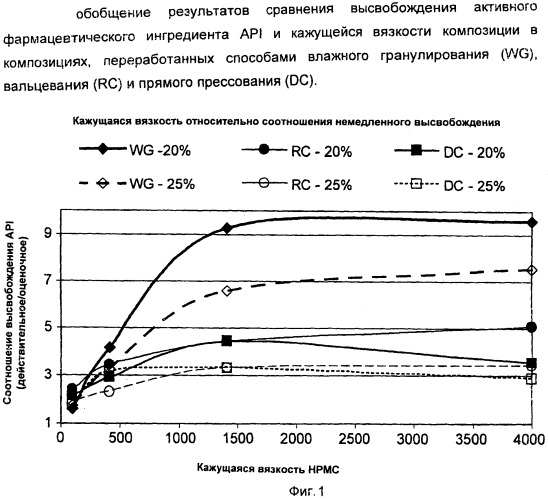
На Фиг.1 приведены обобщенные сравнительные данные высвобождения API и вязкости композиции в композициях, полученных способами влажного гранулирования, вальцевания и прямого прессования.
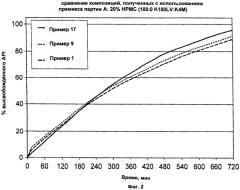
На Фиг.2 приведены обобщенные данные сравнения композиций с использованием премикса партии А.
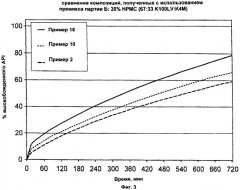
На Фиг.3 приведены обобщенные данные сравнения композиций с использованием премикса партии Б.
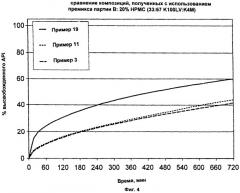
На Фиг.4 приведены обобщенные данные сравнения композиций с использованием премикса партии В.
На Фиг.5 приведены обобщенные данные сравнения композиций с использованием премикса партии Г.
На Фиг.6 приведены обобщенные данные сравнения композиций с использованием премикса партии Д.
На Фиг.7 приведены обобщенные данные сравнения композиций с использованием премикса партии Е.
На Фиг.8 приведены обобщенные данные сравнения композиций с использованием премикса партии Ж.
На Фиг.9 приведены обобщенные данные сравнения композиций с использованием премикса партии З.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ И ПРИМЕРЫ
Одним конкретным результатом исследований и преимуществом раскрытых здесь изобретений является то, что способ влажного гранулирования смеси фармацевтически активных ингредиентов и агентов контролируемого высвобождения обеспечил неожиданные результаты в твердых композициях в отношении характеристик немедленного высвобождения фармацевтически активных ингредиентов при определенных значениях вязкости. Например, композиции с более высокой вязкостью, где смесь фармацевтически активных ингредиентов и агентов контролируемого высвобождения перерабатывали с использованием влажного гранулирования, имели постоянно более высокие значения скорости немедленного высвобождения.
Напротив, другим конкретным результатом исследований и преимуществом раскрытых здесь изобретений является то, что способы прямого прессования и вальцевания показали аналогичные друг другу характеристики в том, что касается характеристик немедленного высвобождения фармацевтически активных ингредиентов при определенных вязкостях. Конкретно композиции с более высокой вязкостью, где смесь фармацевтически активных ингредиентов и агентов контролируемого высвобождения подвергали обработке с использованием прямого прессования и вальцевания, имели постоянно меньшие скорости немедленного высвобождения, чем композиции, которые подвергали обработке с использованием влажного гранулирования.
Изобретение позволит получить композицию фармацевтических агентов, где профили высвобождения можно корректировать для создания композиций с характеристиками как немедленного высвобождения (IR), так и длительного высвобождения (ER). В качестве предпочтительного воплощения, в отношении продуктов для лечения боли, критической потребностью является наличие начальной дозы, высвобождаемой в первую очередь для обеспечения аналгезии, наряду с эффективными уровнями в крови в течение длительных периодов времени. Композиции, приведенные здесь в качестве примеров, обеспечивают такие полезные характеристики.
Дополнительным преимуществом композиций, представленных в воплощениях данного изобретения, является то, что IR/ER композиции могут быть созданы по единому, цельному образцу. В отличие от обычно используемых многослойных подходов в отношении IR/ER композиций, цельные модели имеют значительные преимущества с точки зрения изготовления. Пресс для таблеток/капсул может работать быстрее, так как операции прессования, которые происходят, являются менее сложными. Дополнительно скорости производства могут быть удвоены с таблеточными прессами, которые являются двухсторонними. Также параметры таблеток являются более простыми, поскольку приходится иметь дело лишь с одиночным слоем. В связи с этим меньше сложностей возникает со слипанием слоев друг с другом, что может происходить с двойными слоями. Кроме того, двухслойные таблетки могут иметь более высокую истираемость.
Что касается активных ингредиентов, предпочтительное воплощение включает NSAID (нестероидные противовоспалительные лекарственные средства), присутствующие в количествах, индуцирующих аналгезию или облегчающих боль. Из ингибиторов циклооксигеназы-1, полезных при воплощении настоящего изобретения на практике, включая ингибиторы, которые упомянуты как предпочтительные, ибупрофен может присутствовать в заявленных композициях в количествах, варьирующих от примерно 50 до примерно 800 мг. Предпочтительно он присутствует в количествах, варьирующих от примерно 200 до примерно 600 мг. Наиболее предпочтительно он присутствует в количестве примерно 600 мг. Предложенные здесь термины «эффективное количество» или «терапевтически эффективное количество» активного ингредиента определены как количество агента, по меньшей мере достаточное для обеспечения желательного терапевтического эффекта. Как отмечено выше, настоящее изобретение основано на открытии того, что эффективную дозу противоотечного средства и/или антигистаминного средства можно снизить при введении с нормальной дозой NSAID. Точное требующееся количество будет варьировать от субъекта к субъекту, в зависимости от возраста, общего состояния субъекта, тяжести состояния, которое лечат и конкретного активного агента, который вводят, и тому подобного.
Предложенный здесь термин «стандартная одобренная доза» активного агента определен как количество агента, которое было одобрено Управлением по контролю качества пищевых продуктов и лекарственных средств США как безопасное и эффективное для введения людям в конкретной лекарственной форме. Одобренная доза, таким образом, представляет собой дозу, находящуюся в фармацевтическом продукте, количество активного агента на стандартную лекарственную форму. В настоящем изобретении ссылка на соотношение одобренных доз означает дозы, одобренные для такой же популяции пациентов (например, взрослой относительно взрослой или детской относительно детской) и одобренные для такой же лекарственной формы (например, эликсир, таблетка, капсула, каплет, лекарственная форма контролируемого высвобождения и т.д.).
При практическом применении данного изобретения обычный специалист в данной области может взять одобренную лекарственную форму любого безрецептурного (ОТС) или продаваемого по рецепту противоотечного и/или антигистаминного средства, уменьшить его дозу, например, на 25-50% или более и ввести его совместно с одобренным количеством (дозой) NSAID для достижения эффективного облегчения ринита с меньшими побочными эффектами. В одном воплощении, в настоящем изобретении рассмотрено применение одного или более чем одного из противоотечного, противокашлевого или антигистаминного средства в количестве, которое меньше чем или равно примерно 75% и больше чем 1% от присутствующего в одобренной дозе, относительно количества NSAID, соответствующего примерно 100% количества, присутствующего в стандартной лекарственной форме NSAID. Альтернативный интервал составляет от примерно 10% до примерно 65%. Другой интервал составляет от примерно 30% до примерно 55%. Также возможны интервалы от примерно 35% до примерно 50%.
В настоящем изобретении рассмотрены композиции, содержащие либо один, либо несколько фармацевтически активных ингредиентов (т.е. противоотечное, антигистаминное средства и NSAID).
Нестероидные противовоспалительные лекарственные средства (NSAID) для применения в фармацевтических композициях и способах применения по настоящему изобретению могут быть выбраны из любой из следующих категорий:
(1) производные пропионовой кислоты;
(2) производные уксусной кислоты;
(3) производные фенаминовой кислоты;
(4) производные бифенилкарбоновой кислоты;
(5) оксикамы и
(6) ингибиторы Сох-2 (циклооксигеназа-2).
Соответственно, подразумевают, что термин "NSAID" при использовании здесь означает любое нестероидное противовоспалительное соединение, включая его фармацевтически приемлемые нетоксичные соли, которое подпадает под одну из шести структурных категорий, приведенных выше.
Конкретные соединения, подпадающие под вышеупомянутое определение нестероидных противовоспалительных лекарственных средств для применения в настоящем изобретении, хорошо известны специалистам в данной области, и в разных литературных источниках можно найти ссылку относительно их химических структур, фармакологических активностей, побочных эффектов, интервалов стандартных дозировок и т.д. Смотри, например, Physician's Desk Reference и The Merck Index.
Из производных пропионовой кислоты для применения здесь конкретно рассматривают ибупрофен, напроксен, флурбипрофен, фенопрофен, кетопрофен, супрофен, фенбуфен и флупрофен. Из производных уксусной кислоты типичные соединения включают толметин натрий, зомепирак, сулиндак и индометацин. Из производных фенаминовой кислоты типичные соединения включают мефенамовую кислоту и меклофенамат натрия. Типичные производные бифенилкарбоновой кислоты для применения в настоящем изобретении включают дифлунизал и флуфенизал. Типичные оксикамы включают пироксикам, судоксикам и изоксикам. Типичные ингибиторы Сох-2 включают целекоксиб, рофекоксиб, мелоксикам и нимесулид. Из вышеупомянутых нестероидных противовоспалительных лекарственных средств ибупрофен приводится в качестве примера при воплощении на практике типичных воплощений настоящего изобретения.
В том, что касается количества дозировки нестероидных противовоспалительных лекарственных средств в композициях по изобретению, несмотря на то, что конкретная доза будет варьировать, в зависимости от возраста и массы пациента, тяжести симптомов, частоты побочных эффектов и тому подобного, для людей типичные эффективные аналгетические количества NSAID составляют примерно 200-1000 мг дифлунизала, примерно 50-200 мг зомепирака натрия, примерно 100-800 мг ибупрофена, более предпочтительно 600 мг ибупрофена, примерно 250-1000 мг напроксена, примерно 50-200 мг флурбипрофена, примерно 100-400 мг фенопрофена, примерно 20-40 мг пироксикама, примерно 250-500 мг мефанаевой кислоты, примерно 200-800 мг фенбуфена или примерно 50-100 мг кетопрофена; однако, можно использовать большие или меньшие количества, если это желательно или необходимо.
Термин «антигистаминное средство», используемый в связи с лечением назальных симптомов, связанных с аллергией или простудой, обычно относится к антагонистам Н1-рецептора гистамина. Известно, что многочисленные химические вещества имеют активность антагонистов Н1-рецептора гистамина. Многие полезные соединения можно классифицировать как этаноламины, этилендиамины, алкиламины, фенолтиазины или пиперидины. Типичные антагонисты Н1-рецептора включают, без ограничения: астемизол, азатадин, азеластин, акривастин, бромфенирамин, хлорфенирамин, клемастин, циклизин, каребастин, ципрогептадин, карбиноксамин, дескарбоэтоксилоратадин (также известный как SCH-34117), дезлоратадин, доксиламин, диметинден, эбастин, эпинастин, эфлетиризин, фексофенадин, гидроксизин, кетотифен, лоратадин, левокабастин, мизоластин, меквитазин, миансерин, ноберастин, меклизин, норастемизол, пикумаст, пириламин, прометазин, терфенадин, трипеленнамин, темеластин, тримепразин и трипролидин. Другие соединения можно легко оценить на предмет определения активности Н1-рецепторов известными способами, включая специфичную блокаду сократительного ответа на гистамин изолированной подвздошной кишки морской свинки.
Здесь конкретно рассматривают хлорфенирамин. Обычная взрослая дозировка хлорфенирамина составляет 4 мг перорально каждые 4-6 часов по необходимости, вплоть до максимум 24 мг в сутки. Обычная педиатрическая дозировка хлорфенирамина составляет 2 мг перорально каждые 4-6 часов, вплоть до максимум 12 мг в сутки. Предпочтительной солью является хлорфенирамина малеат. Согласно настоящему изобретению обычную взрослую дозировку, таким образом, снижают до 3 мг или далее до 2 мг перорально каждые 4-6 часов при необходимости, вплоть до максимум 12-18 мг в сутки. Аналогично в воплощении изобретения педиатрическая дозировка составляет 1,5 мг или 1 мг перорально каждые 4-6 часов, вплоть до максимум 6-9 мг в сутки. В дополнительном воплощении изобретение обеспечивает комбинацию педиатрической дозировки хлорфенирамина со взрослой дозировкой NSAID, такого как ибупрофен.
Противоотечные средства для применения в фармацевтических композициях и способах применения по настоящему изобретению включают, но не ограничены, псевдоэфедрин, фенилэфедрин, фенилпропаноламин. Специалисту в данной области известны множество других подходящих противоотечных средств и их одобренных дозировок.
Здесь конкретно рассматривают псевдоэфедрин и фенилэфедрин. Обычная взрослая доза псевдоэфедрина составляет 60 мг каждые 4-6 часов, вплоть до максимум 240 мг в сутки. Обычная педиатрическая доза псевдоэфедрина составляет 15 мг каждые 6 часов, вплоть до максимум 60 мг в сутки для возраста 2-5 лет и 30 мг каждые 6 часов, вплоть до максимум 120 мг в сутки для возраста 6-12 лет. Таким образом, в конкретных воплощениях настоящего изобретения на практике взрослую дозу можно снижать до 45 или 30 мг каждые 4-6 часов, максимум до 120-180 мг в сутки, и педиатрическую дозу можно снижать до примерно 11 или 7,5 мг каждые 6 часов, вплоть до максимум 30-45 мг в сутки. Из вышеизложенного очевидно, что в изобретении рассматривают введение взрослому двойной педиатрической дозы со стандартной взрослой дозой NSAID.
Противокашлевые средства действуют на мозг для подавления кашлевого рефлекса. Такие препараты для подавления кашля используют для облегчения видов сухого непрекращающегося кашля. Чаще всего используемыми лекарственными средствами являются декстрометорфан (антагонист рецептора NMDA (N-метил-O-аспартат)), кодеин и фолкодин, которые являются опиоидами. Однако специалисту в данной области понятно, что существует множество других хорошо известных и обычных противокашлевых средств, которые можно использовать. Настоящее изобретение возможно направлено на применение противокашлевых средств. Противокашлевые средства можно использовать в количествах, меньших чем или равных 75% одобренной дозировки.
Композиции по изобретению готовят в твердой стандартной лекарственной форме, такой как таблетки, капсулы, саше, пастилки и тому подобное. Твердые соединения типично будут вводить перорально.
Типичные композиции по настоящему изобретению относятся к твердым лекарственным формам, таким как нерасфасованные порошки, таблетки, каплеты, драже, капсулы, саше, гранулы и любые другие лекарственные формы, подходящие для перорального введения. Для целей этого описания и сопутствующей формулы изобретения термин «таблетка» равным образом относится к таблетке, каплете или любой другой твердой лекарственной форме, которая подходит для перорального введения.
Также рассматривают включение в композиции по настоящему изобретению одного или более чем одного эксципиента, не имеющего фармацевтической активности. Они включают, но не ограничены, агенты контролируемого высвобождения, разбавители, связывающие вещества, разрыхлители, поверхностно-активные агенты, скользящие вещества, смазывающие вещества, сурфактанты и многие другие исходные вещества, которые придают различные свойства конечному твердому дозированному продукту.
Агенты контролируемого высвобождения обычно включают в фармацевтические композиции в качестве эксципиентов. Такие агенты длительного высвобождения, предпочтительно замещенные производные целлюлозы, такие как гидроксипропилметилцеллюлоза (НРМС), облегчают отложенное высвобождение фармацевтически активных ингредиентов из композиции так, что композицию можно вводить пациенту реже, например один раз в сутки. Агент предпочтительно присутствует в количестве, которое обеспечивает образование гелевой матрицы, из которой постепенно высвобождается активный ингредиент. Кроме того, рассматриваемая здесь композиция может содержать дополнительные агенты замедленного высвобождения, предпочтительно агенты, которые набухают при контакте с водой, такие как поливинилпирролидон, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, другие простые и сложные эфиры целлюлозы, например метилцеллюлоза, метилэтилцеллюлоза, гидроксипропилметилцеллюлоза, карбоксиметилцеллюлоза, крахмал, прежелатинизированный крахмал, полиметакрилат, поливинилацетат, микрокристаллическая целлюлоза, декстраны или их смеси. Обычно агенты контролируемого высвобождения присутствуют в количестве от примерно 0,5% до примерно 50% от массы конечной композиции и более конкретно от примерно 10% до примерно 30% от массы конечной композиции.
Связывающие вещества представляют собой агенты, используемые для придания порошкообразному веществу когезивного качества. Связывающие вещества придают когезивность композиции таблетки, что обеспечивает сохранение интактности таблетки после прессования, а также улучшение качеств свободной текучести путем получения гранул желательной твердости и размера. Подходящие связывающие вещества включают, но не ограничены, крахмал (включая кукурузный крахмал и прежелатинизированный крахмал), желатин, сахара (включая сахарозу, глюкозу, декстрозу, лактозу и сорбит), полиэтиленгликоль, воски, природные и синтетические камеди, например аравийскую камедь, трагакантовую камедь, альгинат натрия, целлюлозы, такие как микрокристаллическая целлюлоза, и синтетические полимеры, такие как полиметакрилаты и поливинилпирролидон.
Смазывающие вещества выполняют целый ряд функций при изготовлении таблеток. Они предотвращают адгезию вещества таблетки с поверхностью пресс-форм и пуансонов, снижают трение между частицами, облегчают выброс таблеток из полости пресс-формы и могут увеличивать скорость хода гранулирования таблеток. Примеры подходящих смазывающих веществ включают, но не ограничены, стеарат магния, стеарат кальция, стеариновую кислоту, глицерилбегенат, тальк, натрия лаурилсульфат, натрия стеарилфумарат, полиэтиленгликоль или их смеси. Обычно смазывающее вещество присутствует в количестве от примерно 0,25% до примерно 5% от массы конечной композиции и более конкретно от примерно 0,5 до примерно 1,5% от массы конечной композиции.
Разрыхлитель представляет собой вещество или смесь веществ, добавленных в таблетку для облегчения ее распада или разложения после введения. Вещества, служащие в качестве разрыхлителей, классифицируются химически как крахмалы, глина, целлюлозы, альгины, камеди и поперечно связанные полимеры. Примеры подходящих разрыхлителей включают, но не ограничены, натрий кроскармелозу, натрия крахмала гликолят, крахмал, магния алюминия силикат, коллоидный диоксид кремния, метилцеллюлозу, агар, бентонит, альгиновую кислоту, гуаровую камедь, цитрусовый жом, карбоксиметилцеллюлозу, микрокристаллическую целлюлозу или их смеси. Обычно разрыхлитель присутствует в количестве от 0% до примерно 30% от массы конечной композиции и более конкретно от примерно 0% до примерно 15% от массы конечной композиции.
Скользящие вещества представляют собой вещества, которые улучшают характеристики текучести порошковой смеси. Примеры скользящих веществ включают, но не ограничены, коллоидный диоксид кремния, тальк или их смеси. Обычно скользящее вещество присутствует в количестве от примерно 0,1% до примерно 10% от массы конечной композиции и более конкретно от примерно 0,1% до примерно 5% от массы конечной композиции.
Адсорбент может представлять собой, например, коллоидный диоксид кремния, микрокристаллическую целлюлозу, силикат кальция или их смеси. Обычно адсорбент присутствует в количестве от примерно 0,05% до примерно 42% от массы конечной композиции и более конкретно от примерно 0,05% до примерно 37% от массы конечной композиции.
Если это желательно, в настоящие композиции могут быть включены другие ингредиенты, такие как разбавители, стабилизаторы и антиадгезивные средства, традиционно используемые для фармацевтических препаратов. Возможные ингредиенты включают красители и корригенты, которые хорошо известны в данной области.
Фармацевтическая композиция, описанная в настоящем изобретении, может быть приготовлена в виде препарата для высвобождения активных ингредиентов замедленным способом. Для лекарственных форм этих компонентов рассматривают разные композиции.
Изобретение дополнительно описано посредством следующих примеров, которые не предназначены для того, чтобы каким-либо образом ограничивать объем заявленного изобретения.
ПРИМЕРЫ
Следующие воплощения демонстрируют преимущества изобретений.
Для исследования эффектов способов получения готовили лабораторные партии цельных образцов в малом масштабе посредством влажного гранулирования (WG), вальцевания (RC) и прямого прессования (DC). Для исследования эффектов полимеров оценивали матрицы с разными категориями вязкости (K100LV и К4М) и уровнями гидроксипропилметилцеллюлозы (20 и 25% НРМС). Препараты премиксов, используемых в конкретных примерах ниже, указаны в Таблице 1.
| Таблица 1 | ||
| Препараты премиксов, используемых в примерах | ||
| Премикс партии А: 20% НРМС (100:0 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (фармакопея США) (BASF) | 67,26 | 600,00 |
| МСС (микрокристаллическая целлюлоза), NF (Avicel pH 102) | 12,56 | 112,00 |
| НРМС (гидроксипропилметилцеллюлоза), USP K100LV Premium CR | 20,18 | 180,00 |
| НРМС, USP K4М Premium CR | 0,00 | 0,00 |
| ВСЕГО | 100,00 | 892,00 |
| Премикс партии Б: 20% НРМС (67:33 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (BASF) | 67,26 | 600,00 |
| MCC, NF (Avicel pH 102) | 12,56 | 112,00 |
| НРМС, USP K100LV Premium CR | 13,45 | 120,00 |
| HPMC, USP K4M Premium CR | 6,73 | 60,00 |
| ВСЕГО | 100,00 | 892,00 |
| Премикс партии В: 20% НРМС (33:67 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (BASF) | 67,26 | 600,00 |
| MCC, NF (Avicel pH 102) | 12,56 | 112,00 |
| НРМС, USP K100LV Premium CR | 6,73 | 60,00 |
| НРМС, USP K4M Premium CR | 13,45 | 120,00 |
| ВСЕГО | 100,00 | 892.00 |
| Премикс партии Г: 20% НРМС (0:100 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (BASF) | 67,26 | 600,00 |
| MCC, NF (Avicel pH 102) | 12,56 | 112,00 |
| НРМС, USP K100LV Premium CR | 0,00 | 0,00 |
| НРМС, USP K4M Premium CR | 20,18 | 180 |
| ВСЕГО | 100,00 | 892.00 |
| Премикс партии Д: 25% НРМС (100:0 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (BASF) | 63,06 | 600,00 |
| MCC, NF (Avicel pH 102) | 11,72 | 111,50 |
| НРМС, USP K100LV Premium CR | 25,22 | 240,00 |
| НРМС, USP K4M Premium CR | 0,00 | 0,00 |
| ВСЕГО | 100,00 | 951,50 |
| Премикс партии Е: 25% НРМС (67:33 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (BASF) | 63,06 | 600,00 |
| MCC, NF (Avicel pH 102) | 11,72 | 111,50 |
| HPMC, USP K100LV Premium CR | 16,82 | 160,00 |
| HPMC, USP K4M Premium CR | 8,41 | 80,00 |
| ВСЕГО | 100,00 | 951,50 |
| Премикс партии Ж: 25% HPMC (33:67 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (BASF) | 63,06 | 600,00 |
| MCC, NF (Avicel pH 102) | 11,72 | 111,50 |
| HPMC, USP K100LV Premium CR | 8,41 | 80,00 |
| HPMC, USP K4M Premium CR | 16,82 | 160,00 |
| ВСЕГО | 100,00 | 951,50 |
| Премикс партии З: 25% HPMC (0:100 K100LV:K4M) | ||
| ~ Объем партии | 4 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Ибупрофен класса 90 USP (BASF) | 63,06 | 600,00 |
| MCC, NF (Avicel pH 102) | 11,72 | 111,50 |
| HPMC, USP K100LV Premium CR | 0,00 | 0,00 |
| HPMC, USP K4M Premium CR | 25,22 | 240 |
| ВСЕГО | 100,00 | 951,50 |
Затем готовили в виде препаратов следующие композиции. Премиксы А-З (в Таблице 1) смешивали и части каждого премикса распределяли для трех способов изготовления. Премикс для прямого прессования смешивали с диоксидом кремния и стеариновой кислотой и прессовали (как описано ниже). Премиксы для вальцевания гранулировали и размалывали на оборудовании лабораторного масштаба, затем смешивали с экстрагранулярным диоксидом кремния и стеариновой кислотой и прессовали. Премиксы для влажного гранулирования гранулировали, сушили и размалывали на оборудовании лабораторного масштаба, затем смешивали с экстрагранулярным диоксидом кремния и стеариновой кислотой и прессовали.
Пример 1: партия А для прямого прессования
| ~ Объем партии | 2 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Смесь А премикса ибупрофена | 98,67 | 892,00 |
| Коллоидный диоксид кремния NF erosol 200 | 0,88 | 8,00 |
| Стеариновая кислота, NF порошок пищевого качества | 0,44 | 4,00 |
| ВСЕГО | 100,00 | 904,00 |
Пример 2: партия Б для прямого прессования
| ~ Объем партии | 2 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Смесь Б премикса ибупрофена | 98,67 | 892,00 |
| Коллоидный диоксид кремния NF Aerosil 200 | 0,88 | 8,00 |
| Стеариновая кислота, NF порошок пищевого качества | 0,44 | 4,00 |
| ВСЕГО | 100,00 | 904,00 |
Пример 3: партия В для прямого прессования
| ~ Объем партии | 2 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Смесь В премикса ибупрофена | 98,67 | 892,00 |
| Коллоидный диоксид кремния NF Aerosil 200 | 0,88 | 8,00 |
| Стеариновая кислота, NF порошок пищевого качества | 0,44 | 4,00 |
| ВСЕГО | 100,00 | 904,00 |
Пример 4: партия Г для прямого прессования
| ~ Объем партии | 2 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Смесь Г премикса ибупрофена | 98,67 | 892,00 |
| Коллоидный диоксид кремния NF Aerosil 200 | 0,88 | 8,00 |
| Стеариновая кислота, NF порошок пищевого качества | 0,44 | 4,00 |
| ВСЕГО | 100,00 | 904,00 |
Пример 5: партия Д для прямого прессования
| ~ Объем партии | 2 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Смесь Д премикса ибупрофена | 98,67 | 951,50 |
| Коллоидный диоксид кремния NF erosol 200 | 0,88 | 8,53 |
| Стеариновая кислота, NF порошок пищевого качества | 0,44 | 4,27 |
| ВСЕГО | 100,00 | 964,30 |
Пример 6: партия Е для прямого прессования
| ~ Объем партии | 2 | Килограммы |
| ~ Доза API | 600,00 | мг |
| Ингредиент | % мас./мас. | мг/дозу |
| Смесь Е премикса ибупрофена | 98,67 | 951,50 |
| Коллоидный диоксид кремния NF Aerosol 200 | 0,88 | 8,53 |
| Стеариновая кислота, NF порошок пищевого качества | 0,44 | 4,27 |
| ВСЕГ |