Микрофлюидизированные эмульсии "масло в воде" и композиции вакцины
Иллюстрации
Показать всеИзобретение относится к фармацевтике и представляет собой композицию вакцины для индукции иммунного ответа у животных. Композиция содержит антиген и 40% эмульсию «масло в воде», разведенную до 2,5%, где указанная 40% эмульсия «масло в воде» содержит 30% об./об. легкого углеводородного неметаболического масла, 10% об./об. лецитина, 0,6% об./об. сорбитана моноолеата, 1,4% об./об. полиоксиэтиленсорбитана моноолеата, причем масляный компонент диспергирован в водном компоненте путем эмульгирования, а композиция вакцины получена с помощью микрофлюидизатора. Средний размер капель в композиции составляет менее 0,3 мкм. Композиция обладает улучшенными физическими признаками, усиленным иммунизирующим действием, а также повышенной безопасностью. 3 н. и 7 з.п. ф-лы, 20 пр., 17 табл., 11 ил.
Реферат
Область изобретения
Данное изобретение относится в целом к области вакцин и, в частности, к адъювантным композициям для усиления иммунного ответа в ветеринарии. В частности, изобретение относится к применению субмикронной эмульсии «масло в воде» в качестве адъюванта вакцины для усиления иммуногенности антигенов. Настоящее изобретение относится к композициям субмикронной эмульсии «масло в воде», композициям вакцины, содержащим антиген, включенный в такие эмульсии, а также способам получения эмульсий и вакцин.
Предшествующий уровень техники
Бактериальные, вирусные, паразитарные и микоплазменные инфекции широко распространены в ветеринарии, например, у крупного рогатого скота, свиней и домашних животных. Заболевания, вызванные этими инфекционными агентами, часто устойчивы к противомикробным фармацевтическим средствам, не оставляя эффективных средств лечения. Следовательно, вакцины все чаще используют для борьбы с инфекционными заболеваниями у таких животных. Полноразмерный инфекционный патоген можно сделать пригодным для применения в композиции вакцины после химической инактивации или соответствующего генетического воздействия. Альтернативно, белковая субъединица патогена может экспрессироваться в рекомбинантной системе экспрессии и быть очищена для применения в композиции вакцины.
Адъювант, как правило, относится к любому веществу, который увеличивает гуморальный и/или клеточный иммунный ответ на антиген. Обычные вакцины состоят из неочищенного препарата убитых патогенных микроорганизмов, и примеси, связанные с культурами патологических микроорганизмов, могут действовать в качестве адъюванта для усиления иммунного ответа. Однако когда в качестве антигенов для вакцинации применяются однородные препараты патологических микроорганизмов или очищенных белковых субъединиц, то иммунитет, вызванный такими антигенами, слабый, и таким образом необходимо добавление к ним определенных экзогенных веществ в качестве адъюванта. Кроме того, производство синтетических и субъединичных вакцин дорогостоящее. Поэтому благодаря адъюванту может потребоваться меньшая доза антигена для стимуляции иммунного ответа, что таким образом сэкономит производственные затраты вакцин.
Известно, что адъюванты действуют различными путями для усиления иммунного ответа. Многие адъюванты модифицируют цитокиновую сеть, связанную с иммунным ответом. Эти иммуномодуляторные адъюванты могут оказывать свой эффект даже без антигена. В целом, иммуномодуляторные адъюванты стимулируют регуляцию определенных цитокинов и параллельно подавляют регуляцию других цитокинов, что приводит к клеточному Th1 и/или гуморальному Th2 ответу.
Некоторые адъюванты способны сохранять конформационную целостность антигена, и такие антигены могут быть эффективно представлены соответствующим иммунным эффекторным клеткам. В результате такого сохранения антигенной конформации адъювантной композицией, вакцина имела бы более продолжительный срок хранения, например такой, как у иммуностимулирующих комплексов (ISCOM). Ozel M., et. al.; Quarternary Structure of the Immunestimmulating Complex (Iscom), J. of Ultrastruc. and Molec. Struc. Res. 102, 240-248 (1989).
Некоторые адъюванты обладают свойством удерживать антиген в виде депо в месте инъекции. В результате, антиген не так быстро выводится печеночным клиренсом. Соли алюминия и эмульсии «вода в масле» действуют посредством эффекта депо кратковременно. Например, можно, используя полный адъювант Фрейнда (FCA), который представляет собой эмульсию «вода в масле», получить долгосрочное депо. FCA обычно остается в месте инъекции до своей биодеградации, которая обеспечит удаление антигена антиген-презентирующими клетками.
По своей физической природе адъюванты могут быть разделены на две широкие категории, а именно адъюванты в виде частиц и адъюванты, не состоящие из частиц. Адъюванты в виде частиц существуют в форме микрочастиц. Иммуноген способен либо включаться, либо связываться с микрочастицами. Соли алюминия, эмульсии «вода в масле», эмульсии «масло в воде», иммуностимулирующие комплексы, липосомы и нано- и микрочастицы являются примерами адъювантов в виде частиц. Адъюванты, не состоящие из частиц, представляют собой как правило иммуномодуляторы, и они как правило используются в сочетании с адъювантами в виде частиц. Мурамилдипептид (адъювантно-активный компонент пептидогликана, экстрагированного из микобактерий), не ионные блок-сополимеры, сапонины (сложная смесь тритерпеноидов, экстрагированных из коры дерева Quillaja saponaria), липид А (дисахарид глюкозамина с двумя фосфатными группами и 5 или 6 цепями жирных кислот, в целом длиной от С12 до С16), цитокины, углеводородные полимеры, производные полисахариды и бактериальные токсины, такие как холерный токсин и лабильный токсин E.coli (LT) являются примерами адъювантов, не состоящих из частиц.
Некоторые из наиболее известных адъювантов представляют собой комбинацию иммуномодуляторов, не состоящих из частиц, и частиц, которые могут придать эффект депо адъювантной композиции. Например, FCA сочетает в себе иммуномодуляторные свойства компонентов Mycobacterium tuberculosis наряду с кратковременным эффектом депо масляных эмульсий.
Масляные эмульсии использовались в качестве адъювантов вакцин долгое время. Le Moignic и Pinoy обнаружили в 1916 г., что суспензия убитой Salmonella typhimurium в минеральном масле повышала иммунный ответ. Затем в 1925 г. Ramon описал крахмальное масло в качестве одного из веществ, усиливающих антитоксический ответ на дифтерийный токсоид. Однако масляные эмульсии не были популярными до 1937 г., пока Фрейнд не предложил адъювантную композицию, в настоящее время известную как полный адъювант Фрейнда (FCA). FCA представляет собой эмульсию «вода в масле», состоящую из минерального (парафинового) масла, смешанного с убитой микобактерией и Artacel A. Artacel A главным образом представляет собой моноолеат маннида и применяется в качестве эмульгирующего агента. Хотя FCA великолепно индуцирует антителогенез, он вызывает сильную боль, образование абсцесса, лихорадку и грануломатозное воспаление. Во избежание нежелательных побочных реакций, был разработан неполный адъювант Фрейнда (IFA). IFA аналогичен FCA по его составу, за исключением отсутствия микобактериальных компонентов. IFA действует посредством образования депо на месте инъекции и медленно высвобождает антиген, стимулируя антиген прогнозирующие клетки.
Другой подход к усовершенствованию FCA был основан на том принципе, что замещение минерального масла биологически совместимым маслом могло бы устранить реакции, связанные с FCA, в месте инъекции. Также предполагали, что эмульсия должна представлять собой эмульсию «масло в воде», а не эмульсию «вода в масле», так как последняя создает долгосрочное депо на месте инъекции. Hilleman et al. описали адъювант на масляной основе “Adjuvant 65”, состоящий из 86% арахисового масла, 10% Arlacel A, в качестве эмульгатора, и 4% моностеарата алюминия, в качестве стабилизатора. Hilleman, 1966, Prog. Med. Virol. 8: 131-182; Hilleman and Beale, 1983, in New Approaches to Vaccine Development (Eds. Bell, R. and Torrigiani, G.), Schawabe, Basel. Для людей Adjuvant 65 был безопасным и активным, но проявлял меньшую адъювантность, чем IFA. Тем не менее, применение Adjuvant 65 у людей было прекращено вследствие реактогенности определенных количеств вакцины и сокращения адъювантности, при использовании очищенного или синтетического эмульгатора вместо Arlacel A. В патентах США №№ 5718904 и 5690942 сообщается, что минеральное масло в эмульсии «масло в воде» можно заменить метаболическим маслом с целью улучшения свойств безопасности.
Кроме адъювантности и безопасности, физические признаки эмульсии также являются коммерчески важными. Физические признаки зависят от стабильности эмульсии. Расслоение эмульсии, образование осадка и слипание являются показателями нестабильной эмульсии. Расслоение эмульсии происходит, когда масляная и водная фазы эмульсии имеют различный удельный вес. Расслоение эмульсии также происходит, когда капли имеют большой исходный размер, когда у них нет броуновского движения. Когда капли больше, тогда наблюдается межповерхностный разрыв, и капли слипаются в крупные частицы. Стабильная устойчивость эмульсии определяется рядом факторов, таких как природа и количество используемого эмульгатора, величина капель в эмульсии и разность плотности между фазами масло и вода.
Эмульгаторы способствуют стабилизации диспергированных капель, снижая межповерхностную свободную энергию и создавая физический и электростатический барьер для слипания капель. В качестве эмульгаторов использовали неионные, а также ионные детергенты. Неионные эмульгаторы находятся на поверхности раздела и образуют относительно объемные структуры, что ведет к пространственному предупреждению образования диспергированных капель. Анионные или катионные эмульгаторы вызывают образование электрического двойного слоя, притягивая противоионы; отталкивающие силы двойного слоя вызывают отталкивание капель друг от друга при их сближении.
Кроме использования эмульгаторов, стабильность эмульсии можно также достичь за счет уменьшения размера капель эмульсии механическими способами. Обычно для изготовления эмульсий используют пропеллерные миксеры, турбинные роторы, коллоидные мельницы, гомогенизаторы и устройства для обработки ультразвуком. Микрофлюидизация представляет собой другой путь увеличения однородности размера капель в эмульсии. Микрофлюидизация может создавать высококачественную, физически стабильную эмульсию с однородным размером частиц в субмикронном диапазоне. Кроме повышения стабильности эмульсии, способ микрофлюидизации обеспечивает заключительную фильтрацию, которая представляет собой предпочтительный путь стерилизации конечного продукта. Более того, субмикронные частицы масла могут поступать из места инъекции в лимфатические сосуды, а затем в лимфатические узлы дренажной сети, кровь и селезенку. Это снижает вероятность образования масляного депо в месте инъекции, которое может вызвать местное воспаление и значительную реакцию на месте инъекции.
Микрофлюидизаторы в настоящее время коммерчески доступны. Образование эмульсии происходит в микрофлюидизаторе по мере того как два флюидизированных потока взаимодействуют на высоких скоростях внутри камеры взаимодействия. Микрофлюидизатор приводится в действие воздухом или азотом и может работать при величинах внутреннего давления, превышающих 20000 фунтов/кв.дюйм. В патенте США № 4908154 сообщается об использовании микрофлюидизатора для получения эмульсий, по существу свободных от каких-либо эмульгирующих агентов.
Ряд субмикронных адъювантных композиций в виде эмульсии «масло в воде» были описаны в литературе. В патенте США № 5376369 сообщается о субмикронной адъювантной композиции в виде эмульсии «масло в воде», известной как адъювантная композиция Syntax (SAF). SAF содержит сквален или сквалан в качестве масляного компонента, образующее эмульсию количество блок-сополимера Pluronic L121 (полиоксипропилен-полиоксиэтилен) и иммунопотенцирующее количество мурамилдипептида. Сквален представляет собой линейный углеводородный предшественник холестерина, обнаруживаемый во многих тканях, особенно в печени акул и у других рыб. Сквалан получают гидрированием сквалена, и он является полностью насыщенным. И сквален, и сквалан могут метаболизироваться, и было проведено достаточное количество их токсикологических исследований. Эмульсии сквалена или сквалана использовали в противораковых вакцинах людей и имели незначительные побочные эффекты и желательную эффективность (см., например, Anthony C. Allison, 1999, Squalene an Squalane emulsions as adjuvants, Methods 19:87-93).
В патенте США № 6299884 и Международной патентной публикации WO 90/14837 сообщалось, что полиокси-пропилен-полиоксиэтилен блок сополимеры не существенны для образования субмикронной эмульсии «масло в воде». Более того, в этих ссылках указывается использование нетоксичного метаболического масла, и явно исключается использование минерального масла и токсичных масел, получаемых в результате перегонки нефти, в таких эмульсионных композициях.
В патенте США № 5961970 описана еще одна субмикронная эмульсия «масло в воде», которая может использоваться как адъювант вакцины. В эмульсии, описанной в этом патенте, гидрофобный компонент выбран из группы, включающий среднецепочечное триглицеридное масло, растительное масло и их смеси. Поверхностно-активное вещество, включенное в эту эмульсию, может представлять собой природное, биологически совместимое поверхностно-активное вещество, такое как фосфолипид (например, лецитин) или фармацевтически приемлемое неприродное поверхностно-активное вещество, такое как TWEEN-80. В этом патенте также описано включение антигена в эмульсию в процессе образования эмульсии, в отличие от смешивания антигена с эмульсией после независимого и косвенного получения эмульсии.
В патенте США № 5084269 сообщается о том, что адъювантная композиция, содержащая лецитин в комбинации с минеральным маслом, уменьшает раздражение в организме животного-хозяина и одновременно усиливает системный иммунитет. Адъювантная композиция, полученная в патенте США № 5084269, промышленно используется в вакцинах, используемых в ветеринарии под торговым названием AMPHIGEN®. Композиция AMPHIGEN® изготавливается из капель мицелл-масла, окруженных лецитином. Эти мицеллы обеспечивают сцепление большого количества цельноклеточных антигенов по сравнению с традиционными адъювантами на масляной основе. Более того, композиции вакцины на основе AMPHIGEN® содержат низкое количество масла, содержащее от 2,5 до 5% минерального масла, по сравнению с другими композициями вакцины, содержащими масляные адъюванты, которые обычно содержат от 10% до 20% масла. Низкое содержание масла в композиции вакцины на основе адъюванта вызывает меньшее раздражение тканей на месте инъекции, что приводит к меньшему числу повреждений и снижает количество обрезок при обработке туш скота на бойне. Кроме того, лецитиновое покрытие, окружающее масляные капли, также уменьшает реакции на месте инъекции, что приводит к получению вакцины, которая является и безопасной, и эффективной.
Композиция AMPHIGEN® используется в качестве адъюванта в ряде вакцин, используемых в ветеринарии, но существует необходимость в поддержании физических признаков вакцины в течение короткого временного и длительного хранения, а также при растворении перед инъекцией. Кроме того, лиофилизированный антиген смешивают с предварительно полученной адъювантной композицией непосредственно перед инъекцией. Это не всегда гарантирует равномерное распределение антигена внутри эмульсии «масло в воде», и признаки эмульсии могут быть нежелательными. Более того, после отстаивания в гомогенизированной эмульсии может возникать фазовое разделение. Поэтому существует необходимость в стабильной адъювантной композиции, в которой не происходит фазового разделения при длительном хранении. Одним из путей предотвращения фазового разделения является уменьшение размера капель и увеличение однородности частиц в эмульсии. Хотя способ микрофлюидизации метаболических композиций в виде эмульсий на масляной основе был описан, микрофлюидизация эмульсий «масло в воде», таких как композиция AMPHIGEN®, еще не осуществлялась.
В настоящем изобретении микрофлюидизация использовалась для обеспечения субмикронного размера окруженных лецитином капель минерального масла. Неожиданно заявителями было обнаружено, что микрофлюидизация композиций вакцины с эмульсией «масло в воде», состоящей из смеси лецитина и масла, не только улучшает физические признаки композиций, но также усиливает иммунизирующее действие композиций. Микрофлюидизированные композиции также отличаются повышенными свойствами безопасности.
Краткое изложение сущности изобретения
Заявители неожиданно обнаружили, что адъювантную активность и свойства безопасности неметаболических эмульсий «масло в воде» на масляной основе можно улучшить посредством микрофлюидизации. Антигены, введенные в микрофлюидизированные эмульсии, стабильны даже тогда, когда антигены вводят перед микрофлюидизацией.
Соответственно, в одном из вариантов осуществления настоящее изобретение относится к композиции в виде субмикронных эмульсий «масло в воде», которую можно использовать в качестве адъюванта вакцины. Композиции в виде субмикронных эмульсий «масло в воде» по настоящему изобретению состоят из неметаболического масла, по меньшей мере, одного поверхностно-активного вещества и водного компонента, где масло диспергировано в водном компоненте со средним размером капель масла в субмикронном диапазоне. Предпочтительно, неметаболическим маслом является легкое минеральное масло. Предпочтительными поверхностно-активными веществами являются лецитин, Tween-80 и SPAN-80.
Предпочтительная эмульсия «масло в воде» по настоящему изобретению состоит из композиции AMPHIGEN®.
Эмульсии «масло в воде» по настоящему изобретению могут содержать дополнительные компоненты, которые целесообразны и желательны, включая консерванты, осмотические агенты, молекулы биологического клеящего вещества и иммуностимулирующие молекулы. Предпочтительные иммуностимулирующие молекулы включают в себя, например, Quil-A, холестерин, GPI-0100, бромид диметилдиоктадециламмония (DDA).
В другом варианте осуществления настоящее изобретение относится к способу получения субмикронной эмульсии «масло в воде». В соответствии с настоящим изобретением, различные компоненты эмульсии, включая масло, одно или несколько поверхностно-активных веществ, водный компонент и любой другой компонент, целесообразный для использования в эмульсии, смешиваются вместе. Смесь подвергают процессу первичного эмульгирования с образованием эмульсии «масло в воде», которую затем пропускают через микрофлюидизатор с получением эмульсии «масло в воде» с каплями менее 1 мкм в диаметре, предпочтительно, со средним размером капель менее чем 0,5 мкм.
В еще одном варианте осуществления настоящее изобретение относится к композициям вакцины, которые содержат антиген и описанную выше субмикронную эмульсию «масло в воде». Антиген вводят либо до, либо после получения эмульсии, предпочтительно до получения.
Антиген, который может быть включен в композицию вакцины по настоящему изобретению, может представлять собой бактериальный, грибковый или вирусный антиген или их комбинацию. Антиген может принимать форму инактивированной, цельной или частичной клетки или вирусного препарата или образовывать антигенные молекулы, полученные обычной очисткой белка, способами генной инженерии или химическим синтезом.
Еще в одном варианте осуществления настоящее изобретение относится к способам получения композиций вакцины, содержащих антиген или антигены, комбинированные с субмикронной эмульсией «масло в воде».
При получении композиций вакцины настоящего изобретения антиген(ы) можно вводить либо до (например, перед микрофлюидизацией), либо после образования эмульсии (например, после микрофлюидизации) с компонентами эмульсии «масло в воде». Предпочтительно, антиген комбинируют с компонентами эмульсии «масло в воде».
В еще одном варианте осуществления настоящее изобретение относится к композициям вакцины, которые содержат микроинкапсулированный антиген и описанную выше субмикронную эмульсию «масло в воде», где микроинкапсулированный антиген комбинируют с эмульсией после получения.
Краткое описание чертежей
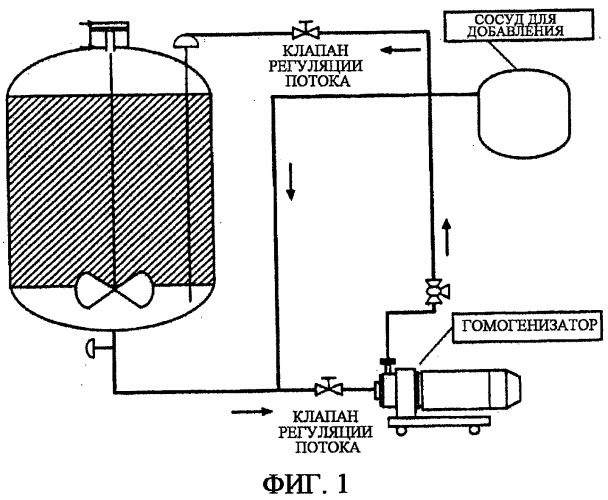
На фиг.1 изображен способ получения в виде партии немикрофлюидизированных композиций вакцины. При этом способе различные компоненты вакцины добавляют в сосуд для добавления слева и, в конечном счете, закачиваются в сосуд для смешивания, где компоненты смешивают вместе простыми механическими способами.
На фиг. 2 изображен способ получения микрофлюидизированных композиций вакцины, содержащих до получения эмульсии включенный антиген. Различные компоненты вакцины добавляют в сосуд для добавления и переносят в блок предэмульсионного перемешивания для смешивания простыми механическими способами. Затем эмульсию пропускают через микрофлюидизатор и собирают в пост-микрофлюидизационную камеру.
На фиг. 3 изображено распределение размера капель вакцины на основе немикрофлюидизированной композиции AMPHIGEN®, вакцины на основе микрофлюидизированной композиции AMPHIGEN® и препарата вакцины, смешанной в газогенераторной печи.
На фиг. 4 показано отсутствие фазового разделения в препарате микрофлюидизированной вакцины.
На фиг. 5 изображено сравнение устойчивости антигенов, введенных до получения эмульсии в препарат вакцины на основе микрофлюидизированной композиции AMPHIGEN® (А907505) и трех контролей, препаратов вакцины на основе микрофлюидизированной композиции AMPHIGEN® (А904369, А904370 и А904371). Все четыре препарата вакцин хранились при 4°С в течение 2 лет. В различные моменты времени в процессе хранения (0, 6, 12 или 24 мес.) все четыре композиции использовали для вакцинации трехмесячных телят. Вакцинацию проводили в 0 и 21 день 2 мл дозами вакцины, и сыворотку брали через 2 недели после второй вакцинации. В каждом из образцов сыворотки определяли титр нейтрализующих антител к вирусу BVD II типа (вирусной диареи крупного рогатого скота). Данные показаны в виде среднего геометрического для 5 животных.
На фиг. 6 показана минимальная средняя квадратическая ректальной температуры у крупного рогатого скота перед и после введения микрофлюидизированной и немикрофлюидизированной вакцин. Т01: Группа плацебо - однократная доза; Т02: Группа плацебо - двойная доза; Т03: Немикрофлюидизированная композиция - однократная доза; Т04: Немикрофлюидизированная композиция - двойная доза; Т05: Микрофлюидизированная композиция - однократная доза; Т06: Микрофлюидизированная композиция - двойная доза.
На фиг. 7 изображены минимальные средние квадратические объемов реакции в месте инъекции, наблюдавшиеся у крупного рогатого скота после введения микрофлюидизированной и немикрофлюидизированной композиций вакцины. Т03: Немикрофлюидизированная композиция - однократная доза; Т04: Немикрофлюидизированная композиция - двойная доза; Т05: микрофлюидизированная композиция - однократная доза; Т06: микрофлюидизированная композиция - двойная доза.
На фиг. 8 показано среднее геометрическое титров IgG для рекомбинантного антигена PauA из Streptococcus aureus после вакцинации различными композициями вакцины, содержащими и рекомбинантный антигена PauA, и антиген цельных клеток E.coli.
На фиг. 9 показано среднее геометрическое титров антигена цельных клеток E.coli из Streptococcus aureus после вакцинации различными композициями вакцины, содержащими и рекомбинантный антигена PauA, и антиген цельных клеток E.coli.
На фиг.10А и 10В изображено распределение размера частиц микрофлюидизированной композиции AMPHIGEN при исходной продукции (фиг. 10А) и через 22 мес. после продукции (фиг. 10В).
Подробное описание изобретения
Авторы настоящего изобретения неожиданно обнаружили, что микрофлюидизация композиций вакцины с добавкой эмульсии «масло в воде», состоящей из смеси лецитина и минерального масла, не только улучшает физические параметры композиций вакцины, но также усиливает иммунизирующее действие композиций вакцины. Микрофлюидизированные композиции вакцины также характеризуются улучшенными свойствами безопасности.
На основании этого обнаружения, настоящее изобретение относится к субмикронным эмульсиям «масло в воде», которые можно использовать в качестве добавки к композициям вакцины. Изобретение также относится к способам получения этих субмикронных эмульсий «масло в воде» с помощью микрофлюидизатора. Кроме того, настоящее изобретение относится к субмикронным композициям вакцины, в которых антиген комбинирован с субмикронной эмульсией «масло в воде». Настоящее изобретение также относится к способам получения таких композиций вакцины. Настоящее изобретение, кроме того, относится к композициям вакцины, содержащим микроинкапсулированные антигены, в сочетании с субмикронной эмульсией «масло в воде», и к способам получения таких вакцин.
Для ясности описания, но не для ограничения, подробное описание изобретения разделено на следующие подразделы, которые описывают или иллюстрируют определенные признаки, варианты осуществления или применение по изобретению.
Субмикронные эмульсии «масло в воде»
В одном из вариантов осуществления настоящее изобретение относится к композициям в виде субмикронной эмульсии «масло в воде», которые можно использовать в качестве добавки к вакцине. Субмикронные эмульсии «масло в воде» по настоящему изобретению усиливают иммуногенность антигенов в композициях вакцины, безопасны при введении животным и стабильны во время хранения.
Субмикронные эмульсии «масло в воде» по настоящему изобретению состоят из неметаболического масла, по меньшей мере, одного поверхностно-активного вещества и водного компонента, где масло диспергировано в водном компоненте со средним размером капель в субмикронном диапазоне.
Под «субмикронным» подразумевается, что капли имеют размер менее чем 1 мкм (микрон), а средний или нормальный размер частиц составляет менее чем 1 мкм. Предпочтительно, средний размер капель эмульсии составляет менее чем 0,8 мкм; предпочтительнее, менее чем 0,5 мкм а еще предпочтительнее, менее чем 0,4 мкм или примерно 0,1-0,3 мкм.
Под «средним размером капель» понимают размер частиц в виде среднего диаметра объема (VMD). VMD рассчитывается умножением диаметра каждой частицы на объем всех частиц этого размера и сложением. Затем эта величина делится на общий объем всех частиц.
Используемый в настоящем описании термин «неметаболическое масло» относится к маслам, которые не могут метаболизироваться организмом животного-индивидуума, которому вводится эмульсия.
Используемые в настоящем описании термины «животное» и «животное-индивидуум» относятся ко всем животным, включая, например, крупный рогатый скот, овец и свиней, не относятся к человеку.
Неметаболические масла, которые можно использовать в виде эмульсии по настоящему изобретению, включают алканы, алкины и другие соответствующие кислоты и спирты, их простые и сложные эфиры и их смеси. Предпочтительно, отдельные соединения масла представляют собой легкие углеводородные соединения, то есть такие компоненты содержат от 6 до 30 атомов углерода. Масло может быть получено синтетически или очищено из нефтяных продуктов. Предпочтительные неметаболические масла, которые могут использоваться в эмульсиях по настоящему изобретению, включают, например, минеральное масло, парафиновое масло и циклопарафины.
Термин «минеральное масло» относится к смеси жидких углеводородов, полученных из нефти путем перегонки. Этот термин является синонимом термина «сжиженный парафин», «вазелиновое масло», то есть масло, которое получают аналогичным образом перегонкой петролатума, но которое имеет несколько более низкую удельную массу, чем белое минеральное масло. См., например, Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pa.: Mack Publishing Company, 1990, at pages 788 and 1323). Минеральное масло может быть получено из различных коммерчески доступных источников, например, J.T.Baker (Phillipsburg, PA), USB Corporation (Cleveland, OH). Предпочтительно, минеральное масло представляет собой легкое минеральное масло, коммерчески доступное под торговым названием DRAKEOL®.
Обычно масляный компонент субмикронных эмульсий по настоящему изобретению присутствует в количестве от 1% до 50% об., предпочтительно, в количестве от 10% до 45%, предпочтительнее, в количестве от 20% до 40%.
Эмульсии «масло в воде» по настоящему изобретению обычно содержат, по меньшей мере, одно (то есть одно или несколько) поверхностно-активное вещество. Вещества, обозначаемые терминами «поверхностно-активные вещества» и «эмульгаторы», которые используются в настоящем описании взаимозаменяемо, представляют собой вещества, которые стабилизируют поверхность масляных капель и поддерживают масляные капли в пределах желательного размера.
Поверхностно-активные вещества, которые могут использоваться в эмульсиях по настоящему изобретению, включают природные биологически совместимые поверхностно-активные вещества и неприродные синтетические поверхностно-активные вещества. Биологически совместимые поверхностно-активные вещества включают фосфолипидные соединения или смесь фосфолипидов. Предпочтительными фосфолипидами являются фосфатидилхолины (лецитин), такие как соевый или яичный лецитин. Лецитин может быть получен в виде смеси фосфатидов и триглицеридов промыванием водой неочищенных растительных масел и разделением и сушкой полученных гидрированных смол. Очищенный продукт может быть получен фракционированием смеси на нерастворимые в ацетоне фосфолипиды и гликолипиды, остающиеся после удаления триглицеридов и растительного масла при промывании ацетоном. Альтернативно, лецитин может быть получен из различных коммерческих источников. Другие подходящие фосфолипиды включают фосфатидилглицерин, фосфатидилинозит, фосфатидилсерин, фосфатидовую кислоту, кардиолипин и фосфатидилэтаноламин. Фосфолипиды могут быть выделены из природных источников или синтезировать обычным путем.
Неприродные синтетические поверхностно-активные вещества, подходящие для использования в субмикронных эмульсиях по настоящему изобретению, включают неионные поверхностно-активные вещества на основе сорбитана, например поверхностно-активные вещества с сорбитаном, замещенным жирной кислотой (коммерчески доступные под названием SPAN® или ARLECEL®), сложные эфиры жирных кислот полиэтоксилированного сорбита (TWEEN®), сложные эфиры жирных кислот полиэтиленгликоля из таких источников как касторовое масло (EMULFOR); полиэтоксилированную жирную кислоту (например, стеариновую кислоту, имеющуюся под названием SIMULSOL M-53), полимер полиэтоксилированного изооктила/формальдегида (TYLOXAPOL), простые эфиры жирных спиртов полиоксиэтилена (BRIJ®); простые не фениловые эфиры полиоксиэтилена (TRITON®N), простые изооктилфениловые эфиры полиоксиэтилена (TRITON®X). SPAN® и TWEEN® являются предпочтительными синтетическими поверхностно-активными веществами.
Предпочтительные поверхностно-активные вещества для использования в эмульсиях «масло в воде» по настоящему изобретению включают лецитин, Twen-80 и SPAN-80.
Обычно количество поверхностно-активного вещества или комбинации поверхностно-активных веществ при использовании двух или более поверхностно-активных веществ, присутствующих в эмульсии, составляет от 0,01% до 10% об., предпочтительно, от 0,1% до 6,0%, предпочтительнее, от 0,2% до 5,0%.
Водный компонент составляет дисперсионную фазу эмульсии и может представлять собой воду, буферный солевой раствор или любой другой подходящий водный раствор.
Эмульсии «масло в воде» по настоящему изобретению могут содержать дополнительные компоненты, которые являются подходящими и желательными, включая консерванты, осмотические агенты, биоадгезивные молекулы и иммуностимулирующие молекулы.
Полагают, что биоадгезивные молекулы могут усиливать доставку и прикрепление антигенов на мишеневой слизистой поверхности, вызывая иммунный ответ. Примеры подходящих биоадгезивных молекул включают кислые, неприродные полимеры, такие как полиакриловая кислота и полиметакриловая кислота (например, CARBOPOL®, CARBOMER); кислотные синтетически модифицированные природные полимеры, такие как карбоксиметилцеллюлоза; нейтральные синтетически модифицированные естественные полимеры, такие как (гидроксипропил)метилцеллюлоза; основные несущие амин полимеры, такие как хитосан; кислотные полимеры, получаемые из природных источников, такие как альгиновая кислота, гиалуроновая кислота, пектин, смола трагаканта и смола карайя; и нейтральные неприродные полимеры, такие как поливиниловый спирт, или их сочетания.
Используемая в настоящем описании фраза «иммуностимулирующие молекулы» относится к тем молекулам, которые усиливают защитный иммунный ответ, индуцированный антигенным компонентом вакцинными композициями. Подходящие иммуностимулирующие вещества включают компоненты стенки бактериальной клетки, например производные N-ацетилмурамил-L-аланил-D-изоглутаминовой кислоты, такие как мурабутид, треонил-MDP и мурамилтрипептид; сапониновые гликозиды и их производные, например, Quil-A, QS 21 и GPI-0100; холестерин; и соединения четвертичного аммония, например бромид диметилдиоктадециламмония (DDA) и N,N-диоктадецил-N,N-бис(2-гидроксиэтил)пропандиамин («авридин»).
Сапонины представляют собой гликозидные соединения, которые продуцируются в качестве вторичных метаболитов у большого количества видов растений. Химическая структура сапонинов придает широкий диапазон фармакологической и биологической активности, включая некоторую мощную и эффективную иммунологическую активность.
Структурно, сапонины состоят из любого агликона, присоединенного с одной или несколькими сахарными цепями. Сапонины можно классифицировать в соответствии с составом их агликонов: тритерпеновые гликозиды, стероидные гликозиды и стероидные алкалоидные гликозиды.
Сапонины можно выделить из коры Quillaja saponaria. В течение длительного времени сапонины были известны как иммуностимуляторы. Dalsgaard, K., “Evaluation of its adjuvant activity with a special reference to the application in the vaccination of cattle against foot-and-mouth disease”, Acta. Vet. Scand. 69: 1-40 1978. Неочищенные экстракты растений, содержащие сапонины, усиливали активность вакцин против ящура. Однако неочищенные экстракты вызывали неблагоприятные побочные эффекты при использовании в вакцинах. В последующем, Dalsgaard частично очистил активный компонент, обладающий свойствами адъюванта, от сапонинов путем диализа, ионнообменной и гель-фильтрационной хроматографией. Dalsgaard, K., et al., “Saponin adjuvants III. Isolation of a substance from Quillaja saponaria Morina with adjuvant activity in foot-and-mouth disease vaccines”, Arch. Gesamte. Virusforsch. 44: 243-254, 1974. Активный компонент, со свойствами адъюванта, очищенный таким путем, известен как «Quil-A». В весовом отношении Quil-A продемонстрировал повышенную активность и сниженные местные реакции по сравнению с сапонинами. Quil-A широко используется в вакцинах, используемых в ветеринарии.
Последующий анализ Quil-A с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) выявил неоднородную смесь близко родственных сапонинов и привел к открытию QS 21, который является мощным адъювантом со сниженной или минимальной токсичностью. Kensil C.R. et al., “Separation and characterization of saponins with adjuvant activity from Quillaja saponaria Molina cortex”, J.Immunol. 146: 431-437, 1991. В отличие от других иммуностимуляторов, QS 21 растворим в воде, и его можно использовать в вакцинах, содержащих композиции по типу эмульсий или несодержащих. Было показано, что QS 21 вызывает Th1 реакцию у мышей, стимулируя продукцию антител IgG2a и IgG2b и индуцирует антиген-специфические CD8+CTL (MHC класса I) в ответ на субъединичные антигены. Клинические исследования людей доказали его адъювантные свойства и приемлемый токсикологический профиль. Kensil, C.R. et al., “Structural and immunological characterization of the vaccine adjuvant QS-21. In Vaccine Design: the subunit and Adjvuant Approach, ”Eds.Powell, M.F. and Newman, M.J.Plenum Publishing Corporation, New York. 1995, pp. 525-541.
В патенте США № 6080725 описаны способы получения и применения конъюгата сапонин-липофил. В конъюгате сапонин-липофил, липофильная часть, например липид, жирная кислота, полиэтиленгликоль или терпен, ковалентно связана с неацетилированным или дезацетилированным тритерпеновым сапонином через карбоксигруппу, присутствующую на 3-О-глюкуроновой кислоте тритерпенового сапонина. Присоединение липофильной части к 3-О-глюкуроновой кислоте сапонина, такого как дезациклосапонин Quillaja, люциосид Р или сапонин из Gypsophia, saponaria и Acanthophyllum, усиливает их адъювантные свойства на гуморальный и клеточный иммунитет. Кроме того, присоединение липофильной части к остатку 3-О-глюкуроновой кислоты не- или дезацетилсапонина дает аналог сапонина, который легче очистить, является менее токсичным, химически более устойчив и обладает равными или лучшими адъювантными свойствами, чем первоначальный сапонин.
GPI-0100 представляет собой конъюгат сапонин-липофил, описанный в патенте США № 6080725. GPI-0100 получают путем добавления алифатического