Способ моделирования и фармакологической коррекции острого повреждения легких в эксперименте
Иллюстрации
Показать всеИзобретение относится к экспериментальной медицине и касается разработки вопросов коррекции острого повреждения легких в пульмонологии, неотложной терапии и реанимации. Способ заключается в том, что создают модель повреждения легких интратрахеальным введением крысам 0,03 мл ацетона. Через час после этого крысам вводят внутривенно однократно комбинированный раствор, содержащий 7,2% натрия хлорида и 6% гидроксиэтил-крахмала в дистиллированной воде, в объеме 4 мл/кг. Способ обеспечивает снижение летальности животных за счет уменьшения гипоксемии, площади инфильтративного поражения легких, предотвращения развития альвеолярного отека легочной ткани и степени ее геморрагического пропитывания. 2 ил., 2 табл.
Реферат
Изобретение относится к области медицины и может быть использовано в пульмонологии, неотложной терапии и реанимации.
Синдром острого повреждения легких (СОПЛ) и его наиболее тяжелая форма - острый респираторный дистресс-синдром (ОРДС) являются одним из основных осложнений различных жизнеугрожающих состояний. По последним данным The National Heart, Lung, and Blood Institute ARDS Clinical Trials Network частота возникновения СОПЛ/ОРДС достигает 75 на 100 000 населения в год, хотя ранее считалось, что этот показатель варьирует от 1,5 до 8,3 на 100 000 жителей в год. К сожалению, приходится констатировать, что летальность пациентов СОПЛ/ОРДС варьирует от 40 до 60% (Leroy.O., Vandenbussche С, Coffmier С, et al. Cammunity - acquired aspiration pneumonia in intensive care units. Epidemiological and prognosis data. Am j Respir Crit Care Med 1997; 156:1922-29).
Основой терапии СОЛП является искусственная вентиляция легких (ИВЛ), которая направлена на поддержание газообмена и позволяет выиграть время для процессов саногенеза. Высокая летальность при СОЛП связана не только с гипоксемией и нарушениями газообмена в легких, но и органной недостаточностью и вторичными легочными осложнениями (аспирационной пневмонией, абсцессом легкого и др.), а также повреждающими факторами ИВЛ (Казахский Национальный медицинский университет им. С.Д. Асфендиярова. Кафедра анестезиологии и реаниматологии с курсом скорой неотложной помощи. Методические рекомендации. Синдром острого повреждения легких (СОПЛ): современные представления о патогенезе клинике и интенсивной терапии. Алматы, 2011 г.). Интерес врачей разных специальностей к данной патологии обусловлен прежде всего тем, что несмотря на интенсивные научные исследования патогенеза и терапии ОРДС, за последние 20 лет не отмечено заметного успеха в клинической практике. Невысокая эффективность терапии СОПЛ показывает, что главная задача - снижение летальности, остается пока нерешенной (Диагностика и интенсивная терапия синдрома острого повреждения легких и респираторного-дистресс синдрома. Колесниченко А.П., Грицан А.И. Материалы международной конференции по респираторной терапии. г.Красноярск, август 2005 г.).
Из накопленного опыта лечения взрослых больных с острым респираторным дистресс-синдромом различного генеза следует выделить некоторые. Так как у больных с ОРДС доказано нарушение функции и продукции эндогенного сурфактанта, а также уменьшение его количества (Griese М. Pulmonary surfactant in health and human lung diseases: state of the art. Eur Res-pir J 1999; 13: 1455-76), существуют методы введения экзогенного сурфактанта с целью восстановления нормального поверхностного натяжения в альвеолах. Кроме того, препараты сурфактанта способны уменьшить риск развития нозокомиальной пневмонии ввиду наличия у них антибактериальных свойств. Сурфактант назначается эндотрахеально либо в виде инсталляций при проведении бронхоскопии, либо через небулайзер. По данным Gregory и соавт., бронхоскопические инсталляции бычьего сурфактанта в дозе 100 мг/кг 4 раза в сутки значительно улучшают показатели оксигенации в течение 120 ч и, кроме того, могут улучшить выживаемость больных с ОРДС. В крупном (более 700 больных) рандомизированном исследовании не было показано влияния ингаляционного синтетического сурфактанта (Exosurf) на выживаемость больных ОРДС, поэтому изучение данной группы препаратов пока продолжается (Anzueto A, Baughman RP, Guntupalli KK et al. Aerosolized surfactant in adults with sepsis-induced acute respiratory distress syndrome. N Engl J Med 1996; 334: 1417-21).
Несмотря на теоретическую роль глюкокортикостероидов (ГКС) при ОРДС (действие на воспалительные цитокины), их эффективность в ранней фазе ОРДС фактически равна нулю. Более того, в некоторых исследованиях был продемонстрирован повышенный риск развития инфекционных осложнений и даже повышение летальности больных с ОРДС при назначении ГКС. Однако роль ГКС может быть значима на поздних стадиях ОРДС (позже 5-10-го дня). В недавнем исследовании была показана эффективность метил-преднизолона в "стрессовых" дозах (начало от 2 мг/кг в сутки с постепенным снижением дозы, длительность терапии 32 дня) у больных с фибропролиферативной фазой ОРДС: улучшение индекса повреждения легких, полиорганной недостаточности и выживаемости больных (88% против 38% в контрольной группе) (Meduri GU, Headley AS, Golden E et al. Effect of prolonged methylprednisolone therapy in unresolving acute respiratory distress syndrome, a randomized controlled trial. JAMA 1998; 280: 159-65).
Существуют веские доказательства роли свободных радикалов в патогенезе ОПЛ/ОРДС: доказано их повреждающее действие на протеины клеток и матрикса, липиды и нуклеиновые кислоты. Системы антиоксидантной защиты у больных с ОРДС истощены: так, концентрация и активность в биологических мембранах одного из наиболее активных компонентов антиоксидантной защиты - глутатиона - значительно снижена. Назначение предшественников глутатиона - N-ацетилцистеина и процистеина - усиливает синтез эндогенного глутатиона. В ряде рандомизированных исследований было показано, что назначение средних доз N-ацетилцистеина (70 мг/кг/с) и процистеина (63 мг/кг/с) ускоряет разрешение ОПЛ/ОРДС, повышает сердечный выброс, однако не влияет на выживаемость больных (Bernard GR, Wheeler АР, Arons MM et al. A trial of antioxidants N-acetylcysteine and procysteine in ARDS. The Antioxidant in ARDS Study Group. Chest 1997; 112: 164-72).
При интерстициальном отеке легких переливание гидроксиэтилкрахмала (ГЭК), не проникающего через сосудистый эндотелий, может уменьшить выраженность интерстициального отека (Groeneveld J. // Crit Care. - 2000. - Vol.4. - Suppl. 2. - P. S16-S20). В экспериментальных работах на животных показана способность ГЭК ослаблять выраженность отека при ожогах, ишемическом/реперфузионном повреждении, сепсисе. Имеются сообщения о способности растворов ГЭК уменьшать капиллярную утечку при повышенной легочной сосудистой проницаемости. Однако эти данные нуждаются в дальнейшем клиническом изучении (Vincent J.-L., Wilkes M.M., Navickis R.J. // Br. J. Anaesth. - 2003. - Vol.91. - P. 625-630).
Учеными из США и Канады под руководством Z.Safdar установлено, что введение гиперосмолярных растворов в кровоток организма стимулирует обмен веществ в клетках, образующих капиллярный барьер легких, и значительно улучшает его качества. Ранее было установлено, что эндотелиальные клетки капилляров легких при воздействии гиперосмолярных растворов (например, сахарозы) начинают активно синтезировать и накапливать белковые вещества, которые могут повлиять на барьерные свойства капилляров. В ходе эксперимента на животных было установлено, что введение в кровь гиперосмолярных растворов изменяет проводимость капилляров и значительно повышает качественные показатели капиллярного барьера легких. В частности, эти препараты предохраняют легочную ткань от повреждения пероксидом водорода, тромбином, фактором некроза опухолей и другими химическими и биологическими агентами (Clin. J. // Invest. - 2003. - Vol. 112. - P. 1541-1549).
Известен способ лечения острого респираторного дистресс-синдрома, при котором в условиях искусственной вентиляции легких с положительным давлением в конце выдоха устанавливают уровень положительного давления в конце выдоха выше предварительно подобранного оптимального на 4-8 см вод. ст. По прошествии 10-15 мин вводят перфторуглерод в виде аэрозоля. Введение осуществляют с помощью распылителя-небулайзера в течение 10-15 минут (RU 2265434, МПК A61K 31/02, A61P 11/00, A61M 16/00, опубл. 10.12.2005).
Недостатки известного способа
1. Отсутствуют экспериментальные разработки по оценке эффективности способа.
2. Выводы по эффективности способа коррекции острого повреждения легких основаны на одном случае пациентки с синдромом острого повреждения легких, отсутствуют статистические данные по оценке данного метода.
3. Недостаточная эффективность способа при критическом состоянии больного - эффективность выявлена лишь на протяжении 13 суток ИВЛ после 64 сеансов ингаляции перфторана, что обусловлено отсутствием влияния перфторуглерода на состояние альвеолярно-капиллярной мембраны, сохраняющийся отек легочной ткани.
Технический результат заключается в снижении летальности при остром повреждении легких за счет уменьшения степени гипоксемии, площади инфильтративного поражения легких. Кроме того, предотвращается развитие альвеолярного отека легочной ткани и снижается степень ее геморрагического пропитывания.
Сущность изобретения заключается в том, что через час после интратрахеального введения 0,03 мл ацетона крысам внутривенно однократно вводят комбинированный раствор, содержащий 7,2% натрия хлорида и 6% гидроксиэтилкрахмала в дистиллированной воде в объеме 4 мл/кг
Способ осуществляется следующим образом. Моделирование острого повреждения легких производят путем интратрахеального введения 0,03 мл ацетона крысам на фоне уретанового наркоза. Фармакологическую коррекцию синдрома острого повреждения легких осуществляют путем внутривенного однократного введения комбинированного раствора, содержащего 7,2% натрия хлорида, 6% гидроксиэтилкрахмала в дистиллированной воде в объеме 4 мл/кг, через 1 час после аспирации ацетона.
Пример 1
Эксперименты проводили на 50 беспородных крысах обоего пола массой 250-300 г, выращенных в условиях вивария. Эксперименты проведены в соответствии с этическими нормами и рекомендациями по гуманизации работы с лабораторными животными, отраженными в «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» (Страсбург, 1985). Содержание и работу с лабораторными животными проводили в соответствии с приказом Министерства здравоохранения Российской Федерации от 23 августа 2010 г. №708а «Об утверждении правил Лабораторной практики». Исследование одобрено Локальным этическим комитетом ФГБОУ ВПО «Мордовский государственный университет им. П.П. Огарева».
Животных разделили на группы по 15 в каждой. 1-ю группу составили интактные крысы, животным 2-й группы (контроль) под уретановым наркозом производили моделирование острого повреждения легких путем интратрахеального введения 0,03 мл ацетона. Животным 3-й группы через 1 час после аспирации ацетона в/в вводили комбинированный раствор 7,2% NaCl и 6%ГЭК в объеме 4 мл/кг. Данный комбинированный раствор соответствует по своему рН 3,5 - 6 и теоретической осмолярности 2464 мОсмоль/л, препарату для «малообъемной реанимации» гиперХАЕС.
Большинство животных (75%) после аспирации ацетона находилось на самостоятельном дыхании, остальные переводились на ИВЛ (0,5 л/мин, ЧД - 70/мин). Оценка эффективности в/в введения комбинированного раствора 7,2% NaCl и 6%ГЭК проводилась через 1 час после в/в введения и через 1 сутки. Для этого у животных определяли насыщение артериальной крови кислородом при помощи пульсоксиметра. Также исследуемыми показателями явились: частота дыхания (ЧД), объем выдоха, частота сердечных сокращений (ЧСС), артериальное давление (АД), которые определялись с помощью системы для экспериментальных исследований BiopacSystems MP 150. Уровень летальности в экспериментальных группах определяли спустя сутки от момента моделирования СОПЛ. Животные забивались через 1 сутки после моделирования СОПЛ под уретановым наркозом, у животных извлекались легкие с последующим определением их массы и площади поражения. Площадь поражения оценивали по количеству долей легких, подвергнувшихся инфильтративному уплотнению. Легкие после извлечения фиксировали в 10% нейтральном формалине с последующим приготовлением гистологических препаратов. Гистологические препараты окрашивали гематоксилином и эозином. Значимость различий сравниваемых величин определяли на основании t- критерия Стьюдента. Значимыми считали различия при р<0,05.
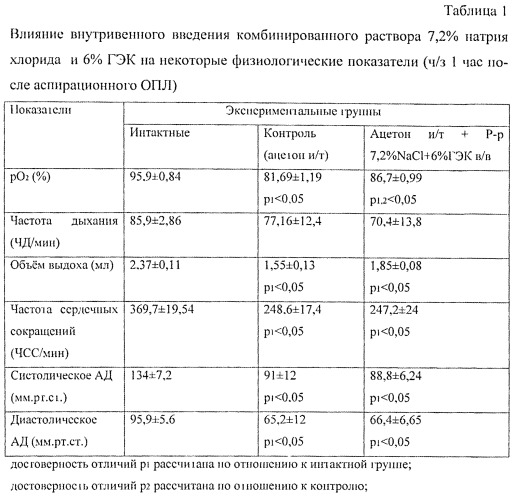
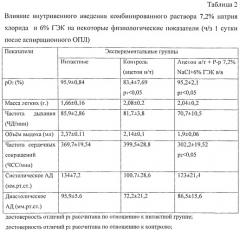
Как показали наши исследования, всех животных через 1 час на фоне аспирационного повреждения легких отмечалась гипоксемия, которая достоверно корригировалась в/в введением раствора 7,2% NaCl и 6%ГЭК, однако уровень кислородного насыщения гемоглобина оставался достоверно ниже, чем у интактных животных (табл.1). При этом в контрольной группе и группе с использованием раствора 7,2% NaCl и 6%ГЭК отмечалось снижение объема выдоха, ЧСС и АД по отношению к значениям интактных животных (р<0,05, табл.1). Летальность через сутки в контрольной группе составила 57,14%, а в группе с применением раствора 7,2% NaCl и 6% ГЭК - 22,2%. Кислородное насыщение крови в контрольной группе оставалось ниже, чем у интактных крыс (р<0,05), а в группе, где после аспирации применялся раствор 7,2% NaCl и 6% ГЭК, процентное содержание оксигемоглобина было достоверно выше контрольного значения и не отличалось от такового у интактных животных (табл.2). ЧСС у животных, которым вводили раствор 7,2% NaCl и 6% ГЭК была меньше, чем у животных контрольной группы (р<0,05, табл.2).
Количество пораженных долей легких спустя сутки в контрольной группе составило 4,5±0,19, что достоверно больше, чем после введения комбинированного раствора 7,2% NaCl и 6% ГЭК (1,58±0,42).
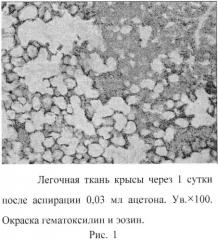
В легочной ткани крыс через 1 сутки после аспирации ацетона отмечаются крупноочаговые кровоизлияния (рис.1). Межальвеолярные перегородки резко утолщены (отечны), инфильтрированы лейкоцитами (рис.1). Мышечная стенка артериол утолщена. Эритроциты выходят за пределы просветов сосудов. Воздушность легких снижена, имеются очаги дистелектазов и ателектазов. Стенка бронхов не утолщена. Воспалительных изменений в слизистой бронхов не выявлено. В просвете отсутствуют элементы экссудации.
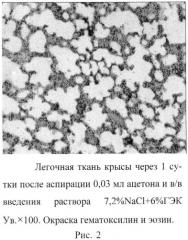
В группе животных, у которых применялся комбинированный раствор 7,2% NaCl и 6% ГЭК, очаги кровоизлияний и геморрагического пропитывания отсутствуют. Межальвеолярные перегородки утолщены, но степень их лейкоцитарной инфильтрации значительно менее выражена, чем в контроле. Эритроциты не обнаруживаются периваскулярно. Воздушность легких сохранена (рис.2). Очаги ателектазов встречаются крайне редко. Просвет альвеол чистый. Эпителий бронхиол, средних и крупных бронхов без признаков воспаления.
Таким образом, однократное внутривенное введение комбинированного раствора 7,2% натрия хлорида и 6% гидроксиэтилкрахмала в дистиллированной воде в объеме 4 мл/к при экспериментальном синдроме общего повреждения легких через 1 час от момента аспирационного повреждения ацетоном уменьшает степень гипоксемии, а спустя 1 сутки от момента ОПЛ снижает летальность, снижает частоту развития ОРДС, уменьшает степень гипоксемии и уменьшает площадь инфильтративного поражения легких. Кроме того, предотвращает развитие альвеолярного отека легочной ткани и снижает степень ее геморрагического пропитывания.
Способ фармакологической коррекции острого повреждения легких в эксперименте, заключающийся в том, что через час после интратрахеального введения 0,03 мл ацетона крысам внутривенно однократно вводят комбинированный раствор, содержащий 7,2% натрия хлорида и 6% гидроксиэтил-крахмала в дистиллированной воде, в объеме 4 мл/кг.